一株溶藻细菌的分离、筛选与分子鉴定
2017-02-10朱晓漫罗玉双李娜邹万生熊鹏潘慧李红丽
朱晓漫, 罗玉双, 李娜, 邹万生, 熊鹏, 潘慧, 李红丽
一株溶藻细菌的分离、筛选与分子鉴定
朱晓漫, 罗玉双, 李娜, 邹万生, 熊鹏, 潘慧, 李红丽
(湖南文理学院水产高效健康生产湖南省协同创新中心, 湖南常德, 415000; 湖南文理学院环洞庭湖水产健康养殖及加工湖南省重点实验室, 湖南常德, 415000; 湖南文理学院动物学湖南省高校重点实验室, 湖南常德, 415000)
为了筛选对铜绿微囊藻有溶藻活性的菌株, 采用试管法筛选溶藻效果好的细菌, 显微观察高效溶藻菌的溶藻作用方式, 对其热稳定性、耐酸碱能力及紫外稳定性进行考察, 并采用16S rDNA序列分析鉴定溶藻菌种类。共筛选获得7株具有溶藻效果的细菌, 其中F15菌株对铜绿微囊藻溶藻效果最好。菌株F15的溶藻活性物质为胞外产物, 当其生长到对数期时, 其胞外产物的溶藻效果达到最大, 按体积比1∶6将其加入藻液, 培养3 d后, 铜绿微囊藻的去除率达55%以上。该溶藻活性产物对加热、酸碱及紫外线处理均具有较好的稳定性。16S rDNA序列分析表明, F15菌株与ATCC 14579同源性最高, 达99%, 被鉴定为蜡状芽孢杆菌。F15菌株溶藻效果好, 稳定性高, 具有开发成生物控藻菌剂的潜在价值。
铜绿微囊藻; 溶藻细菌; 分离与筛选; 溶藻特征; 分子鉴定
铜绿微囊藻()是养殖水体中常见的鱼类不易消化的蓝藻[1], 亦是富营养化水体引起水华现象的优势藻种之一, 因其有毒产物藻毒素毒性大、难降解、可被生物富集, 已成为渔业生产及水环境中的公害[2–4]。相比传统的物理及化学除藻方法, 生物控藻因具有环境友好的特性日益引起人们的重视, 包括利用水生动物摄食[5]、植物的化感作用(Allelopathic effects)[6–7]以及微生物调控[8]。因微生物具有营养需求简单、倍增时间短、繁殖迅速的特点, 利用溶藻细菌防治蓝藻水华成为当前研究的热点[9], 内容涉及溶藻细菌的分离及鉴定[10–13]、溶藻活性物质的提纯与鉴定[14–16]以及控藻机制研究[17–20]等。本研究通过从环洞庭湖区养殖水体池底泥中筛选出对铜绿微囊藻具有溶解效果的溶藻细菌, 研究其溶藻活性与稳定性, 旨在为养殖水体水华的有效控制提供技术资料。
1 材料与方法
1.1 供试藻种培养及其生长曲线测定
实验藻种为铜绿微囊藻(, FACHB 905), 购自中科院水生生物研究所藻种库。藻种活化后, 采用BG-11改良培养基, 培养条件: 温度25 ℃, 光照强度2 000 Lux, 光暗比12 h∶12 h。通过测量叶绿素a(Chla)的含量(采用乙醇法)及显微观察了解铜绿微囊藻的生长情况。培养藻液每2 d取样1次, 设立平行组。每次取3 mL藻液, 10 000 r/min离心5 min收集藻细胞。加3 mL95%乙醇, 4 ℃冰箱放置 24 h 后5 000r/min离心5 min, 收集上清液, 测定其665、649和750 nm波长下的吸光度, 按公式Chla(mg/L) = (665−750) × 13.7 − (649−750) × 5.76算出叶绿素a含量。
1.2 培养基
藻种培养基(BG-11): NaNO31.5 g, Na2CO30.02 g, K2HPO40.04 g, CaCl2·7H2O 0.036 g, MgSO4·7H2O 0.075 g, 柠檬酸0.006 g,柠檬酸铁0.006 g, 微量元素溶液A51 mL, 蒸馏水1 000 mL, 琼脂20 g。
微量元素溶液A5: H3BO42.86g, MnCl2·4H2O 1.81g, ZnSO40.222g, Na2MoO40.39 g, CuSO4·5H2O 0.08 g, Co(NO3)2·6H2O 0.05g,蒸馏水1 000 mL。
细菌分离培养基(牛肉膏蛋白胨培养基): 蛋白胨10 g, 牛肉膏3 g, NaCl 5 g, 琼脂粉18 g, 蒸馏水1 L。
1.3 细菌的分离与培养
从环洞庭湖区养殖水体采集底泥样品, 在牛肉膏蛋白胨培养基上以稀释涂布法筛选出单菌落。将不同形态的分离纯化的单菌落划线接种至牛肉膏蛋白胨斜面上, 培养24 h后于4 ℃冰箱保存备用。
1.4 溶藻细菌的筛选
溶藻细菌的筛选结合安鑫龙与曹宾霞等研究方法[21–22], 具体步骤如下。
细菌的活化: 将保存于冰箱中的细菌划线接种到牛肉膏蛋白胨平板中, 取生长状况良好的单菌落接种到牛肉膏蛋白胨液体培养基中, 28 ℃, 150 r/min 的恒温摇床中活化培养。
初筛: 取分离纯化的单菌落中活化程度较好的17种细菌, 分别制成菌悬液, 将各菌种菌悬液(500 µL)与培养好的铜绿微囊藻(3 mL)按1∶6的比例混合, 放入光照培养箱培养, 25 ℃, 光照强度为2 000 Lux, 光暗比为12 h∶12 h, 培养3 d, 观察藻液是否产生黄化现象, 判断溶藻效果。每种菌处理设置2个平行组, 用不加菌液的铜绿微囊藻液做空白对照组(以下均称空白对照组)。
复筛: 将初筛所获具溶藻活性细菌活化和发酵培养, 按10%接种量分别将发酵液转接至含50 mL铜绿微囊藻液的250 mL三角瓶中, 25 ℃, 2 000 Lux, 光暗比12h∶12h, 光照培养3 d, 连续观察, 根据藻液开始黄化的时间及溶解的程度比较溶藻效果。实验重复3次, 设平行组及空白对照组。
1.5 溶藻物质的溶藻方式
细菌可以通过直接溶藻或间接溶藻方式抑制有害藻类的生长[23]。直接溶藻指溶藻细菌直接进攻宿主, 接触或入侵藻细胞溶藻[24]。间接溶藻指溶藻细菌通过营养竞争或分泌某种代谢产物来溶解藻类或抑制藻类生长[25]。
接种溶藻菌到牛肉膏蛋白胨液体培养基中, 置于150 r/min, 28 ℃的恒温摇床中培养24 h, 用培养后的发酵液制得无菌滤液和菌体重悬液, 然后按体积比1∶6比例分别将其加入相同浓度的铜绿微囊藻液中混合培养。设空白对照组及平行组, 培养3 d, 比较溶藻效果, 并取样在相差显微镜下观察藻细胞裂解情况, 显微拍照记录。
无菌滤液的制备: 10 000 r/min离心发酵液10 min, 收集上清液, 用0.22 µm滤膜过滤2次得到无菌滤液。
菌体重悬液的制备: 发酵培养液离心取完上清后的沉淀菌体, 用无菌蒸馏水洗涤, 再离心去掉上清液, 加入BG-11培养基制得菌体重悬液。
1.6 溶藻细菌生长曲线的测定
将溶藻菌F15活化培养12 h, 再取5 mL培养液于装有50 mL牛肉膏蛋白胨液体培养基的250 mL三角瓶中培养, 设平行组, 每2 h取样一次, 在波长600 nm处测量吸光度。
1.7 溶藻物质的稳定性测定
以培养过夜的F15菌株培养液制备无菌滤液(含溶藻物质), 进行溶藻物质的pH值、温度及紫外稳定性检测, 具体操作如下。
pH值稳定性测定: 将无菌滤液pH值分别调至5.0、7.0、9.0, 常温下保持2 h, 然后将pH值调回原液pH值(约8.0), 分别取500 µL溶液加入3 mL藻液混合培养, 设立平行组及空白对照组, 另取未做任何处理的无菌滤液与藻液共同培养作为阳性对照。按1.1方法中培养条件处理3 d后, 测定各处理组叶绿素a含量, 计算去藻率, 比较不同处理的溶藻效果。
温度稳定性测定: 将无菌滤液分别于60、80、100 ℃水浴加热处理1 h, 静置至室温后, 分别取500 µL加入3 mL藻液混合培养, 设立平行组及空白对照组。另取未做任何处理的无菌滤液与藻液共同培养作为阳性对照。按1.1方法中培养条件处理3 d后, 测定各处理组叶绿素a含量, 计算去藻率, 比较不同处理的溶藻效果。
紫外线稳定性测定: 在超净工作台, 将无菌滤液于365 nm紫外灯下分别照射10、30、60 min后, 分别取500 µL加入3 mL藻液混合培养, 设立平行组及空白对照组。另取未做任何处理的无菌滤液与藻液共同培养作为阳性对照。按1.1方法中培养条件处理3 d后, 测定各处理组叶绿素a含量, 计算去藻率, 比较不同处理的溶藻效果。
1.8 溶藻细菌F15的分子生物学鉴定
采用16S rDNA序列测定和同源性比较的方法, 热裂解法制备F15细菌基因组模板, 采用引物27F/ 1492R扩增其16S rDNA序列。PCR反应体系(50μL)为2×Taq Master Mix 25 μL, 10 μmol/L 27F和1492R引物各2 μL, DNA模版2 μL, ddH2O 19 μL。PCR反映条件为94 ℃预变性 5 min 后, 94 ℃变性30 s, 58 ℃退火30 s , 72 ℃延伸1.5 min, 30个循环, 最后72 ℃延伸5 min。琼脂糖凝胶电泳回收扩增产物送生工生物工程(上海)有限公司测序, GeneBank Blast同源性搜索对比分析测序结果, 下载相似度98%以上的序列, 使用MEGA5.2软件构建系统发育树。
2 结果与分析
2.1 铜绿微囊藻的生长曲线
采用叶绿素a测定方法对试验所用铜绿微囊藻FAC- HB 905进行生长测定, 生长曲线见图1。
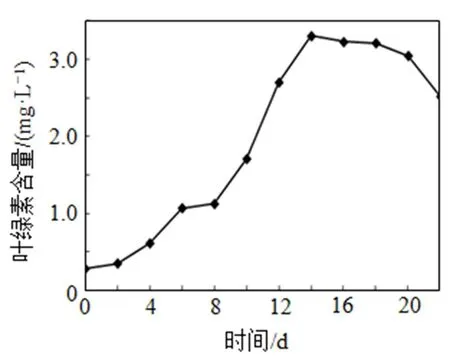
图1 铜绿微囊藻生长曲线
由图1可知, 铜绿微囊藻的生长适应期大约为2 d, 生长对数期2~14 d, 14 d后基本处于稳定期, 20 d后进入衰亡期。本试验中进行溶藻实验时一般取对数生长期的藻液。
2.2 溶藻细菌的筛选结果
从养殖水体底泥共分离纯化获得17株细菌, 采用试管培养法按菌藻体积比1∶6培养, 定时观察共培养液的颜色变化及形态变化。与空白组(CK管)对照, 共发现7株细菌(F15、F16、q、i、21、p、F18)菌悬液在与藻液共培养期间陆续出现不同程度的黄化现象, 至第3 d均出现十分明显的黄化现象(图2), 表明这7株细菌在与藻液共同培养的情况下对藻细胞都具有一定的溶解效果。随后进行三角瓶藻菌扩大共同培养, 从这7株菌株中复筛出一株高效溶藻的菌株F15, 该菌株对铜绿微囊藻的溶解效果相比其他菌株均要快速、彻底。

图2 7株细菌对铜绿微囊藻溶藻效果观察

CK: 空白对照; A: F15无菌滤液处理; B: F15菌体重悬液处理。
图3 F15菌株培养液不同组份对铜绿微囊藻的溶藻效果
2.3 溶藻细菌的溶藻方式
为探究溶藻细菌F15的溶藻方式, 以培养过夜的F15菌株无菌滤液及菌体重悬液分别处理铜绿微囊藻FACHB 905, 结果见图3。并取样于相差显微镜下观察藻细胞裂解情况, 结果见图4。
由图3可知: 与空白对照组相比, F15无菌滤液处理组的藻体基本完全黄化, 死亡的藻碎片聚集试管底部, 而F15菌体重悬液处理组没有出现明显黄化现象, 但共培养液的绿颜色明显浅于空白对照组。这说明F15主要是通过释放胞外溶藻物质裂解藻细胞, F15菌体与藻液共培养过程中也可能产生了少量的胞外溶藻物质, 在一定程度上抑制了铜绿微囊藻的生长。
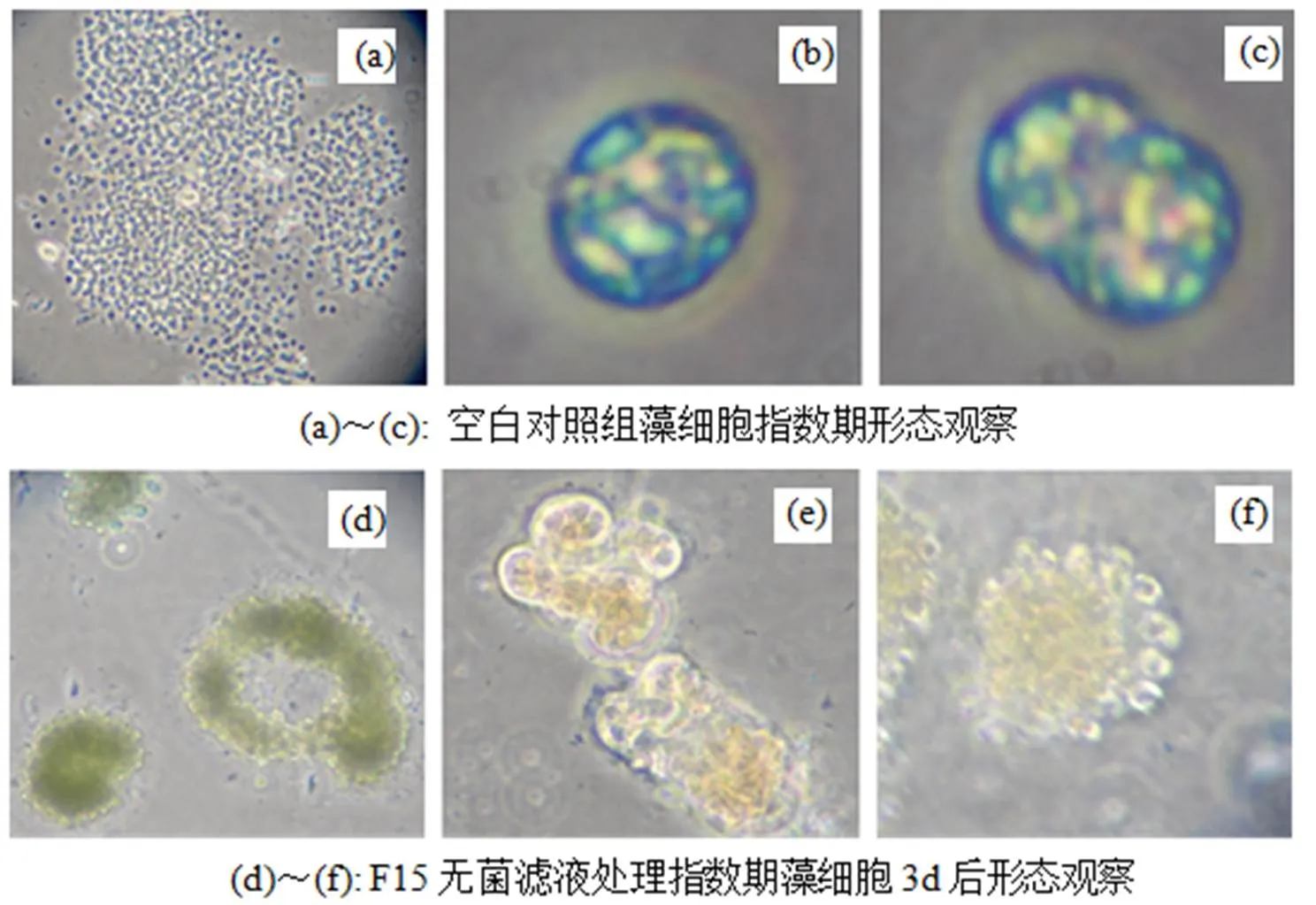
图(a)、(d)放大倍数100, 图(b)、(c)放大倍数1 000, 图(e)、(f)放大倍数为400。
图4 相差显微镜下F15菌株对铜绿微囊藻裂解作用观察
由图4可见, 空白对照组铜绿微囊藻细胞形态完整, 藻细胞分散(图4(a)), 细胞内大量颗粒状泡型假空泡。在相差显微镜下呈明显鲜艳的蓝绿色, 呈现特定的形状(图4(b)、4(c))。而F15无菌滤液处理组, 绝大多数藻细胞的形态都发生改变, 细胞团聚现象逐渐加剧(图4(d)), 随后细胞破裂, 胞内物质渗出, 出现许多细胞碎片。在相差显微镜下呈现颜色灰暗的黄色(图4(e)、4(f)), 同时观察到有少量细胞呈空泡状, 细胞未完全裂解, 但是胞内物质渗出。这表明F15的溶藻物质是通过破坏藻细胞膜内物质的结构和细胞膜的完整性, 使细胞膜内物质流出导致藻细胞裂解死亡的。
2.4 F15菌株的不同生长阶段对溶藻效果的影响
为研究F15菌株不同生长阶段溶藻活性物质的产生情况, 首先测定了F15菌株的生长曲线(图5), 然后分别取不同生长时期的菌液与藻液共培养, 比较其溶藻效果, 结果见图6。
由图5可知, F15的生长延滞期为0~4 h, 生长对数期为4~20 h, 20 h后进入稳定期。
由图6可知, 对数生长期(12 h)的F15对铜绿微囊藻溶解效果最好, 去藻率达57.3%。处于停滞期(4 h)和稳定期(24 h)的F15溶藻效果相对低一些, 去藻率分别为55.9%和56.2%, 但没有显著差异(>0.05)。这说明F15的不同生长阶段对溶藻效果没有显著影响。

图5 F15菌株的生长曲线
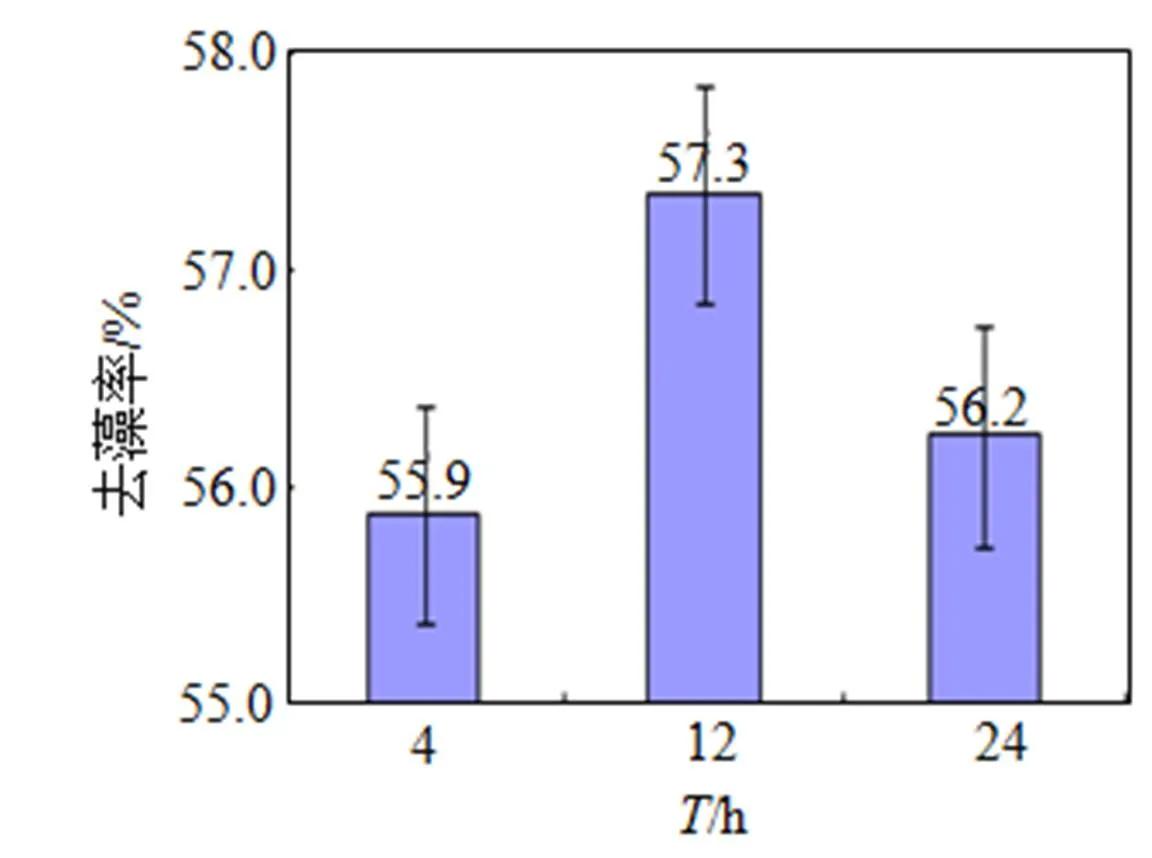
图6 不同生长阶段F15菌株的溶藻效果比较
2.5 F15菌株溶藻物质的稳定性测定
F15菌株溶藻物质对pH值、温度及紫外照射稳定性检测结果见图7。
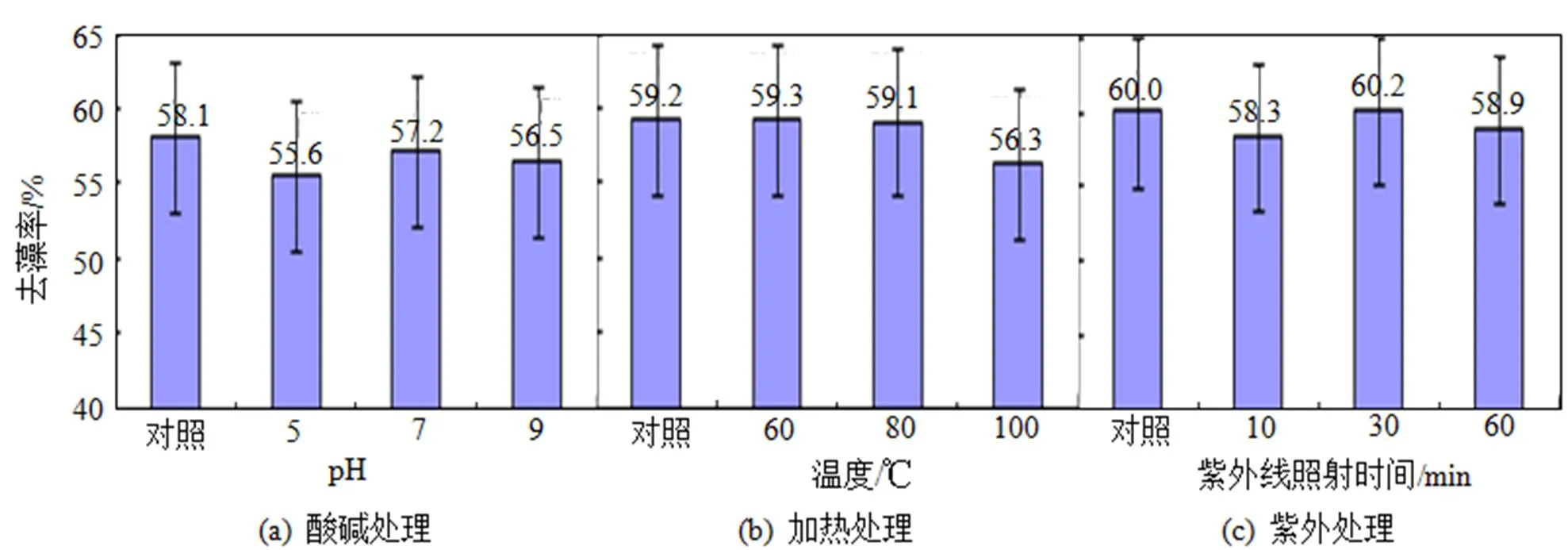
图7 不同处理的F15溶藻物质对铜绿微囊藻溶藻效果比较(对照pH8.0)

M—DL2000 DNA Marker; 1~3—F15菌16S rDNA 基因PCR扩增产物。
图8 溶藻细菌F15的16S rDNA基因PCR扩增产物凝胶电泳检测
由图7可知, F15菌株溶藻物质经酸碱处理后, 其去藻率略有下降, 分别为55.6%(pH调至5.0)、57.2%(pH调至7.0)和56.5%(pH调至9.0)(图7(a)), 但与阳性对照组去藻率(平均为58.1%)相比没有显著差异(>0.05), 这说明该溶藻物质对酸碱稳定。对溶藻物质采取60、80甚至100 ℃高温处理以及10~60 min的紫外照射, 其去藻率与阳性对照相比也没有显著差异(图7(b)、7(c)), 这说明菌株F15的溶藻活性产物对加热及紫外线处理均具有较好的稳定性。
2.6 F15菌株的分子生物学鉴定结果
以27F和1492R为引物, PCR扩增溶藻细菌F15的16S rDNA基因, 通过琼脂糖凝胶检测获得1.5 kb左右大小的清晰条带, 且特异性好(图8)。

图9 溶藻细菌F15 16S rDNA基因序列的系统发育树
16S rDNA基因测序后在网上进行 Blast 比对序列分析结果表明溶藻细菌F15属于芽孢杆菌属(sp.)。基于 16S rDNA 构建的系统发育树见图9。由图9可见, F15与聚为一簇, 亲缘关系最近, 因此鉴定为蜡样芽孢杆菌。
3 结论
目前水体富营养化已成为全球关注的水环境问题, 我国养殖水体水华频发, 造成的环境和经济问题日益引起高度重视。本研究以指数生长期铜绿微囊藻为受试藻种, 从环洞庭湖区养殖水体底泥中筛选获得7株具有溶藻活性的细菌, 其中F15菌株溶藻活性最好(图2), 且细菌各生长时期的溶藻活性没有显著差异(图6)。F15溶藻活性物质主要为胞外产物, 将其发酵样品的无菌滤液(即活性物质粗提物)按1∶6比例与铜绿微囊藻混合培养3 d, 去藻率达55%以上, 同时其单独的菌体重悬液对铜绿微囊藻生长也有一定的抑制作用。这说明F15菌株无论是在细菌培养基, 还是在藻种培养基内均能产生溶藻活性物质, 发挥溶藻作用。因此, 该菌在蓝藻水华微生态调控制剂开发上可能具有潜在的应用价值。
F15菌株发酵后无菌滤液与菌体的溶藻效果比较, 前者明显优于后者(图3), 说明菌株F15主要是通过分泌胞外产物溶解铜绿微囊藻间接溶藻。显微观察结果显示F15的溶藻物质是通过破坏藻细胞膜内物质的结构和细胞膜的完整性, 使细胞膜内物质流出导致藻细胞裂解死亡的。
F15菌溶藻活性物质在不同温度、酸碱度以及紫外照射等条件处理下都具有较好的稳定性。采集草鱼精养池塘水华(镜检优势藻种为水华微囊藻), 以F15发酵后无菌滤液进行处理, 亦表现了良好的溶藻效果, 这为利用溶藻细菌F15控制藻类危害的实际应用提供了一定的理论依据。
本试验以无菌藻种, FACHB 905为材料, 排除其他微生物的干扰, 真实地反映藻类细胞与F15细菌之间的关系, 但在实际的养殖水中藻菌关系比较复杂, 水华多是优势藻种与细菌菌群的混合体, 有关F15菌株是否具有选择性溶藻特性、调控菌藻平衡的机理及其生物安全性还有待进一步研究。
[1] 石志中, 陈鹤平, 王建华, 等. 池塘微囊藻水华的研究与治理[J]. 淡水渔业, 2000, 30(4): 37–39.
[2] Alexova R, Fujii M, Birch D, et al. Iron uptake and toxin synthesis in the bloomforming Microcystis aeruginosa under iron limitation [J]. Environmental Microbiology, 2011, 13(4): 1 064–1 077.
[3] 张世羊, 成水平, 贺锋, 等. 两种不同株铜绿微囊藻培养液对大型溞的毒性效应研究[J]. 水生生物学报, 2008, 32(5): 637–642.
[4] 王吴, 徐立红. 微囊藻毒素研究的当前进展和未来方向[J]. 水生生物学报, 2011, 35(3): 504–515.
[5] 陆开宏, 金春华, 王扬才. 罗非鱼对蓝藻的摄食消化及对富营养化水体水华的控制[J]. 水产学报, 2006, 29(6): 811–818.
[6] 刘光涛, 周长芳, 孙利芳, 等. 凤眼莲化感物质对铜绿微囊藻, 斜生栅藻生长及细胞数相对比例的影响[J]. 环境科学学报, 2011, 31(10): 2 303–2 311.
[7] 高云霓, 刘碧云, 王静, 等. 苦草释放的酚酸类物质对铜绿微囊藻()的化感作用[J]. 湖泊科学, 2011, 23(5): 761–766.
[8] 吴刚, 席宇, 赵以军. 溶藻细菌研究的最新进展[J].环境科学研究, 2002, 15(5): 43–46.
[9] 史顺玉, 刘永定, 沈银武. 细菌溶藻的初步研究[J]. 水生生物学报, 2004, 28(2): 219–221.
[10] 王祥荣, 胡欢, 母锐敏, 等. 1 株铜绿微囊藻降解菌的分离鉴定及其溶藻特征[J]. 复旦学报(自然科学版), 2010, 49(1): 94–98.
[11] 裴海燕, 胡文容, 曲音波, 等. 一株溶藻细菌的分离鉴定及其溶藻特性研究 [J].环境科学学报, 2005, 25(6): 796– 780.
[12] 梁锏文, 林炜铁. 溶藻放线菌的分离鉴定及其溶藻特性[J]. 环境科学与技术, 2009, 32(9): 69–72.
[13] Nakamura N, Nakano K, Sugiura N, et a1. A novel cyanobacteriolytic bacterium.. isolated from a eutrophic lake [J]. Journal of Bioscience and Bioengineering, 2003, 95(2): 179–184.
[14] Lee S, Kato J, Takiguchi N, et al. Involvement of an extracellular protease in algicidal activity of the marine bacterium. Strain A28 [J]. Applied and Environmental Microbiology, 2000, 66(1): 4 334–4 339.
[15] 余甜甜, 张炳火, 李汉全, 等.一株放线菌对铜绿微囊藻的溶藻活性[J]. 生态与农村环境学报, 2011,27(2): 58–63.
[16] Kodani S, Imoto A, Mitsutani A. Isolation and identification of the antialgal compound, harmane(1-methyl-β -carboline), produced by the algicidal bacterium,. K44-1 [J]. Journal of Applied Phycology, 2002,14(2): 109–114.
[17] 罗固源, 刘静, 王金霞, 等. 一株溶藻细菌对铜绿微囊藻的溶藻机理初探[J]. 生态环境学报, 2010, 19(11): 2 647– 2 651.
[18] 晋利, 刘兆普, 赵耕毛, 等. 一株溶藻细菌对铜绿微囊藻生长的影响及鉴定[J]. 中国环境科学, 2010, 30(2): 222–227.
[19] Wang H, Liu L, Liu Z P, et al. Investigations of the characteristics and mode of action of an algalytic bacterium isolated from Tai Lake [J]. Journal of applied phycology, 2010, 22(4): 473–478.
[20] 李保珍, 冯佳, 谢树莲. 光合细菌对铜绿微囊藻生长的抑制效应[J]. 生态环境学报, 2009, 18(5): 1 736–1 740.
[21] 安鑫龙, 李豫红, 李艳红, 等. 溶藻微生物的研究方法[J]. 水利渔业, 2005, 25(2):17–18.
[22] 曹宾霞, 王耀兵, 赵水晶, 等. 塔玛亚历山大藻溶藻细菌筛选方法的初步研究[J]. 海洋环境科学, 2008, 27(2): 186– 189.
[23] 邓建明, 陶勇, 李大平, 等. 溶藻细菌及其分子生物学研究进展[J]. 应用与环境生物学报, 2009, 15(6): 895–900.
[24] Lee Y K, Ahn C Y, Kim H S et al. Cyanobactericidal effect of Rhodococcus sp. isolated from eutrophic lake on Microcystis sp [J]. Biotechnology Letters. 2010, 32 (11): 1 673–1 678.
[25] Doucette G J, McGovern E R, Babinchak J A. Algicidal bacteria active against Gymnodinium breve (Dinophyceae). I. Bacterial isolation and characterization of killing activity [J]. Journal of Phycology, 1999, 35: 1 447–1 454.
(责任编校:刘刚毅)
Isolation, screening and molecular identification of an algae- lying bacterium
Zhu Xiaoman, Luo Yushuang, Zou Wansheng, Xiong Peng, Pan Hui, Li Hongli
(Collaborative Innovation Center for Efficient and Health Production in Hunan Province, Hunan University of Arts and Science, Changde 415000, China; Key Laboratory of Health Aquaculture and Product Processing in Dongting Lake Area of Hunan Province, Hunan University of Arts and Science, Changde 415000, China ; Zoology Key Laboratory of Hunan Higher Education, Hunan University of Arts and Science, Changde 415000, China)
Isolation, screening and identification of algae-lying bacteria againstfrom bottom sediment of the fresh-water cultured bases. Bacteria with high algicidal activity againstwere screened by tube methods, the mode of algicidal action was observed by microscope, its thermal stability, acid alkaline and ultraviolet-resistant were assessed. The isolated algicidal bacterium was identified by 16S rDNA gene sequence analysis. Seven algae-lying bacteria were obtained, of these, F15 strain has the best lying effect against. The algae-lying substance of F15 strain was extracellular products, it has the highest lytic efficiency at logarithmic growth station, more than 55%ofhad been removed by 3 days after adding the extracellular products with 1:6 volume ratio. It was stability to heat, pH and ultra-violet radiation.The 16S rDNA sequence analysis of F15 strain showed that it is homology withstrain ATCC 14579, the similarity was up to 99%. F15 strain was identified as. Taken together, F15 strain has a great algicidal effect and a high stability, suggested that it has potential value for the development of biological agent against.
;algae-lying bacteria; isolation and screening; algicidal characteristics; molecul- ar identification
10.3969/j.issn.1672–6146.2017.01.007
Q 959
A
1672–6146(2017)01–0028–07
朱晓漫, 358108634@qq.com;罗玉双, luofish2014@126.com。
2016–11–09
湖南省科技计划项目(No.2012FJ3091); 湖南省高校创新平台开放基金项目(12K121); 湖南省“十二五”重点建设学科(动物学); 2015年湖南文理学院大学生创新创业研究项目(ZD1507); 2015年湖南文理学院研究性教学课程项目。
