埃索美拉唑钠原料药残留溶剂的测定
2017-02-10李佑达张玲谭淑珍王述维
李佑达, 张玲, 谭淑珍, 王述维
埃索美拉唑钠原料药残留溶剂的测定
李佑达1, 张玲1, 谭淑珍1, 王述维2
(1. 长沙理工大学化学与生物工程学院, 湖南长沙, 410114; 2. 长沙市如虹医药科技股份有限公司, 湖南长沙, 410007)
利用顶空气相色谱法测定了埃索美拉唑钠原料药中6种有机溶剂的含量。在该色谱条件下, 6种有机溶剂均能彼此完全分离, 峰面积与浓度呈现良好线性关系, 相关系数均大于0.990。检出限(3S/N)分别为1.52、7.37、2.54、0.17、4.37、0.67 μg/mL, 定量限(10S/N)分别为2.83、10.92、7.93、0.34、9.83、2.69 μg/mL。平均回收率均在98.74%~108.59%范围内。该方法适用于实际样品的残留溶剂测定。
气相色谱法; 顶空进样; 埃索美拉唑钠; 残留溶剂
埃索美拉唑(esopmeprazole)是奥美拉唑的S-异构体, 是第一个发展为异构体的质子泵抑制剂[1]。该药主要用于治疗胃食管反流病、幽门螺杆菌阳性的消化性溃疡及与胃酸相关的消化系统疾病[2-4], 与奥美拉唑或R-奥美拉唑异构体相比, 埃索美拉唑口服后肝脏代谢率明显偏低, 能更持久强效地抑制胃酸分泌[5-6]。不同企业在生产埃索美拉唑钠时, 往往采用不同的合成路线及精制工艺, 从而导致所采用的溶剂品种不同。
本研究小组与湖南如虹制药有限公司合作, 联合开发了埃索美拉唑钠的制备新工艺。该工艺中使用了丙酮、二氯甲烷、乙酸乙酯、正庚烷、甲基异丁基酮和甲苯作为反应溶剂或萃取剂, 这些溶剂在成品中均可能有残留。为了确保用药安全, 必须对各溶剂的残留进行严格控制。根据中国药典要求, 乙酸乙酯、丙酮、正庚烷和甲基异丁基酮均属于三类溶剂, 在原料药中允许的残留限度均为0.5%; 甲苯和二氯甲烷均属于二类溶剂, 在原料药中允许的残留限度分别为0.089%和0.06%[7]。湖南如虹制药有限公司拟订的产品质量标准为甲苯残留量不得过0.03%, 其他溶剂的残留限度均按药典标准执行。
气相色谱法具有分离效率高、分析速度快、灵敏度高、选择性好等优点, 是药品中残留溶剂检测的首选方法[8-13]。埃索美拉唑钠本身不容易挥发, 而热稳定性又较差, 温度高时容易发生分解, 若采取直接进样方式进行气相色谱测定, 易造成进样口堵塞, 同时其热分解产物对残留溶剂的测定容易产生干扰。故本文拟采取顶空进样方式, 利用气相色谱法对埃索美拉唑钠原料药中残留溶剂进行测定。探索测定的最佳条件, 建立能灵敏和准确地测定埃索美拉唑钠原料药中6种残留溶剂的分析方法, 并通过系统的方法学验证, 检验所建立方法的可行性。
1 材料与方法
1.1 仪器与试剂
仪器: Agilent 6890气相色谱仪, DK-3001A顶空进样器(北京中兴分析仪器技术研究所)。
试剂: 丙酮、二氯甲烷、乙酸乙酯、正庚烷、甲基异丁基酮、甲苯的对照品和N, N二甲基甲酰胺(DMF)均为分析纯; 埃索美拉唑钠供试品由湖南如虹制药有限公司提供(批号: 150922、150929、151009)。
1.2 溶液的配制
各残留溶剂的对照品贮备液。称取某溶剂对照品适量, 用DMF溶解并定量稀释即得。丙酮、二氯甲烷、乙酸乙酯、正庚烷、甲基异丁基酮和甲苯的对照品贮备液的浓度分别为5 434、682.0、5 716、5 256、5 460、335.8 μg/mL。
各残留溶剂的对照品溶液。取上述某一残留溶剂的对照品贮备液适量, 用DMF进行定量稀释即得该残留溶剂的对照品溶液。丙酮、二氯甲烷、乙酸乙酯、正庚烷、甲基异丁基酮和甲苯的对照品溶液的准确浓度分别为543.4、68.2、571.6、525.6、546.0、33.58 μg/mL。
残留溶剂的混合对照品溶液。于100 mL容量瓶中, 分别准确加入上述6种残留溶剂对照品贮备溶液各10.00 mL, 然后用DMF稀释至刻度, 摇匀, 即得。
供试品溶液。取埃索美拉唑钠供试品约0.5 g, 精密称定, 置于20 mL顶空瓶中, 精密加入N, N-二甲基甲酰胺5 mL使溶解, 密封瓶口, 作为供试品溶液。
空白溶液。量取N, N-二甲基甲酰胺5 mL, 置20 mL顶空瓶中, 密封瓶口, 作为空白溶液。
1.3 色谱条件及方法
测定条件: 采用Agilent DB-624毛细管柱(30 m × 0.32 mm × 1.8 μm)测定; 柱温采取程序升温方式, 升温程序为40 ℃保持2 min, 然后以30 ℃/min的速率升温至230 ℃, 保持10 min; 进样口温度为200 ℃; 检测器温度为250 ℃; 进样量为1 mL; 载气为N2; 载气流速为2.0 mL/min; 分流比为5∶1; 顶空平衡温度为90 ℃; 顶空平衡时间为30 min; 阀箱温度为110 ℃; 管路温度为130 ℃。
测定方法。量取对照品溶液或供试品溶液5.00 mL, 密封于20 mL顶空瓶中, 经顶空平衡后, 量取其顶端气体1 mL, 注入气相色谱仪, 记录色谱图, 按外标法以峰面积来计算各残留溶剂的浓度或含量。
2 结果与分析
2.1 色谱条件的选择
2.1.1 溶解样品的溶剂及稀释剂的选择
埃索美拉唑钠易溶于水、二甲基亚砜、N, N-二甲基甲酰胺、N, N-二甲基乙酰胺等溶剂中。埃索美拉唑钠在水中溶解后稳定性较差、易降解, 降解的部分产物可能会干扰测定; 二甲基亚砜在室温较低时易凝固、黏度较大, 用它作溶剂时在冬天使用不太方便; N, N-二甲基甲酰胺比N, N-二甲基乙酰胺价格更便宜, 故选择DMF作为溶解样品的溶剂及稀释剂。
2.1.2 色谱柱类型及分离温度的选择
Agilent DB-624毛细管柱是固定液为(6%)氰丙基苯基-(94%)二甲基聚硅氧烷的毛细管柱, 其极性中等, 丙酮、二氯甲烷、乙酸乙酯、甲基异丁基酮和甲苯均为极性中等的溶剂, 按照“相似相溶”的原则, 选择该柱作为分析柱比较合适。当色谱柱的温度采用恒定温度如60 ℃进行检测时, 由于上述6种残留溶剂的沸点范围较宽, 所有组分均完成出峰所需的时间太长, 而且甲苯的响应值太小, 灵敏度低, 典型图谱见图1(a); 当色谱柱的温度采取程序升温方式时, 试验了不同的升温程序, 结果发现采取1.3中给定的条件升温时, 混合对照品溶液中各组分均能彼此完全分离, 空白溶液(DMF)对测定无干扰, 完成一次样品分析所需时间较短, 典型图谱见图1(b), 故在测定埃索美拉唑钠原料药中残留溶剂时, 色谱柱温度采用1.3中给定的条件升温。
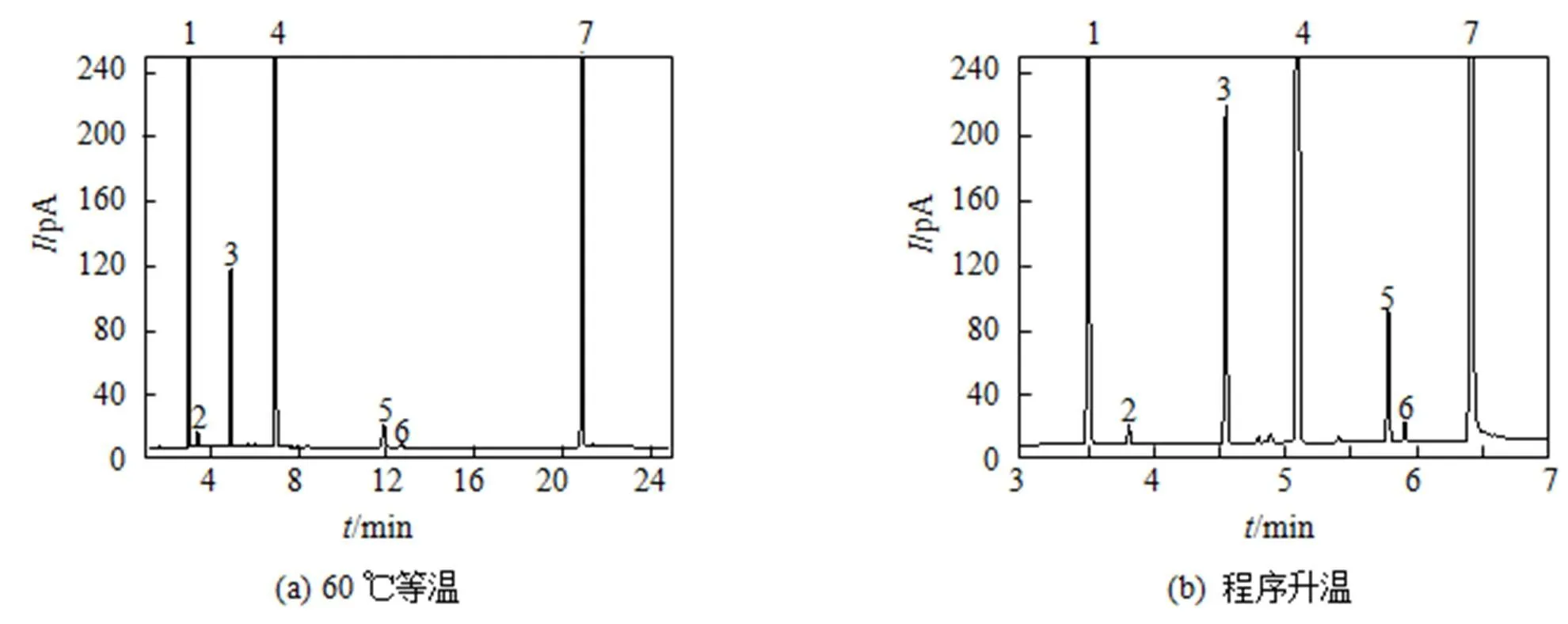
1—丙酮; 2—二氯甲烷; 3—乙酸乙酯; 4—正庚烷; 5—甲基异丁基酮; 6—甲苯; 7—溶剂。
图1 残留溶剂的混合对照品溶液在不同升温程序下的典型色谱图
2.1.3 顶空平衡条件的选择
将混合对照品溶液分别在80、90、100 ℃下进样分析, 各溶剂的峰面积随温度升高而增大。为提高试验的灵敏度, 同时避免DMF的分压过高, 选择顶空平衡温度为90 ℃; 将混合对照品溶液在90 ℃下分别平衡30 min和40 min后进样分析, 各溶剂峰面积基本维持不变, 这表明顶空瓶中气-液两相已达平衡, 故选择顶空平衡温度为90 ℃、顶空平衡时间为30 min。
通过上述一系列试验, 得到了埃索美拉唑钠原料药中残留溶剂测定的优化条件, 具体内容见1.3。
2.2 分析方法的验证
为了检验1.3节中测定条件及方法的可行性, 从以下几个方面进行了方法学的验证。
2.2.1 专属性和系统适用性
分别取空白溶剂和混合对照品溶液, 按1.3节的色谱条件及方法进行测定, 结果表明空白溶剂对测定无干扰、各残留溶剂峰均能彼此分离, 各相邻峰之间的分离度均大于1.5。再取混合对照品溶液, 连续测定5次, 所得色谱图中各残留溶剂保留时间的相对标准偏差均小于1.0%, 各残留溶剂峰面积的相对标准偏差均小于10%, 理论塔板数按各残留溶剂计均大于5 000, 各残留溶剂峰的拖尾因子均小于2.0, 各相邻峰之间的分离度均大于1.5, 这些结果均表明本方法的系统适用性良好。
2.2.2 检出限与定量限
精密量取某溶剂的对照品溶液适量, 用DMF逐级稀释, 配制成一系列已知浓度的该溶剂对照品溶液, 取样进行气相色谱分析。丙酮、二氯甲烷、乙酸乙酯、正庚烷、甲基异丁基酮和甲苯的检出限(3S/N)分别为1.52、7.37、2.54、0.17、4.37、0.67 μg/mL, 相当于在供试品中的含量分别为0.001 5%、0.007 4%、0.002 5%、0.000 2%、0.004 4%、0.000 7%; 定量限(10S/N)分别为2.83、10.92、7.93、0.34、9.83、2.69 μg/mL, 相当于在供试品中的含量分别为0.002 8%、0.011 0%、0.007 9%、0.000 3%、0.009 8%、0.002 7%。
2.2.3 线性关系
量取各残留溶剂对照品贮备溶液适量, 用DMF稀释成不同浓度的线性溶液, 各线性溶液的组成见表1。

表1 各线性溶液中各残留溶剂的浓度 /(µg·mL-1) 线性溶液丙酮二氯甲烷乙酸乙酯正庚烷甲基异丁基酮甲苯 A1 087136.401 1431 0511 09267.20 B815.3102.30857.4788.4819.050.40 C543.5 68.20571.6525.6546.033.60 D271.8 34.10285.8262.8273.016.80 E135.9 17.05142.9131.4136.5 8.40 F54.40 6.8257.2052.6054.60 3.40
分别量取各线性溶液5.00 mL, 密封于20 mL顶空瓶中, 按照1.3节中的色谱条件和方法进行测定。 以各残留溶剂的浓度()为横坐标, 以各残留溶剂的峰面积()为纵坐标作图, 并进行线性回归, 具体结果见表2。结果表明各残留溶剂的峰面积与浓度的线性关系良好, 相关系数均大于0.990 0。
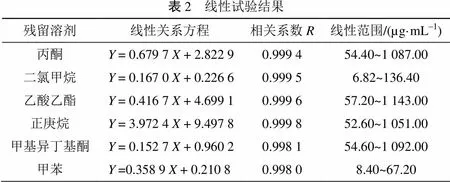
表2 线性试验结果 残留溶剂线性关系方程相关系数R线性范围/(µg·mL-1) 丙酮Y = 0.679 7 X + 2.822 90.999 454.40~1 087.00 二氯甲烷Y = 0.167 0 X + 0.226 60.999 56.82~136.40 乙酸乙酯Y = 0.416 7 X + 4.699 10.999 657.20~1 143.00 正庚烷Y = 3.972 4 X + 9.497 80.999 852.60~1 051.00 甲基异丁基酮Y = 0.152 7 X + 0.960 20.998 154.60~1 092.00 甲苯Y =0.358 9 X + 0.210 80.998 08.40~67.20
2.2.4 精密度试验
通过对埃索美拉唑钠3批供试品的初步检验发现, 只有正庚烷和乙酸乙酯被检出, 其他溶剂均未被检出。批号为150922的样品中乙酸乙酯和正庚烷含量经检测分别为0.23%、0.28%。为了检验本方法测定供试品中可能存在的各种残留溶剂的精密度, 特向供试品溶液中加入丙酮、二氯甲烷、甲基异丁基酮和甲苯, 构成精密度试验溶液, 利用此溶液来检验本方法的精密度。
(1) 供试品贮备溶液的配制。取埃索美拉唑钠(批号: 150922)约50 g, 精密称定为50.013 5 g, 用DMF溶解并定量稀释至100 mL, 所得溶液的准确浓度为500.135 mg/mL。
(2) 精密度试验溶液的配制。于50 mL容量瓶中, 准确加入上述埃索美拉唑钠供试品贮备溶液10.00 mL, 再分别加入丙酮、二氯甲烷、甲基异丁基酮、甲苯的对照品贮备溶液各5.00 mL, 最后用DMF稀释至刻度, 摇匀, 即得。同法配制6份。
(3) 精密度试验方法及结果。依次精密量取各精密度试验溶液5.00 mL, 分别密封于不同的20 mL顶空瓶中, 按照1.3节中的色谱条件和方法进行测定, 所得丙酮、二氯甲烷、甲基异丁基酮、甲苯峰面积的相对标准偏差分别为1.4%、1.7%、2.1%、3.0%, 表明本方法的精密度良好。
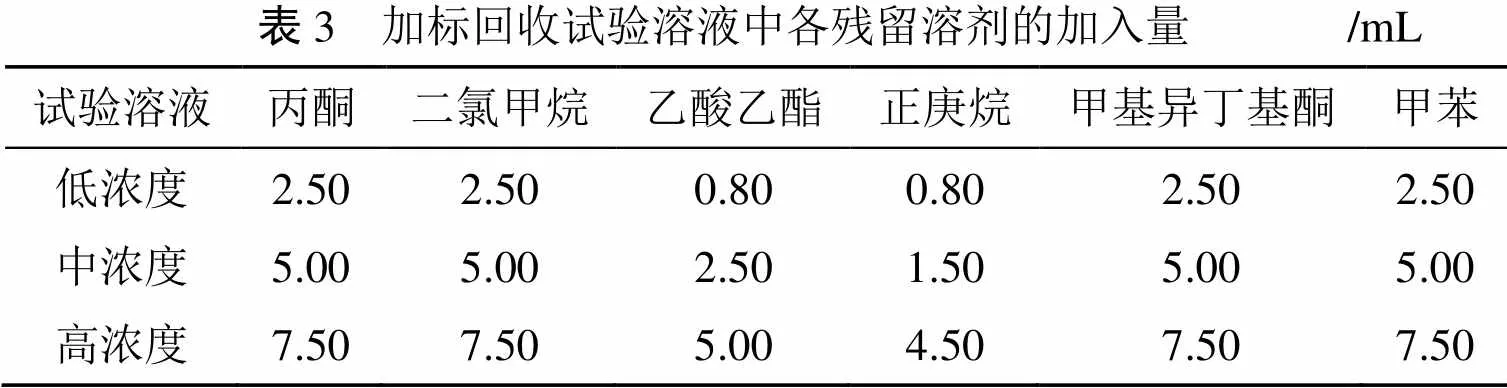
表3 加标回收试验溶液中各残留溶剂的加入量 /mL 试验溶液丙酮二氯甲烷乙酸乙酯正庚烷甲基异丁基酮甲苯 低浓度2.502.500.800.802.502.50 中浓度5.005.002.501.505.005.00 高浓度7.507.505.004.507.507.50
2.2.5 加标回收试验
(1) 加标回收试验溶液的配制。于50 mL容量瓶中, 准确加入1.2节中的供试品贮备溶液10.00 mL, 然后分别加入丙酮、二氯甲烷、乙酸乙酯、正庚烷、甲基异丁基酮、甲苯的对照品贮备溶液各适量, 最后用DMF稀释至刻度, 制得低、中、高3种浓度下的加标回收试验溶液各3份。

表4 回收率试验结果 溶剂回收率/%平均回收率/%RSD/% 低中高 丙酮105.60 99.21 97.32100.714.31 二氯甲烷102.39 99.21 98.12 99.912.22 乙酸乙酯105.87110.79109.11108.592.31 正庚烷 99.74 96.22100.26 98.742.23 甲基异丁基酮 98.62101.32105.57101.843.44 甲苯 99.81 94.37104.06 99.414.89
(2) 加标回收试验方法及结果。依次精密量取各加标回收试验溶液5.00 mL, 分别密封于不同的20 mL顶空瓶中, 按照1.3节中的色谱条件和方法进行测定, 所得结果见表4。由表4可知, 各残留溶剂的平均回收率均在98.74%~108.59%之间, 表明本方法的准确度高。
2.3 实际样品的测定
取埃索美拉唑钠供试品2批(批号: 150929、151009), 按1.2节中方法配制成供试品溶液, 按照1.3节中色谱条件及方法进行测定, 3批样品中乙酸乙酯含量分别为0.23%、0.24%, 正庚烷含量分别为0.30%、0.29%, 其他溶剂均未被检出。
3 结论
本研究应用顶空气相色谱法测定埃索美拉唑钠原料药中残留溶剂的含量, 实验结果表明, 各溶剂的峰面积与浓度的线性关系良好(相关系数均超过0.990)、线性范围宽, 各残留溶剂的加标回收率均在98.74%~108.59%范围内, 该方法适用于埃索美拉唑钠原料药中残留溶剂的测定。
[1] Hanna Cotton, Thomas Elebring, Magnus Larsson, et al. Asymmetric synthesis of esomeprazole [J]. Tetrahedron: Asymmetry, 2000, 11(18): 3 819–3 825.
[2] Lesley J, Christopher J, Gordon M, et a1. Esomeprazole: A review of its use in the management of Acid-Related disorders [J]. Drugs, 2002, 62(10): 1 503–1 538.
[3] Geoffrey Davidson, Mbbs, M D, Tobias G, et al. Efficacy and safety of once-daily esomeprazole for the treatment of gastroesophageal reflux disease in neonatal patients [J]. The Journal of Pediatrics, 2013, 163(3): 692–698.
[4] 彭兰, 冯琦, 李昌平, 等. 埃索美拉唑与奥美拉唑治疗反流性食管炎的疗效观察[J]. 西部医学, 2009, 21(6): 962– 966.
[5] 肖冬媛. 埃索美拉唑与奥美拉唑治疗胃溃疡的临床对比分析[J]. 中国现代药物, 2016, 10(1): 136–137.
[6] Xiao D Y.Clinical comparison of esomeprazole and omeprazole in the treatment of gastric ulcer [J]. Chinese Journal of Modern Medicine, 2016, 10(1): 136–137.
[7] 牛春燕, 罗金燕, 王学勤, 等. CYP2C19基因多态性对埃索美拉唑乙酸效应的影响[J]. 西安交通大学学报, 2014, 25(5): 487–489.
[8] 国家药典委员会. 中华人民共和国药典[M]. 北京: 中国医药科技出版社, 2015: 105–109.
[9] Colin D M, Jacob Kay, Yi Li, et a1. Quantification of residual solvents in antibody drug conjugates using gas chromatography [J]. Analytica Chimica Acta, 2014, 850(19): 92–96.
[10] Carla M T, Milagros Montemurro, María M, et a1. Multiple responses optimization in the development of a headspace gas chromatography method for the determination of residual solvents in pharmaceuticals [J]. Journal of Pharmaceutical Analysis, 2015, 5(5): 296–306.
[11] Yu Y J, Chen B, Shen C D, et a1. Multiple headspace single-drop microextraction coupled with gas chromatography for direct determination of residual solvents in solid drug product [J]. Journal of Chromatography A, 2010, 1217(32): 5 158– 5 164.
[12] Raquel O, Guillem C, Joan F D, et a1. Static headspace gas chromatographic method for quantitative determination of residual solvents in pharmaceutical drug substances according to European Pharmacopoeia requirements [J]. Journal of Chromatography A, 2004, 1057(1-2): 193–201.
[13] 刘薇芝, 胡汉昆, 刘萍, 等. 顶空毛细管气相色谱法测定硝酸异康唑中5种有机溶剂残留[J]. 中国医院药学杂志, 2016, 36(1): 9–12.
(责任编校:刘晓霞)
Determination of residual solvents for drug substances of Esomeprazole Sodium
Li Youda1, Zhang Ling1, Tan Shuzhen1, Wang Shuwei2
(1. College of Chemistry and Biological Engineering, Changsha University of Science and Technology, Changsha 410114, China; 2. Changsha RHON Pharmaceutical Science and Technology Co. Ltd, Changsha 410007, China)
A gas chromatography (GC) method is developed for determination of six residual solvents including acetone, dichloromethane, ethyl acetate,-heptane, methyl isobutyl ketone and toluene in the drug substance of Esomeprazole Sodium. The six residual solvents are separated completely under the given chromatogram system. The calibration curve of each solvent shows that it is a good linear relationship, and the correlation coefficientsofeach solvent is more than 0.990; the limits of detection (3S/N) are listed as 1.52, 7.37, 2.54, 0.17, 4.37 and 0.67 μg/mL, and the limits of quantitation (10S/N) are 2.83, 10.92, 7.93, 0.34, 9.83, 2.69 μg/mL, respectively; the meanrecoveries of each solvent were all in the range of 98.74%~108.59%. The method is suitable for determination of residual solvents in practical samples.
gas chromatography; headspace sampling; Esomeprazole Sodium; residual solvent
10.3969/j.issn.1672–6146.2017.01.005
O 657.71
A
1672–6146(2017)01–0019–05
张玲, 274248988@qq.com。
2016-06-07
湖南省教育厅科研项目(14A012)。
