反应激活型酶荧光探针的研究进展
2017-01-19钱明张留伟王静云
钱明,张留伟,王静云
(大连理工大学生命科学与技术学院,辽宁 大连 116024)
反应激活型酶荧光探针的研究进展
钱明,张留伟,王静云
(大连理工大学生命科学与技术学院,辽宁 大连 116024)
酶在维持生物体内稳态与生命活动的正常运行方面发挥着举足轻重的作用。某些特定酶含量及活性的异常与人类重大疾病的发生与发展密切相关。因此,生物体内特定酶的实时原位检测及可视化成像具有重要的意义。化学荧光探针具有选择性好、灵敏度高及高时空分辨率可视化成像等优点,近年来研究者设计合成了大量的可用于生物体系内酶识别与可视化成像的荧光探针。目前识别酶的荧光探针主要有两类:(1)基于酶对荧光探针分子中酶抑制剂基团的识别引起探针荧光信号的变化;(2)基于酶对荧光探针特异性催化反应来实现识别前后荧光信号的激活,称为反应激活型酶荧光探针。对反应激活型酶荧光探针的设计策略及4种重大疾病相关的生物标志酶(单胺氧化酶、β-半乳糖苷酶、硝基还原酶、γ-谷氨酰转肽酶)的识别可视化荧光探针研究进展进行了综述,对未来酶识别荧光探针的研究方向进行了展望。
荧光;探针;酶;成像;细胞生物学
引 言
酶是细胞内一种具有催化效应的生物大分子,在维持生命活动的正常运行过程中扮演着不可或缺的角色。特定酶含量及活性的异常通常与某些疾病的发生和发展密切相关[1],如某些癌症的发生与 β-半乳糖苷酶的过表达存在密切关系[2],低氧肿瘤内硝基还原酶的浓度显著升高[3-5],神经退行性疾病的发生通常伴随着单胺氧化酶的高水平表达[6]等。因此,开发高效的检测手段来实现对生物体系中特定标志酶的活性检测和可视化成像对深入研究重大疾病的发病机制及其早期诊断具有举足轻重的作用。传统的酶活性分析检测手段如比色法[7-8]、电化学法[9]、酶联免疫吸附法[10]等无法实现对生物体系内特定酶的活性进行实时原位无损伤检测。基于荧光团的荧光探针法具有操作简便,灵敏度高,选择性强,可实现实时快速、原位无损伤检测、高时空分辨率可视化成像等优势[11]。近年来,荧光探针已广泛用于活细胞/亚细胞水平离子及小分子的识别及可视化成像[12-13],同时也成为生物体系中酶活性检测与可视化成像的一种重要手段,是生命科学和医学诊断领域的研究热点。根据探针荧光信号变化的触发方式不同,酶荧光探针主要可以分为两类:(1)基于酶对荧光探针分子中酶抑制剂基团的识别引起荧光探针荧光信号的变化[14-16],可以称为抑制剂型酶荧光探针。此类探针能够实现较强的酶结合亲和力和良好的选择性检测,但存在灵敏度相对不足的局限性;(2)基于酶对荧光探针特异性催化反应来实现识别前后荧光信号的激活,称为反应激活型酶荧光探针[17-18],这类探针能够通过酶的高效催化转化能力实现荧光信号的放大和高检测灵敏度。因此,本文就反应激活型酶荧光探针的一般设计策略,4种与疾病相关的重要生物标志酶的反应激活型荧光探针的研究进展进行综述。
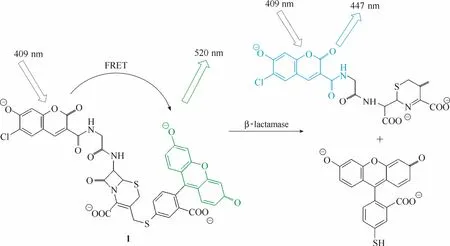
图1 探针1与内酰胺酶的响应示意图Fig.1 Proposed sensing mechanism for β-lactamase of probe 1
1 酶活性的检测历史
酶活性的检测最早可以追溯到 1939年,当时Gomoki[19]利用磷酸酶催化甘油三磷酸水解释放出的磷酸能与钙离子形成不溶于水的磷酸钙盐的特性测定了组织切片中磷酸酶的活性。这是首次基于酶的催化能力而设计的酶活性检测方法。自此以后,一系列新型检测方法如比色法[7-8]、电化学法[9]、酶联免疫吸附法[10]、荧光探针法等被开发出来用于酶活性的检测,大大地提高了检测的灵敏度。1998年,Tsien等[20]设计开发了首例真正意义上能用于活细胞中内酰胺酶活性检测的荧光探针1 (图1)。该探针将香豆素(能量给体)和荧光素(能量受体)用内酰胺环基团(可被内酰胺酶特异性催化水解断裂)连接。未与内酰胺酶识别前,由于荧光共振能量转移效应(fluorescence resonance energy transfer,FRET)的存在,探针在520 nm 处有最大的荧光发射(荧光素的荧光发射峰);酶识别探针后,内酰胺环断裂,香豆素与荧光素分离,FRET效应被抑制,探针的最大荧光发射波长蓝移至447 nm(香豆素的荧光发射峰)。实验结果显示探针在两个波长处的荧光强度比 ( I447/ I520)与酶的活性存在良好的线性关系,且荧光强度比在酶识别前后呈现高达70倍的增强。而且该探针具有较强的细胞穿膜能力,能够实现活细胞内酶活性的定性和定量检测。从此,酶活性检测荧光探针成为研究细胞内生化过程和功能的一种有效的工具。近年来,得益于荧光检测仪器特别是激光共聚焦显微镜等的发展,具有优良性能的荧光团的涌现(荧光素、罗丹明、氟硼二吡咯、萘酰亚胺、香豆素等)和荧光响应机理[光诱导电子转移(photo induced electron transfer, PeT)、分子内电荷转移(intramolecular charge transfer, ICT)、螺环开闭机理(spirocyclic switch)、荧光共振能量转移等]的发展,涌现了一批优秀的酶荧光探针[14-16,21-33],使得对各种酶活性进行实时原位检测和可视化荧光成像成为可能,为生命科学和医学的研究和发展奠定了坚实的基础。
2 反应激活型酶荧光探针设计策略
反应激活型酶荧光探针的设计策略通常有3种途径来实现[34]。第1种途径[图2(a)]是在现有的荧光团的基础上引入一些保护基团,在保护基团的保护下,荧光团处于荧光淬灭状态。一旦与酶识别,酶的催化作用使保护基团裂解,荧光团的荧光重新恢复,从而达到对特定酶荧光响应的目的。众所周知,水解酶是一种具有极强水解能力的酶,因此这种设计策略特别适合外切型水解酶探针的设计,如糖苷酶、磷酸酶、肽酶等酶的探针设计。第2种途径[图2(b)]是利用荧光共振能量转移效应来实现,探针通常由能量供体荧光团、受体荧光团、连接臂3部分组成。酶的催化作用使得连接臂断裂,供受体荧光团分离,FRET效应抑制,荧光信号发生改变。此种设计策略适合一些内切型水解酶的探针设计,如β-内酰胺酶、蛋白酶、磷酸二酯酶等。第3种途径[图 2(c)]是将探针分子的荧光团进行直接转化,使得荧光团的荧光性能发生变化,从而达到对酶活性荧光响应的目的。此类设计策略比较适合一些氧化还原酶和转移酶的探针设计。除了上述探针设计策略外,一些荧光探针的基本响应机理如光诱导电子转移[31]、分子内电荷转移[22-24]、螺环开闭[21,28]等同样被广泛用于酶探针的荧光响应过程。
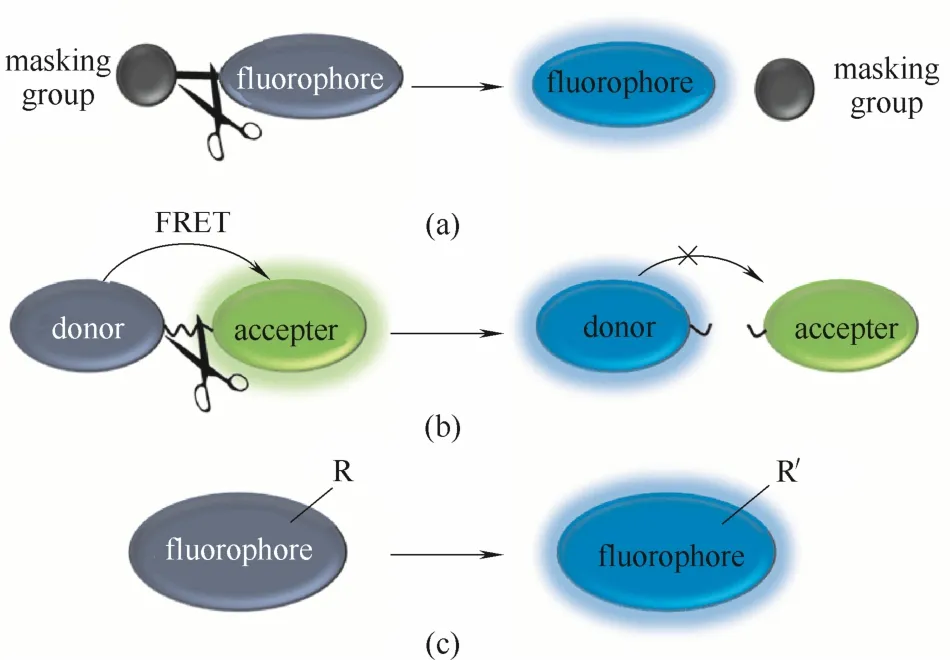
图2 反应激活型酶荧光探针的3种常见设计策略[34]Fig.2 Three common design strategies for reaction-activated probe for enzymes[34]
3 反应激活型酶荧光探针的研究进展
近年来,得益于荧光探针技术的日益成熟以及对酶的生化特性的深入理解,多种优秀反应激活型酶荧光探针被报道[21-33]。其中单胺氧化酶、β-半乳糖苷酶、硝基还原酶、γ-谷氨酰转肽酶均在人体内生理病理过程中发挥着关键的作用,是重要的疾病标志酶。开发识别这4种酶的可视化荧光探针一直备受关注。因此,本文将对近十年来检测上述 4种疾病标志酶的荧光探针的重要研究进展分别进行评述。
3.1 单胺氧化酶荧光探针的研究进展
单胺氧化酶(monoamine oxidase, MAOs, EC 1.4.3.4)是人体内一种催化各种胺类物质发生氧化脱氨反应的膜结合线粒体酶,在人体内维持神经递质和有机胺类水平动态平衡方面发挥着至关重要的作用[35]。据文献报道,单胺氧化酶在脑和中枢神经系统正常生命活动过程中扮演着关键的角色,其活性的异常变化与多种神经递质代谢紊乱引起的神经退行性疾病和精神病的发生有关[6,36]。近年来单胺氧化酶已经成为各种脑紊乱相关疾病的重要治疗靶标。因此开发能够实现高灵敏、高选择性、实时原位检测生物体系中单胺氧化酶活性的荧光探针具有十分重要的生物医学意义。近年来,已经出现一大批能够用于生物体系中单胺氧化酶活性检测的荧光探针[25,27,30,37-46]。2005年,Sames等[37]报道了首例能够用于线粒体(从细胞中分离出来)内单胺氧化酶活性检测的荧光探针2 (图3)。该探针是基于酶促氧化后探针分子发生环化反应和 PeT机理设计而成。探针分子中对香豆素母体具有强PeT效果的氨乙基在单胺氧化酶的催化下,发生脱氨基作用形成乙醛,接着乙醛再与苯环上的氨基发生分子内环化形成吲哚环结构,使得PeT效应被抑制,从而实现荧光“OFF-ON”的效果。该探针巧妙地在香豆素母体的6号碳位上引入氨基,7号碳位上引入氨乙基。这种基团引入方式不仅能够防止副产物的产生,而且能够在短时间内实现对单胺氧化酶高达200倍的荧光响应。
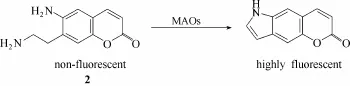
图3 探针2与单胺氧化酶的响应示意图Fig.3 Proposed sensing mechanism for MAOs of probe 2
2007年,Chang等[38]设计合成了两例能够用于活细胞内单胺氧化酶活性检测的探针3和4 (图4)。这两例探针均以具有优良光物理性能和良好生物相容性的荧光团试卤灵(resorufin)为母体,在母体基础上引入丙胺基醚衍生物,使探针处于荧光淬灭状态。在单胺氧化酶的催化下,探针分子经过氧化、β-消去反应释放出试卤灵荧光团,从而实现荧光增强的效果。实验结果显示,探针 3和4不仅能在体外实现对单胺氧化酶高灵敏的荧光响应,而且还能在单胺氧化酶过表达的PC12神经细胞内实现对单胺氧化酶活性的检测。
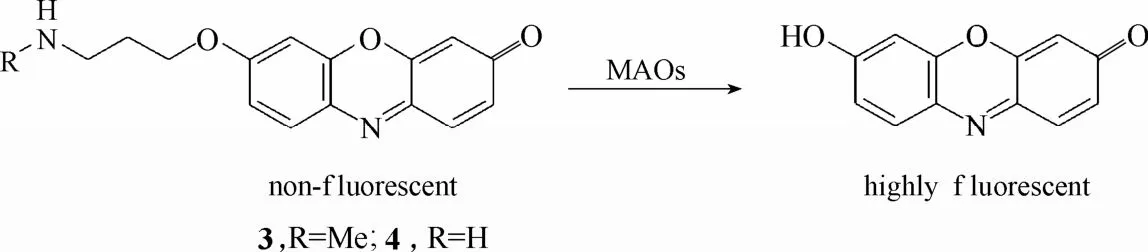
图4 探针3、4与单胺氧化酶的响应示意图Fig. 4 Proposed sensing mechanism for MAOs of probe 3, 4
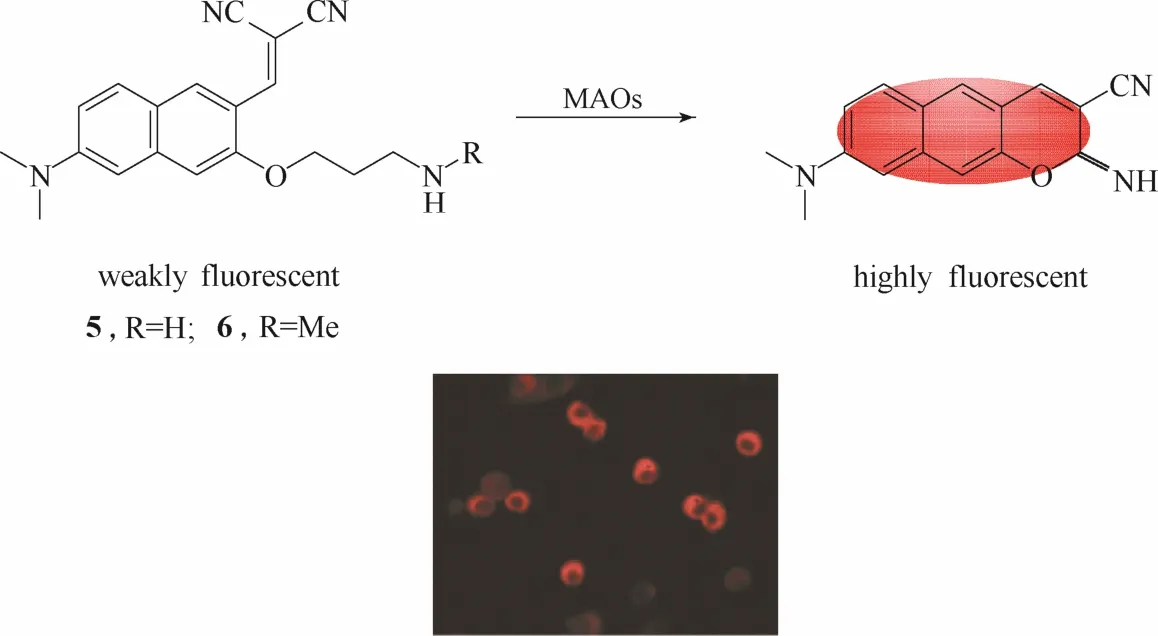
图5 探针5、6与单胺氧化酶的响应示意图及探针5的细胞成像图Fig.5 Proposed sensing mechanism for MAOs of probe 5,6 and fluorescent images of 5 in living cells
与单光子荧光探针相比,双光子荧光探针具有较强的组织穿透能力,能够降低组织自发荧光的干扰,降低激发光对细胞的损伤,避免光致漂白的发生等优点,因此特别适合生物体系中酶活性的检测[47]。2012年,Kim 等[39]设计合成了两例能够用于活细胞内单胺氧化酶检测和成像的双光子荧光探针5和6 (图5)。探针5和6均以萘的衍生物为荧光团母体,分别引入氨丙基和N-甲基氨丙基作为识别基团。在单胺氧化酶的催化下,处于荧光淬灭状态的探针经过氧化反应、消去反应、分子内缩合成环3个步骤转化成强荧光发射的产物,实现对单胺氧化酶的荧光响应。实验结果显示探针5和6不仅能够在体外实现对单胺氧化酶的快速响应,而且还具有较强的细胞膜穿透能力,能够在嗜铬细胞中对高表达的单胺氧化酶实现高分辨率的双光子成像。
人体内的单胺氧化酶具有两种不同的异构体,单胺氧化酶A(MAO A)和单胺氧化酶B (MAO B)。这两种异构体不仅具有形状不同的活性中心、不同的底物选择性、不同的抑制剂敏感性,而且在人体内具有不同的空间分布和生理作用[48]。遗憾的是,很多探针都不能高选择性地将这两种异构体区分开来。2012年,Zhu等[40]设计合成了一例对MAO B具有高度选择性的荧光探针7 (图6)。该探针以香豆素为母体,在母体上引入1-甲基-1, 2, 3, 6-四氢吡啶作为识别基团。探针7与MAO B发生特异性识别后,在酶的催化下,发生氧化反应和水解反应释放出香豆素荧光团,实现对MAO B的荧光响应。分子对接表明探针7能够与MAO B 活性部位中的羟基发生较强的氢键作用,而与 MAO A 活性部位羟基之间没有显著的氢键作用。因此,探针7能将两种单胺氧化酶异构体区分开来,实现对MAO B活性的特异性检测。
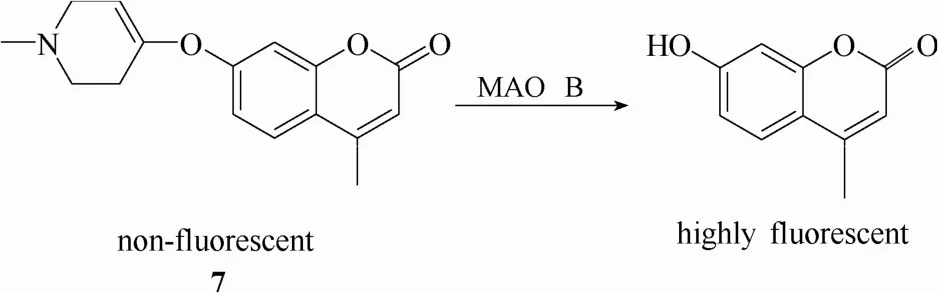
图6 探针7与单胺氧化酶B的响应示意图Fig. 6 Proposed sensing mechanism for MAO B of probe 7
2014年,Yao等[25]设计合成了首例能够用于帕金森疾病模型中MAO B特异性检测和成像的双光子荧光探针8 (图7)。该探针以典型双光子荧光团acedan(2-甲氨基-6-乙酰基萘)为母体,以丙胺作为识别基团,母体与识别基团之间用氨基甲酸酯结构单元作为连接结构。具有强拉电子能力的氨基甲酸酯会破坏acedan荧光团的推拉电子体系,使探针处于荧光淬灭状态。与MAO B识别后,在酶的催化作用下,探针发生氧化反应和β-消去反应释放出acedan荧光团,实现对MAO B的荧光响应。分子对接显示,该探针能够与MAO B的活性口袋(长且窄)发生高亲和力的结合而与MAO A的活性口袋结合亲和力较差。因此该探针能够很好地将两种异构体区分开来,实现对MAO B的特异性检测。将该探针用于一系列帕金森疾病模型和临床样品中MAO B活性的检测和成像,进一步验证了MAO B是帕金森疾病发展过程的一种重要的生物标志酶,探针8具有应用于临床上诊断帕金森疾病的潜能。
与增强型或淬灭型荧光探针相比,比率型荧光探针在生物体系(细胞、组织、活体等)中酶活性的检测方面具有独特的优势。这类探针利用两个波长处的荧光强度比例变化显示酶活性变化,因此能够很好地排除探针浓度、生物体系微环境因素(pH、温度、极性等)、激发光源强度、仪器测量误差等因素的影响,实现高灵敏度、高精确度的酶活性检测[49-50]。
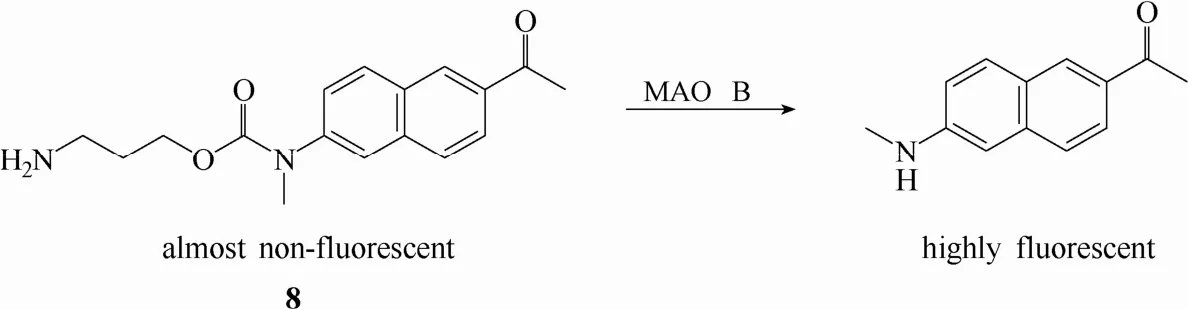
图7 探针8与单胺氧化酶B的响应示意图Fig. 7 Proposed sensing mechanism for MAO B of probe 8
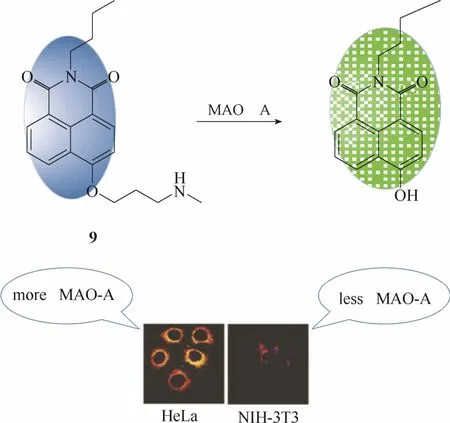
图8 探针9与单胺氧化酶A的响应示意图及细胞成像图Fig. 8 Proposed sensing mechanism for MAOs of probe 9 and fluorescent images in living cells
2016年,Ma等[30]报道了一例能够选择性检测活细胞内MAO A活性的比率型荧光探针9 (图8)。该探针以1, 8-萘酰亚胺为母体,在母体上引入丙胺作为识别基团。未与MAO A识别前,该探针在波长454 nm处具有较强的荧光发射。一旦与MAO A发生特异性识别,探针将发生氧化反应和 1,6-消去反应使荧光团4-羟基-N-丁基-1,8-萘酰亚胺(最大发射波长为550 nm)释放出来。酶促反应前后,两个波长处的荧光强度比(I550/ I454)发生明显的变化,实现对MAO A的比率响应。最重要的一点是,该探针对两种单胺氧化酶异构体具有明显的亲和力强弱的差异,其对MAO A的亲和力明显强于MAO B。因此该探针能够很好地将两种异构体区分开来,实现对MAO A活性的特异性检测。作者将该探针成功地应用于MAO A表达水平存在明显差异的两种细胞中成像。结果显示MAO A高水平表达的HeLa细胞中的荧光强度比例显著地强于MAO A低水平表达的NIH-3T3细胞。
3.2 β-半乳糖苷酶探针的研究进展
β-半乳糖苷酶(β-galactosidase,β-Gal,EC 3.2.1.23)是人体内一种具有重要生理病理作用的水解酶,其主要生理功能是催化水解糖苷键,将乳糖转化成半乳糖。据文献报道,该酶的表达水平与细胞衰老[22]、某些癌症的发生[2]存在密切关系。因此,β-半乳糖苷酶活性的检测在生命医学领域存在重要的意义。相比其他检测手段,利用荧光探针技术来实现生物体系中β-半乳糖苷酶活性的检测具有重大优势。最早使用荧光探针来检测β-半乳糖苷酶活性可以追溯到1963年,Edelstein等[51]开发了一例β-半乳糖苷酶荧光探针10 (图9)。遗憾的是,该探针的细胞穿透能力较差,不能直接用于细胞或组织成像,只有借助低渗振荡或细胞固定的方法将探针传送到细胞内才能实现细胞内 β-半乳糖苷酶活性检测。但近年来,许多性能优异的β-半乳糖苷酶荧光探针[2,21-23,52-57]被设计合成出来。日本东京大学的Nagano等十多年来一直致力于 β-半乳糖苷酶探针的研究,设计合成了一系列β-半乳糖苷酶荧光探针,在β-半乳糖苷酶荧光探针的开发和理论研究方面做出了卓越的贡献。
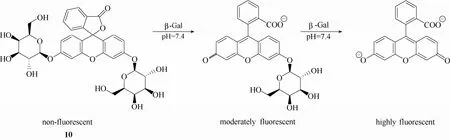
图9 探针10与β-半乳糖苷酶的响应示意图Fig.9 Proposed sensing mechanism for β-Gal of probe 10
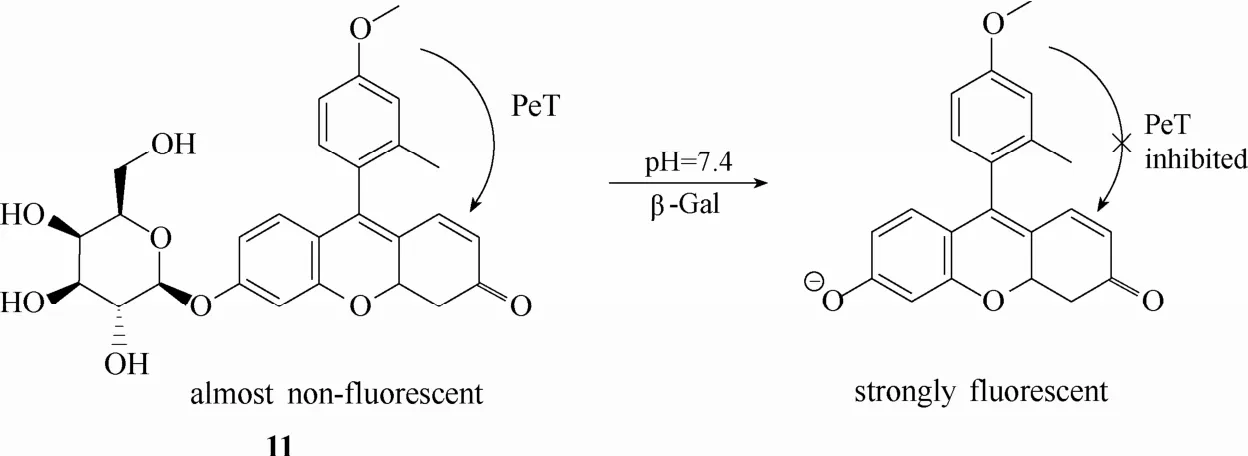
图10 探针11与β-半乳糖苷酶的响应示意图Fig.10 Proposed sensing mechanism for β-Gal of probe 11
2005年,Nagano等[52]设计合成了一例基于荧光素PeT机理的荧光探针11 (图10)。该探针的设计灵感来源于对羧基荧光素PeT机理的深入理解。他们研究发现荧光素中位苯环上的取代基团类型(影响电子供体的氧化势能)和氧蒽杂环上苯酚基的存在形式(影响电子受体的还原势能)对荧光素的PeT效果和荧光量子产率具有显著的影响。通过调整中位苯环上基团的取代类型以及氧蒽杂环上苯酚基的存在形式(质子化形式或去质子化形式)可以实现对荧光发射效果的调控。探针11在羧基荧光素的基础上,中位苯环 2号位上的羧基被替换成甲基,4号位引入新的基团甲氧基,氧蒽杂环上的酚羟基被半乳糖取代。探针11未与β-半乳糖苷酶识别之前,由于氧蒽杂环的酚羟基被半乳糖取代,因此中位苯环部分对氧蒽杂环的PeT效应足够强,此时探针的荧光量子产率较低,荧光几乎处于淬灭状态。当β-半乳糖苷酶与探针识别后,在酶的催化下,半乳糖从探针分子上断裂,生成的产物在中性或碱性环境下以去质子化的苯酚离子形式存在,此时中位苯环部分对氧蒽杂环的PeT效应大大减弱,荧光量子产率升高,荧光发射得以恢复。虽然该探针能够在体外实现对 β-半乳糖苷酶活性高达 440倍的荧光响应,但是其细胞成像的效果却并不十分理想。最大的问题在于该探针被水解后的产物在细胞中的保留效果较差。
为了解决这个问题,该团队[53]于 2007年报道了一例新型荧光探针12 (图11)。该探针在探针 11的基础上引入乙酰羟甲基酯(acetoxymethyl,AM)以增加其细胞内保留能力。探针进入细胞被β-半乳糖苷酶水解后,紧接着被细胞内的酯酶水解,使得探针以羧酸离子形式存在,亲水性大大增强,不容易扩散出细胞,从而实现细胞内β-半乳糖苷酶的高分辨率成像。该探针还可对小鼠肿瘤模型中外源性β-半乳糖苷酶活性进行检测和成像(外源性β-半乳糖苷酶通过连接抗生素蛋白而定位于癌细胞)。但不足的是,该探针需要两种酶的协同作用,响应时间较慢。而且酯酶在细胞外区域普遍存在,可能会使得探针未进入细胞内之前就被酯酶水解成水溶性的羧酸盐形式,影响其进入细胞的能力,使得活体内成像效果降低。
为了进一步改善此问题,该团队[54]于 2011年报道了一例新型β-半乳糖苷酶荧光探针13 (图12)。该探针能够完美解决细胞穿透能力限制、细胞内保留能力差等问题,实现对果蝇组织中β-半乳糖苷酶活性的高分辨率成像。该探针不再以PeT为荧光响应机理,而是以氧蒽杂环类探针的另一种常见的探针设计机理——螺环开闭机理设计而成。未被β-半乳糖苷酶水解前,在生理pH条件下,探针主要以螺环形式存在,处于荧光淬灭状态。一旦被β-半乳糖苷酶水解,生成的产物在生理pH条件主要以螺环开环的形式存在,能够发射强荧光,从而实现对β-半乳糖苷酶高达76倍的荧光响应。遗憾的是,该探针不能很好地用于小鼠肿瘤模型内β-半乳糖苷酶的成像,主要原因在于该探针存在较高的荧光背景强度。
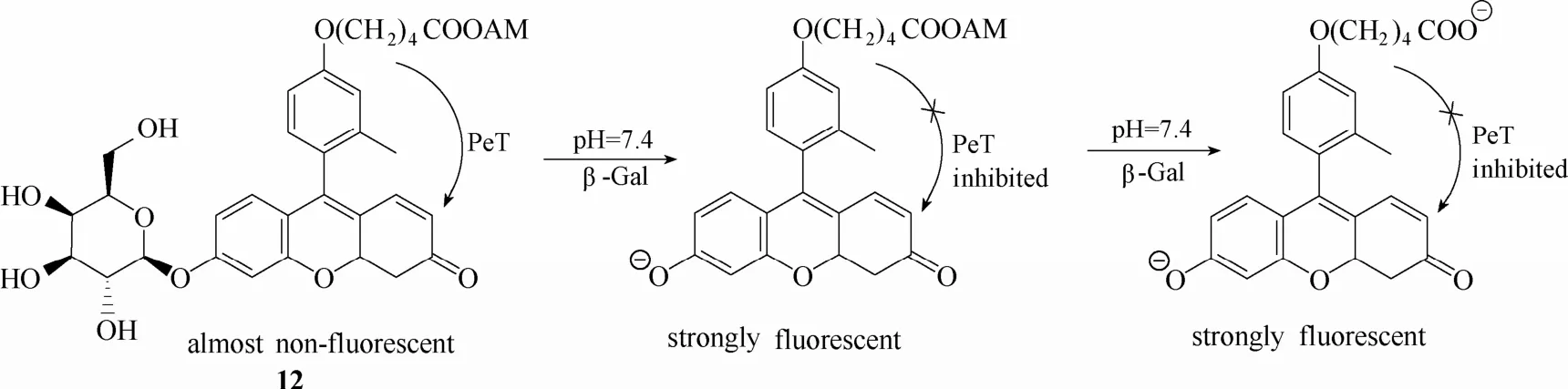
图11 探针12与β-半乳糖苷酶的响应示意图Fig.11 Proposed sensing mechanism for β-Gal of probe 12

图12 探针13与β-半乳糖苷酶的响应示意图Fig.12 Proposed sensing mechanism for β-Gal of probe 13
为了进一步提高探针的成像信噪比,实现小鼠肿瘤模型内β-半乳糖苷酶的识别及高分辨成像,该团队[21]于 2015年设计了一例能够用于小鼠腹膜小转移瘤内β-半乳糖苷酶成像的荧光探针14 (图13)。该探针在探针 13的基础上,引入强拉电子基团亚甲基三氟化碳结构单元(—CH2—CF3)来提高螺环状态的存在比例(未与酶识别之前),从而降低探针分子的背景荧光强度,实现对β-半乳糖苷酶更大的荧光响应比例。实验结果显示该探针能够在生理pH条件下实现对β-半乳糖苷酶高达1420倍的荧光响应。作者不仅将该探针用于7种卵巢癌细胞内β-半乳糖苷酶的可视化荧光成像,而且还实现了卵巢癌小鼠模型内窥镜成像,表明该探针具有应用于临床上诊断卵巢癌转移和荧光指导手术切除肿瘤的潜能。
2016年,Han等[57]报道了一例基于ICT机理的双光子比率型荧光探针15 (图14)。该探针在具有双光子发射性能的 1,8-萘酰亚胺荧光团上引入半乳糖,半乳糖的引入使得荧光团的ICT程度发生变化,荧光发射峰蓝移至 440 nm。与 β-半乳糖苷酶识别后,在酶的水解作用下,探针释放出1,8-萘酰亚胺荧光团(最大发射波长为545 nm),实现对β-半乳糖苷酶的荧光比率响应。实验结果显示该探针能够成功实现活细胞和活体内β-半乳糖苷酶的高分辨率双光子成像。
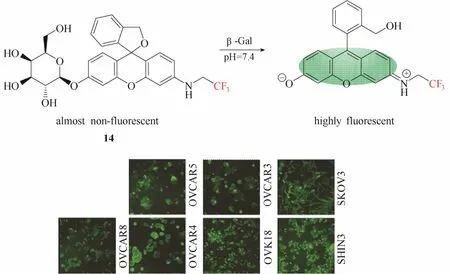
图13 探针14与β-半乳糖苷酶的响应示意图及细胞成像图Fig.13 Proposed sensing mechanism for β-Gal of probe 14 and fluorescent images in living cells
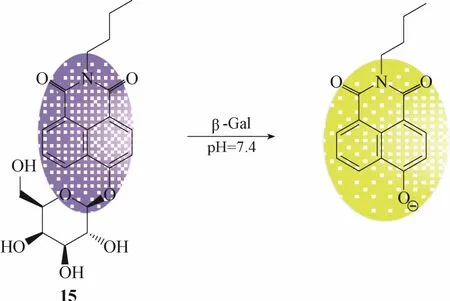
图14 探针15与β-半乳糖苷酶的响应示意图Fig.14 Proposed sensing mechanism for β-Gal of probe 15
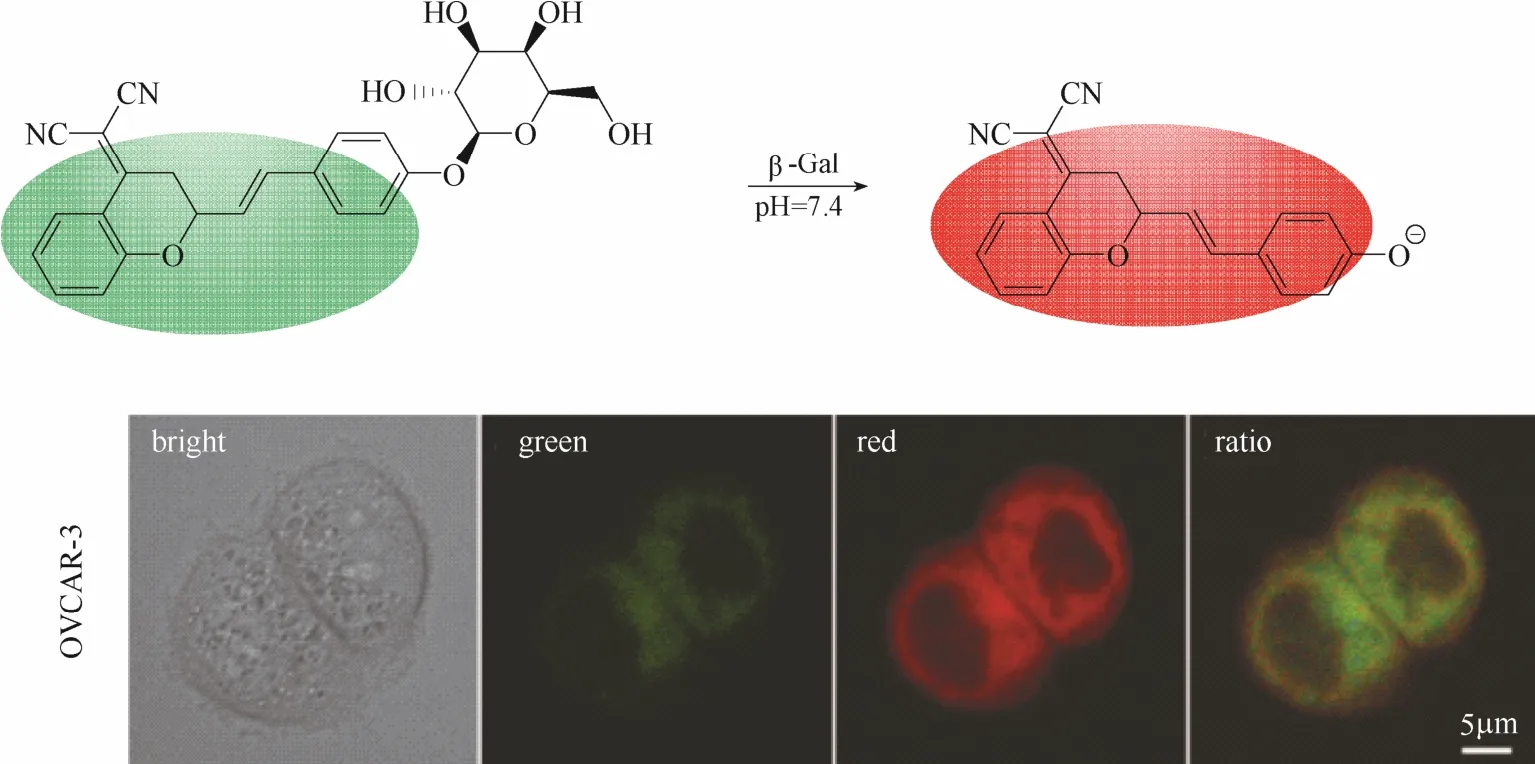
图15 探针16与β-半乳糖苷酶的响应示意图及细胞成像图Fig.15 Proposed sensing mechanism for β-Gal of probe 16 and fluorescent images in living cells
同年,Zhu等[23]报道了一例近红外比率型荧光探针16 (图15)。该探针以苯并吡喃腈的衍生物为母体,在母体上引入半乳糖单元作为识别基团。苯并吡喃腈的衍生物具有典型的D-π-A电子推拉体系、光稳定性极好、发射波长位于近红外区域而且具有约150 nm的斯托克斯位移,是一种具有优良光物理性能的近红外荧光团。该探针同样利用典型的ICT机理设计而成,β-半乳糖苷酶水解前后,探针的ICT程度发生明显变化,荧光最大发射波长红移(从500 nm红移至685 nm),实现对β-半乳糖苷酶的比率型荧光响应。基于苯并吡喃腈衍生物良好的荧光性能以及探针的比率响应效果,该探针被成功应用于卵巢癌细胞内荧光成像和结肠癌小鼠模型内β-半乳糖苷酶活性的高分辨率三维成像。
3.3 硝基还原酶探针的研究进展
硝基还原酶(nitroreductase, NTR, EC 1.7.99.4)是人体内一种代谢芳香族硝基化合物或者硝基取代的杂环化合物的还原酶。据文献报道,硝基还原酶浓度的升高与缺氧肿瘤的发生、侵袭和迁移存在密切的关系[3-5]。肿瘤的低氧通常伴随着微脉管的异常增生,因此会限制化疗药物扩散进入肿瘤内部,使治疗效果大大降低[58]。因此检测肿瘤内硝基还原酶的活性可以实现肿瘤的早期诊断和化疗药物的抗癌效果的评估。近年来,一系列性能优良的小分子荧光探针[3-5, 24, 26, 31-32, 59-61]被开发出来用于缺氧肿瘤内硝基还原酶活性的实时原位监控和可视化荧光成像。
硝基还原酶荧光探针的设计原理大致可以分为两类,即基于多米诺反应机理和基于硝基直接还原成氨的反应机理实现在硝基还原酶识别前后荧光信号的改变[62]。所谓的多米诺反应机理是指探针上硝基还原酶识别基团硝基被酶还原成羟胺或氨基后电子重新排列而诱导碳氧键断裂反应(电子重排和1, 6-消去反应),释放出荧光团,实现荧光信号的改变。基于此反应机理,Qian等[24]于2011年报道了一例能够实现硝基还原酶比率型检测的荧光探针17 (图16)。该探针以萘酰亚胺衍生物为荧光团,在荧光团上引入硝基苄基单元作为识别基团,识别基团与荧光团之间通过对氨基甲酸酯结构单元连接。具有强吸电子能力的氨基甲酸酯的存在削弱了萘酰亚胺分子内电荷转移程度,使荧光探针发射波长蓝移至475 nm。一旦硝基还原酶识别探针,探针通过多米诺反应将萘酰亚胺(最大发射波长为550 nm)释放,从而实现对硝基还原酶的比率型荧光响应。实验结果显示该探针具有较好的生物相容性和细胞穿膜能力,能够用于不同缺氧状态下细胞内硝基还原酶活性的监测以及体外肿瘤内硝基还原酶的成像研究。
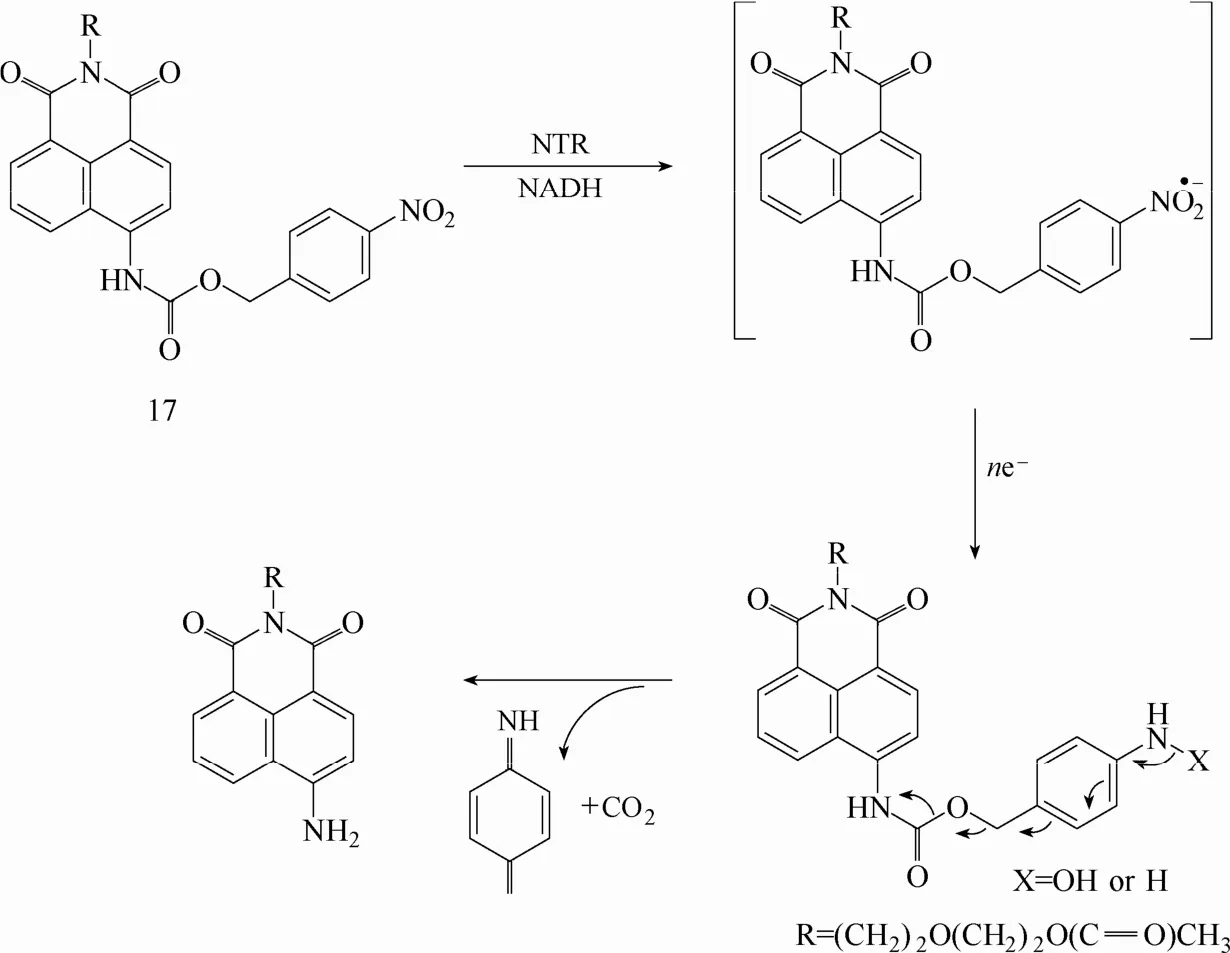
图16 探针17与硝基还原酶的响应示意图Fig.16 Proposed sensing mechanism for NTR of probe 17
2013年,基于上述同样的机理,Ma等[59]设计合成了一例高灵敏的硝基还原酶荧光探针 18 (图17)。该探针以试卤灵为荧光团,在荧光团上引入5-硝基呋喃作为识别基团。未与硝基还原酶识别前,5-硝基呋喃的引入使探针处于荧光淬灭状态。一旦与硝基还原酶发生特异性识别,探针发生多米诺分解反应释放出试卤灵荧光团,实现荧光响应。实验结果表明该探针可用于缺氧肿瘤细胞中硝基还原酶活性的检测和可视化成像研究。
2015年,Zhang等[32]报道了一例能够用于肿瘤细胞和组织内硝基还原酶检测和可视化成像的双光子荧光探针19 (图18)。该探针以具有优良双光子发射性能的萘衍生物作为荧光团,引入对硝基苄基作为识别基团。硝基还原酶识别前后,探针出现高达70倍的荧光强度变化。作者利用该探针成功实现缺氧HeLa细胞中硝基还原酶的高分辨率双光子成像,进一步验证了肿瘤细胞缺氧状态与硝基还原酶浓度的关系。
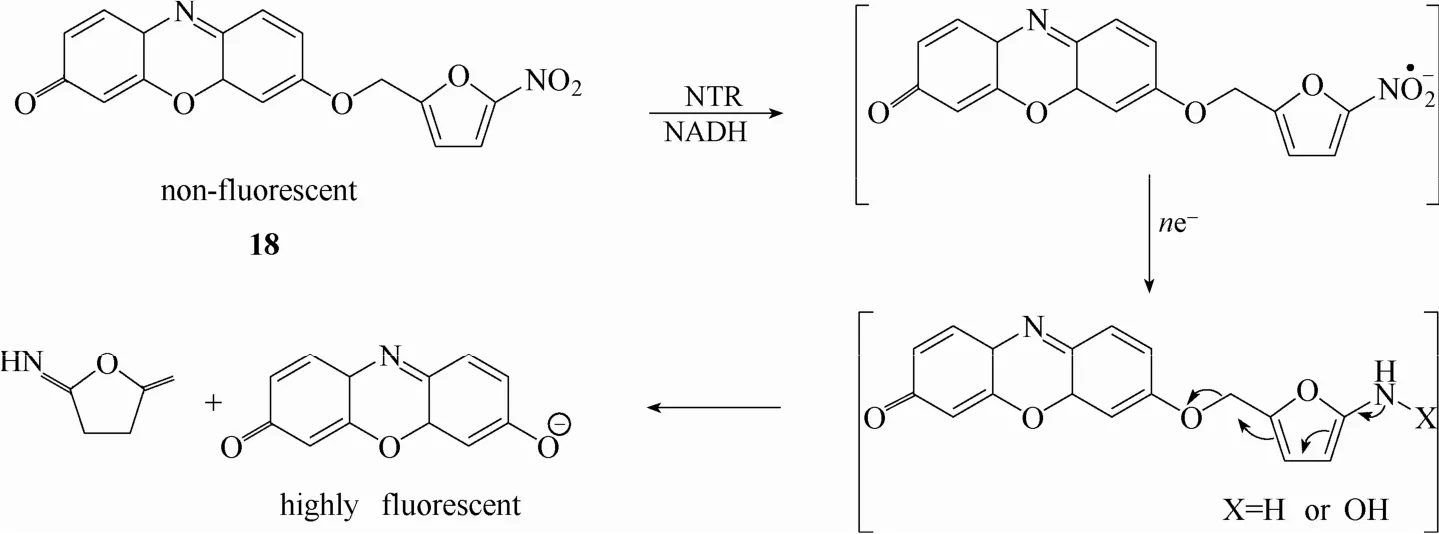
图17 探针18与硝基还原酶的响应示意图Fig.17 Proposed sensing mechanism for NTR of probe 18
另一种常见的用于设计硝基还原酶探针的策略为基于荧光团上的硝基直接还原为氨基的反应机理。通过将吸电子基团硝基直接转化成氨基使得荧光团分子内的电子云分布或电子环境发生显著改变,从而实现荧光性能的变化。基于此设计策略,2013年,Tang等[31]报道了一例近红外硝基还原酶探针20 (图19)。该探针以具有近红外发射性能的七甲川菁染料为母体,在母体上引入硝基咪唑作为识别基团。硝基还原酶将吸电子基团硝基咪唑直接还原成氨基咪唑从而实现荧光从淬灭到恢复的变化。实验结果显示,该探针在不同氧气水平条件下的荧光成像强度存在明显差异,低氧条件下荧光强度明显增强。作者成功将该探针用于研究实体瘤变化时上皮细胞-间质细胞的转化过程与细胞内的缺氧状态之间的关系。
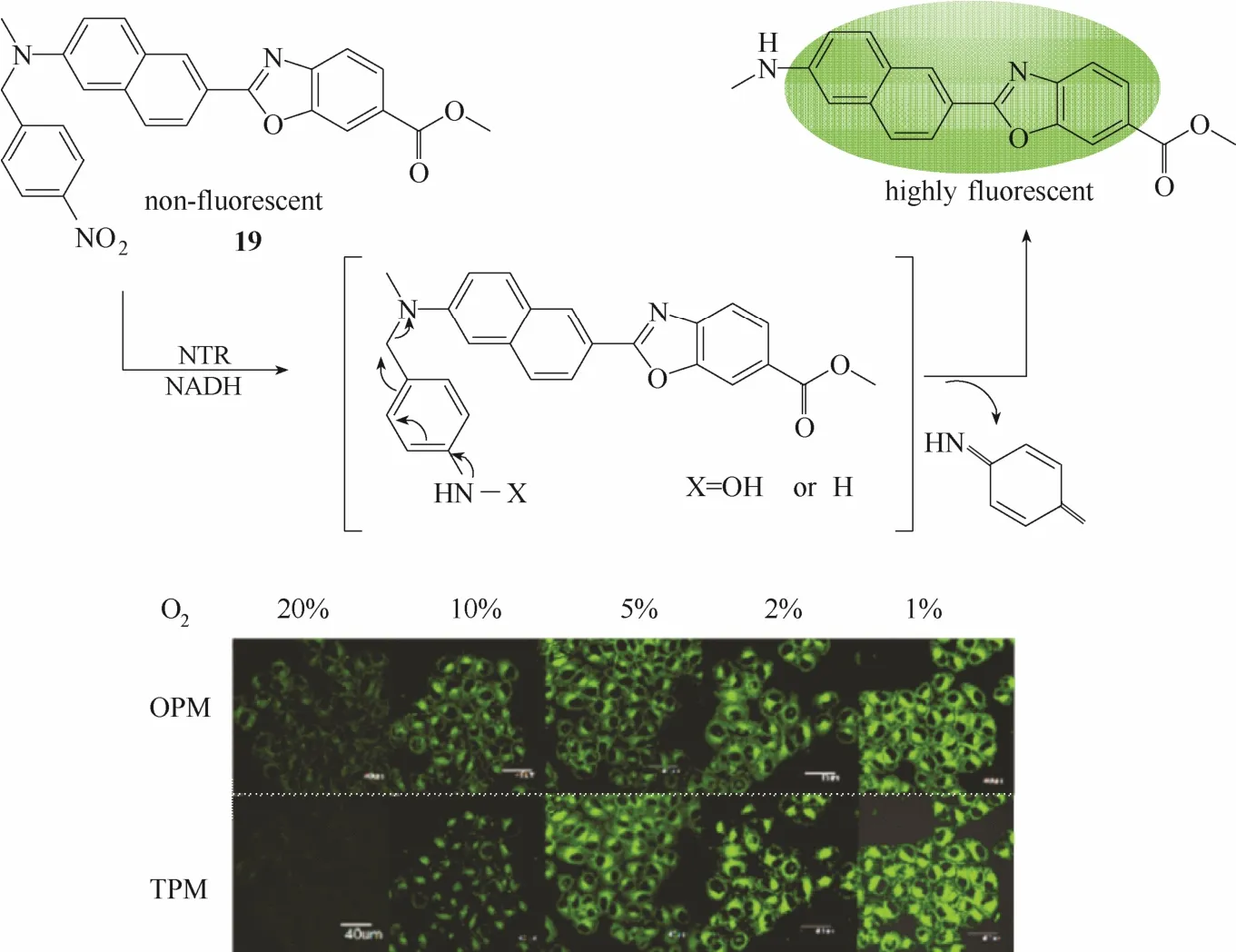
图18 探针19与硝基还原酶的响应示意图及缺氧状态下的细胞成像图Fig.18 Proposed sensing mechanism for NTR of probe 19 and fluorescent images in living cells under hypoxic conditions
2015年,Li等[26]报道了一例超灵敏的近红外硝基还原酶探针21 (图20)。探针分子中的硝基苯基团在硝基还原酶的催化下被直接还原成苯胺从而实现荧光从淬灭到恢复的变化。作者合成了5例探针来研究硝基在苯环上的取代位置以及硝基苯与荧光团母体之间的连接基团类型对酶识别能力的影响,最终发现探针21(对硝基取代,酯键连接)与酶具有最强的亲和力和识别效果。实验结果显示探针21能够实现对硝基还原酶高达110倍的荧光响应。基于该探针的超灵敏和高选择响应效果以及优良的近红外发射性能,作者将该探针成功用于缺氧条件下A549细胞内成像及小鼠低氧肿瘤模型内高分辨率成像。
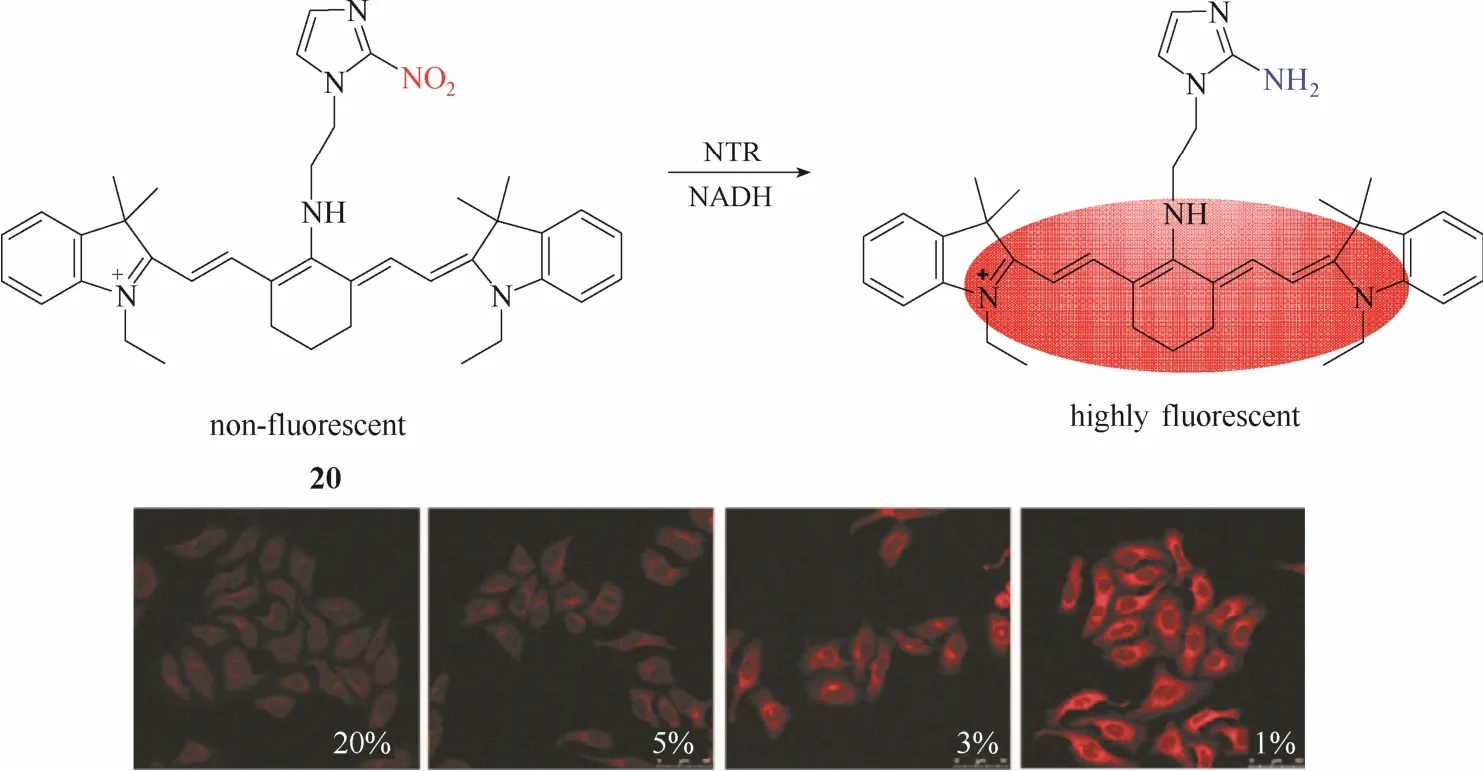
图19 探针20与硝基还原酶的响应示意图及不同氧气状态下的细胞成像图Fig.19 Proposed sensing mechanism for NTR of probe 20 and fluorescent images in living cells under different oxygen conditions
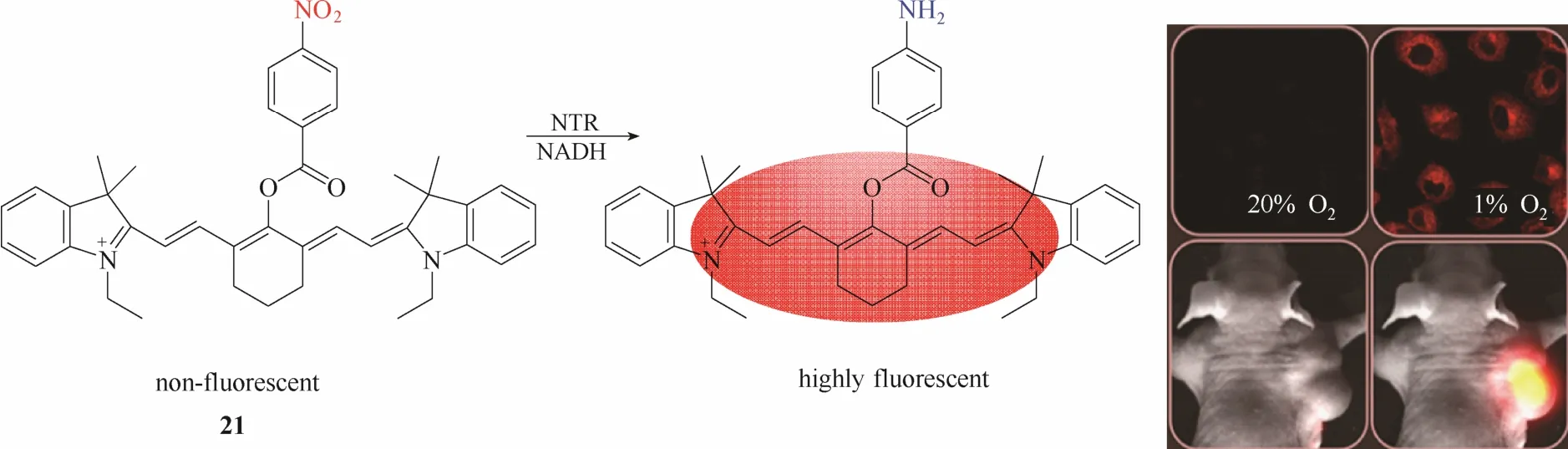
图20 探针21与硝基还原酶的响应示意图及缺氧状态下的细胞及活体成像图Fig.20 Proposed sensing mechanism for NTR of probe 21 and fluorescent images in living cells under hypoxic conditions and in vivo
3.4 γ-谷氨酰转肽酶探针的研究进展
γ-谷氨酰转肽酶(γ-gumatyl transpeptidase, GGT, EC 2.3.3.2)是人体内一种重要的细胞膜结合酶,主要功能是选择性催化裂解γ-谷氨酰基[63]。据文献报道,GGT在体内发挥着关键的生理病理作用,例如药物滥用所导致的肝脏损伤通常伴随着 GGT 水平升高[64],一些癌症如子宫颈癌、卵巢癌等的发生和发展也与癌细胞内过表达的 GGT水平存在密切关系[65-66]。因此,开发高效的检测手段用于体内GGT活性的检测具有巨大的应用价值。2011年,Urano等[28]报道了一例基于罗丹明螺环开闭机理的 γ-谷氨酰转肽酶荧光探针22 (图21)。该探针以罗丹明为母体,在母体上引入谷氨酸作为识别基团。未与GGT识别前,探针以螺环形式存在而处于荧光淬灭状态。当探针与 GGT发生识别作用后,在酶的催化下,探针中的γ-谷氨酰基团断裂,分子内电子重排诱导螺环打开,从而实现荧光恢复的效果。实验结果显示该探针不仅能够在 11种人卵巢癌细胞内实现高分辨率成像,还能够通过外表直接喷洒探针溶液的方式在超短时间内(1 min)实现卵巢癌小鼠模型内高信噪比成像。基于该探针超高灵敏、超快速响应、高分辨活体成像效果,该探针具有应用于临床上手术指导肿瘤切除的潜能。
2015年,Fan等[29]报道了一例比率型γ-谷氨酰转肽酶探针 23 (图 22)。该探针是以氟硼二吡咯(boron dipyrromethene, BODIPY)为母体,在母体上引入谷胱甘肽作为识别基团。谷氨酰转肽酶识别探针后,在酶的催化下,探针发生γ-谷酰基转移作用,释放出半胱氨酸的氨基,接着氨基对硫原子发生亲核攻击,形成分子内的N-S交换,产生氨基取代的BODIPY,从而实现酶促反应前后荧光信号的变化,达到对γ-谷氨酰转肽酶荧光响应的目的。实验结果显示该探针能够在体外达到对γ-谷氨酰转肽酶快速、高选择性、比率响应的效果,并且被成功用于卵巢癌细胞内γ-谷氨酰转肽酶活性的检测和高分辨率成像。
同年,Ma等[67]报道了一例高灵敏的γ-谷氨酰转肽酶荧光探针24 (图23)。该探针以甲酚紫为荧光团母体,在母体的氨基位置上引入谷氨酸作为识别基团。利用γ-谷氨酰转肽酶的谷酰基转移作用将谷氨酸从探针分子上断裂下来,释放出具有强荧光发射效果的甲酚紫荧光团,实现荧光“OFF-ON”的效果。实验结果显示该探针不仅能被用于活细胞内γ-谷氨酰转肽酶荧光成像和人血清中 γ-谷氨酰转肽酶活性的检测,而且还成功实现了对正常人血清样品和肝癌患者血清样品的区分。
2016年,Wu等[33]报道了一例γ-谷氨酰转肽酶双光子荧光探针25 (图24)。该探针以苯并吡喃腈作为荧光团母体,谷氨酸作为识别基团。在γ-谷氨酰转肽酶的催化作用下,处于荧光淬灭状态的探针将发生谷氨酰基转移作用释放出强荧光发射的苯并吡喃腈荧光团,实现对γ-谷氨酰转肽酶的荧光响应。实验结果表明该探针不仅能在人卵巢癌A2580细胞内实现对 γ-谷氨酰转肽酶的单光子与双光子荧光成像,而且还能够用于斑马鱼模型内 γ-谷氨酰转肽酶荧光成像。利用斑马鱼模型,该探针成功揭示了γ-谷氨酰转肽酶活性与药物导致的肝损伤之间的关系。
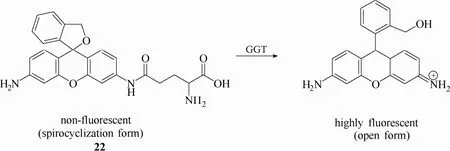
图21 探针22与γ-谷氨酰转肽酶响应示意图Fig.21 Proposed sensing mechanism for GGT of probe 22

图22 探针23与γ-谷氨酰转肽酶响应示意图Fig.22 Proposed sensing mechanism for GGT of probe 23
4 总结和展望
综上所述,本文主要综述了反应激活型酶识别荧光探针的设计策略及与重大疾病密切相关的单胺氧化酶、β-半乳糖苷酶、硝基还原酶、γ-谷氨酰转肽酶荧光探针的研究现状。虽然目前相应的酶荧光探针取得了一定的进展,但还是有如下亟待解决的问题。
(1)目前识别亚细胞器中酶的荧光探针报道基本没有,而不同细胞器中酶活性的不同可能会引起不同的疾病,因此研制新型靶向识别不同细胞器中酶的荧光探针会成为广大科研工作者的研究热点。
(2)设计合成生物相容性好、水溶性适中、能对活体内深层组织中酶活性检测和可视化成像的近红外荧光探针仍是一个重要的研究领域。
(3)为提高对酶识别的选择灵敏度和成像时空分辨率,发展比率型双光子酶识别荧光探针也会是未来十分活跃的研究领域。
(4)随着蛋白质及转录组学的进一步发展,越来越多的与疾病相关的标志酶被挖掘,而识别新标志酶的荧光探针的研究将受到广泛的关注。
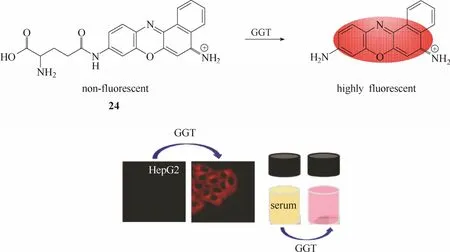
图23 探针24与γ-谷氨酰转肽酶响应示意图及血清与细胞成像图Fig.22 Proposed sensing mechanism for GGT of probe 24 and fluorescent images in living cells and serum
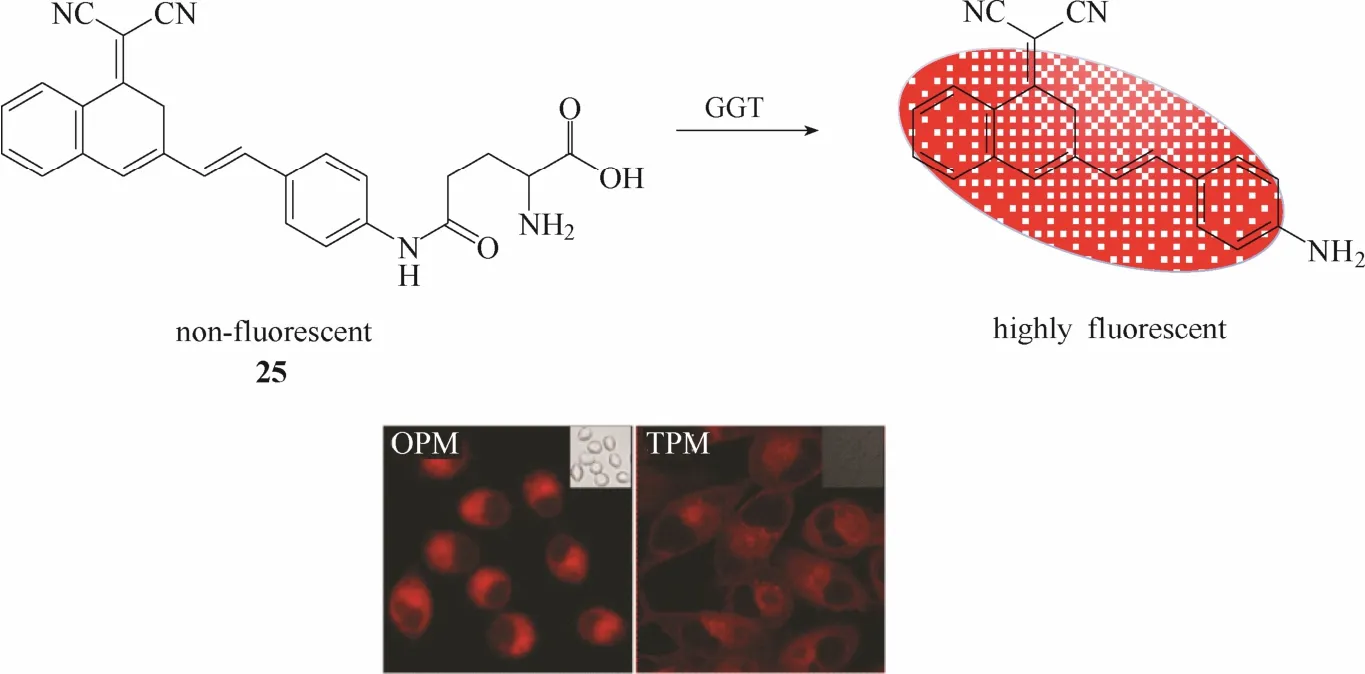
图24 探针25与γ-谷氨酰转肽酶响应示意图及细胞成像图Fig.24 Proposed sensing mechanism for GGT of probe 25 and fluorescent images in living cells
[1]WIJDEVEN R H, NEEFJES J, OVAA H. How chemistry supports cell biology: the chemical toolbox at your service[J]. Trends in Cell Biology, 2014, 24(12): 751-760.
[2]PENG L, GAO M, CAI X L, et al. A fluorescent light-up probe based on AIE and ESIPT processes for β-galactosidase activity detection and visualization in living cells[J]. Journal of Materials Chemistry B, 2015, 3: 9168-9172.
[3]XUE C, LEI Y J, ZHANG S C, et al. A cyanine-derived “turn-on”fluorescent probe for imaging nitroreductase in hypoxic tumor cells[J]. Analytical Methods, 2015, 7: 10125-10128.
[4]YUAN J, XU Y Q, ZHOU N N, et al. A highly selective turn-on fluorescent probe based on semi-cyanine for the detection of nitroreductase and hypoxic tumor cell imaging[J]. RSC Advances, 2014, 4: 56207-56210.
[5]XU J, SUN S B, LI Q, et al. A rapid response “turn-on” fluorescent probe for nitroreductase detection and its application in hypoxic tumor cell imaging[J]. Analyst, 2015, 140: 574-581.
[6]YOUDIM M B H, EDMONDSON D, TIPTON K F. The therapeutic potential of monoamine oxidase inhibitors[J]. Nature Reviews Neuroscience, 2006, 7(4): 295-309.
[7]SONG Y J, WEI W L, QU X G. Colorimetric biosensing using smart materials[J]. Advance Materials, 2011, 23(37): 4215-4236.
[8]WANG J S, WU L, REN J S, et al. Visualizing human telomerase activity with primer-modified Au nanoparticles[J]. Small, 2012, 8(2): 259-264.
[9]CHIKKAVEERAIAH B V, BHIRDE A A, MORGAN N Y, et al. Electrochemical immunosensors for detection of cancer protein biomarkers[J]. ACS Nano, 2012, 6(8): 6546-6561.
[10]ALBERTI D, VAN'T ERVE M, STEFANIA R, et al. A quantitative relaxometric version of the ELISA test for the measurement of cell surface biomarkers[J]. Angewandte Chemistry, 2014, 126: 3556-3559.
[11]TERAI T, NAGANO T. Small-molecule fluorophores and fluorescent probes for bioimaging[J]. Pflugers Archiv : European Journal of Physiology, 2013, 465(3): 347-359.
[12]姜娜, 杨洪宝, 樊江莉, 等. 线粒体荧光探针最新研究进展[J]. 化工学报, 2016, 67(1):176-190. JIANG N, YANG H B, FAN J L, et al. Progress in research of mitochondrial fluorescence probes[J]. CIESC Journal, 2016, 67(1):176-190.
[13]张世玲, 彭孝军. 氟离子荧光探针的研究进展[J]. 化工学报, 2016, 67(1):191-201. ZHANG S L, PENG X J. Research progress on fluorescent probes for fluoride ions[J]. CIESC Journal, 2016, 67(1):191-201.
[14]WANG B H, FAN J L, WANG X W, et al. Nile blue based infrared fluorescent probe imaging tumors that over-express cyclooxygenase-2[J]. Chemical Communications, 2015, 51: 792-795.
[15]ZHANG H, FAN J L, WANG J Y, et al. Fluorescence discrimination of cancer from inflammation by molecular response to COX-2 enzymes[J]. Journal of the American Chemical Society, 2013, 135(46): 17469-17475.
[16]ZHANG H, FAN J L, WANG J Y, et al. An off-on COX-2-specific fluorescent probe: targeting the Golgi apparatus of cancer cells[J]. Journal of the American Chemical Society, 2013, 135(31): 11663-11669.
[17]QIAN L H, LI L, YAO S Q. Two-photon small molecule enzymatic probes[J]. Accounts of Chemical Research, 2016, 49(4): 626-634.
[18]EDGINGTON L E, VERDOES M, BOGYO M. Functional imaging of proteases: recent advances in the design and application of substrate-based and activity-based probes[J]. Current Opinion in Chemical Biology, 2011, 15(6): 798-805.
[19]GOMOKI G. Microtechnical demonstration of phosphatase in tissue sections[J]. Proceedings of the Society for Experimental Biology and Medicine, 1939, 42: 23-26.
[20]ZLOKARNIK G, NEGULESCU P A, KNAPP T E, et al. Quantitation of transcription and clonal selection of single living cells with β-lactamase as reporter[J]. Science, 1998, 279: 1764-1765.
[21]ASANUMA D, SAKABE M, KAMIYA M, et al. Sensitive β-galactosidase-targeting fluorescence probe for visualizing small peritoneal metastatic tumours in vivo[J]. Nature Communications, 2015, 6: 6463-6469.
[22]LEE H W, HEO C H, SEN D, et al. Ratiometric two-photon fluorescent probe for quantitative detection of β-galactosidase activity in senescent cells[J]. Analytical Chemistry, 2014, 86(20): 10001-10005.
[23]GU K Z, XU Y S, LI H, et al. Real-time tracking and in vivo visualization of β-galactosidase activity in colorectal tumor with a ratiometric near-infrared fluorescent probe[J]. Journal of American Chemical Society, 2016, 138(16): 5334-5340.
[24]CUI L, ZHONG Y, ZHU W P, et al. A new prodrug-derived ratiometric fluorescent probe for hypoxia high selectivity of nitroreductase and imaging in tumor cell[J]. Organic Letters, 2011, 13: 928-931.
[25]LI L, ZHANG C W, CHEN G Y, et al. A sensitive two-photon probe to selectively detect monoamine oxidase B activity in Parkinson's disease models[J]. Nature Communications, 2014, 5: 3276-3285.
[26]LI Y H, SUN Y, LI J C, et al. Ultrasensitive near-infrared fluorescence-enhanced probe for in vivo nitroreductase imaging[J]. Journal of the American Chemical Society, 2015, 137(19): 6407-6416.
[27]SHEN W, YU J, GE J Y, et al. Light-up probes based on fluorogens with aggregation-induced emission characteristics for monoamine oxidase-a activity study in solution and in living cells[J]. ACS Applied Materials & Interfaces, 2016, 8(1): 927-935.
[28]URANO Y, SAKABE M, KOSAKA N, et al. Rapid cancer detection by topically spraying a γ-glutamyltranspeptidase-activated fluorescent probe[J]. Science Translational Medicine, 2011, 3(110): 110-119.
[29]WANG F Y, ZHU Y, ZHOU L, et al. Fluorescent in situ targeting probes for rapid imaging of ovarian-cancer-specific gamma-glutamyltranspeptidase[J]. Angewandte Chemie International Edition in English, 2015, 54(25): 7349-7353.
[30]WU X F, LI L H, SHI W, et al. Sensitive and selective ratiometric fluorescence probes for detection of intracellular endogenous monoamine oxidase A[J]. Analytical Chemistry, 2016, 88(2): 1440-1446.
[31]XU K H, WANG F H, PAN X, et al. High selectivity imaging of nitroreductase using a near-infrared fluorescence probe in hypoxic tumor[J]. Chemical Communications, 2013, 49(25): 2554-2556.
[32]ZHANG J, LIU H W, HU X X, et al. Efficient two-photon fluorescent probe for nitroreductase detection and hypoxia imaging in tumor cells and tissues[J]. Analytical Chemistry, 2015, 87(23): 11832-11839.
[33]ZHANG P S, JIANG X F, NIE X Z, et al. A two-photon fluorescent sensor revealing drug-induced liver injury via tracking γ-glutamyltranspeptidase (GGT) level in vivo[J]. Biomaterials, 2016, 80: 46-56.
[34]KOMATSU T, URANO Y. Evaluation of enzymatic activities in living systems with small-molecular fluorescent substrate probes[J]. Analytical Sciences, 2015, 31: 257-265.
[35]SHIH J C, CHEN K, RIDD M J. Monoamine oxidase: from genes to behavior[J]. Annual Review of Neuroscience, 1999, 22: 197-217.
[36]CASPI A, MCCLAY J, MOFFITT T E, et al. Role of genotype in the cycle of violence in maltreated children[J]. Science, 2002, 297: 851-853.
[37]CHEN G, YEE D J, GUBERNATOR N G, et al. Design of optical switches as metabolic indicators new fluorogenic probes for monoamine oxidases (MAO A and B)[J]. Journal of the American Chemical Society, 2005, 127: 4544-4545.
[38]ALBERS A E, RAWLS K A, CHANG C J. Activity-based fluorescent reporters for monoamine oxidases in living cells[J]. Chemical Communications, 2007, 44: 4647-4649.
[39]KIM D, SAMBASIVAN S, NAM H, et al. Reaction-based two-photon probes for in vitro analysis and cellular imaging of monoamine oxidase activity[J]. Chemical Communications, 2012, 48(54): 6833-6835.
[40]LONG S B, CHEN L, XIANG Y, et al. An activity-based fluorogenic probe for sensitive and selective monoamine oxidase-B detection[J]. Chemical Communications, 2012, 48(57): 7164-7166.
[41]LI X F, ZHANG H T, XIE Y S, et al. Fluorescent probes for detecting monoamine oxidase activity and cell imaging[J]. Organic & Biomolecular Chemistry, 2014, 12(13): 2033-2036.
[42]SHEN W, LONG S B, YU S A, et al. Design, synthesis, and evaluation of an activity-based probe for cellular imaging of monoamine oxidases[J]. Medicinal Chemistry Research, 2011, 21(11): 3858-3862.
[43]ZHOU W H, VALLY M P, SHULTZ J, et al. New bioluminogenic substrates for monoamine oxidase assays[J]. Journal of the American Chemical Society, 2006, 128: 3122-3123.
[44]XIANG Y M, HE B Y, LI X F, et al. The design and synthesis of novel “turn-on” fluorescent probes to visualize monoamine oxidase-B in living cells[J]. RSC Advances, 2013, 3(15): 4876-4879.
[45]LI X F, YU J J, ZHU Q, et al. Visualization of monoamine oxidases in living cells using “turn-on” fluorescence resonance energy transfer probes[J]. Analyst, 2014, 139: 6092-6095.
[46]ZHANG Y X, XU Y F, TAN SH Y, et al. Rapid and sensitive fluorescent probes for monoamine oxidases B to A at low concentrations[J]. Tetrahedron Letters, 2012, 53(51): 6881-6884.
[47]KIM H M, CHO B R. Small-molecule two-photon probes for bioimaging applications[J]. Chemical Reviews, 2015, 115(11): 5014-5055.
[48]WANG C C, BILLETT E, BORCHERT A, et al. Monoamine oxidases in development[J]. Cellular and Molecular Life Science, 2013, 70(4): 599-630.
[49]THOMAS J A. Optical imaging probes for biomolecules: an introductory perspective[J]. Chemical Society Reviews, 2015, 44: 4494-4500.
[50]KIKUCHI K. Design, synthesis and biological application of chemical probes for bio-imaging[J]. Chemical Society Reviews, 2010, 39(6): 2048-2053.
[51]ROTMAN B B, ZDERIC J A, EDELSTEIN M. Fluorogenic substrates for β-D-galactosidases and phosphatases derived from fluorescein (3, 6-dihydroxyfluoran) and its monomethyl ether[J]. Proceedings of the National Academy of Sciences, 1963, 50: 1-6.
[52]URANO Y, KAMIYA M, KANDA K, et al. Evolution of fluorescein as a platform for finely tunable fluorescence probes[J]. Journal of the American Chemical Society, 2005, 127: 4888-4894.
[53]KAMIYA M, KOBAYASHI H, HAMA Y, et al. An enzymatically activated fluorescence probe for targeted tumor imaging[J]. Journal of the American Chemical Society, 2007, 129: 3918-3929.
[54]KAMIYA M, ASANUMA D, KURANAGA E, et al. β-Galactosidase fluorescence probe with improved cellular accumulation based on a spirocyclized rhodol scaffold[J]. Journal of the American Chemical Society, 2011, 133(33): 12960-12963.
[55]HAN J Y, HAN M S, TUNG C H. A fluorogenic probe for β-galactosidase activity imaging in living cells[J]. Molecular Biosystems, 2013, 9(12): 3001-3008.
[56]SAKABE M, ASANUMA D, KAMIYA M, et al. Rational design of highly sensitive fluorescence probes for protease and glycosidase based on precisely controlled spirocyclization[J]. Journal of the American Chemical Society, 2013, 135(1): 409-414.
[57]ZHANG X X, WU H, LI P, et al. A versatile two-photon fluorescent probe for ratiometric imaging E.coli β-galactosidase in live cells and in vivo[J]. Chemical Communications, 2016, 52(53): 8283-8286.
[58]WILSON W R, HAY M P. Targeting hypoxia in cancer therapy[J]. Nature Reviews Cancer, 2011, 11(6): 393-410.
[59]LI Z, LI X H, GAO X H, et al. Nitroreductase detection and hypoxic tumor cell imaging by a designed sensitive and selective fluorescent probe, 7-[(5-nitrofuran-2-yl)methoxy]-3H-phenoxazin-3-one[J]. Analytical Chemistry, 2013, 85(8): 3926-3932.
[60]SHI Y M, ZHANG S C, ZHANG X R. A novel near-infrared fluorescent probe for selectively sensing nitroreductase (NTR) in an aqueous medium[J]. Analyst, 2013, 138(7): 1952-1955.
[61]ZHU D J, XUE L, LI G P, et al. A highly sensitive near-infrared ratiometric fluorescent probe for detecting nitroreductase and cellular imaging[J]. Sensors and Actuators B: Chemical, 2016, 222: 419-424.
[62]万琼琼, 李照, 马会民. 硝基还原酶荧光探针的研究进展[J]. 分析科学学报, 2014, 30: 755-760. WAN Q Q, LI Z, MA H M. Progress in fluorescent probes for nitroreductase[J]. Journal of Analytical Science, 2014, 30: 755-760.
[63]RICKETTS W A, HANIGAN M H. Extracellular glutathione is a source of cysteine for cells that express γ-glutamyl transpeptidase[J]. Biochemistry, 1993, 32: 6302-6306.
[64]STEFANIUK P, CIANCIARA J, DRAPALOA W. Present and future possibilities for early diagnosis of hepatocellular carcinoma[J]. World Journal of Gastroenterology, 2010, 16(4): 418-424.
[65]YAOD F, JIANGD R, HUANG Z W, et al. Abnormal expression of hepatoma specific γ-glutamyl transferase and alteration of γ-glutamyl transferase gene methylation status in patients with hepatocellular carcinoma[J]. Cancer, 2000, 88: 761-769.
[66]POMPELLA A, TATA D V, PAOLICCHI A, et al. Expression of γ-glutamyltransferase in cancer cells and its significance in drug resistance[J]. Biochemical Pharmacology, 2006, 71(3): 231-238.
[67]LI L H, SHI W, WANG Z, et al. Sensitive fluorescence probe with long analytical wavelengths for γ-glutamyl transpeptidase detection in human serum and living cells[J]. Analytical Chemistry, 2015, 87(16): 8353-8359.
Progress in research of reaction-activated fluorescent probe for enzymes
QIAN Ming, ZHANG Liuwei, WANG Jingyun
(School of Life Science and Biotechnology, Dalian University of Technology, Dalian 116024, Liaoning, China)
Enzyme plays an extremely important role in maintaining homeostasis and the normal life activities in biological systems. The abnormality of some particular enzymes activity is closely relevant to the occurrence and development of related diseases. Therefore, it is of great significance to detect and visualize specific enzyme in vivo with an in-situ and real-time method. The chemical fluorescent probes are endowed with the obvious advantages such as good selectivity, high sensitivity, high imaging resolution and so forth. In recent years, researchers have designed and synthesized a series of fluorescent probes for enzyme detection and visualized imaging in living systems. Based on the trigger mode of fluorescence response, the enzymatic fluorescent probes can be generally divided into two categories: (1) probes based on the recognition between enzyme and specific groups of its inhibitor existing in the probes, called inhibitor-based enzymatic fluorescent probes and (2) probes based on the effective catalytic ability of specific enzyme, also known as the reaction-activated enzymatic fluorescent probes. Herein, in this review, the design strategies of reaction-activated fluorescent probe for enzymes and the research progress of reaction-activated fluorescent probes for four important disease-related enzymes (monoamine oxidase, β-galactosidase, nitroreductase, γ-gumatyl transpeptidase) were mainly reviewed, and the future research of fluorescent probes for enzymes was prospected.
fluorescence; probes; enzyme; imaging; cell biology
Prof. WANG Jingyun, wangjingyun67@dlut. edu.cn
O 657.3
:A
:0438—1157(2017)01—0008—15
10.11949/j.issn.0438-1157.20161279
2016-09-12 收到初稿,2016-10-19 收到修改稿。
联系人:王静云。
:钱明(1993—),男,博士研究生。
国家自然科学基金项目(21376039)。
Received date: 2016-09-12.
Foundation item: supported by the National Natural Science Foundation of China (21376039).
