PTH、细胞内钙和CaSR在心肌损伤中的“三角关系”*
2017-01-19徐长庆
罗 星, 徐长庆
(哈尔滨医科大学病理生理教研室,黑龙江 哈尔滨 150001)
·综 述·
PTH、细胞内钙和CaSR在心肌损伤中的“三角关系”*
罗 星, 徐长庆△
(哈尔滨医科大学病理生理教研室,黑龙江 哈尔滨 150001)
甲状旁腺激素; 细胞内钙; 钙敏感受体; 心肌损伤
甲状旁腺激素 (parathyroid hormone, PTH) 是甲状旁腺细胞分泌的调控机体钙磷代谢的重要激素。近年来,PTH对于心肌的毒性作用开始受到人们关注。钙敏感受体 (calcium-sensing receptor, CaSR) 是G蛋白偶联家族成员之一,可以感受细胞外钙浓度的细微变化,并通过多种途径调节细胞内钙浓度,进而控制PTH的分泌。CaSR在心肌细胞、肾小管上皮细胞和甲状旁腺细胞等广为表达。细胞内钙作为第二信使,参与细胞的多种功能,诸如兴奋-收缩偶联、受精等过程。高浓度的PTH、细胞内钙和高表达的CaSR,均与心肌细胞的损伤息息相关。
1 细胞内钙与心肌损伤
细胞内钙作为第二信使,在机体许多生理和病理过程涉及的细胞信号转导中扮演了非常重要的角色。细胞内钙稳态与细胞的生存、代谢和功能密切相关。心肌细胞内钙来源于钙离子通道介导的细胞外钙内流和肌浆网 (sarcoplasmic reticulum, SR) 内钙外流。细胞外钙内流主要由电压依赖型钙离子通道 (voltage-dependent calcium channel, VDCC) 和受体操纵型钙离子通道 (receptor-operated calcium channel, ROCC) 介导,前者主要受膜电位控制,后者取决于配体的性质。ROCC存在于细胞膜(例如α受体和β受体)和肌浆网[三磷酸肌醇 (inositol triphosphate, IP3) 受体和ryanodine受体]。心肌细胞内钙主要存在于肌浆网(第一钙库)以及细胞浆和线粒体(第二钙库)中。肌浆网由IP3敏感池和IP3不敏感池组成,分别受IP3受体系统和ryanodine受体系统调控。钙离子经过单个L型钙通道引起的局部细胞内钙增加称为钙小星 (Ca2+sparklet),后者诱发肌浆网上数个ryanodine受体同时开放,形成更高浓度的钙火花 (calcium sparks)。钙火花负责触发心肌的兴奋-收缩偶联。
细胞内钙超载是指细胞内游离钙显著增加,可激活多条心肌凋亡信号通路(例如线粒体凋亡通路,死亡受体凋亡通路和内质网应激凋亡通路),是各种心血管疾病细胞死亡的共同通路[1]。在小鼠心肌缺血-再灌注损伤中,损伤组心肌细胞细胞内游离钙比正常组明显升高。其机制可能是钠钙交换体反向转运,大量钙离子进入细胞浆;缺血时ATP供给不足,肌浆网钙泵障碍,摄取钙减少[2];还有实验报道,细胞内钙超载通过线粒体钙离子单向转运体引起线粒体细胞凋亡途径,是缺血-再灌注损伤导致心肌死亡的主要原因[3]。线粒体通透性转运孔 (mitochondrial permeability transition pore, MPTP)是存在于线粒体内膜表面的高导电性复合蛋白通道,目前发现MPTP主要组成成分有电压依赖型阴离子通道 (voltage-dependent anion chancel, VDAC)、腺苷酸转位蛋白 (adenine nucleotide translocator, ANT)和亲环蛋白D (cyclophilin, Cyp-D)。Cyp-D的生理功能是保证蛋白质的准确折叠,并且Cyp-D上有Ca2+和ANT的结合位点,在线粒体钙超载的情况下,Cyp-D先后与钙离子和ANT结合,使得ANT构象发生改变,促进MPTP开放[4]。MPTP开放后跨膜电位下降,从而导致细胞色素C (cytochrome C, Cyt C) 和细胞凋亡诱发因子 (apoptosis-inducing factor, AIF) 的释放[5]。释放的Cyt C在胞质中与凋亡蛋白酶活化因子1 (apoptotic protease-activating factor 1, Apaf-1) 形成复合物,导致ATP的大量消耗并促进Apaf-1的聚合,其N端的CARD结构域与procaspase-9的CARD寡聚化,通过级联反应,依次激活caspase-7和caspase-3,引起细胞凋亡[6]。线粒体外膜间隙释放的AIF也可以直接活化caspase-3[7]。通过激活线粒体凋亡途径诱发心肌细胞凋亡,是细胞内钙超载导致心肌损伤的主要机制。
2 PTH与心肌损伤
PTH是尿毒症血症的重要心脏毒素,对心血管系统影响极大。血清PTH水平过高可导致心肌肥大、心脏损伤和血管钙化,影响血压甚至影响血糖和血脂[8]。血清PTH的正常值范围为12~76 ng/L。文献报道,慢性肾衰竭病人常伴有继发性甲状旁腺功能亢进,血清中PTH水平升高。Fujii等[9]的实验发现,PTH>500 ng/L的慢性肾衰竭患者心室重量指数和室间隔厚度较PTH正常者显著升高,说明高浓度PTH可促进心肌细胞肥大甚至损伤。Halapas等[10]在小鼠模型中发现,PTH相关蛋白(例如PTH1-34)同PTH一样,可与PTH受体结合,进而参与心肌肥大和心肌损伤的过程。PTH升高时,血管紧张素Ⅱ (angiotensin II, Ang II) 随之升高,后者通过调节许多原癌基因的表达,导致心肌细胞及心肌间质细胞增生和纤维化[11]。研究表明,PTH(或PTH相关蛋白)和Ang II均可与心肌细胞膜上各自相应的G蛋白偶联受体结合,激活cAMP和PKC途径,活化心肌细胞上L型钙通道,使钙内流增多,也可能导致心肌细胞线粒体上钙离子单向交换体开放,引起细胞内和线粒体钙超载,促进心肌肥大和细胞凋亡。亦有最新的研究显示,心脏局部的肾素-血管紧张素系统也参加了钙超载的发生[12]。心脏在代偿期多呈向心性肥大,失代偿时可发展为心衰。晚期继发性甲状旁腺亢进的病人,常伴发舒张期功能障碍[13]。最新研究表明,糖耐量也是PTH影响心肌代谢的一个重要方面。高PTH引起胰岛B细胞中腺苷三磷酸水平升高,细胞内钙浓度升高,减少胰岛素分泌,糖耐量异常,导致心肌损害[14]。
临床上,对于继发性甲状旁腺亢进患者,常采用甲状旁腺切除术或者钙三醇(维生素D3的代谢物)来治疗,并取得较好效果。在甲状旁腺切除术后,患者血钙水平和血脑钠肽水平明显下降,左心室重量指数、左心室射血分数、收缩功能等均有明显改善,但是内皮源型的舒张功能改善不大。
总之,PTH分泌异常对心肌的结构和功能有一定的影响,甚至导致心肌损伤。具体机制有待进一步研究。
3 CaSR与心肌损伤
CaSR是G蛋白偶联受体C家族成员,广泛存在心血管系统,在心肌细胞、血管平滑肌和血管内皮细胞都有表达,参与细胞内钙稳态、心肌兴奋-收缩偶联、细胞基因表达和细胞凋亡的调控[15]。有人在大鼠和小鼠心肌缺血-再灌注 (ischemia-reperfusion, I/R) 损伤模型发现,心肌I/R可引起CaSR表达增加,激活磷脂酶C (phospholipase C, PLC),催化磷酯酰肌醇二磷酸 (phosphatidylinosital biphosphate, PIP2) 产生IP3和甘油二酯(diacylglycerol, DAG),IP3和DAG分别促使内质网上IP3受体钙离子通道和质膜L型钙通道开放,细胞内钙超载,继而诱导线粒体钙离子单向转运体 (mitochondrial calcium uniporter, MCU) 开放,线粒体膜电位下降,引起心肌细胞经线粒体途径凋亡[16]。MCU本身与细胞内钙亲和力极低,但发生细胞内钙超载后,高浓度的Ca2+与MCU的亚基MCU1的EF臂Ca2+结合域结合,协同开放MCU通道[17]。MCU开放后,钙离子大量进入线粒体,抑制ATP的合成,使得心肌能量产生障碍;激活线粒体膜上磷脂酶,引起线粒体膜损伤;并在线粒体内形成磷酸钙沉积,改变了线粒体膜的通透性,从而导致线粒体钙超载引起心肌损伤[18]。国内研究者发现,用三氯化钆 (GdCl3) 激动CaSR后细胞外信号调节激酶 (extracellular signal-regulated kinase, ERK) 磷酸化和Bcl-2表达增加,而caspase-3表达也上调,细胞凋亡增加;使用酪氨酸蛋白激酶阻断剂PD98059后,ERK磷酸化降低,Bcl-2表达减少,心肌凋亡增加。可见,CaSR促进ERK磷酸化与酪氨酸蛋白激酶有关,而且CaSR激活的促凋亡作用大于抑凋亡作用[14]。有人在动物实验中观察到,糖尿病心肌病模型组的心肌凋亡率较对照组显著升高,但是加入CaSR阻断剂NSP2390后,细胞凋亡率明显下降[18]。此外,人们还观察到,心肌I/R损伤大鼠和高位截瘫受损小鼠,其心肌细胞上CaSR表达都显著升高。可见,CaSR在心肌细胞凋亡中的作用,各家实验结果不尽相同,需要进一步深入研究。有人发现,ATP敏感钾通道开放剂预处理可抵抗心肌I/R损伤,同时使CaSR表达和细胞凋亡减少[19],提示ATP敏感钾通道开放剂的心肌保护作用可能和CaSR的表达降低有关。Yang等[20]在细胞培养的研究中,同样观察到ATP敏感性钾通道开放剂吡那地尔可减少缺氧复氧所致的CaSR表达和细胞凋亡增加。显然,心肌细胞CaSR的表达和活性异常与心肌损伤关系密切。
4 PTH与CaSR
PTH与CaSR息息相关,都参与体内钙稳态的调节。CaSR在甲状旁腺和肾小管上均有表达,可感受细胞外钙离子浓度的变化,继而发挥不同的生理功能。CaSR调节甲状旁腺激素分泌的具体机制尚不清楚,主要有2种假说。在细胞外钙升高时,CaSR主要通过2条通路影响PTH分泌,其一是Gq蛋白激活引起肌醇磷脂集聚,其二是Gi蛋白激活导致ERK1/2磷酸化,二者均能抑制PTH的分泌[21]。位于3q21.1的CaSR基因突变会导致甲状旁腺功能紊乱。失活突变可导致新生儿严重甲亢、继发性甲亢和家族性低尿钙高钙血症;激活突变则可导致低钙血症、巴氏综合征和自身免疫性甲状旁腺功能减退[22]。CaSR基因突变常呈剂量效应。例如单个CaSR基因的失活突变可引起轻微高钙血症,无明显临床症状,然而纯合突变则可引起新生儿严重甲亢。失活突变的机制主要有:(1)CaSR受体在细胞内生物合成障碍或降解增加[23];(2)CaSR的细胞内生物合成及表达正常,但是向内质网转运异常[24];(3)CaSR表达及转运正常,但是对钙离子等配体的结合力下降[25]。CaSR基因的失活突变,可引起原发性或继发性甲状旁腺亢进,进而对心肌产生毒性。针对CaSR这个靶点,采用CaSR激动剂可抑制PTH的释放,减少心脏毒性等并发症。Block等[26]用拟钙剂西那卡塞(30~180 mg)对741例继发性甲状旁腺功能亢进患者进行治疗,结果显示西那卡塞治疗组PTH下降43%(对照组上升9%),血钙血磷明显下降。国内研究人员分别对于36例继发性甲状旁腺患者进行维生素D3冲击疗法和西那卡塞疗法,结果显示2组钙磷浓度和PTH都较对照组显著下降,而且PTH在西那卡塞治疗组下降比维生素D3组更为明显[27]。从PTH作为心肌毒素的角度看,拟钙剂确实可以保护心脏,但是缺少确切的临床试验验证。反过来,PTH也会影响CaSR的激活。CaSR对于细胞外钙极度敏感,当细胞外钙超过1.3 mmol/L(正常血清游离钙为1.0 mmol/L~1.25 mmol/L),CaSR激活,通过一系列信号传导通路,发挥不同生物学效应。有研究显示,PTH可升高细胞外钙,从而激活细胞表面CaSR,活化细胞内MAPKK通路,促进细胞增殖[28]。但是,在心肌损伤方面,PTH是否也是经过相同的途径升高细胞外钙,再激活CaSR引起细胞内钙超载,继而导致细胞凋亡,这个假设尚没有实验来证实。如果该假说得到证实,CaSR有望成为未来治疗甲状旁腺功能亢进所致心肌损伤的新靶点。
5 PTH、细胞内钙与心肌损伤
PTH主要生理功能是升高细胞外钙和降低血磷。但是研究表明,PTH对细胞内钙也有调节作用。赵卫红等[29]将原代培养的小鼠心肌细胞,分别用PTH以及PTH和硝苯地平联合处理,发现单纯PTH处理组小鼠心肌细胞内游离钙较对照组明显升高,而且细胞凋亡率升高。而硝苯地平和PTH联合处理组细胞内钙和细胞凋亡率较单纯PTH处理组有所降低,但仍比正常对照组高。加入硝苯地平后细胞内钙离子和细胞凋亡率下降说明PTH通过G蛋白偶联激活腺苷酸环化酶,开放细胞膜上电压依赖型钙通道,促进细胞内钙超载;而和对照组比较,依然有较高细胞凋亡率,暗示还有其它途径引起钙超载和细胞凋亡。亦有研究显示,钙三醇也可以改善PTH引起的心肌细胞内钙超载和心肌细胞凋亡[30]。
综上所述,PTH、CaSR和细胞内钙之间存在复杂而又紧密的关系。PTH可以间接激动CaSR,引起一系列的信号转导通路的活化,而CaSR又可以抑制PTH的分泌。PTH可以升高细胞内游离钙,发挥第二信使的正常生理功能;在病理状态下,则可引起细胞内钙超载。CaSR也可以通过G蛋白偶联途径,升高细胞内钙,引起心肌凋亡。所以,PTH、CaSR和细胞内游离钙之间形成一个互相影响的三角关系,最终以细胞内钙超载为核心环节,导致心肌损伤。PTH是否可以通过升高细胞外钙,间接激活CaSR,进而升高细胞内钙,引起细胞内钙超载,这一假想有待于通过实验验证。如果得到证实,将进一步揭示继发性甲状旁腺功能亢进心肌损伤的新机制(图1)。
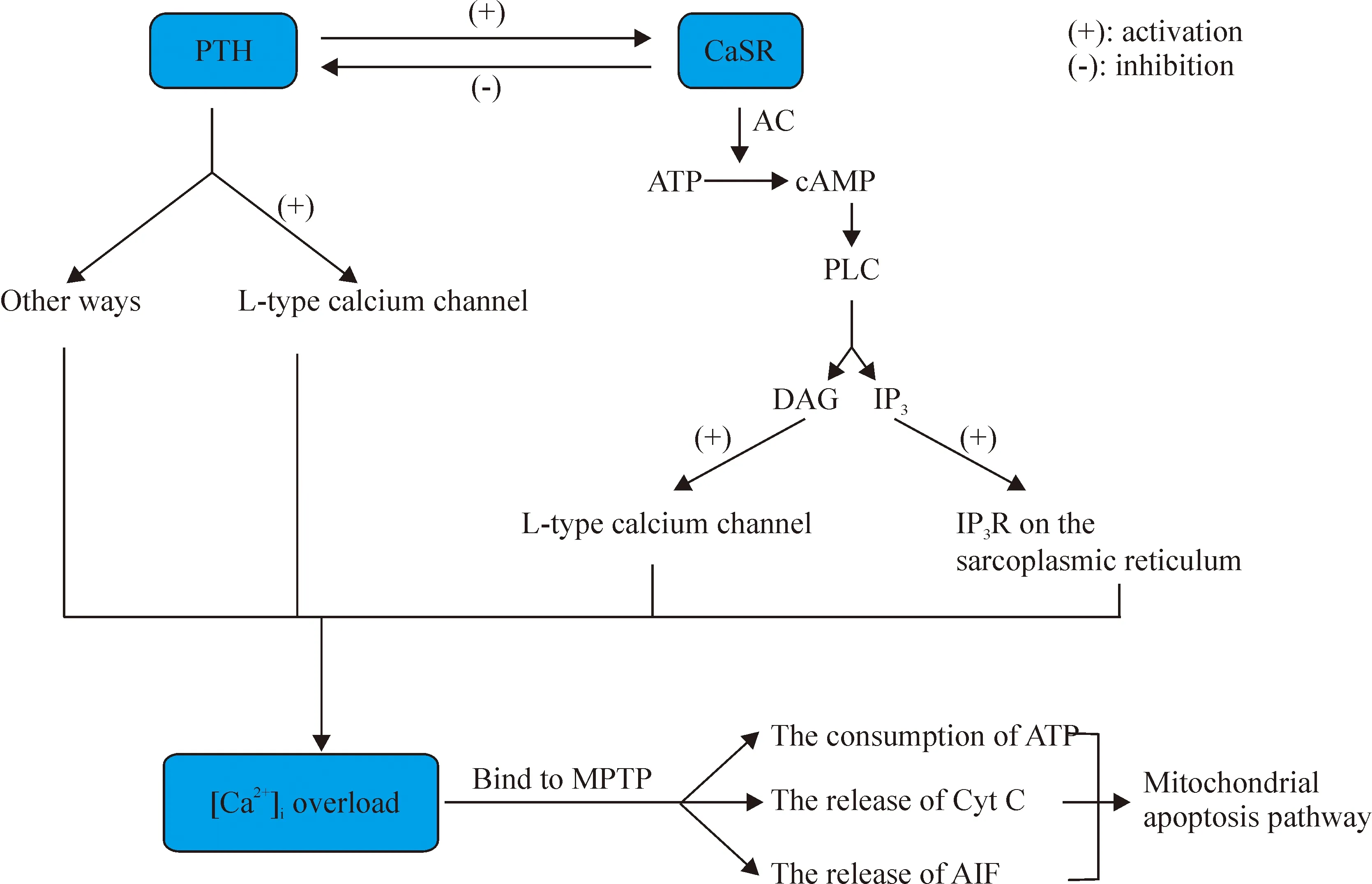
Figure 1.The triangle relationship of PTH, CaSR and intracellular calcium and their potential mechanism of apoptosis. PTH can activate CaSR by increasing the concentration of the extracellular calcium, while the activation of CaSR is able to inhibit the release of PTH in reverse. Moreover, excessive increase in PTH activates CaSR, which contributes to the opening of L-type calcium channel and IP3R calcium channel. Intracellular calcium overload caused by the opening of those channels is capable of inducing mitochondrial apoptosis pathway.
图1 PTH、CaSR和细胞内钙之间的潜在关系及其导致细胞凋亡的推测图示
6 展望
随着人们物质生活水平的提高和精神压力的增加,慢性肾衰竭的主要病因糖尿病和高血压病的发病率将越来越高。继发性甲状旁腺功能亢进诱发心肌损伤是慢性肾衰竭致死的主要原因。因此,进一步阐明甲状旁腺亢进心肌病的机制显得分外重要。对于PTH是否可以通过增加细胞外钙间接激动CaSR进而引起细胞内钙超载的这一假设,如果得到证实,将可能指导临床用药,给慢性肾衰竭患者带来福音。
[1] Zimmerman AN, Hülsmann WC. Paradoxical influence of calcium ions on the permeability of the cell membranes of the isolated rat heart [J]. Nature, 1996, 211(5049):646-653.
[2] Sugishita K, Su Z, Li F, et al. Gender influences [Ca2+]iduring metabolic inhibition in myocytes overexpressing the Na+-Ca2+exchanger [J]. Circulation, 2001, 104(17):2101-2106.
[3] Zhao ZQ. Oxidative stress-elicited myocardial apoptosis during reperfusion[J]. Curr Opin Pharmacol, 2004, 4(2):159-165.
[4] Woodfield K, Rtmck A, Brdiczka D, et al. Direct de-monstration of a specific interaction between cyclophilin-D and the adenine nucleotide translocase confirms their role in the mitochondrial permeability transition[J]. Biochem J, 1998, 336(Pt 2): 287-290.
[5] He L, Pollens AT, Medrano CJ, et al. Lead and calcium produce rod photo receptor cell apoptosis by opening the mitochondrial permeability transition pore[J]. J Biol Chem, 2000, 275(16):12175-12184.
[6] Randon RB, Rohde LE, Comerlato L, et al. The role of secondary hyperparathyroidism in left ventricular hypertrophy of patients under chronic hemodialysis[J]. Braz J Med Biol Res, 2005, 38( 9):1409-1416.
[7] Ebisawa K, Kimura K, Nakayama T, et al. Cardiac electrophysiologic effects of parathyroid hormone in the guinea pig[J]. Heart Vessels, 1995, 10(3):128-137.
[8] Andersson P, Rydberg E, Willenheimer R. Primary hyperparathyroidism and heart disease: a review[J]. Eur Heart J, 2004, 25(20):1776-1787.
[9] Fujii H, Kim JI, Abe T, et al. Relationship between pa-rathyroid hormone and cardiac abnormalities in chronic dialysis patients[J]. Intern Med, 2007, 46(18):1507-1512.
[10]Halapas A, Diamanti-Kandarakis E, Kremastinos D, et al. The PTHrP/PTH.1-R bioregulation system in cardic hypertrophy: possible therapeutic implications[J]. In Vivo, 2006, 20(6B):837-844.
[11]朱甫祥, 马丽英, 王孝铭, 等. 局部肾素血管紧张素系统在心肌细胞氧反常中的作用[J]. 中国病理生理杂志, 1997, 13(2):126-128.
[12]汪关煜, 钱 莹, 朱 萍, 等. 慢性肾衰患者甲状旁腺激素与左心室结构和功能的关系[J]. 肾脏病与透析肾移植杂志, 2001, 10(1):25-27.
[13]Khan S. Secondary hyperparathyroidism is associated with higher cost of care among chronic kidney disease patients with cardiovascular comorbidities[J]. Nephron Clin Pract, 2007, 105(4):c159-c164.
[14]Hörl WH. The clinical consequences of secondary hyperparathyroidism: focus on clinical outcomes[J]. Nephrol Dial Transplant, 2004, 19(Suppl 5):v2-v8.
[15]徐长庆, 张伟华. 心血管疾病钙敏感受体的研究进展[J]. 中国病理生理杂志, 2010, 26(2):409-413.
[16]Lu FH, Tian Z, Zhang WH, et al. Calcium-sensing receptors regulate cardiomyocyte Ca2+signaling via sarcoplasmic reticulum-mitochondrion interface during hypoxia/reoxygenation[J]. J Biomed Sci, 2010, 17:50.
[17]徐 斌, 李 泱. 线粒体钙单向转运体及其蛋白相互作用的调控[J]. 中国病理生理杂志, 2015, 31(12):2291-2295.
[18]杨彦玲, 师养荣, 李建龙, 等. 心肌缺血再灌注损伤研究进展[J]. 心血管病研究进展, 2003, 24(2):116-121.
[19]Qi HP, Cao YG, Huang W, et al. Crucial role of cal-cium-sensing receptor activation in cardiac injury of diabetic rats[J]. PLoS One, 2013, 8(5):e65147.
[20]Yang I, Yu T. Prolonged donor heart preservation with pinacidil: the role of mitochondria and the mitochondrial adenosine triphosphate-sensitive potassium channel[J]. J Thorac Cardiovasc Surg, 2010, 139(4):1057-1063.
[21]王晓巍, 陈智勇, 朱化刚. 钙敏感受体在甲状旁腺功能亢进中的作用[J]. 国际外科学杂志, 2011, 38(5):339-342.
[22]Hannan FM, Thakker RV. Calcium-sensing receptor (CaSR) mutations and disorders of calcium, electrolyte and water metabolism[J]. Best Pract Res Clin Endocrinal Metab, 2013, 27(3):359-371.
[23]Pidasheva S, Canaff L, Simonds WF, et al. Impaired cotranslational processing of the calcium-sensing receptor due to signal peptide missense mutations in familial hypocalciuric hypercalcemia[J]. Hum Mol Genet, 2005, 14(12):1679-1690.
[24]Pidasheva S, Grant M, Cauaff L, et al. Calcium-sensing receptor dimerizes in the endoplasmic reticulum: bioche-mical and biophysical characterization of CASR mutants retained intracellularly[J]. Hum Mol Genet, 2006, 15(14):2200-2209.
[25]Zajiekova K, Vrbikova J, Canaff L, et al. Identification and functional characterization of a novel mutation in the calcium-sensing receptor gene in familial hypocalciuric hypercalcemia: modulation of clinical severity by vitamin D status[J]. J Clin Endocrinol Metab, 2007, 92(7):2616-2623.
[26]Block GA, Martin KJ, Francisco AL, et al. Cinacalcet for secondary hyperparathroidism in patients receiving hemodialysis[J]. N Engl J Med, 2004, 350(15):1516-1525.
[27]殷 勋. 钙敏感受体激动剂治疗维持甲状旁腺功能亢进患者的临床研究[J]. 中国民康医学, 2016, 28(3):28-32.
[28]Miao D, He B, Lanske B, et al. Skeletal abnormalities inPth-null mice are influenced by dietary calcium[J]. Endocrinology, 2004, 145(4):2046-2053.
[29]赵卫红, 王笑云, 张晓文. 甲状旁腺素对大鼠心肌细胞内游离钙和细胞凋亡的影响[J].中国药理学通报, 2014, 19(7):826-835.
[30]赵卫红, 王笑云, 张晓文. 钙三醇和甲状旁腺素对鼠心肌细胞凋亡的影响及机制[J].中国临床康复, 2004, 8(24):5004-5005.
(责任编辑:林白霜, 罗 森)
Triangle relationship of PTH, intracellular calcium and CaSR in myocardial damage
LUO Xing, XU Chang-qing
(DepartmentofPathophysiology,HarbinMedicalUniversity,Harbin150001,China.E-mail:xucq45@126.com)
Parathyroid hormone (PTH) is an important hormone secreted by parathyroid cells, and regulates the metabolism of calcium and phosphorus in the body. In recent years, the toxic effect of PTH on myocardium has been reported. Calcium-sensing receptor (CaSR), a member of G protein-coupled receptor family, can feel the subtle change of extracellular calcium concentration and regulate intracellular calcium concentration through multifarious ways in order to control the secretion of PTH. The expression of CaSR is observed in parathyroid cells, renal tubular epithelial cells, myocardial cells, etc. Intracellular calcium, as a second messenger, participates in various cell functions, such as excitation-contraction coupling, fertilization and so on. The injury of myocardial cells is intimately linked with high concentrations of PTH and intracellular calcium, and high expression of CaSR.
Parathyroid hormone; Intracellular calcium; Calcium-sensing receptor; Myocardial damage
1000- 4718(2017)01- 0179- 05
2016- 06- 30
2016- 10- 28
国家自然科学基金资助项目(No.81270311)
R363
A
10.3969/j.issn.1000- 4718.2017.01.031
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 0451-86674548; E-mail: xucq45@126.com
