毒胡萝卜素诱导大鼠冠状动脉平滑肌细胞内质网应激模型的建立*
2017-01-19陈肖燕邓春玉邝素娟单志新林秋雄
陈肖燕, 邓春玉, 邝素娟, 杨 慧, 饶 芳, 单志新, 林秋雄, 姜 立△
(1汕头大学医学院,广东 汕头 515041; 2广东省人民医院医学研究部,广东省医学科学院,广东 广州 510080)
毒胡萝卜素诱导大鼠冠状动脉平滑肌细胞内质网应激模型的建立*
陈肖燕1, 2, 邓春玉2, 邝素娟2, 杨 慧2, 饶 芳2, 单志新2, 林秋雄2, 姜 立2△
(1汕头大学医学院,广东 汕头 515041;2广东省人民医院医学研究部,广东省医学科学院,广东 广州 510080)
目的: 探讨SD大鼠冠状动脉平滑肌细胞(coronary artery smooth muscle cells,CASMCs)原代培养方法,并建立CASMCs内质网应激(endoplasmic reticulum stress,ERS)模型。方法: 用组织块贴壁法培养CASMCs,光学显微镜观察细胞形态。免疫荧光技术检测CASMCs的标志分子α-SMA和SM-MHC的表达。采用Western blot检测ERS发生的标志物BiP和CHOP的蛋白表达水平。结果: 冠状动脉组织块贴壁培养6 d后,细胞从组织块边缘爬出,呈长梭型,9~10 d细胞生长汇合后表现出平滑肌细胞典型的“峰-谷”状。免疫荧光技术鉴定结果显示,α-SMA和SM-MHC表达呈阳性。不同浓度(0.5、1和2 μmol/L)的毒胡萝卜素(thapsigargin,TG)处理CASMCs 24 h后,Western blot结果显示,TG(1和2 μmol/L)处理组的BiP和CHOP蛋白表达与对照组相比增加,差异具有统计学意义。与对照组相比较,1 μmol/L TG处理CASMCs 24和48 h后BiP和CHOP蛋白表达显著性增加。结论: 采用组织块贴壁法可以成功培养CASMCs。利用1 μmol/L TG诱导24 h可建立CASMCs 的ERS模型。
冠状动脉平滑肌细胞; 组织块贴壁法; 内质网应激
内质网是真核细胞重要的细胞器之一,其稳定性是保障内质网功能的基本条件,但是一些病理因素可导致内质网应激(endoplasmic reticulum stress,ERS),如内质网钙代谢紊乱、缺血再灌注损伤、氧化应激、缺氧、酸中毒、高同型半胱氨酸、卵磷脂合成障碍等[1]。ERS是指由于上述原因引起细胞内质网功能紊乱、错误蛋白或未折叠蛋白在内质网腔内聚集的一种亚细胞器病理状态。ERS可使细胞产生未折叠蛋白反应(unfolded protein reaction,UPR)来缓解内质网压力,从而使内质网恢复稳定。但如果ERS过强或持续时间过长,超过细胞自身调节能力可诱发细胞凋亡,进而导致一系列病理反应[2-3]。发生ERS的细胞能调节内质网应激相关性促凋亡分子[如C/EBP同源蛋白(C/EBP homologous protein,CHOP)和caspase-12等],以及促存活分子[如生长阻滞及DNA损伤诱导蛋白34(growth arrest and DNA-damage-inducible protein 34,GADD34)和免疫球蛋白结合蛋白(binding immunoglobulin protein,BiP)等]的表达活化,最终决定细胞是适应ERS还是凋亡[4]。目前,ERS的这种双向应答方式成为了治疗心血管疾病和癌症的潜在靶点[5-8]。
研究表明,冠状动脉平滑肌细胞(coronary artery smooth muscle cells,CASMCs)发生ERS与冠状动脉粥样硬化和血管钙化等病理变化密切相关[9-12],但其具体机制尚未阐明。本研究旨在培养原代CASMCs,并在细胞水平构建CASMCs的ERS模型,为研究ERS的发生机制提供一种细胞模型。
材 料 和 方 法
1 实验动物
SPF级SD大鼠,雄性,180~200 g,购自中山大学实验动物中心,许可证号为SCXK(粤)2011-0029。
2 主要试剂
DMEM/F12细胞培养基、胎牛血清购自Gibco;0.25%胰蛋白酶以及Ⅰ抗稀释液购自上海碧云天公司;抗BiP、CHOP和GAPDH抗体购自Cell Signaling Technology;抗α-SMA和SM-MHC抗体购自Abcam;Ⅱ抗购自Invitrogen;封闭牛奶和loading buffer购自Bio-Rad;TG购自Sigma;PVDF膜购自Millipone。
3 主要方法
3.1 大鼠CASMCs的培养 采用颈椎脱臼法处死SD大鼠,在无菌条件下迅速取出大鼠心脏。用显微器械在显微镜下分离出心脏的前降支、右冠状动脉及间隔支,操作时动作要轻柔,避免对血管的过度损伤。将冠状动脉剪碎至1 mm×1 mm大小块状放入6孔板中,加入2 mL 20%胎牛血清的1×105U/L青霉素和100 mg/L链霉素的DMEM/F12培养基,于37 ℃、5% CO2培养箱内绝对静置孵育3~5 d。第6天在显微镜下观察细胞已从血管组织块中爬出,在第9~10天细胞汇合成片时,用0.25%的胰酶原孔消化细胞,使细胞均匀铺在6孔板中,每48 h换液。待细胞长满时以1∶2进行传代,随后改用含10%胎牛血清的DMEM/F12培养基培养细胞。
3.2 大鼠CASMCs的鉴定 采用免疫荧光技术对第4代细胞进行细胞鉴定,检测CASMCs的标记分子α-SMA和SM-MHC的表达。将爬片置于浓硫酸中浸泡并过夜,第2天先用自来水冲洗20遍,再用三蒸水冲洗3遍,高压消毒烘干后将玻片置于6孔培养板中。0.25%胰酶消化细胞后重悬细胞,计数,将3×105接种到细胞培养板。4%多聚甲醛固定细胞15 min,PBS洗5 min×3次,0.2% Triton X-100破膜20 min,PBS洗5 min×3次。山羊血清封闭30 min,封闭后加入α-SMA(1∶100)和SM-MHC(1∶100)的Ⅰ抗4 ℃静置过夜。PBS洗5 min×3次, 避光加入荧光Ⅱ抗(1∶1 000),PBS洗5 min×3次,最后加入DAPI染核5 min,封片后用荧光显微镜观察。
3.3 TG诱导大鼠CASMCs 取5~6代原代CASMCs,将CASMCs均匀地接种到6孔板上,分为空白对照组(blank组)、DMSO组和TG(0.5、1和2 μmol/L)处理组,TG处理时间为24 h。此外,用1 μmol/L的TG处理CASMCs 12、24和48 h后用PBS清洗3遍,用于提取总蛋白。
3.4 Western blot检测BiP和CHOP蛋白的表达量的变化 蛋白裂解液加入丝氨酸蛋白酶抑制剂后提取CASMCs总蛋白,利用BCA法测定蛋白浓度。将蛋白提取液用10%的SDS-PAGE进行分离,然后将电泳分离凝胶上的蛋白通过电转的方法转移到PVDF膜上。5%脱脂牛奶封闭2 h,4 ℃过夜孵育BiP(1∶1 000)、CHOP(1∶1 000)和GAPDH(1∶2 500)Ⅰ抗。TBST洗5 min×3次,常温孵育Ⅱ抗(1∶2 500) 1 h,TBST洗5 min×3次,最后用ECL试剂盒显影蛋白条带。
4 统计学处理
用SPSS 19.0统计软件进行分析。实验数据采用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析(one-way ANOVA),组间两两比较采用SNK-q法。以P<0.05为差异有统计学意义。
结 果
1 大鼠CASMCs的培养及鉴定
冠状动脉组织贴块6 d,倒置显微镜观察发现CASMCs已从冠状动脉边缘中爬出,并且形状为长梭型。9~10 d组织块周围的细胞相互汇合, 逐渐铺满瓶底时,具有CASMCs典型的“峰-谷”形状,见图1。免疫荧光结果提示α-SMA(红色)和SM-MHC(绿色)染色呈阳性,说明所培养的细胞为CASMCs,见图2。

Figure 1.Inverted microscopic images of the rat CASMCs (×100). A: at 7 d; B: at 9 d.
图1 大鼠冠状动脉血管平滑肌细胞倒置显微镜图像
2 毒胡萝卜素处理CASMCs可使BiP和CHOP蛋白表达增加
不同浓度的TG(0.5、1和2 μmol/L)处理CASMCs 24 h后,Western blot检测结果表明,TG(1和2 μmol/L)处理组的BiP蛋白表达与对照组相比增加,差异具有统计学意义,0.5 μmol/L TG处理组的BiP蛋白表达与对照组相比没有统计学差异。TG(0.5、1和2 μmol/L)处理组的CHOP蛋白表达与对照组相比均显著性增加,不同浓度处理组间的BiP和CHOP蛋白表达没有统计学差异,见图3、4。1 μmol/L TG处理CASMCs不同时间的结果显示,TG(12和24 h)处理组的BiP蛋白表达与对照组相比显著增加,TG处理12 h的BiP蛋白表达与对照组相比无显著差异。1 μmol/L TG处理CASMCs 12、24和48 h后CHOP蛋白表达与对照组相比均显著性增加。不同时间处理组间的BiP蛋白呈时间依赖性增加,见图5、6。
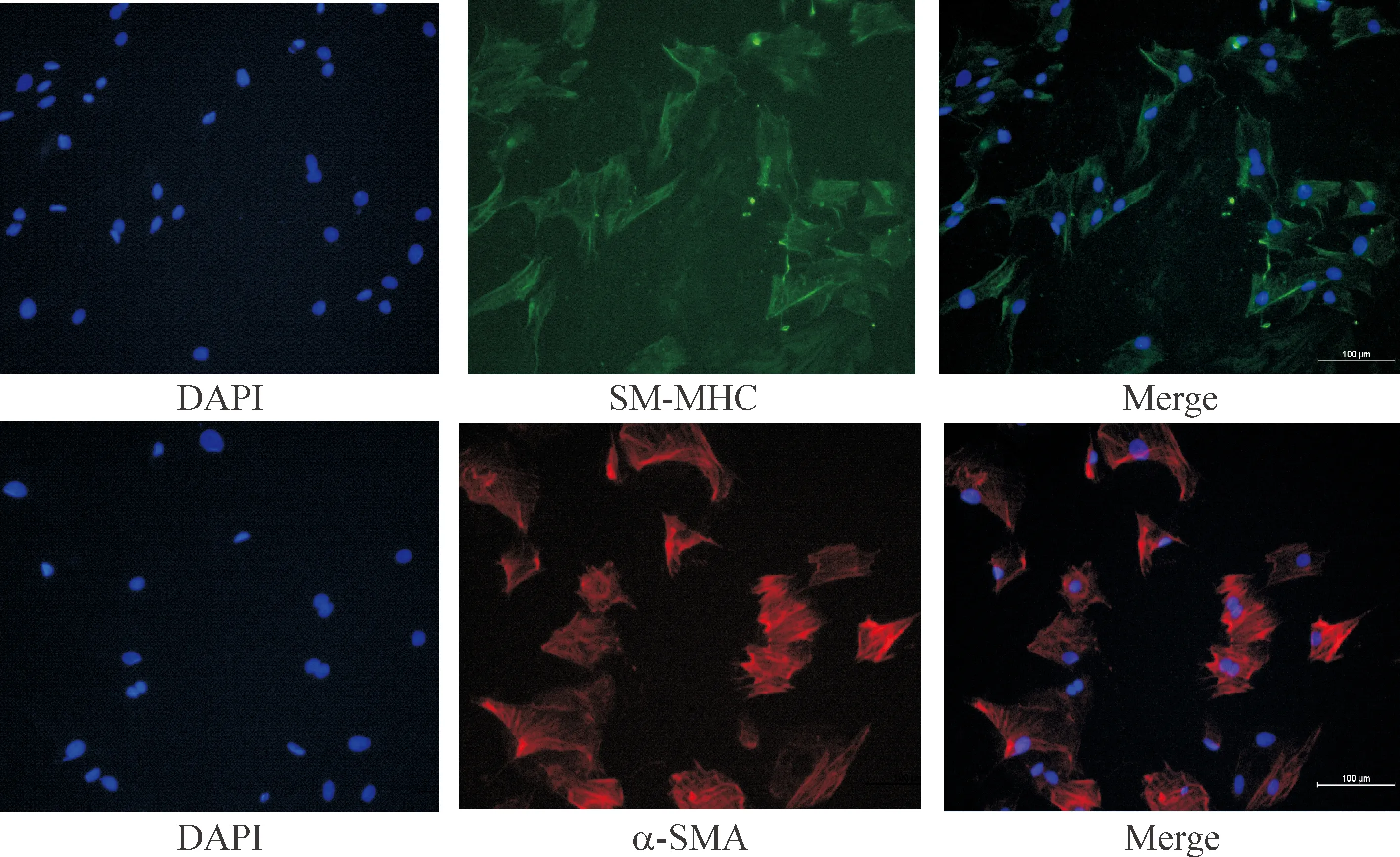
Figure 2.Identification of CASMCs. Immunofluorescence staining of SM-MHC and α-SMA in the CASMCs (×100). The CASMCs were stained with antibodies against SM-MHC (green) and α-SMA (red). The nuclei were stained with DAPI.
图2 大鼠冠状动脉血管平滑肌细胞的鉴定
讨 论
1 内质网应激及药物诱导
ERS存在于许多疾病的发生发展进程中,如自身免疫疾病、癌症、非酒精性脂肪肝、心脏病、动脉粥样硬化、二型糖尿病、肥胖以及神经系统功能紊乱[13]。因ERS常导致内质网内未折叠蛋白或错误折叠蛋白的蓄积,引起UPR,故一般用参与UPR的标志性分子BiP和CHOP的表达上调来提示ERS的发生[14-15]。蛋白激酶R样内质网激酶(protein kinase R-like endoplasmic reticulum kinase, PERK)、需肌醇酶1(inositol-requiring enzyme 1,IRE-1)和活化转录因子6(activating transcription factor 6,ATF6)是内质网应激3条信号通路的重要感应蛋白[1]。这3种感应蛋白在未发生ERS时均以无活性的状态与BiP结合,当ERS发生时BiP与上述3种蛋白分离,并使其活化,进而激活相应的信号通路[2-3]。钙离子代谢紊乱是ERS的重要诱发因素,细胞内稳定的钙离子浓度对于内质网分子伴侣BiP十分重要[16]。TG作为钙泵和Mg2+-ATPase的抑制剂,可以促进内质网钙离子向胞浆转运,使内质网Ca2+浓度下降,紊乱其功能,导致未折叠蛋白在内质网内积累,引起ERS。在细胞培养和动物实验中常被用来诱导ERS[16-17]。
2 CASMCs的培养及鉴定
血管平滑肌细胞(vascular smooth muscle cells,VSMCs)位于血管中膜,是构成血管壁组织结构及维持血管张力的主要细胞成分,其结构及功能的改变是导致高血压、动脉粥样硬化和血管成形术后再狭窄等多种心血管病的细胞病理学基础。目前主动脉血管平滑肌细胞(aortic vascular smooth muscle cells,AVSMCs)培养技术已经很成熟,但因冠状动脉的分离难度较主动脉大,CASMCs的培养比AVSMCs困难,国内相关报道比较少见。原代培养VSMCs主要有酶消化培养法和组织块贴壁法2种方法。采用酶消化培养法所需时间短, 获得的细胞量多。但由于酶消化法步骤繁锁,且胶原酶价格昂贵, 实验成本高。另外,冠状动脉的组织量较少,不宜采用酶消化培养法。本研究利用组织块贴壁法培养CASMCs更为简便、经济、有效。SM-MHC和α-SMA是CASMCs的标记分子,可用来鉴定原代CASMCs。经过免疫荧光鉴定DAPI所染细胞核与SM-MHC和α-SMA所染细胞骨架重合,结果为阳性,表明所培养出的细胞是CASMCs。

Figure 3.Protein expression of BiP after treatment with different doses of TG. Mean±SD.n=3.*P<0.05vsblank group.
图3 不同浓度毒胡萝卜素处理组的BiP蛋白表达量增加

Figure 4.Protein expression of CHOP after treatment with diffe-rent doses of TG. Mean±SD.n=3.**P<0.01vsblank group.
图4 不同浓度毒胡萝卜素处理组的CHOP蛋白表达量增加
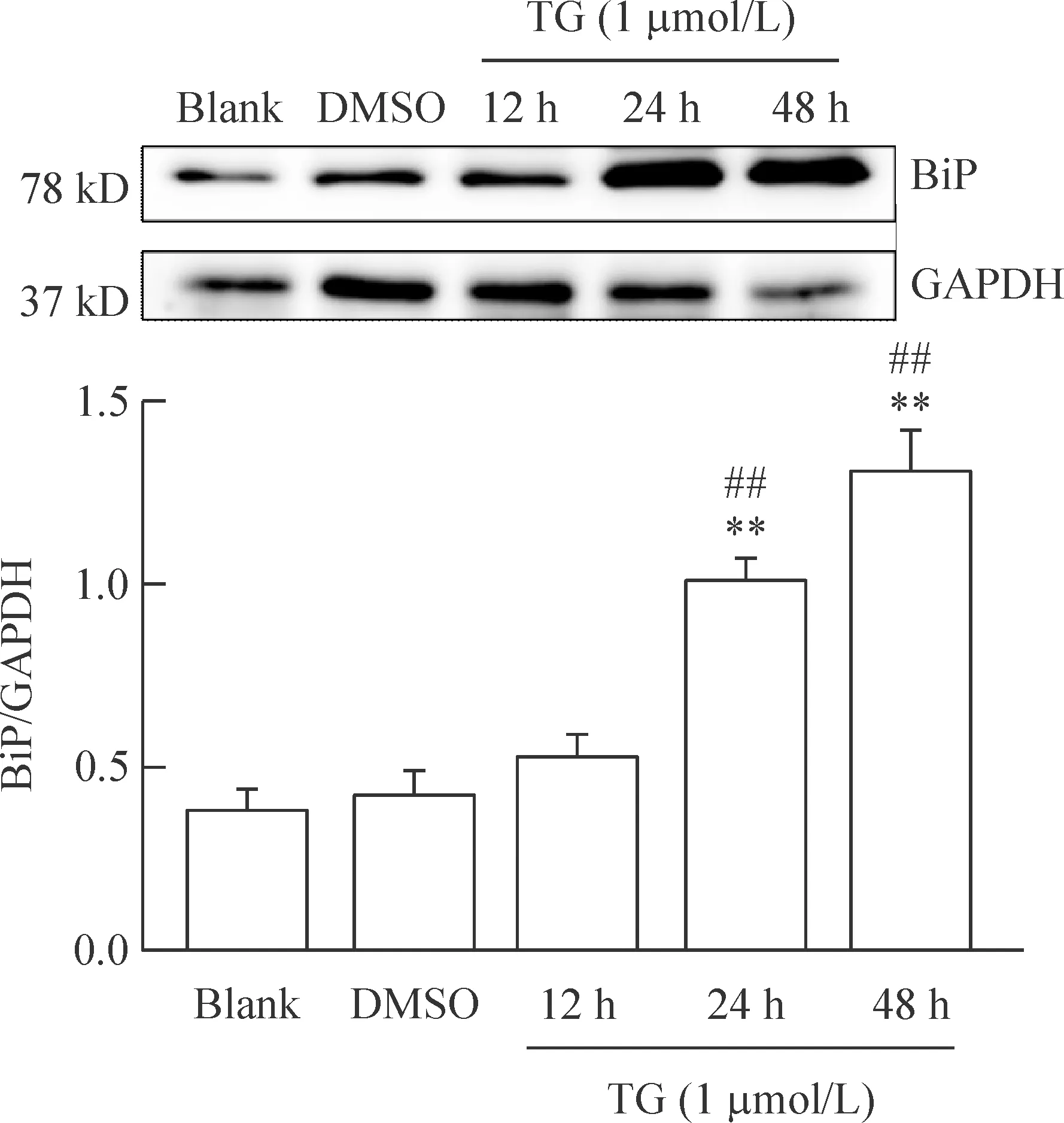
Figure 5.Protein expression of BiP after treatment with TG for different time. Mean±SD.n=3.**P<0.01vsblank group;##P<0.01vsTG (12 h) group.
图5 毒胡萝卜素不同时间处理组的BiP蛋白表达量增加

Figure 6.Protein expression of CHOP after treatment with TG for different time. Mean±SD.n=3.**P<0.01vsblank group.
图6 毒胡萝卜素不同时间处理组的CHOP蛋白表达量增加
3 ERS模型的构建
CASMCs 的ERS模型可用于研究ERS相应的分子机制,有助于防治心血管疾病和肿瘤治疗。不同浓度TG处理CASMCs 24 h后,TG(1和2 μmol/L)处理组的BiP蛋白表达量相比对照组显著增加,0.5 μmol/L TG处理组的BiP蛋白表达与对照组相比较没有统计学差异,说明诱导ERS的最低有效浓度为1 μmol/L。1 μmol/L TG处理CASMCs不同的时间后,TG(24和48 h)处理组的BiP蛋白的表达量相比对照组显著增加,TG处理12 h的BiP蛋白表达与对照组相比没有统计学差异,说明TG处理CASMCs 24 h是诱导ERS最短的有效时间。ERS发生时,通过上调BiP蛋白表达激活ATF6、PERK和IRE-1介导的3条生存信号通路来缓解内质网压力。细胞在正常情况下CHOP蛋白的表达很低,当ERS发生时CHOP蛋白表达上调,CHOP作为转录因子可调节DOCs、Bcl-2和GADD34的表达来诱导细胞凋亡。
综上所述,组织块贴壁法培养CASMCs实验方法简单,高效,纯度较高。1 μmol/L TG处理CASMCs 24 h可构建该细胞的ERS模型,为研究ERS的发生机制提供细胞模型。
[1] Zhang X, Yuan Y, Jiang L, et al. Endoplasmic reticulum stress induced by tunicamycin and thapsigargin protects against transient ischemic brain injury: involvement of PARK2-dependent mitophagy[J]. Autophagy, 2014, 10(10):1801-1813.
[2] Pluquet O, Pourtier A, Abbadie C. The unfolded protein response and cellular senescence. A review in the theme: cellular mechanisms of endoplasmic reticulum stress signaling in health and disease[J]. Am J Physiol Cell Physiol, 2015, 308(6): C415-C425.
[3] 全文淑, 金英顺, 金吉哲, 等. 过度内质网应激在慢性环孢素A肾毒性细胞凋亡中的作用机制[J]. 中国病理生理杂志, 2014, 30(6):1047-1051.
[4] Lu M, Lawrence DA, Marsters S, et al. Opposing unfolded-protein-response signals converge on death receptor 5 to control apoptosis[J]. Science, 2014, 345(6192): 98-101.
[5] Liu MQ, Chen Z, Chen LX. Endoplasmic reticulum stress: a novel mechanism and therapeutic target for cardiovascular diseases[J]. Acta Pharmacol Sin, 2016, 37(4): 425-443.
[6] Zhang SX, Sanders E, Fliesler SJ, et al. Endoplasmic reticulum stress and the unfolded protein responses in retinal degeneration[J]. Exp Eye Res, 2014, 125:30-40.
[7] Luo B, Lee AS. The critical roles of endoplasmic reticulum chaperones and unfolded protein response in tumorigenesis and anticancer therapies[J]. Oncogene, 2013, 32(7):805-818.
[8] Suh DH, Kim MK, Kim HS, et al. Unfolded protein response to autophagy as a promising druggable target for anticancer therapy[J]. Ann N Y Acad Sci, 2012, 1271: 20-32.
[9] Sozen E, Karademir B, Ozer NK. Basic mechanisms in endoplasmic reticulum stress and relation to cardiovascular diseases[J]. Free Radical Biol Med, 2015, 78:30-41.
[10]Duan X, Zhou Y, Teng X, et al. Endoplasmic reticulum stress-mediated apoptosis is activated in vascular calcification[J]. Biochem Biophys Res Commun, 2009, 387(4): 694-699.
[11]姚树桐, 秦树存. 内质网应激在动脉粥样硬化发生、发展和防治中的作用[J]. 中国病理生理杂志, 2014, 30(2):364-368, 384.
[12]Myoishi M, Hao H, Minamino T, et al. Increased endoplasmic reticulum stress in atherosclerotic plaques associated with acute coronary syndrome[J]. Circulation, 2007, 116(11):1226-1233.
[13]Schonthal AH. Endoplasmic reticulum stress: its role in disease and novel prospects for therapy[J]. Scientifica (Cairo), 2012, 2012: 857516.
[14]Zhou AX, Wang X, Lin CS, et al. C/EBP-homologous protein (CHOP) in vascular smooth muscle cells regulates their proliferation in aortic explants and atherosclerotic lesions[J]. Circ Res, 2015, 116(11):1736-1743.
[15]Fu XL, Gao DS. Endoplasmic reticulum proteins quality control and the unfolded protein response: the regulative mechanism of organisms against stress injuries[J]. Biofactors, 2014, 40(6):569-585.
[16]Yoshida H. ER stress and diseases[J]. FEBS J, 2007, 274(3):630-658.
[17]岳 雯, 姚树桐, 鲍 颖, 等. 槲皮素对毒胡萝卜素诱导的巨噬细胞内质网应激凋亡途径的抑制作用及机制[J]. 中国病理生理杂志, 2012, 28(3):518-523.
(责任编辑: 陈妙玲, 罗 森)
Model construction of rat coronary artery smooth muscle cell endoplasmic reticulum stress induced by thapsigargin
CHEN Xiao-yan1, 2, DENG Chun-yu2, KUANG Su-juan2, YANG Hui2, RAO Fang2, SHAN Zhi-xin2, LIN Qiu-xiong2, JIANG Li2
(1ShantouUniversityMedicalCollege,Shantou515041,China;2MedicalResearchCenter,GuangdongGeneralHospital,GuangdongAcademyofMedicalSciences,Guangzhou510080,China.E-mail:jiangli27556@vip.126.com)
AIM: To investigate the primary culture method for coronary artery smooth muscle cells (CASMCs), and to establish the endoplasmic reticulum stress (ERS) model in CASMCs of SD rats. METHODS: CASMCs were cultured by tissue explant method. The morphological characteristics were observed under optical microscope. The marker proteins of CASMCs, including α-SMA and SM-MHC, were identified by immunofluorescence technique. The protein expression levels of BiP and CHOP, the marker molecules of ERS, were determined by Western blot. RESULTS: The spindle-shaped CASMCs climbed out from the edge of coronary artery tissues after 6 d, and formed the typical "hill and valley" growth pattern of CASMCs at 9~10 d. The result of immunofluorescence technique showed that α-SMA and SM-MHC were positively expressed. The results of Western blot showed that the protein expression of BiP and CHOP in TG (1 and 2 μmol/L) treatment groups was increased compared with control group. Compared with control group, the protein expression of BiP and CHOP was significantly increased after 1 μmol/L TG treatment for 24 and 48 h. CONCLUSION: CASMCs can be successfully cultured by tissue explant method. ERS model of CASMCs was established by 1 μmol/L TG treatment for 24 h.
Coronary artery smooth muscle cells; Tissue explant method; Endoplasmic reticulum stress
1000- 4718(2017)01- 0128- 05
2016- 06- 27
2016- 11- 22
国家自然科学基金资助项目(No. 81273516; No. 81470440)
R363
A
10.3969/j.issn.1000- 4718.2017.01.021
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 020-83820615; E-mail: jiangli27556@vip.126.com
