牛磺酸减轻内毒素诱导的大鼠心肌损伤*
2017-01-19汤文天陆晓华王国光姜玉新
汤文天, 王 静, 刘 骏 △, 陆晓华, 王国光, 姜玉新
(1芜湖市第一人民医院心血管内一科, 安徽 芜湖 241000; 皖南医学院 2机能实验中心,3病理生理教研室, 4生理教研室, 安徽 芜湖 241002)
牛磺酸减轻内毒素诱导的大鼠心肌损伤*
汤文天1, 王 静1, 刘 骏1△, 陆晓华2, 王国光3, 姜玉新4
(1芜湖市第一人民医院心血管内一科, 安徽 芜湖 241000; 皖南医学院2机能实验中心,3病理生理教研室,4生理教研室, 安徽 芜湖 241002)
目的: 探讨牛磺酸对内毒素(即脂多糖, LPS)诱导的大鼠心肌损伤的影响。方法: 健康雄性Sprague-Dawley(SD)大鼠30只随机分为3组:正常对照组、内毒素模型组及牛磺酸处理组。正常对照组和内毒素模型组大鼠尾静脉注射生理盐水,牛磺酸处理组大鼠尾静脉注射牛磺酸(100 mg/kg),2 h后,内毒素模型组和牛磺酸处理组大鼠腹腔注射LPS(10 mg/kg),正常对照组大鼠腹腔注射生理盐水。注射内毒素6 h后,采集血样品和心肌组织,检测血清超氧化物歧化酶(SOD)活性、丙二醛(MDA)含量、肿瘤坏死因子α(TNF-α)及白细胞介素6(IL-6)水平;光镜下观察心肌形态学变化;Western blot检测心肌组织磷酸化核因子κB(p-NF-κB)、环氧合酶2(COX-2)、TNF-α、IL-6及血红素加氧酶1(HO-1)的表达。结果: 与正常对照组比较,内毒素模型组大鼠血清SOD活性及心肌组织HO-1表达明显降低(P<0.01),血清MDA、TNF-α和IL-6水平明显升高(P<0.01),心肌组织p-NF-κB、 COX-2、TNF-α及IL-6水平明显升高(P<0.01)。与内毒素模型组比较,牛磺酸处理组大鼠血清MDA、TNF-α和IL-6水平明显降低(P<0.01),牛磺酸处理明显降低心肌组织COX-2、TNF-α、IL-6及p-NF-κB水平(P<0.01),血清SOD活性及心肌组织HO-1表达明显提高(P<0.01)。组织学观察显示内毒素模型组大鼠心肌组织有炎症细胞浸润,心肌纤维排列疏松不规则,而正常对照组和牛磺酸处理组大鼠心肌纤维排列整齐规则。结论: 牛磺酸预处理能减轻内毒素诱导的心肌损伤,其机制可能通过HO-1/CO信号下调p-NF-κB/COX-2而发挥作用。
牛磺酸; 脂多糖; 心肌损伤
内毒素亦称脂多糖(lipopolysaccharide,LPS),是革兰氏阴性菌细胞壁的组成成分之一。由感染引起的内毒素血症(endotoxemia)或脓毒血症为临床上常见的一种全身炎症反应综合征,心肌损伤是其重要的病理学变化。心肌损伤而导致的心功能障碍成为脓毒血症患者死亡的重要原因[1-2]。牛磺酸是(taurine, TAU)一种非蛋白含硫氨基酸,广泛存在于各种动物体内,有许多重要的生物学功能,研究表明,牛磺酸有抗氧化及抗炎作用[3-4]。本研究旨在评价牛磺酸在内毒素诱导的心肌损伤中的心肌保护作用。
材 料 和 方 法
1 试剂
牛磺酸和LPS购自Sigma; SOD和MDA试剂盒购自南京建成生物工程研究所;TNF-α及IL-6 ELISA检测试剂盒购自合肥博美生物工程有限公司;HO-1、TNF-α、IL-6、COX-2及NF-κB多克隆抗体购自上海生物工程有限公司。
2 动物分组及模型复制
雄性Sprague-Dawley (SD)大鼠30只,体重260~300 g,购自南京青龙山动物养殖场(许可证号:SCXK2009-0001)。大鼠自由饮水、进食,在1周的适应后,随机分为3组:正常对照(control, CON)组、LPS模型组及TAU处理组,每组各10只。大鼠以戊巴比妥钠(40 mg/kg)麻醉,正常对照组大鼠尾静脉注射生理盐水2 h后,腹腔注射生理盐水;内毒素模型组大鼠尾静脉注射生理盐水2 h后,腹腔注射LPS(10 mg/kg);牛磺酸处理组大鼠尾静脉注射牛磺酸(100 mg/kg)2 h后,腹腔注射LPS(10 mg/kg)。各组腹腔注射生理盐水和LPS 6 h后,动脉采集血样品,处死,取心肌组织。
3 抗氧化作用分析
血样品于1 200×g离心分离血清,血清SOD活性以黄嘌呤氧化酶法检测,血清MDA含量以硫代巴比妥酸比色法测定,操作过程严格按试剂盒操作说明进行。SOD活性以×103U/L表示,MDA含量表示为μmol/L。
4 血清炎症因子检测
血清中TNF-α和IL-6以商业试剂盒检测,操作过程严格按试剂盒操作说明进行。血清TNF-α和IL-6浓度均表示为ng/L。
5 组织形态学观察
取心肌置于10%中性甲醛中固定,石蜡包埋,切5 μm切片,以苏木素-伊红(hematoxylin and eosin,HE)染色,光学显微镜观察形态结构,并拍照。
6 Western blot分析
取心肌0.2 mg于冰冷的PBS中洗去血迹,置入有2 mL冰冷的裂解液的匀浆器中,加20 μL新配苯甲基磺酰氟匀浆、裂解。裂解液在4 ℃下,以13 000 ×g转速离心15 min。取含等量蛋白的裂解液以十二烷基硫酸钠-聚丙烯酰胺凝胶电泳进行分离后,转至硝酸纤维素膜,取出膜以含5%脱脂奶粉TBST液封闭,加HO-1、TNF-α、IL-6、COX-2及NF-κB多克隆抗体,在4 ℃下孵育过夜,加碱性磷酸酶标记的Ⅱ抗孵育2 h后,洗膜后,DAB显色。
7 统计学分析
数据用均数±标准差(mean±SD)表示,实验结果采用SPSS 16.0软件进行统计学分析,多组间相互比较采用单因素方差分析及SNK-q检验。以P<0.05 为差异有统计学意义。
结 果
1 牛磺酸对抗氧化作用的影响
与正常对照组比较,内毒素组大鼠血清抗氧化酶SOD活性明显降低(P<0.01),脂质过氧化标志物MDA含量升高(P<0.01);与内毒素组比较,牛磺酸处理组大鼠血清SOD活性明显升高(P<0.01),MDA含量明显降低(P<0.01),见图1。牛磺酸处理明显提高SOD活性,降低MDA含量。
2 牛磺酸的抗炎作用
为评估牛磺酸的抗炎作用,检测血清炎症细胞因子TNF-α和IL-6的变化。结果表明,内毒素组大鼠血清炎症细胞因子TNF-α和IL-6水平较对照组明显升高(P<0.01),牛磺酸处理组大鼠血清TNF-α和IL-6水平较内毒素组明显降低(P<0.01),提示牛磺酸可能有抑制内毒素诱导的炎症细胞因子产生,具有抗炎作用,见图2。
3 心肌形态学变化
组织学观察显示,内毒素组大鼠心肌有炎症细胞浸润,心肌纤维排列疏松且不规则,并伴有断裂及空泡化出现;牛磺酸处理组大鼠心肌纤维排列较为紧密而有规则,见图3(图中箭头所示为炎症细胞浸润)。

Figure 1.Effects of taurine on SOD activity and MDA content in serum. Mean±SD.n=10.**P<0.01vsCON;##P<0.01vsLPS.
图1 牛磺酸对大鼠血清SOD活性和MDA含量的影响
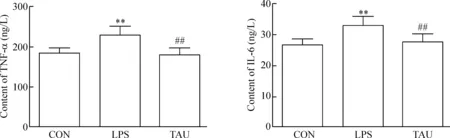
Figure 2. Effects of taurine on levels of TNF-α and IL-6 in serum. Mean±SD.n=10.**P<0.01vsCON;##P<0.01vsLPS.
图2 牛磺酸对大鼠血清TNF-α和IL-6水平的影响

Figure 3. Effects of taurine on LPS-induced myocardial damage in rats (HE staining, ×400).
图3 牛磺酸对心肌结构的影响
4 牛磺酸对心肌组织蛋白表达的影响
与正常对照组比较,内毒素组大鼠心肌组织HO-1表达明显降低,p-NF-κB、COX-2、TNF-α和IL-6表达明显升高(P<0.01);与内毒素组相比,牛磺酸处理组大鼠HO-1表达明显升高,p-NF-κB、COX-2、TNF-α和IL-6表达明显降低(P<0.01),见图4。
讨 论
由感染产生的大量内毒素进入血液而引起的内毒素血症是临床上非常常见的一种全身炎症[5-6]。炎症反应的瀑布式爆发累及多种器官,导致重要器官功能障碍,累及心脏而发生心功能衰竭而使病情恶化,病死率提高[7-8]。因此,提高其防治是医学研究的重要课题。
大量研究表明,炎症反应和炎症细胞因子的释放在内毒素引起的心肌损伤中起着非常重要的作用[9]。内毒素与细胞膜上Toll样受体(Toll-like receptors,TLRs)结合,进而激活细胞内NF-κB信号通路,促进炎症细胞因子转录,表达增加。NF-κB通过磷酸化而被激活,进一步上调COX-2的表达,COX-2可通过诱导前列腺素的产生参与炎症及痛感[10]。炎症细胞因子如TNF-α及IL-6等参与内毒素引起的器官损伤,TNF-α可直接损伤心肌纤维[11]。本研究显示,内毒素处理大鼠血清及心肌炎症细胞因子TNF-α及IL-6明显升高,COX-2表达及NF-κB磷酸化水平提高,并且心肌有炎症细胞浸润。牛磺酸是一种内源性非蛋白氨基酸,研究证明其具有许多生理功能,如有免疫调节作用[12]。牛磺酸在体内可被转化为牛磺酸氯胺,被认为是一种低毒的炎症调节物[13]。我们的研究结果显示,牛磺酸预处理明显改善内毒素诱导的心肌形态学变化,降低内毒素诱导的炎性因子水平,并降低COX-2表达及NF-κB磷酸化水平,提示牛磺酸可通过抑制炎症细胞因子转录信号,减少炎症介质释放而起抗炎作用。
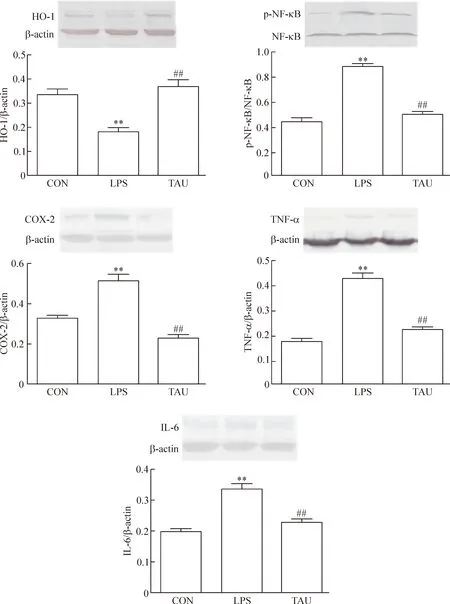
Figure 4. Effects of taurine on expression of HO-1, p-NF-κB, COX-2, TNF-α and IL-6 in myocardial tissues. Mean±SD.n=10.**P<0.01vsCON;##P<0.01vsLPS.
图4 牛磺酸对大鼠心肌组织HO-1、p-NF-κB、COX-2、TNF-α和IL-6表达的影响
内毒素诱导的活性氧及自由基的释放是其致器官损伤的重要环节。在内毒素血症中,内毒素调控的巨噬细胞呼吸爆发释放的活性氧及自由基激活NF-κB信号[14],进而调节炎症细胞因子的表达。因此,提高机体的抗氧化作用,降低活性氧有利于对炎症反应的调节及减轻组织损伤。研究证实,牛磺酸提高机体抗氧化酶,增强抗氧化作用。有研究显示牛磺酸增加HO-1的表达[15]。HO-1是一种诱导型酶,催化血红素转化为一氧化碳(CO)、胆绿素及游离铁离子,催化产物一氧化碳和胆绿素均有抗炎及抗氧化作用[16-17]。并有研究进一步证实HO-1/CO信号通过调控NF-κB/COX-2而抑制炎症细胞因子释放[18-19]。本研究的结果显示,牛磺酸预处理提高SOD活性及HO-1的表达,并降低MDA的血清含量。提示牛磺酸通过提高抗氧化酶改善抗氧化作用。
综上所述,牛磺酸预处理减轻内毒素所诱导的心肌损伤。结果提示其作用通过提高抗炎及抗氧化作用,其机制可能是牛磺酸诱导的HO-1/CO信号通过调控NF-κB/COX-2而发挥作用。关于其详细机制尚需进一步的研究。
[1] Romero-Bermejo FJ, Ruiz-Bailen M, Gil-Cebrian J, et al. Sepsis-induced cardiomyopathy [J]. Curr Cardiol Rev, 2011, 7(3):163-183.
[2] 赵邦术, 刘 玲, 刘新伟, 等. 烟酰胺磷酸核糖转移酶在内毒素致大鼠心肌损伤中的作用[J]. 中华麻醉学杂志,2014,34(6):750-752.
[3] Wang L, Zhao N, Zhang F, et al. Effect of taurine on leukocyte function [J]. Eur J Pharmacol, 2009, 616(1-3):275-280.
[4] Schaffer SW, Azuma J, Mozaffari M. Role of antioxidant activity of taurine in diabetes[J]. Can J Physiol Pharmacol, 2009, 87(2):91-99.
[5] Liu J, Zhao S, Tang J, et al. Advanced glycation end products and lipopolysaccharide synergistically stimulate proinflammatory cytokine/chemokine production in endothelial cells via activation of both mitogen-activated protein kinases and nuclear factor-κB[J]. FEBS J, 2009, 276(16):4598-4606.
[6] 李 攀, 赵祎博, 李小丽, 等. 内毒素耐受状态小鼠对大肠埃希菌敏感性及促炎细胞因子水平变化的研究[J]. 中国临床药理学与治疗学, 2015, 20(3):261-265.
[7] Zhao P, Turdi S, Dong F, et al. Cardiac-specific overexpression of insulin-like growth factor 1 (IGF-1) rescues lipopolysaccharide-induced cardiac dysfunction and activation of stress sign aling in murine cardiomyocytes[J].Shock, 2009, 32(1):100-107.
[8] 朱明慧, 黄礼兵, 朱 娟, 等. 参希胶囊对内毒素血症小鼠心脏的保护作用[J]. 南京中医药大学学报,2015, 31(3):258-260.
[9] Baumgarten G, Knuefermann P, Nozaki N, et al.Invivoexpression of proinflammatory mediators in the adult heart after endotoxin administration: the role of Toll-like receptor-4[J]. J Infect Dis, 2001, 183(11):1617-1624.
[10]Williams JA, Shacter E. Regulation of macrophage cytokine production by prostaglandin E2. Distinct roles of cyclooxygenase-1 and -2[J]. J Biol Chem, 1997, 272(41): 25693-25699.
[11]Wang YY, Yu XH, Wang FQ, et al. Yohimbine promotes cardiac NE release and prevents LPS-induced cardiac dysfunction via blockade of presynaptic α2A-adrenergic receptor[J]. PLoS One, 2013, 8(5): e63622.
[12]Schuller-Levis GB, Park E. Taurine and its chloramine: modulators of immunity [J]. Neurochem Res, 2004, 29(1):117-126.
[13]Marcinkiewicz J, Kurnyta M, Biedroń R, et al. Anti-inflammatory effects of taurine derivatives (taurine chloramine, taurine bromamine, and taurolidine) are mediated by different mechanisms[J]. Adv Exp Med Biol, 2006, 583: 481-492.
[14]von Dessauer B, Bongain J, Molina V, et al. Oxidative stress as a novel target in pediatric sepsis management [J]. J Crit Care, 2011, 26(1):103.e1-103.e7.
[15]Wang GG, Li W, Lu XH, et al. Taurine attenuates oxidative stress and alleviates cardiac failure in type I diabetic rats [J]. Croat Med J, 2013, 54(2):171-179.
[16]Stocker R, Yamamoto Y, McDonagh AF, et al. Bilirubin is an antioxidant of possible physiological importance [J]. Science, 1987, 235(4792):1043-1046.
[17]Shih RH, Yang CM. Induction of heme oxygenase-1 atte-nuates lipopolysaccharide-induced cyclooxygenase-2 expression in mouse brain endothelial cells [J]. J Neuroinflammation, 2010, 7:86.
[18]Morse D, Pischke SE, Zhou Z, et al. Suppression of inflammatory cytokine production by carbon monoxide involves the JNK pathway and AP-1 [J]. J Biol Chem, 2003, 278(39):36993-36998.
[19]Sarady JK, Otterbein SL, Liu F, et al. Carbon monoxide modulates endotoxin-induced production of granulocyte macrophage colony-stimulating factor in macrophages [J]. Am J Respir Cell Mol Biol, 2002, 27(6):739-745.
(责任编辑: 陈妙玲, 罗 森)
Protective effects of taurine on LPS-induced myocardial damage in rats
TANG Wen-tian1, WANG Jing1, LIU Jun1, LU Xiao-hua2, WANG Guo-guang3, JIANG Yu-xin4
(1FirstDepartmentofCardiovascularInternalMedicine,WuhuFirstPeople’sHospital,Wuhu241000,China;2ExperimentalCenterforFunctionSubjects,3DepartmentofPathophysiology,4DepartmentofPhysiology,WannanMedicalCollege,Wuhu241002,China.E-mail: 13905533991@163.com)
AIM: To investigate the effects of taurine on lipopolysaccharide (LPS)-induced myocardial damage in rats. METHODS: Healthy male SD rats (n=30) were randomly divided into control group (CON), LPS model group (LPS) and taurine treatment group (TAU). The rats in CON group and LPS group were intravenously injected with normal saline, and the rats in TAU group were injected with taurine (100 mg/kg). After 2 h, the rats in LPS group and TAU group were intraperitoneally injected with LPS at 10 mg/kg, and the rats in CON group were injected with normal saline. Six hours after injection of LPS, the blood samples were collected for determination of superoxide dismutase (SOD) activity, malondialdehyde (MDA) content, and tumor necrosis factor α (TNF-α) and interleukin-6 (IL-6) levels. The myocardial tissues were processed for histological examination and the analysis of Western blot. RESULTS: Compared with CON group, LPS significantly reduced SOD activity in the serum and heme oxygenase 1 (HO-1) protein expression in the myocardial tissues, increased the serum content of MDA and levels of TNF-α and IL-6. LPS also significantly elevated the levels of TNF-α and IL-6, and up-regulated the cyclooxygenase-2 (COX-2) expression and phosphorylation of nuclear factor kappa B (NF-κB) in the myocardial tissues. Taurine pretreatment significantly elevated SOD activity and HO-1 protein expression level, decreased the levels of COX-2, TNF-α, IL-6 and phosphorylated NF-κB. Histological observation showed that taurine reduced inflammatory response in the myocardial tissue. CONCLUSION: Taurine attenuates LPS-induced myocardial damage in rats. The beneficial effects of taurine may be associated with its reduction of p-NF-κB/COX-2 signaling by activation of HO-1/CO.
Taurine; Lipopolysaccharides; Myocardial damage
1000- 4718(2017)01- 0123- 05
2016- 07- 25
2016- 10- 07
国家自然科学基金资助项目(No. 81172790)
R363.2
A
10.3969/j.issn.1000- 4718.2017.01.020
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 13905533991; E-mail: 13905533991@163.com
