有氧运动通过激活PI3K(p110α)/Akt信号通路保护2型糖尿病小鼠心功能*
2017-01-19林延艳赵林双
林延艳, 赵林双, 刘 意
(广州军区武汉总医院内分泌科,湖北 武汉 430070)
有氧运动通过激活PI3K(p110α)/Akt信号通路保护2型糖尿病小鼠心功能*
林延艳, 赵林双△, 刘 意
(广州军区武汉总医院内分泌科,湖北 武汉 430070)
目的: 探讨高糖状态下有氧运动对小鼠心功能障碍的作用及相关机制,为糖尿病心功能障碍的运动疗法提供理论和实践依据。方法: 将小鼠分成正常非运动组(NNC组)、正常运动组(ENC组)、糖尿病非运动组(NDM组)和糖尿病运动组(EDM组)。实验结束后,评估小鼠的心脏功能,观察心肌组织的病理改变、纤维化情况、ANP的mRNA表达、PI3K(p110α)及Akt的蛋白水平。结果: 超声心动图可见糖尿病小鼠心功能降低(P<0.05),运动干预后心功能逐渐恢复(P<0.05)。HE和Masson染色后光镜下可见NDM组小鼠心肌结构极度紊乱,细胞排列不规整,纤维化程度增加,而EDM组心肌受损程度改善。与NNC组相比,糖尿病小鼠心肌组织中ANP的mRNA表达上调,PI3K(p110α)和Akt的蛋白水平受抑制(P<0.05),级联失活。与NDM组相比,EDM组ANP的mRNA降低,PI3K(p110α)和Akt的蛋白水平升高(P<0.01)。结论: 糖尿病导致小鼠心肌损害,降低心功能;运动干预可能通过激活PI3K(p110α)/Akt信号通路,缓解高糖导致的心功能障碍,保护心肌细胞。
运动; 心功能; 糖尿病; 心肌
糖尿病(diabetic mellitus,DM)是一类发病机制复杂的疾病,在全球范围内已成为导致死亡的第3大危险因素。流行病学研究发现,80%以上糖尿病患者死于心血管系统疾病,是非糖尿病人群心血管系统疾病病死率的2~3倍[1]。其中,糖尿病心肌损害是DM常见而严重的心血管并发症,也是心脏疾病的独立危险因素,已逐渐成为人类健康的重要威胁之一。在糖尿病心肌损害的保护措施中,除药物干预外,规律性地运动在心肌保护作用中扮演重要的作用。作为DM的一个有效的心脏保护措施,运动能否改善DM诱导的心肌结构和功能损害及其发挥心肌保护作用的机制尚不明确。
在近10年的研究中,研究人员利用基因修饰等工具发现磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)的p110α/蛋白激酶B(protein kinase B,PKB,又称Akt)信号通路在心肌细胞生长和生存中扮演的重要作用。PI3K(p110α)不但参与了胰岛素及胰岛素样生长因子1(insulin-like growth factor-1,IGF-1)对心脏生长发育的调控,且在鼠类的病理性心肌模型中,PI3K(p110α)还能抑制胚胎基因的重新编码,模拟运动训练所带来的益处,最终延长寿命;而表达显性负效体PI3K(p110α)的小鼠寿命年限明显缩短[2];PI3K(p110α)还与改善心脏能量物质供应、增强离体心脏心肌收缩力密切相关[3-5]。此外,PI3K(p110α)的下游Akt激活后也与细胞的各类调控反应相关,包括抑制凋亡,调控细胞增殖、代谢、肥大等[6-8]。但PI3K(p110α)/Akt是否参与运动的DM心肌保护作用目前尚未见到报道。本研究拟在构建糖尿病模型小鼠,通过探索糖尿病状态下心功能的改变与PI3K(p110α)/Akt信号通路激活的相关性,以进一步了解运动影响心功能的分子机制。
材 料 和 方 法
1 实验动物
5周龄SPF级C57BL/6小鼠购自武汉大学动物实验中心,体重13~15 g,实验动物合格编号为42000500006666。饲养环境为室温20~24 ℃,相对湿度40%~60%,基础饲料由实验动物中心提供,自由摄食饮水,12 h交替照明。
2 主要试剂
链脲佐菌素(streptozotocin,STZ)购自Sigma;BCA蛋白定量试剂盒(碧云天生物技术有限公司);抗Akt抗体和抗p-Akt抗体(Cell Signaling Technology);兔抗PI3K(p110α)抗体(武汉三鹰生物技术有限公司);抗GAPDH抗体(杭州贤至生物有限公司);兔抗羊II抗和羊抗兔II抗(武汉博士德生物工程有限公司);TRIzol(Aidlab);cDNA第一链合成试剂盒(Vazyme)。PCR引物由武汉擎科生物有限公司合成;血糖仪及血糖试纸(Johnson & Johnson)。
3 主要方法
3.1 糖尿病小鼠模型的建立 将适应性喂养1周后的小鼠随机分成正常对照(normal control,NC)组和DM模型组,NC组普通饲料喂养,DM组高糖高脂饲料喂养(普通饲料中加入10%蔗糖、10%猪油、2%胆固醇和0.15%胆酸钠)。4周后,全部小鼠禁食10 h,DM组按照50 mg/kg剂量腹腔注射STZ溶液,连续5 d,同时NC组注射等量柠檬酸缓冲液。72 h后测尾尖血糖,10 d后行腹腔注射葡萄糖耐量实验(intrape-ritoneal glucose tolerance test,IPGTT),造模成功标准为空腹血糖(fasting plasma glucose,FPG)≥7.0 mmol/L和(或)2 h 血糖(plasma glucose,PG)≥11.1 mmol/L。
3.2 实验动物干预及分组 DM模型建立后,继续8周高糖高脂喂养,再将NC组和DM组分为运动亚组和非运动亚组,即包括正常对照运动组(normal control exercise group,ENC;n=8)、正常非运动组(normal control non-exercise group,NNC;n=8)、糖尿病运动组(diabetic exercise group,EDM;n=10)和糖尿病非运动组(diabetic non-exercise group,NDM;n=10)。ENC和EDM组进行5周的无负重游泳干预。运动方案是Ploug等所用方法的改良版[9-10]:游泳训练 每天1次,每周5 d,第1次15 min,以后每次增加15 min直至每天45 min,按照每天45 min运动量直至第2周结束,后3周每天运动60 min,一共5周。
3.3 小鼠体重、空腹血糖和糖耐量情况的监测 每周测定小鼠体重,每3周复测小鼠空腹血糖,开始运动干预后改为每周监测血糖。在最后一次运动结束后给各组小鼠做IPGTT。
3.4 心功能及血压的测量 各组小鼠于DM诱导15周末,用1%戊巴比妥钠50 mg/kg腹腔注射麻醉,仰卧固定,使用Vevo 1100心脏超声诊断仪测定心脏的大小和功能,在心脏收缩和舒张过程中测定左室舒张末期容积(left ventricular end-diastolic volume,LVEDV)和左室收缩末期容积(left ventricular end-systolic volume,LVESV),比较左室射血分数(left ventricular ejection fraction,LVEF)及左室短轴缩短率(left ventricular shortening fraction,LVFS)以评价心脏收缩功能。处理动物前,清醒状态下尾袖法给各组小鼠测量血压。
3.5 样本的收集及处理 最后一次游泳运动结束24 h后,给所有小鼠称重,腹腔注射1%戊巴比妥钠50 mg/kg麻醉,留取心脏标本,称重,计算“心脏指数(HW/BW)=心脏重量(mg)/体重(g)”。部分心脏组织4%多聚甲醛固定,剩余心脏组织-70 ℃下保存。
3.6 心脏组织的病理结构观察 取4%多聚甲醛固定的心脏组织,常规的梯度脱水、石蜡包埋、切片(5 μm),做常规HE、Masson染色,光镜下观察心脏组织形态病理学改变及纤维化程度。
3.7 实时荧光定量PCR实验 提取小鼠心脏组织总RNA后经分光光度计行RNA定量和定性检测。ANP引物的正义链为5’-CTGGGACCCCTCCGATAGAT-3’,反义链为5’-CACTCTGGGCTCCAATCCTG-3’;β-actin引物的正义链为5’-CACGATGGAGGGGCCGGACTCATC-3’,反义链为5’-TAAAGACCTCTATGCCAACACAGT-3’。PCR的扩增条件为94 ℃ 4 min; 94 ℃ 30 s, 56 ℃ 30 s, 72 ℃ 25 s, 30个循环;72 ℃ 5 min。扩增完成后60 ℃开始升温作熔解曲线验证扩增产物的特异性。反应完成后设定基线值和阈值,计算机分析得到循环阈值(Ct),基因相对表达量以2-ΔΔCt值计算分析。
3.8 Western blot法检测蛋白表达 提取小鼠心脏组织总蛋白后BCA法测定总蛋白浓度。经过10%的SDS-PAGE分离,PVDF膜印迹,5%脱脂奶粉室温下封闭2 h,加入抗GAPDH抗体(1∶1 000)、抗Akt抗体(1∶1 000)、抗p-Akt抗体(1∶1 000)和抗PI3K(p110α)抗体(1∶1 500),4 ℃孵育过夜。用封闭液稀释相应的经辣根过氧化物酶(HRP)标记的 II 抗(1∶50 000) 37 ℃摇床孵育2 h。洗去多余Ⅱ抗,经ECL发光液发光、X光胶片压片后显影、定影。分析胶片灰度值,确定样品中目的蛋白相对含量。
4 统计学处理
采用SPSS 20.0软件进行数据分析,计量资料用均数±标准差(mean±SD)表示。组间比较采用单因素方差分析,如差异显著,对该指标的均值进行SNK-q检验。以P<0.05为差异有统计学意义。
结 果
1 4组小鼠的体重、血糖情况
与NC组小鼠相比,DM组小鼠体重下降;与NNC组比较,ENC、NDM和EDM组的心脏指数增高。游泳干预后,EDM组小鼠的空腹血糖明显低于NDM组,葡萄糖耐量也明显改善,差异具有统计学显著性(P<0.01);而NNC和ENC组的空腹血糖和葡萄糖耐量变化不大。这说明运动对正常小鼠血糖无影响,但在一定程度上可改善糖尿病小鼠空腹血糖、葡萄糖耐量情况,见图1、表1。

Figure 1. The blood glucose levels of intraperitoneal glucose tolerance test (IPGTT) and the area under the curve. Mean±SD.n=4~5.*P<0.05vsNNC group;#P<0.05vsENC group;△P<0.05vsNDM group.
图1 腹腔注射葡萄糖耐量实验的血糖值及曲线下面积
表 1 运动前后小鼠空腹血糖的变化情况
Table 1. The changes of fasting blood glucose in the mice before and after exercise (mmol/L. Mean±SD)

TreatmentnBeforeexerciseAfterexerciseNNC46.52±0.396.30±0.59ENC46.82±0.485.77±0.59&NDM523.98±1.16∗#26.25±4.14∗#EDM523.43±2.55∗#18.87±3.51∗#△&
*P<0.05vsNNC group;#P<0.05vsENC group;△P<0.05vsNDM group;&P<0.05vsbefore exercise.
2 4组小鼠的血压、心功能情况
无论是对于正常小鼠还是DM小鼠,运动均可以在一定程度上增强心肌收缩能力,改善心肌射血功能。与NNC组比较,未干预的DM小鼠心肌射血功能降低,LVEF和FS均下降,差异具有统计学显著性(P<0.05)。在DM组中,运动干预的EDM亚组的LVEF和FS明显高于未干预的NDM亚组(P<0.05)。NDM组的LVESV明显高于ENC组(P<0.05),而各组的LVEDV变化较小,但差异无统计学显著性。尾袖法测量各组小鼠血压发现,NDM亚组的收缩压、舒张压均稍有降低,与ENC组比较,其收缩压降低差异有统计学显著性,而与其它组比较血压变化的差异无统计学显著性,见表2。
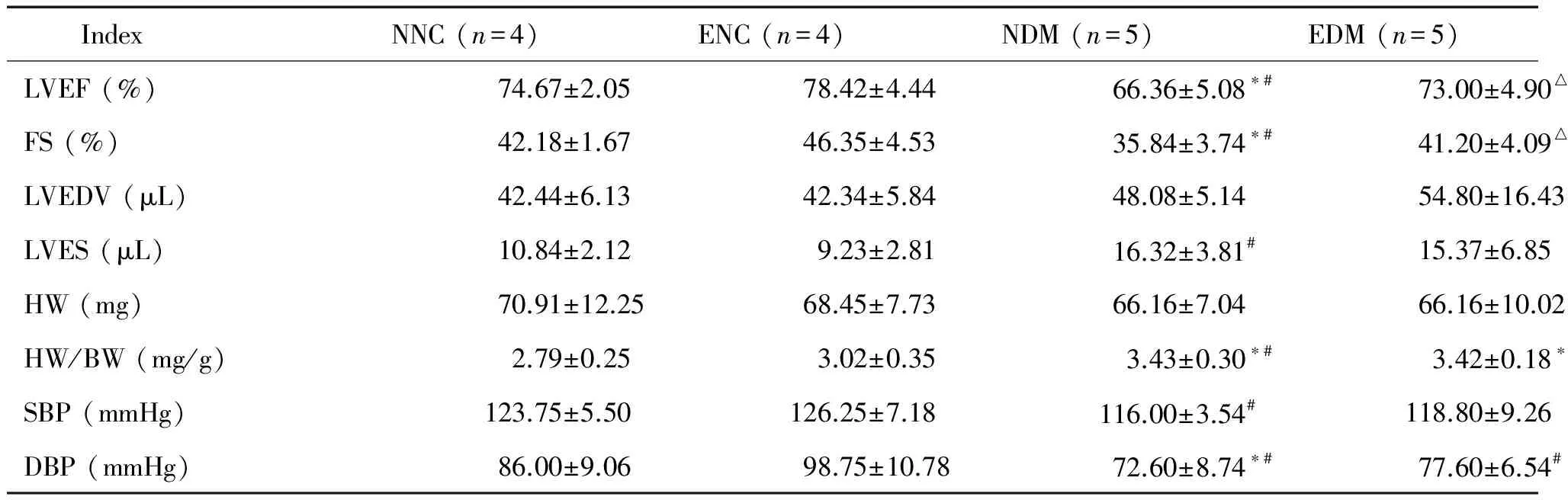
表2 各组小鼠心功能和血压情况的比较
*P<0.05vsNNC group;#P<0.05vsENC group;△P<0.05vsNDM group.
3 心脏的病理学改变
HE染色可见NNC和ENC组小鼠的心肌细胞排列整齐,细胞核明显,结构清晰,染色均匀。NDM组小鼠心肌结构极度紊乱,细胞排列十分不规整,心肌细胞间隙变大,连接不甚紧密,部分区域心肌断裂,且心肌内纤维化程度增加。EDM组心肌形态结构较NDM组明显改善,心肌细胞排列未见明显紊乱,也未见明显的肌纤维断裂,细胞核形状较规整,心肌结构趋向正常,心肌纤维化程度降低,见图2A。Masson染色可见NNC和ENC组小鼠的心肌细胞核为深蓝色,胶原纤维呈绿色,细胞间可见少量胶原纤维均匀分布。NDM组小鼠的心肌纤维化程度增加,运动干预后的EDM组心肌胶原纤维增生不甚明显,走向较正常,见图2B。

Figure 2. The pathological changes of the myocardial tissues under light microscope (×400).A: HE staining; B: Masson staining.
图2 光镜下心肌组织的病理学改变
4 运动对小鼠心肌内胚胎基因ANP mRNA表达的影响
与NNC和ENC组相比,NDM和EDM组心肌组织中胚胎基因ANP的mRNA表达上调(P<0.01),而该胚胎基因的表达在NNC和ENC组间的差异无统计学显著性。这说明高糖可以诱导心肌组织中胚胎基因的表达,但是运动可以改善DM小鼠心肌组织中胚胎基因的表达,而运动对正常小鼠心肌内胚胎基因的表达无影响,见图4。
5 运动对心肌内信号通路PI3K(p110α)/Akt蛋白表达的影响
如图4结果显示,T2DM显著地降低PI3K(p110α)和磷酸化Akt的蛋白水平(P<0.01),而高糖对这些蛋白的抑制作用可以被运动所缓解,使得PI3K(p110α)和磷酸化Akt趋向正常组水平。这提示高糖状态下,运动对心脏的保护作用可能部分与PI3K(p110α)/Akt信号通路激活相关。
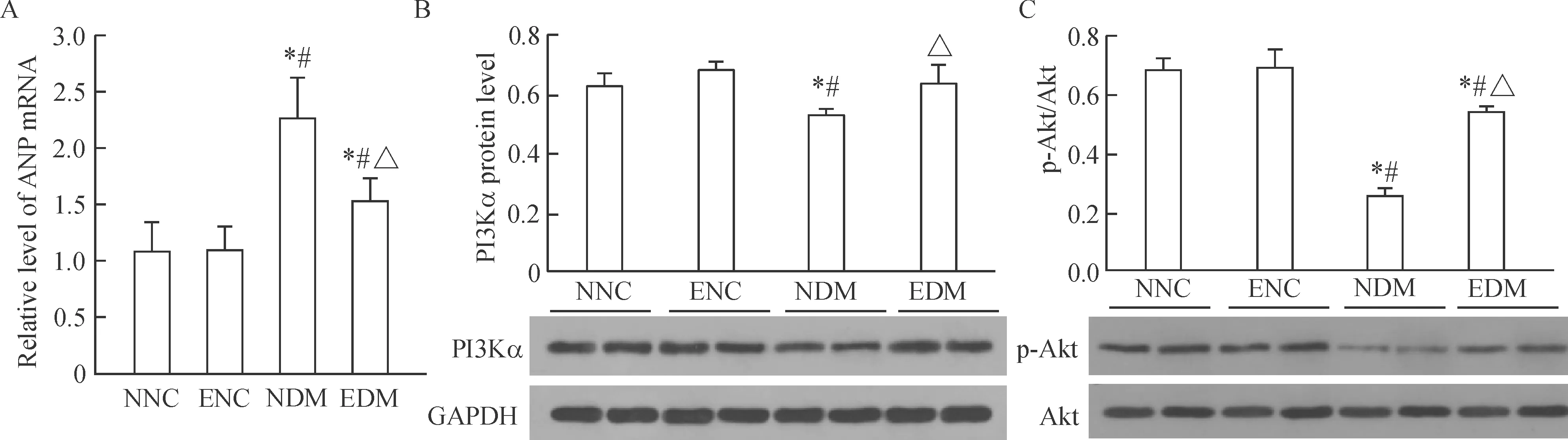
Figure 3. The mRNA expression of ANP (A) and the protein levels of PI3Kα/Akt (B, C) in the myocardium. Mean±SD.n=4~5.*P<0.05vsNNC group;#P<0.05vsENC group;△P<0.05vsNDM group.
图3 心肌内ANP mRNA表达及PI3Kα/Akt蛋白水平的变化
讨 论
本实验通过构造糖尿病模型,发现运动改善糖尿病小鼠血糖、心功能及病理性损伤的作用可能与PI3K(p110α)/Akt信号通路激活相关。
长期以来,运动一直被视为DM药物治疗的有效辅助措施。近期研究发现,规律性地参加体育运动,可降低50%的心血管疾病发生风险[11]。即使对老年群体,运动仍是一个重要的非药物治疗策略[12-13]。因此,早期合理运动被视为预防心功能不全和心衰的重要措施之一。本实验研究发现,运动不仅能在一定程度上降低DM小鼠空腹血糖和葡萄糖耐量,而且能改善糖尿病小鼠的心肌射血功能,减轻DM小鼠心肌病理性损害,保护高糖状态下心肌细胞;但研究发现糖尿病小鼠血压呈下降趋势,考虑可能与受损的射血功能导致外周循环血量降低相关。众所周知,长期的高血糖会导致心肌能量供应不足,心肌纤维化加重,心肌发生病理性重构,最终影响心脏的正常工作。运动作为DM的重要保护措施之一,其发挥心肌保护作用的机制涉及多个方面,包括改善能量代谢,抑制细胞凋亡、氧化应激损害、心肌纤维化等。但目前关于高糖状态下,运动对心肌细胞保护作用的具体信号通路尚未统一。
PI3K(p110α)大量表达于心血管系统中,在心肌细胞生长和正常心功能的维护中发挥重要的作用。一方面,PI3K(p110α)可以促使心肌功能的正常发挥,当心肌过表达PI3K(p110α)或PI3K(p110α)上游信号受体IGF-1(IGF1R)时可促使心肌细胞增大或心脏生理性肥大;相反,当表达显性负效体PI3K(p110α)或者敲除PI3K(p110α)的调控亚基p85后可导致心脏变小,并且能抵消IGF-1受体过表达所诱导的生理性肥大[14-15]。PI3K(p110α)过表达还可以促使冠状动脉血管生成以保证心肌细胞氧气和营养物质的顺利供应[3],增强离体心脏的收缩功能[4];而当显性负效体PI3K(p110α)过表达时则会降低心脏基本收缩能力[16]。另一方面,PI3K(p110α)还可以保护病理状态下的心功能:在扩张性心肌病模型中,PI3K(p110α)还能通过模拟运动训练,抑制胚胎基因的重新编码,延长寿命;而表达显性负效体PI3K(p110α)的小鼠则出现寿命年限缩短[2]。敲除PI3K(p110α)会加重因压力负荷或心肌梗死导致的病理性的心肌损害,但PI3K(p110α)激活后可以缓解上述病理变化所导致的损害[2, 17]。此外,研究发现,PI3K(p110α)的下游Akt也控制各类调节反应,包括抑制凋亡,调控细胞增殖、代谢、肥大等[6-7]。简而言之,PI3K(p110α)/Akt信号通路在生理性心肌生长中扮演重要角色,并且可以保护病理状态下的心肌,改善心肌功能,延长寿命。
本研究发现,运动干预后的小鼠心肌组织中PI3K(p110α)表达和Akt磷酸化水平增强,PI3K(p110α)/Akt信号通路被激活;NDM组小鼠心肌内PI3K(p110α)表达及Akt磷酸化水平受抑制,而运动干预的EDM组小鼠心肌内PI3K(p110α)表达和Akt磷酸化水平得以改善。结合前人研究的成果,我们推测运动后的糖尿病小鼠心肌内PI3K(p110α)/Akt信号通路被激活,活化的PI3K(p110α)/Akt信号通路通过作用于其下游的磷酸化糖原合成激酶、内皮型一氧化氮合酶、哺乳动物雷帕霉素靶蛋白等,提高细胞生存率,保护高糖状态下的心肌细胞[6, 18-19]。因此我们认为,运动对高糖状态下小鼠心肌细胞的保护作用可能或至少部分是通过激活PI3K(p110α)/Akt信号通路实现的。当运动诱导PI3K(p110α)表达增强时,其下游的Akt也随之被激活,再通过一系列的蛋白激活促进心肌细胞发生生理性肥大,调控代谢,增强心肌收缩力,从而保护病理状态下的心肌细胞,改善心功能。运动这种保护糖尿病心肌功能、延缓糖尿病心肌损害发生发展的作用,在临床上可以在一定程度上改善糖尿病患者生活质量,减轻经济压力,并且还能避免药物治疗带来的或多或少的副作用。
总之,本实验提示在运动保护DM心肌细胞的机制研究中,PI3K(p110α)/Akt信号通路的激活发挥关键的作用;该信号通路激活后可以降低高糖状态导致的心肌损伤,增强心肌收缩能力,最终改善心功能,这为DM心肌损害的治疗甚至逆转心肌损害提供了新思路。
[1] Sowers JR, Epstein M, Frohlich ED. Diabetes, hypertension, and cardiovascular disease: an update[J]. Hypertension, 2001, 37(4):1053-1059.
[2] Mcmullen JR, Amirahmadi F, Woodcock EA, et al. Protective effects of exercise and phosphoinositide 3-kinase(p110α) signaling in dilated and hypertrophic cardiomyopathy[J]. Proc Natl Acad Sci U S A, 2007, 104(2):612-617.
[3] Bekhite MM, Finkensieper A, Binas S, et al. VEGF-mediated PI3K class IA and PKC signaling in cardiomyogenesis and vasculogenesis of mouse embryonic stem cells[J]. J Cell Sci, 2011, 124(Pt 11):1819-1830.
[4] Yano N, Tseng A, Zhao TC, et al. Temporally controlled overexpression of cardiac-specific PI3Kα induces enhanced myocardial contractility: a new transgenic model[J]. Am J Physiol Heart Circ Physiol, 2008, 295(4):H1690-H1694.
[5] 方 军, 吴黎明, 陈良龙. RISK信号通路在心肌预处理及后处理中的作用[J]. 中国病理生理杂志, 2009, 25(10):2062-2067.
[6] Hanada M, Feng J, Hemmings BA. Structure, regulation and function of PKB/AKT: a major therapeutic target[J]. Biochim Biophys Acta, 2004, 1697(1-2):3-16.
[7] Brazil DP, Park J, Hemmings BA. PKB binding proteins: getting in on the Akt[J]. Cell, 2002, 111(3):293-303.
[8] 王华祖, 龚兴国. 蛋白激酶B的研究进展[J]. 中国病理生理杂志, 2003, 19(11):84-89.
[9] Ploug T, Stallknecht BM, Pedersen O, et al. Effect of endurance training on glucose transport capacity and glucose transporter expression in rat skeletal muscle[J]. Am J Physiol, 1990, 259(6 Pt 1):E778-E786.
[10]尚画雨, 夏 志, 张 丹, 等. 8周游泳运动对2型糖尿病大鼠周围神经病变的影响[J]. 中国病理生理杂志, 2014, 30(4):719-724.
[11]Gomes CP, Kim TK, Wang K, et al. The implications on clinical diagnostics of using microRNA-based biomarkers in exercise[J]. Expert Rev Mol Diagn, 2015, 15(6):761-772.
[12]Oliveira J, Mesquita-Bastos J, Argel de Melo C, et al. Postaerobic exercise blood pressure reduction in very old persons with hypertension[J]. J Geriatr Phys Ther, 2016, 39(1):8-13.
[13]甄 洁, 李晓霞. 有氧运动抑制心梗后心力衰竭大鼠左室重塑及交感神经重塑[J]. 中国病理生理杂志, 2015, 31(6):973-979.
[14]Shioi T, Kang PM, Douglas PS, et al. The conserved phosphoinositide 3-kinase pathway determines heart size in mice[J]. EMBO J, 2000, 19(11):2537-2548.
[15]Mcmullen JR, Shioi T, Huang WY, et al. The insulin-like growth factor 1 receptor induces physiological heart growth via the phosphoinositide 3-kinase(p110α) pathway[J]. J Biol Chem, 2004, 279(6):4782-4793.
[16]Liang W, Oudit GY, Patel MM, et al. Role of phosphoinositide 3-kinase α, protein kinase C, and L-type Ca2+channels in mediating the complex actions of angiotensin II on mouse cardiac contractility[J]. Hypertension, 2010, 56(3):422-429.
[17]Lin RC, Weeks KL, Gao XM, et al. PI3K(p110α) protects against myocardial infarction-induced heart failure: identification of PI3K-regulated miRNA and mRNA[J]. Arterioscler Thromb Vasc Biol, 2010, 30(4):724-732.
[18]Oudit GY, Sun H, Kerfant BG, et al. The role of phosphoinositide-3 kinase and PTEN in cardiovascular physio-logy and disease[J]. J Mol Cell Cardiol, 2004, 37(2):449-471.
[19]Doble BW, Woodgett JR. GSK-3: tricks of the trade for a multi-tasking kinase[J]. J Cell Sci, 2003, 116(Pt 7):1175-1186.
(责任编辑: 林白霜, 罗 森)
Aerobic exercise protects cardiac function of T2DM mice by activation of PI3K (p110α)/Akt signaling pathway
LIN Yan-yan, ZHAO Lin-shuang, LIU Yi
(DepartmentofEndocrinology,WuhanGeneralHospitalofGuangzhouMilitaryCommand,Wuhan430070,China.E-mail:zls7111@aliyun.com)
AIM: To study the protective effect of aerobic exercise on cardiac dysfunction in mice and its mechanism, and to provide theoretical and practical basis for the exercise therapy of diabetic cardiac dysfunction.METHODS: The mice were divided into normal control non-exercise (NNC) group, normal control exercise (ENC) group, diabetic non-exercise (NDM) group and diabetic exercise (EDM) group. At the end of the experiment, the cardiac function was evaluated by echocardiography. The pathological changes of the myocardial tissues and the development of fibrosis were observed. The mRNA expression of ANP, and the protein levels of PI3K (p110α) and Akt were determined. RESULTS: The decrease in cardiac function of diabetic mice was observed, and the cardiac function recovered after exercise intervention (P<0.05). Under light microscope with HE and Masson staining, the myocardial structure in NDM group was in extreme disorder, cell arrangement was not neat, and the degree of fibrosis increased, but the myocardial damage was improved in ENC group. Compared with NNC group, the mRNA expression of ANP in the myocardium of diabetic mice was up-regulated (P<0.05). The protein levels of PI3K (p110α) and Akt were decreased (P<0.05), and the cascade was inactivated. Compared with NDM group, the mRNA expression of ANP was down-regulated and the protein levels of PI3K (p110α) and Akt were up-regulated in EDM group (P<0.05). CONCLUSION: Diabetes results in myocardial damage in mice, and reduces cardiac function. Exercise intervention alleviates the heart dysfunction induced by high glucose via activating PI3K(p110α)/Akt signaling pathway to protect the structure and function of the myocardium.
Exercise; Cardiac function; Diabetes mellitus; Myocardium
1000- 4718(2017)01- 0073- 06
2016- 05- 18
2016- 11- 09
湖北省自然科学基金资助项目(No. 2012FFB06807)
R363; R587.2
A
10.3969/j.issn.1000- 4718.2017.01.012
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 027-50772198; E-mail: zls7111@aliyun.com
