疏水性胍类离子液体萃取水溶液中的重金属离子
2017-01-18车佳宁彭昌军刘洪来汪华林
车佳宁, 刘 飞, 彭昌军, 刘洪来, 杨 强, 汪华林
(华东理工大学 1.结构可控先进功能材料及其制备教育部重点实验室;2.国家环境保护化工过程环境风险评价与控制重点实验室,上海 200237)
疏水性胍类离子液体萃取水溶液中的重金属离子
车佳宁1, 刘 飞1, 彭昌军1, 刘洪来1, 杨 强2, 汪华林2
(华东理工大学 1.结构可控先进功能材料及其制备教育部重点实验室;2.国家环境保护化工过程环境风险评价与控制重点实验室,上海 200237)
合成了疏水性胍类离子液体,考察室温下离子液体对水溶液中金属离子(Fe3+、Cu2+、Co2+、Ni2+、Zn2+)的萃取能力。实验结果表明该离子液体对Fe3+萃取具有高选择性,萃取率为90%;对其他金属离子萃取率仅为40%左右。为了进一步研究离子液体对Fe3+的萃取性能,分别从两相体积比、萃取时间、金属离子起始浓度及溶液pH等因素研究了其对Fe3+的捕集效果。结果表明:室温下,0.2 mL离子液体与5 mL的FeCl3溶液超声混合5 min后,溶液中Fe3+萃取率为90%;且溶液中金属离子的起始浓度对萃取效果影响较小,但溶液pH对其影响较大。通过实验与理论计算发现,离子液体对Fe3+的萃取过程存在阳离子交换与离子对的共同作用机制,但离子对作用占主导地位。
疏水性; 胍类离子液体; 萃取; 金属离子; 计算
近些年来,利用离子液体(ILs)捕集分离废水中重金属离子的研究已受到越来越多的重视[1-15]。单独使用常规ILs作萃取剂时,萃取效果往往并不理想[1-3],萃取分离所依靠的是离子交换机制和离子对作用。由于金属离子在ILs中的溶解度非常低,必须提高ILs用量才能提高金属离子的去除效果,但都不可避免地造成ILs进入到水相中,造成水体的二次污染和ILs的损失。为克服这一弊端,可选择憎水性ILs为有机相,再添加对金属离子有特殊作用的协萃剂(螯合剂)[5-7]。研究发现,在同样添加螯合剂的情况下,ILs系统往往比传统有机溶剂系统具有更高的萃取率[4]。此时,螯合剂往往对金属离子具有一定选择性[5-7]。
萃取分离水体中金属离子最理想的ILs必须满足两个基本要求:首先,ILs在水中的溶解度要极低,即选用疏水性的ILs;其次,ILs结构中必须含有能螯合金属离子的功能基团,即选用功能性ILs。只有这样,才能最大限度地避免ILs损失和水体的二次污染。一般而言,增加ILs的疏水性可选用疏水性的阴离子、或在阳离子上嫁接较长的碳链。功能性ILs主要包括在阳离子取代基上引入脲、硫脲、硫醚的ILs[8],以及含二硫基团和氰基的ILs[9-10]。研究发现,功能性ILs均能显著提高金属离子的脱除效果[8-10],例如,二硫基团修饰的吡啶ILs对溶液中的Au3+具有较强的萃取能力[10]。此外,在阳离子上也可修饰其他如2-羟基苄胺单元[11]等,也可采用具备特殊的阴离子构建功能ILs[12-14]。Vladimir 等[14]合成了阴离子型ILs三辛基甲基水杨酸铵盐(TOMAS),实验发现TOMAS 对Fe3+、Cu2+等金属离子具有较强的萃取能力。刘梦莹等[15]合成了3种含硫脲基团的疏水性ILs,研究发现,与传统ILs相比,官能团的引入使Cu2+萃取率从20%提高到99%。量化计算说明,含硫脲基团的功能化ILs除了其阴离子与Cu2+间存在静电作用,官能基团上的硫还能够与Cu2+形成路易斯酸碱相互作用[15]。可见,功能性ILs在萃取金属离子方面有其独特优势。
在胍类离子液体中,3个氮原子共轭使其具有良好的热稳定性[16]。通过改变胍类ILs氮原子上基团可以实现较高的催化性能[17-18],也可通过改变阴离子种类实现诸如溶解性能的调节[16]。目前,胍类ILs主要用于有机合成与酸性气体的吸收等[17-19],但用于捕集金属离子的研究鲜有报道。由于胍离子液体中的氮上含有孤对电子,它可与金属离子发生配位作用,不需要另外嫁接功能基团即可实现对金属离子的萃取。基于此,本文合成了一种疏水性胍类ILs,即N,N,N’,N’-四甲基-N”-辛基胍双三氟甲基磺酰亚胺盐[C8TMG][NTf2]。在此基础上,探讨了室温条件下其萃取分离水溶液中金属离子的能力,研究了不同因素对金属离子(特别是Fe3+)萃取效果的影响,并结合量化计算探究了萃取机理。
1 实验部分
1.1 试剂
四甲基胍(TMG)(Aladdin,纯度99%);1-溴辛烷(纯度99%),购自上海思域化工科技有限公司;二水合氯化铜,六水合氯化钴,六水合氯化镍,氯化铁,氯化锌,均为分析纯,均购自国药集团化学试剂;双三氟甲基磺酰亚胺锂(Macklin,纯度99%);乙腈,色谱纯,购自百灵威化学。其他化学品均为分析纯,无需进一步处理。
1.2 合成方法
ILs的合成参照文献[18]进行,将0.05 mol四甲基胍(TMG)与15 mL乙腈加入到装有磁力搅拌子的三口圆底烧瓶中,在冰水浴和氮气保护下缓慢滴加0.05 mol 1-溴辛烷与15 mL乙腈的混合溶液,滴加完毕后常温下搅拌反应24 h,减压下旋蒸除去乙腈,残余物使用30 mL乙酸乙酯清洗5次,减压蒸除乙酸乙酯,得到白色固体,收率为62%,将得到白色固体溶解于50 mL去离子水中,并加入0.03 mol双三氟甲基磺酰亚胺锂(LiNTf2),35 ℃下搅拌反应12 h后分层,上层为水相,下层为离子液体相。加入二氯甲烷进行多次萃取,旋蒸除去二氯甲烷与少量的水得到终产物[C8TMG][NTf2]。所合成的离子液体经核磁表征确认为目标ILs,其结果如下:[C8TMG][NTf2]:1H-NMR(400 MHz,DMSO,δ):0.862(t,3H);1.257~1.533(m,8H);2.862(s,6H);2.892(s,6H);3.096(m,2H)。IR(涂层)υ:2 930,2 858,1 616,1 466,1 411,1 352 cm-1。
1.3 金属离子的萃取
称取一定量的金属盐溶于去离子水中,定量配制成不同质量浓度的金属盐溶液。将金属盐溶液与ILs按一定体积比混合,超声,离心分离后取上层水相,用等离子体发射光谱仪(ICP-AES,Varian700-ES系列,购自美国瓦里安公司) 对上层溶液中的金属离子含量进行分析。ILs相中金属离子含量通过起始浓度与上层溶液中金属离子含量的差值得到。其中,ICP-AES检测Fe3+回归方程为
I=4 842.7ρ+274.33 (R2=0.999 5)
(1)
其中:I为发射信号强度,ρ为金属离子质量浓度,mg/L。
金属离子的萃取率(E)可通过式(2)计算:
(2)
其中ρini为水相中金属离子的初始质量浓度,mg/L,ρfin为萃取后水相中金属离子的质量浓度,mg/L。
金属离子在ILs相与水相中的分配系数(D)是达到平衡时两相的质量浓度之比,分配系数采用式(3)计算:
(3)
其中:Vaq,VIL分别为水相和离子液体相的体积,mL。
2 结果与讨论
2.1 [C8TMG][NTf2]对不同金属离子的萃取效果
分别取质量浓度均为100 mg/L左右的金属盐(Fe3+、Cu2+、Co2+、Ni2+、Zn2+)的水溶液5 mL,加入一定体积的 [C8TMG][NTf2],超声混合10 min后静置分层,分析水溶液前后的金属离子含量即可得到[C8TMG][NTf2]萃取能力,具体结果见图1。
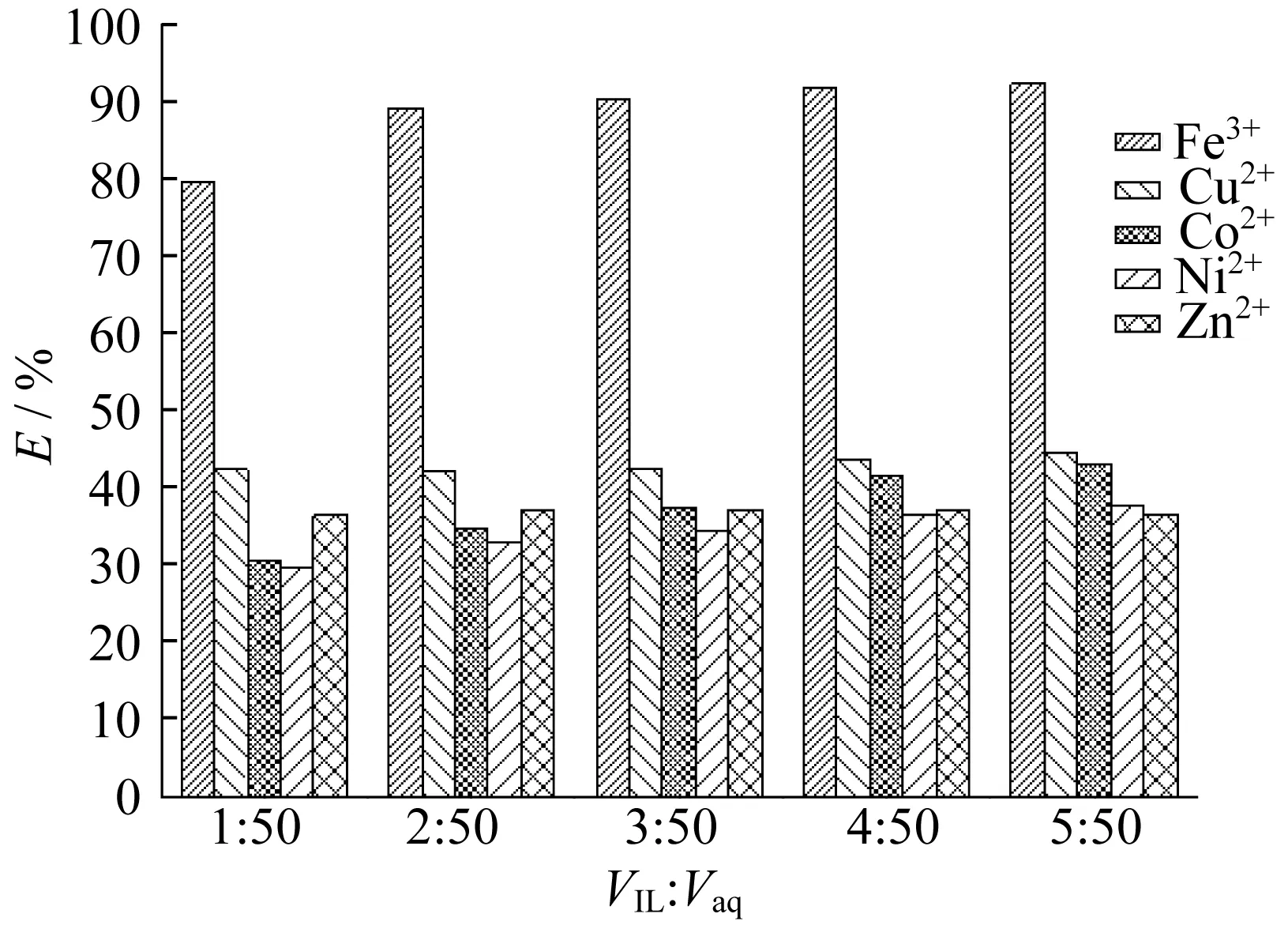
图1 [C8TMG][NTf2]对5种金属离子的萃取效果Fig.1 Effect of VIL∶Vaq on extraction efficiencies of five kinds of metal ions
从图1中可知,[C8TMG][NTf2]对所考察的5种金属离子均具有一定的萃取分离能力,但对Fe3+的萃取率最高,可达80%以上,而对Cu2+、Co2+、Ni2+和Zn2+的萃取率均低于45%。这说明制备的 [C8TMG][NTf2]对Fe3+具有明显的萃取优势,可实现对Fe3+的选择性分离。另一方面,随着ILs体积的增加,不同金属离子的萃取率均小幅升高,与传统ILs和功能性ILs的萃取规律一致[20]。当VIL∶Vaq从1∶50增加到2∶50时,ILs对Fe3+的萃取率可从80%左右上升到90%,再进一步提高VIL:Vaq时,萃取率增加幅度较小。考虑到实际操作,如无特殊说明,后续实验中的体积比VIL∶Vaq均采用2∶50,即VIL=0.2 mL,Vaq=5 mL。
实际废水中一般含有多种重金属离子,为了研究不同金属离子之间的萃取干扰,取质量浓度为100 mg/L含有5种金属离子(Fe3+、Cu2+、Co2+、Ni2+、Zn2+)的水溶液5 mL,加入0.2 mL [C8TMG][NTf2],超声混合10 min后静置分层,实验所得到的Fe3+的萃取率为85.6%,Cu2+为23.6%,Ni2+、Zn2+、Co2+分别为11.6%,7.2%与4.0%,实验结果表明金属离子在混合溶液中的萃取率均比单一金属溶液中低,但该离子液体对Fe3+仍然具有萃取优势。
2.2 萃取机理
为探讨[C8TMG][NTf2]与金属离子的相互作用机制以及为何对Fe3+具有选择性的萃取优势,本文采用量化计算的方法进行了分析。所有计算均在B3LYP/aug-cc-pVDZ的水平上进行,具体细节可以参阅相关文献[21-22]。首先获得了[C8TMG][NTf2]的表面静电势最小值Vs,min(见图2),Vs,min能描述以及预测分子间静电相互作用的反应位点。Vs,min值的负号体现了其对于正离子的吸引能力,并且绝对值越大表示具有越强的吸引正离子的作用。计算发现,[C8TMG][NTf2]的Vs,min主要位于阴离子氮和氧原子周围,这说明氮和氧原子能够提供电子对,与酸性的离子或金属形成配位,即[C8TMG][NTf2]可通过静电相互作用实现金属离子的萃取。而且[C8TMG][NTf2]的Vs,min(-228.50 kJ/mol)比传统的1-乙基-3-甲基咪唑双三氟甲基磺酰亚胺盐[EMIM][NTf2]的Vs,min(-216.21 kJ/mol) 更负,说明在相同阴离子情况下,胍类阳离子型ILs应该有比咪唑阳离子型ILs更好的萃取金属离子的能力。

图2 [C8TMG][NTf2]的表面静电势图Fig.2 Computed electrostatic potential of [C8TMG][NTf2]
但Vs,min的分析并不能给出其对不同金属离子相互作用的差异,为此,本文进一步计算了胍类ILs与金属离子的相互作用能,所有的能量均进行了零点振动能(ZPE)校正,并利用Boys和Bernardi方法考虑了基组重叠误差(BSSE)。将离子对与5种金属离子(Fe3+、Co2+、Ni2+、Cu2+、 Zn2+)构成的体系在B3LYP/6-311++G(d,p)理论水平下进行优化,得到最稳定的结构如图3所示。从优化后的结果可知,Fe3+与ILs间存在4个相互作用位点,Fe3+除了与阴离子上的氧和氮发生相互作用外,还能与阳离子上的氮原子发生作用,其中Fe3+…O和Fe3+…N的键长分别在2.01×10-10m与2.27×10-10m左右,均小于相应原子的范德华半径之和。但其他金属离子只与阴离子发生相互作用。其中,Cu2+与阴离子间存在3个作用位点,Ni2+、Zn2+与阴离子间存在2个作用位点,而Co2+仅与氧原子发生相互作用。 [C8TMG][NTf2]与5种金属离子之间的相互作用能绝对值有如下顺序:ILs-Fe3+(2 785.59 kJ/mol)> ILs-Cu2+(1 199.10 kJ/mol)>ILs-Ni2+(1 086.57 kJ/mol)>ILs-Zn2+(935.93 kJ/mol)>ILs-Co2+(671.75 kJ/mol),即IL-Fe3+之间的结合能远远大于其他4种金属离子与ILs间的结合能。可见,Fe3+能同时与阴阳离子发生作用,而且存在非常高的结合能应该是[C8TMG][NTf2]对Fe3+具有选择性萃取的本质原因。另外,计算获得的 [EMIM][NTf2]与Fe3+之间的相互作用能的绝对值为1 261.75 kJ/mol,表明与传统ILs相比,[C8TMG][NTf2]与金属Fe3+的结合效果更优。
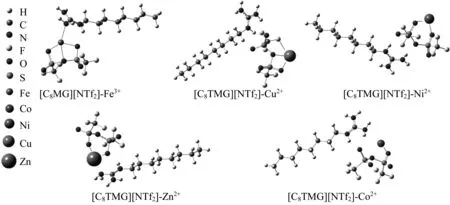
图3 [C8TMG][NTf2]与各金属离子之间的相互作用Fig.3 Interaction between the various metal ions and [C8TMG][NTf2]
Fe3+同时能与阴阳离子发生作用也可从萃取前后ILs的红外谱图(见图4)上得到证实。萃取前红外谱图中1 618 cm-1处为C=N的伸缩振动吸收峰,萃取后该振动吸收峰红移到1 596 cm-1处,萃取前3 270 cm-1处为C=N—H键中N—H键的伸缩振动吸收峰,萃取后该峰减弱,这说明ILs中阳离子上的N原子与Fe3+具有较强的相互作用。
由于Fe3+能同时与[C8TMG][NTf2]中的阴阳离子发生作用,萃取时应该存在阳离子交换与离子对作用两种机制。本文利用核磁内标法(对苯二甲酸二甲酯为内标物)定量测定了萃取前后上层水溶液中ILs的含量。实验发现,[C8TMG][NTf2]在纯水中的质量分数仅为0.16%,说明[C8TMG][NTf2]具有较强的疏水性。如果水中存在Fe3+,加入[C8TMG][NTf2]萃取后,Fe3+的萃取率可达90%以上。如果纯粹是阳离子交换,则水相中[C8TMG][NTf2]的质量分数应该非常高,但实验测得水相中[C8TMG][NTf2]的质量分数仅为0.38%。可见,在萃取Fe3+过程中,存在阳离子交换与离子对作用两种机制,但离子对作用占主导地位。
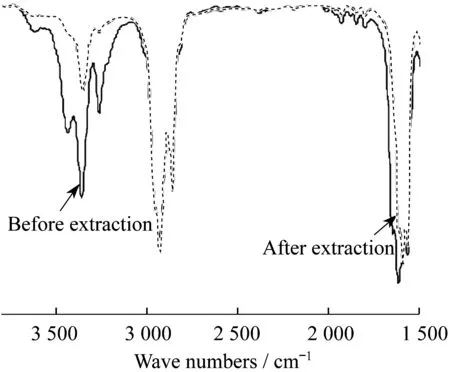
图4 萃取前后离子液体的红外谱图Fig.4 Infrared spectra of the IL before and after extraction
2.3 不同因素对Fe3+萃取效果的影响
不同萃取时间对萃取效果的影响见图5。实验发现,当萃取时间(t)仅为1 min时,Fe3+萃取率即可达64.8%。随着萃取时间的增加,萃取率也逐渐增加。当t=5 min时,萃取率上升为90%。随后,随萃取时间的增加,萃取率几乎保持不变。这说明,在超声强化下,疏水性胍类ILs能快速分散于水相中,并能较快与Fe3+间发生作用,即萃取时间为5 min时,Fe3+在两相中的分配能达到平衡。如果采用传统的震荡混合方式一般需要较长的平衡时间[3,7]。考虑到ILs的黏度、疏水性以及实际操作条件,超声萃取时间可选定为5 min。
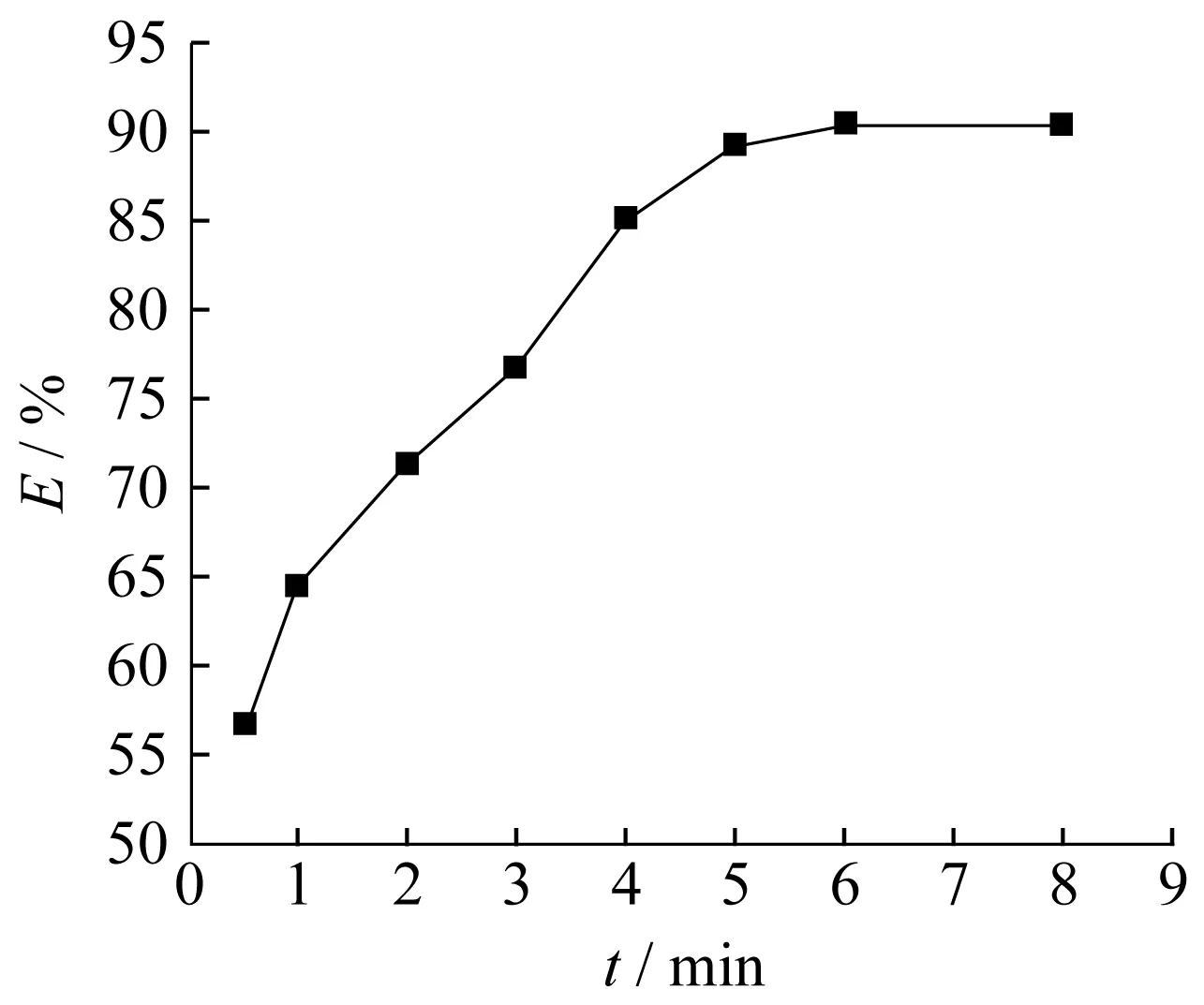
图5 [C8TMG][NTf2]对Fe3+的萃取率随时间变化曲线Fig.5 Effect of ultrasound time on the extraction efficiencies of Fe3+ with [C8TMG][NTf2]
Fe3+初始质量浓度对萃取效果的影响见图6。总体而言,在10~100 mg/L范围内,随着金属离子初始质量浓度的增加,萃取率有所增加,但其幅度并不显著。即使Fe3+质量浓度低至10 mg/L时,其萃取率也可达到89%,已与高浓度下萃取率十分接近。实验发现,不同质量浓度下Fe3+在离子液体相与水相中的分配系数也相对较高(数量级为102),而且金属离子的初始质量浓度对分配系数的影响也较小,这与功能性离子液体的规律类似[12]。从分配系数的角度可知,选定的胍类离子液体的确能够有效捕集Fe3+。
Fe3+为弱碱阳离子,在碱性条件下能够与OH-结合形成沉淀。因此,理论上碱性条件下有利于Fe3+的去除。为了单纯考查在酸性范围内溶液的pH值对萃取效果的影响,取质量浓度为100 mg/L且用盐酸调节其pH分别为0.5、1、2、3的Fe3+水溶液5 mL,加入0.2 mL的 [C8TMG][NTf2],超声5 min,实验所得到Fe3+的萃取率分别为4.4%、4.7%、28.9%和42.4%。这一结果说明,Fe3+的萃取受pH影响较大。随着溶液的酸性增强,Fe3+的萃取率下降,这是由于pH会影响官能团的存在形式以及其与金属离子之间的配位作用,实验与Luo等[23]关于金属离子萃取过程受pH影响的结论是一致的。这一结果说明,当采用[C8TMG][NTf2]从水溶液中萃取Fe3+后,可通过调节pH将金属离子反萃取出来,从而实现ILs的重复利用。
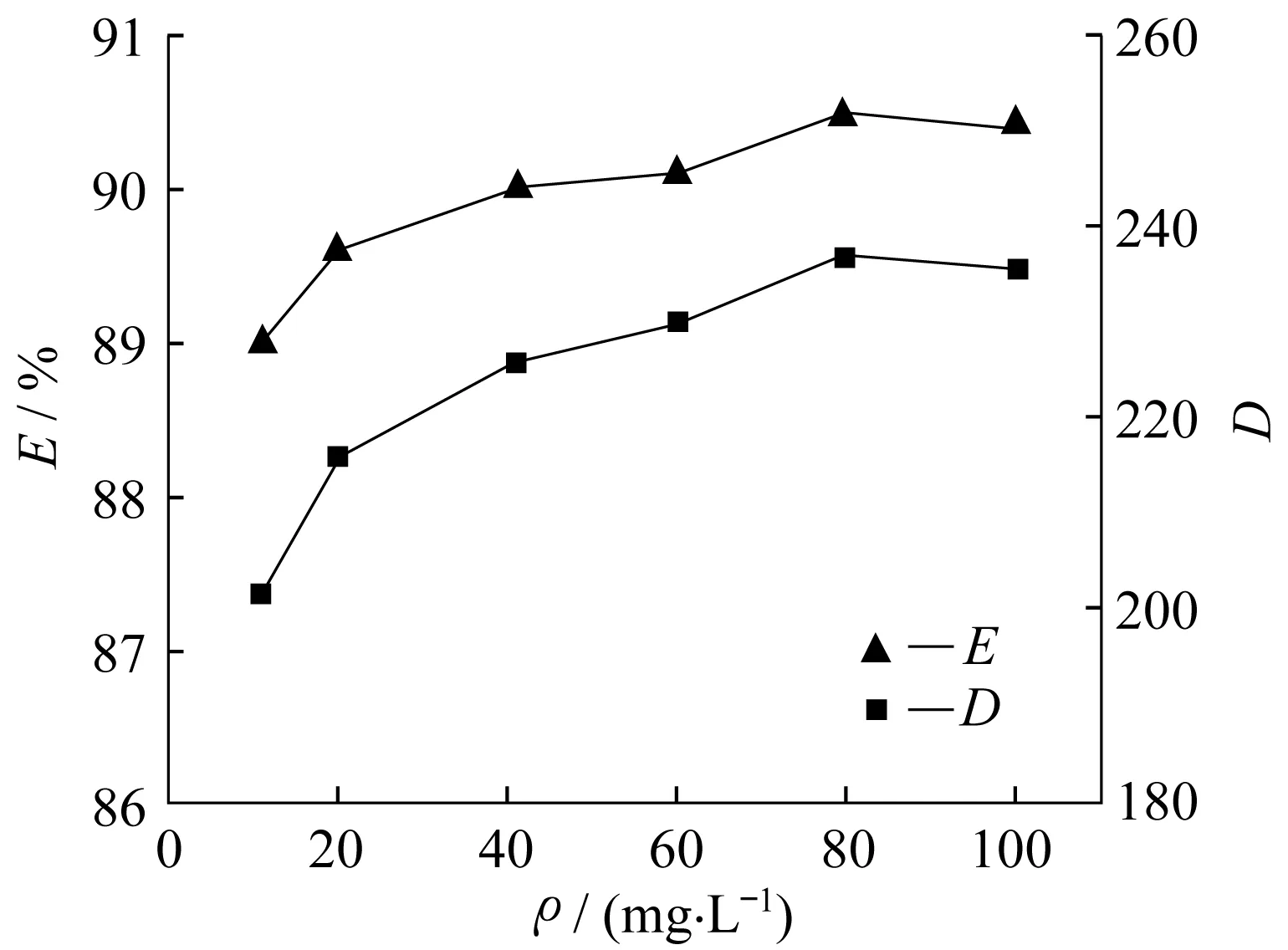
图6 不同质量浓度的Fe3+对萃取率与分配系数的影响Fig.6 Effect of different concentration of Fe3+ on the extraction efficiencies and distribution coefficients of Fe3+ with [C8TMG][NTf2]
3 结 论
(1) 合成的离子液体[C8TMG][NTf2]对5种不同金属离子(Fe3+、Cu2+、Co2+、Ni2+、Zn2+)具有一定的萃取能力,但对Fe3+的萃取效果最好,可实现Fe3+的选择性萃取。
(2) 超声波强化作用下,Fe3+在ILs与水相中可在5 min内达到分配平衡。Fe3+的萃取率会随ILs用量增加而增加,当Vaq∶VIL= 25时,Fe3+的萃取率可达90%以上。Fe3+初始质量浓度对萃取率影响较小。
(3) 溶液的pH对萃取效果的影响较大。随着酸度增加,Fe3+的萃取率逐渐减少,可通过pH的摆动效应实现对Fe3+的反萃取以及离子液体的回收利用。
(4) Fe3+的萃取存在阳离子交换与离子对的共同作用机制,但离子对共同作用占主导地位。
[3] NOBUYUKI K,YASUHISA I.Extraction mechanism of metal ion from aqueous solution to the hydrophobic ionic liquid,1-butyl-3-methylimidazolium nona-fluorobutane sulfo-nate [J].Monatshefte Fur Chemie,2007,138(11):1145-1151.
[4] LI Changping,XIN Baoping,XU Wenguo.Extraction ability of ionic liquids for Cu(Ⅱ) and Ni(Ⅱ)[J].Journal of Dalian Maritime University,2008,34(3):17-20.
[5] HIRAYAMA N,DEGUCHIC M ,KAWASUMIA H,etal.Use of 1-alkyl-3-methylimidazolium hexafluorophosphate room temperature ionic liquids as chelate extraction solvent with 4,4,4-trifluoro-1-(2-thienyl)-1,3-butanedion[J].Talanta,2005,65(1):255-260.
[6] TSUKATANI T,KATANO H,TATSUMI H,etal.Halogen-free water-immiscible ionic liquids based on tetra-octyla mmonium cation and dodecylsulfate and dodecyl-benzenesulfonate anions,and their application as chelate extraction solvent[J].Analytical Sciences,2006,22(2):199-200.
[7] DADFARNIA S,SHABANI A M,BIDABADI M S,etal. A novel ionic liquid/micro-volume back extraction procedure combined with flame atomic absorption spectrometry for determination of trace nickel in samples of nutritional interest[J].Journal of Hazardous Materials,2010,173(1-3):534-538.
[8] VISSER A E,RICHARD P S,ROGERS R D.Task-specific ionic liquids incorporating novel cations for the coordination and extraction of Hg2+and Cd2+:Synthesis,characterization,and extraction studies[J].Environmental Science & Technology,2002,36(11):2523-2529.
[9] PAPAICONOMOU N,LEE J M,SALMINEN J,etal.Selective extraction of copper,mercury,silver,and palladium ions from water using hydrophobic ionic liquids[J].Industrial and Engineering Chemistry Research,2008,47(15):5080-5086.
[10] LEE J M.Extraction of noble metal ions from aqueous solution by ionic liquids[J].Fluid Phase Equilibria,2012,319(13):30-36.
[11] OUADI A,GADENNEB,HESEMANN P,etal.Task-specific ionic liquids bearing 2-hydroxybenzylamine units:Synthesis and americium extraction studies[J].Chemistry A European Journal,2006,12(11):3074-3081.
[12] FISCHER L,FALTA T,KOELLENSPERGER G,etal.Ionic liquids for extraction of metals and metal containing compounds from co mmunal and industrial waste water[J].Water Research,2011,45(15):4601-4614.
[13] MESSAD A,MOHAMADOU A,BOUDESOCQUE S,etal.Task-specific ionic liquid with coordinating anion for heavy metal ion extraction:Cation exchange versus ion-pair extraction[J].Separation Science and Technology,2013,107(107):172-178.
[14] VLADIMIR M,EGOROV D I,DJIGAILO D S.Task-specific ionic liquid trioctlymethyla mmonium salicylate as extraction solvent for tranition metal ions[J].Talanta,2010,80:1177-1182.
[15] 刘梦莹,车佳宁,吴蔚闳,等.功能性离子液体萃取水溶液中Cu2+:实验与理论[J].化学学报,2015,73:116-125.
[16] 段海峰,郭旭,李胜海,等.胍盐离子液体的研究进展[J].有机化学,2006,26(10):1335-1343.
[17] JIANG Tao,GAO Haixiang,HAN Buxing,etal.Ionic liquid catalyzed Henry reaction[J].Tetrahedron Letters,2004,45(12):2699-2701.
[18] 易兵,张阳,党丽敏,等.新型胍离子液体的合成及在Henry反应中的应用[J].湘潭大学自科学报,2011,33(2):74-77.
[19] BATES E D,MAYTON R D,NTAI I,etal.CO2Capture by a task-specific ionic liquid[J].Journal of the American Chemical Society,2002,124(6):926-927.
[20] VISSER A E,ROGERS R D.Task-specific ionic liquids for the extraction of metal ions from aqueous solutions [J].Chemical Communications,2001,32(17):135-136.
[21] WU Weihong,LU Yunxiang,LIU Yingtan,etal.Weak energetic effects between X-π and X-N halogen bonds:CSD search and theoretical study [J].Chemical Physics Letters,2013,582:49-55.
[22] BULAT F A,TORO-LABBE A,BRINCK T,etal.Quantitative analysis of molecular surfaces:Areas,volumes,electrostatic potentials and average local ionization energies [J].Journal of Molecular Modelin,2010,16(11):1679-1691.
[23] LUO Huimin,DAI Sheng,BONNESEN P V,etal.Extraction of cesium ions from aqueous solutions using Calix[4]arene-bis(tert-octylbenzo-crown-6) in ionic liquids[J].Analytical Chemistry,2004,76(76):3078-3083.
Extraction of Heavy Metal Ions from Aqueous Solution with Hydrophobic Guanidine Ionic Liquid
CHE Jia-ning1, LIU Fei1, PENG Chang-jun1, LIU Hong-lai1, YANG Qiang2, WANG Hua-lin2
(1.Key Laboratory for Advanced Materials; 2.Environmental Protection Key Laboratory of Environmental Risk Assessment and Control on Chemical Process,East China University of Science and Technology,Shanghai 200237,China)
The hydrophobic guanidine ionic liquid was synthesized to study the extraction of heavy metal ions(Fe3+,Cu2+,Co2+,Ni2+,Zn2+) from aqueous solution at room temperature.The results showed the extraction efficiency of Fe3+was up to 90%,while that of other metal ions was about 40%.In order to further study the extraction effect of Fe3+,the influences of volume ratio between aqueous solution and ionic liquids,extracted time,the initial concentration of metal ion,as well as pH were analyzed with the ionic liquid.When 0.2 mL ionic liguid and 5 mL FeCl3solution were mixed by supersonic vibration at room temperature,the extraction efficiency of Fe3+was 90%.The results also suggested that initial concentration of metal ions in solution had little effect on the extraction efficiency,however,pH had great effect on it.The experiment results and theoretical calculations proved that the mechanisms of the extraction for Fe3+were the ion-pair and the cation exchange,in which the ion-pair played the main role.
hydrophobicity; guanidine ionic liquid; extraction; metal ions; calculation
1006-3080(2016)06-0782-06
10.14135/j.cnki.1006-3080.2016.06.006
2016-03-11
国家重点基础研究计划(2015CB251401);国家自然科学基金(21476070);中央高校基本科研业务费(222201313001)
车佳宁(1989-),女,山东人,硕士生,研究方向为分子热力学。E-mail:1254961146@qq.com
彭昌军,E-mail:cjpeng@ecust.edu.cn
O69
A
