模拟干旱胁迫下大麦叶片保护性酶的发育遗传分析
2017-01-17包海柱徐寿军张凤英刘志萍吕二锁
包海柱,徐寿军,张凤英, 刘志萍, 吕二锁
(1.内蒙古农业大学 农学院,内蒙古 呼和浩特 010019;2.内蒙古农牧业科学院,内蒙古 呼和浩特 010031;3.内蒙古民族大学,内蒙古 通辽 028000)
模拟干旱胁迫下大麦叶片保护性酶的发育遗传分析
包海柱1,2,徐寿军3,张凤英2, 刘志萍2, 吕二锁2
(1.内蒙古农业大学 农学院,内蒙古 呼和浩特 010019;2.内蒙古农牧业科学院,内蒙古 呼和浩特 010031;3.内蒙古民族大学,内蒙古 通辽 028000)
为明确大麦抗旱生理性状的发育遗传,在大麦抗旱育种中加以利用。采用ADMP(加性-显性-母本-父本)遗传模型及条件方差分析方法,分析了模拟干旱胁迫下的大麦叶片4种保护性酶(超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、谷胱甘肽还原酶(GSHR))的发育遗传效应。结果表明,在不同发育阶段4种保护性酶的遗传效应不尽相同,在遗传效应类别、遗传表达量上存在差异;随着生育进程推进,4种保护性酶的条件遗传主效应表现出一定依时空波动和间歇性。在出苗-拔节阶段,以SOD的显性效应强,GSHR的母本效应最强;在拔节-开花阶段,SOD、POD存在较大的加性遗传效应,GSHR存在最大值的父本效应;在开花-灌浆阶段,SOD、POD的加性遗传效应高于相应的显性遗传效应,SOD、CAT被检测到较大的母本遗传效应,GSHR的父本效应最强。根据研究结果可知,在不同生育阶段以保护性酶指标进行抗旱鉴定时,可如下进行:出苗-拔节阶段,对高代材料或亲本而言,适宜测定GSHR;对F1或F2而言,适宜测定SOD。拔节-开花阶段,对高代材料或亲本而言,适宜测定SOD、POD;对F1或F2而言,适宜测定POD。开花-灌浆阶段,对高代材料或亲本而言,适宜测定SOD、POD、CAT、GSHR;对F1或F2而言,适宜测定POD。
大麦;保护性酶;遗传效应
我国北方的春播大麦区,多为旱作坡耕地,干旱及季节性干旱一直是困扰当地大麦生产的主要限制因素,常因干旱减产30%以上。干旱能够影响作物从种子萌发到成熟的各个生育阶段,并具体到蒸腾、光合、呼吸、酶活力、养分的吸收等生理代谢过程。
有研究表明,逆境环境下,植物体内的保护性酶对清除活性氧起着至关重要的作用[1-3]。敬礼恒等[4]、汤丰收等[5]的研究认为,作物抗旱性的强弱与超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、谷胱甘肽还原酶(GSHR)的活性呈正相关;李萍等[6]、任鹏等[7]研究表明,严重干旱处理下的SOD、POD活性显著或极显著高于其他处理。Neil等[8]和Shinozaki等[9]认为,植物体在识别逆境压力信号后,能够做出应答,使相关适应性基因启动,并转录产生逆境胁迫应答蛋白,王曙光等[10]在大豆上的研究也认为,SOD、POD等保护性酶能够对逆境做出反应,类似的研究也认为,在减轻活性氧伤害,清除自由基过程中,上述保护性酶起到了关键作用[11-14]。
在保护性酶的遗传研究方面,张文英等[15]认为SOD的活性存在较高的的加性效应和显性效应。李志远[16]在玉米上的研究表明,不同环境下玉米叶片SOD活性的遗传主效应占主导地位,并受控于显性效应。宋美珍等[17]在棉花上的研究认为,叶片CAT以加性上位性效应为主,POD以加性效应为主,SOD活以显性效应为主。
本研究以抗旱性存在差异、无血缘关系的大麦遗传群体为材料,应用ADMP遗传模型及条件分析方法[18-19],对PEG6000模拟干旱下,大麦发育进程中的保护性酶进行了遗传分析,以期揭示其动态遗传特征,为大麦抗旱品种选育提供参考。
1 材料和方法
1.1 试验材料
供试材料为196个抗旱性存在差异的遗传群体,该群体包括14个亲本,及其以亲本为基础通过双列杂交方式获得的182个F1杂交组合。
1.2 试验设计
将196个供试遗传群体种植于内蒙古民族大学试验农场。顺序排列设计,3行区,6 m行长,行距0.25 m,管理措施略高于当地大田生产。在大麦生育期(苗期、拔节期、开花期、灌浆期),进行人工模拟干旱胁迫处理,具体如下:同一部位嫩叶取2份后置于冰桶带回室内备用,其中1份用蒸馏水洗净后直接测定酶活;另1份用25% PEG6000液体浸泡24 h后测定酶活[20]。
1.3 测定内容
所测保护性酶包括超氧化物歧化酶、过氧化物酶、过氧化氢酶和谷胱甘肽还原酶活性。SOD、POD、CAT活性的测定方法采用王学奎[21]的方法,GSHR活性测定采用Gosset等[22]的方法。
1.4 数据分析
数据分析参考Atchley等[23]、 朱军[18]及Zhu[19]的ATMP线性遗传模型方法,将任意t时刻的生理指标观测值y(t)分解为如下方程1所示,同时将y(t)定义为时间区间[0 t]内的遗传效应总量。
y(t)[24]=μ(t)+E(t)+A(t)+D(t)+M(t)+P(t)+AE(t)+DE(t)+ME(t)+PE(t)+B(t)+е(t)
①
①式中μ、E、A、D、M及P分别为均值、环境效应、加性效应、显性效应、母本效应、父本效应[24];AE、DE、ME及PE分别为加性与环境的互作、显性与环境的互作、母本与环境的互作、父本与环境的互作[24];B和е分别为区组效应和剩余效应[24]。
应用R软件对数据进行统计分析,利用x2检验、Logistic回归和非参数Kruskal-Wallis检验对不同种类酱油、不同采样地点、不同生产季度等的污染情况进行比较,以α=0.05为检验水准。
同理,时间区间[t-1 t]时刻的净遗传效应如方程②:
Y(t︱t-1)[24]=μ(t︱t-1)+E(t︱t-1)+A(t︱t-1)+D(t︱t-1)+M(t︱t-1)+P(t︱t-1)+AE(t︱t-1)+DE(t︱t-1)+ME(t︱t-1)+PE(t︱t-1)+B(t︱t-1)+е(t︱t-1)
②
抽样采用Jackknife法,遗传方差分量值的估算采用MINQUE①法,数据处理应用SAS 9.0和QGA[18]软件进行。
2 结果与分析
2.1 出苗至拔节期叶片酶活性遗传效应
出苗至拔节期的遗传效应分析见表1。结果表明,4种保护性酶的加性效应均未达显著水平;对显性效应而言,除POD外的SOD、CAT、GSHR的显性效应达到显著及以上水平,其中以SOD的显性效应最强;在母本效应中,所测定的4种保护性酶的母本效应均达显著及以上水平,并以GSHR的母本效应最强;在父本效应中,仅GSHR的父本效应为0,其余3种酶的均达极显著水平,并以POD的父本效应最大。
在胁迫条件下,环境互作也存在不同程度的遗传效应,其中4种酶的显性×环境均达极显著水平;加性×环境互作效应达到显著水平及以上水平的有SOD和GSHR;母本×环境互作达显著及以上水平的为SOD和CAT;对父本×环境互作而言,CAT的效应达到极显著水平,余者效应为0。

表1 大麦出苗至拔节期叶片保护性酶活性净遗传方差比值Tab.1 Net genetic variance components rate for enzyme activities in leaves from sowing to jointing %
注:**.0.01极显著水平;*.0.05显著水平。VA(t︱t-1).净加性效应方差; VD(t︱t-1).净显性效应方差; VM(t︱t-1).净母本效应方差; VP(t︱t-1).净父本效应方差; VAE(t︱t-1).净加性与环境互作效应方差; VDE(t︱t-1).净显性与环境互作效应方差; VME(t︱t-1).净母本与环境互作效应方差;VPE(t︱t-1).净父本与环境互作效应方差;Ve(t︱t-1).净机误方差。表2-4同。
Note:**.Indicates significance at 1% probalility level;*.Indicates significance at 5% probalility level.VA(t︱t-1).Net additive effects variance;VD(t︱t-1).Net dominance effects variance;VM(t︱t-1).Net maternal effects variance;VP(t︱t-1).Net paternal effects variance;VAE(t︱t-1).Net additive×environment interaction effects variance;VDE(t︱t-1)=Net dominance×environment interaction effects variance;VME(t︱t-1).Net maternal×environment interaction effects variance;VPE(t︱t-1).Net paternal×environment interaction effects variance;Ve(t︱t-1).Net error effects variance.The same as Tab.2-4.
2.2 拔节至开花期叶片酶活性遗传效应
大麦拔节至开花期的遗传效应分析见表2。由表2可以看出,拔节至开花期,加性、显性及母本×环境互作效应均达显著及以上水平的为SOD和POD;母本效应中POD未达显著水平,其余3种酶达极显著水平;父本效应达显著及以上的酶为CAT和GSHR;加性×环境、显性×环境互作效应中,均表现为SOD、CAT的效应达到极显著水平,POD和GSHR的效应为0。在父本×环境互作效应中,仅POD的效应表现突出,并达极显著水平。

表2 大麦拔节至开花期叶片酶活性条件遗传方差比值Tab.2 Net gengetic variance components rate for enzyme activities in leaves from jointing to flowering %
2.3 开花至灌浆期叶片酶活性遗传效应
开花至灌浆期的遗传效应见表3。由表3可知,此生育期内,在加性效应中,SOD、POD的效应达显著及以上水平,并以SOD效应最大;在显性效应中,仅POD的效应达显著水平;在母本效应中,除POD外的3种保护性酶:SOD、CAT、GSHR的效应均达显著及以上水平,并以SOD的效应最大;在父本效应中,仅GSHR的效应被检测到,并达极显著水平。
在环境互作效应中,4种保护性酶的父本×环境均达显著及以上水平,其中以POD的父本与环境互作效应最强;对母本×环境互作效应而言,除CAT外,其余3种酶的母本与环境互作效应均达极显著水平,并以POD的母本与环境效应最强;在显性×环境的互作效应中,POD、GSHR的显性与环境的互作效应未被检测到,其中CAT的显性×环境互作效应大于SOD的互作效应;在加性×环境的互作效应中,仅CAT存在微弱、未达显著水平的互作效应,其余3种酶的互作效应未被检测到。

表3 大麦开花至灌浆期叶片酶活性条件遗传方差比值Tab.3 Net genetic variance components rate for enzyme activities in leaves from flowering to grain filling %
2.4 生育进程中4种酶的主效应发育遗传
为了能够更直观地显示遗传主效应,将表1-3中的遗传主效应提取后得表4,由表4可知,随着生育进程推进,4种保护性酶的加性、显性、母本及父本的条件遗传效应表现出一定的依时空波动和间歇性。
在SOD的遗传效应中,出苗至灌浆阶段,其条件加性效应表现为拔节前关闭,拔节后开始表达,并在拔节至灌浆期间高水平表达,并使净效应表达量达到最大值(VA(t︱t-1)=36.13),而后加性效应降低;条件显性效应在出苗至拔节阶段最强(VD(t︱t-1)=41.02),而后随着生育进程依次降低,并在开花至灌浆期间失去显著性的表达;在母本效应中,表现出先上升后降低趋势;对SOD的条件父本效应而言,仅在出苗至拔节期间有显著性的表达,而在拔节至灌浆期间,未被检测到父本效应(VP(t︱t-1)=0)。
在POD的遗传效应中,在出苗至拔节阶段,其条件加性、条件显性效应均未被检测到,但拔节至开花、开花至灌浆阶段,其加性效应和显性效应表现出基本等量强度的遗传效应;在母本、父本效应中,在出苗至拔节阶段,其母本效应和父本效应均被检测到,而在随着生育进程的推进,其母本和父本效应消失。
对CAT而言,出苗后其条件加性效应和显性的表达趋势近似相同,都表现为出苗至拔节的时间段分别被检测到条件加性和显性效应,随后基因表达关闭,二者的区别在于加性效应不显著,而显性效应显著;在母本及父本效应中,其基因表达效应均随发育进程表现为依次降低,并以出苗至拔节期的效应最强,其中条件父本效应在开花至灌浆阶段基因关闭。
在GSHR的遗传效应中,其条件加性效应和显性均表现为在出苗至拔节阶段被检测到,随后消失,区别在于起始阶段的显性遗传效应显著;在母本效应中,全程的基因表达强度呈衰退趋势,出苗至拔节阶段的效应最强为70.24,是开花至灌浆阶段的5.6倍;在出苗至灌浆的发育过程中,父本效应的高强度表达时间段为拔节之后,而在出苗至拔节阶段其效应未被检测到。
通过上述分析可知,在出苗至拔节阶段是SOD显性效应、POD父本效应、CAT父本效应及GSHR母本效应的净表达量的高峰期;在拔节至开花阶段,遗传净效应表达量高的分别为SOD加性效应、POD加性效应、CAT母本效应及GSHR父本效应;在开花至灌浆阶段,以SOD加性效应、POD加性效应、CAT母本效应及GSHR父本效应的净表达程度强。以此可明确,以上分析中4种酶的遗传效应净表达量高峰期就是其对应效应基因表达的活跃期。
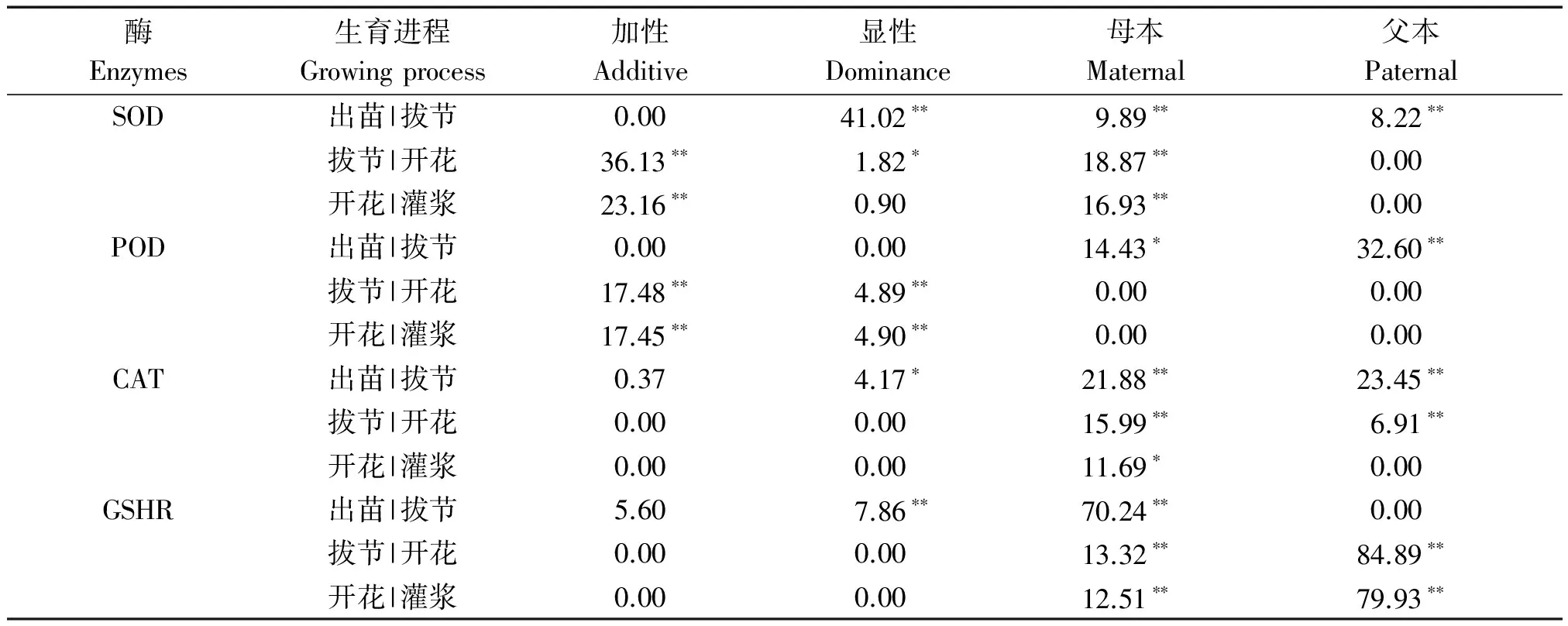
表4 遗传主效应Tab.4 Genetic main effects
3 结果与讨论
发育遗传理论表明,数量性状的遗传效应实际是生物体内诸多基因顺序表达的过程,相关基因的表达具有时空性和累积性;因此,获得某特定时段内的遗传净表达量有助于揭示生物体发育进程中的遗传动态[23-25]。
本研究以抗旱性存在差异的遗传群体为材料,以ADMP遗传模型为基础,应用条件分析方法,分析了PEG6000胁迫下大麦叶片SOD、POD、CAT、GSHR 4种保护性酶随发育进程中(出苗-拔节、拔节-开花、开花-灌浆)的遗传效应。结果表明,所测定的4种保护性酶的遗传表现为加性效应、显性效应、母本效应、父本效应及环境互作效应,而且在不同发育时期,其遗传效应的表达量存在依时空变化的特征。
在出苗-拔节阶段,SOD、CAT、GSHR检测到了一定的显性效应,说明在此阶段存在一定的杂种优势,其中以SOD的显性效应强;同时,显著及以上水平的母体及父本效应被检测到,其中以GSHR的母本效应最强。
在拔节-开花阶段,除SOD、POD存在较大的加性效应,GSHR存在最大值的父本效应。
在开花-灌浆阶段,SOD、POD表现出较大的加性效应,并分别高于各自的母体效应和显性效应;CAT被检测到较大的母体遗传效应;对GSHR而言,存在最大值的父本效应。
综上所述可知,所测4种保护性酶的遗传机理不尽同;在不同发育阶段,其遗传效应存在类别、表达量上的差异。因此,在进行抗旱育种实践中,针对基于保护性酶的抗旱鉴定时,所测指标的侧重点应有所不同,根据本研究结果可做如下选择:在出苗-拔节阶段,对高代材料或亲本而言,适宜测定GSHR;对F1或F2而言,适宜测定SOD;拔节-开花阶段,对高代材料或亲本而言,适宜测定SOD、POD;对F1或F2而言,适宜测定POD;开花-灌浆阶段,对高代材料或亲本而言,适宜测定SOD、POD、CAT、GSHR;对F1或F2而言,适宜测定POD。
本研究结果表明,利用条件方差分析的方法,可揭示与抗旱相关的4种保护性酶在植株发育进程中的间断性表达情况,因此,更能准确地描述其在特定发育时期的净遗传效应的动态表达量,能为不同时期的抗旱鉴定、杂交亲本的选择及栽培技术的改进提供理论参考。
[1] 杨宏羽,王 蒂,王 丽,等.不同磷水平对向日葵幼苗根系生长及保护酶活性的影响[J].甘肃农业大学学报,2015,50(4):63-68.
[2] 冯世座,刘合芹.极端温度对粳稻苗期光合特性及生理生化特性的影响[J].浙江师范大学学报:自然版,2012,35(3):330-337.
[3] 王志威,牟思维,闫丽丽,等.水分胁迫对春播玉米苗期生长及其生理生化特性的影响[J].西北植物学报,2013,33(2):343-351.
[4] 敬礼恒,刘立成,梅 坤,等.水稻抗旱性能鉴定方法及评价指标研究进展[J].中国农学通报,2013,29(12):1-5.
[5] 汤丰收,张新友,张 俊,等. 高油、高产花生新品种豫花9326抗旱生理特性及生产适应性研究[J].花生学报,2014,43(3):7-12
[6] 李 萍,侯万伟,刘玉皎.干旱胁迫对蚕豆苗期植株形态及叶片保护酶活性的影响[J].西南农业学报,2014,27(3):1029-1036.
[7] 任 鹏,赵保平,刘瑞芳,等.水分胁迫对燕麦穗颖渗透调节和抗氧化能力的影响[J].西北植物学报,2014,34(10):2049-2055.
[8] Neil S J,Burnett E C.RegIllation of gene expression during water deficit stress[J].Plant Growth Regul,1999,29:23-33.
[9] Shinozaki K,Yamaguchi-Shinozaki K.Gene networks involved in drought stress response and tolerance[J].Journal of Experimental Botany,2007,58(2):221-227.
[10] 王曙光,赵建奎,宁幸莲,等.PEG-6000引发对老化大豆种子膜透性及保护性酶活性的影响[J].华北农学报,2012,27(6):113-117.
[11] 赵 梅,王晶珊,李文香.不同品种花生抗氧化能力的研究[J].中国粮油学报,2011,26(9):70-73.
[12] 张文英,智 慧,柳斌辉,等.谷子孕穗期一些生理性状与品种抗旱性的关系[J].华北农学报,2011,26(3):128-133.
[13] 张 军,吴秀宁,鲁 敏,等.拔节期水分胁迫对冬小麦生理特性的影响[J].华北农学报,2014,29(1):129-134.
[14] 宋培玲,张 键,郝丽芬,等.不同抗性油菜品种接种黑胫病菌防御酶活性变化研究[J].华北农学报,2015,30(2):110-115.
[15] 张文英,柳斌辉,彭海城,等.冬小麦抗旱性状遗传力分析[J].干旱地区农业研究,2009,27(3):44-47.
[16] 李志远.不同环境下玉米叶片SOD活性遗传效应分析[J].种子,2010,29(2):85-89.
[17] 宋美珍,喻树迅,范术丽,等.短季棉早熟不早衰生化性状的遗传分析[J].西北植物学报,2005,25(5):903-910.
[18] 朱 军.遗传模型分析方法[M].北京:中国农业出版社,1997.
[19] Zhu J.New approaches of genetic analysis for quantitative traits and their applications in breeding[J].Journal of Zhejiang University:Agriculture & Life Science,2000,26(1):1-6.
[20] 贾 婷,赵 钢,彭镰心,等.PEG-6000引发对苦荞种子萌发及幼苗生长的影响[J].成都大学学报:自然科学版,2012,3(1):1-3.
[21] 王学奎.植物生理生化实验原理和技术[M].2版.北京:高等教育出版社,2006.
[22] Gosset D R,Millhollon E P,Lucas M C.Antioxidant response to NaCl stress in salt-tolerant and salt-sensitive cultivars of cotton[J].Crops Sci,1994,34(3):706-714.
[23] Atchley W R,Zhu J.Developmental quantitative genetic,conditional epigenetic variability and growth in mice[J].Genetics,1997,147(2):765-776.
[24] Atchley W R,Zhu J.Developmental quantitative genetic models of evolutionary change[J].Developmenttal Genetics,1994,15(1):92-103.
[25] 包海柱,高聚林,马 庆,等.基于ADM模型的油用向日葵籽实含油率动态发育遗传研究[J].中国油料作物学报,2013,35(5):533-538.
Developmental Genetic Analysis of Protective Enzymes in Barley Leaves under Simulating Drought
BAO Haizhu1,2,XU Shoujun3,ZHANG Fengying2,LIU Zhiping2,LÜ Ersuo2
(1.Agricultural College,Inner Mongolia Agricultural University,Huhhot 010019,China; 2.Inner Mongolia Academy of Agriculture and Animal Husbandry Sciences,Huhhot 010031,China; 3.Inner Mongolia University for Nationalities,Tongliao 028000,China)
In order to understand developmental behavior of four protective enzymes (SOD,POD,CAT,GSHR) in Barley.Experimental data based on 196 genetic populations were used for the additive-dominant-maternal-paternal(ADMP) model with genotype ×environment interaction and multivariable conditional analysis.The results showed that the genetic effects of 4 protective enzymes were not the same in different developmental stages.In the emergence to jointing stage,the dominant effect of SOD was the most strongest and the maternal effect of GSHR had the maximum value;from jointing to flowering,the SOD and POD had a relatively large additive effect,but GSHR had the maximum value of paternal effect;from the flowering to grain filling,the value of additive genetic was greater than the dominant effect on SOD and POD,the larger maternal effect of SOD and CAT had been detected,Meanwhile,the maximal value of paternal effect was detected on GSHR.In different growth stage,the drought-resistant identification indexes could be used:From emergence to jointing stage,the identification indexes was GSHR for the inbred line or parents,and SOD was suitable indexes for F1or F2of filial generation.From jointing to flowering stage,SOD and POD could be used as identification indexs for the inbred line or parents,meanwhile,POD could also be used to identify for F1or F2of filial generation.Flowing to grain filling stage,4 enzymes could be used as identification index for the inbred line or parents,but for F1or F2generation,only POD was suitable index.
Barley;Protective enzymes;Genetic effect
2016-09-20
内蒙古自然科学基金项目(2015MS0378);内蒙古农牧业创新基金项目;农业部现代农业-大麦青稞产业技术体系建设项目(CARS-05)
包海柱(1971-),男,内蒙古通辽人,研究员,博士,主要从事作物遗传育种研究。
S512.3
A
1000-7091(2016)06-0100-05
10.7668/hbnxb.2016.06.016
