35.5 kDa亚基缺失对花生球蛋白受热行为影响
2017-01-17石爱民刘红芝
徐 飞,刘 丽,石爱民,刘红芝,杨 颖,胡 晖,王 强
(中国农业科学院 农产品加工研究所,农业部农产品加工综合性重点实验室,北京100193)
油料蛋白
35.5 kDa亚基缺失对花生球蛋白受热行为影响
徐 飞,刘 丽,石爱民,刘红芝,杨 颖,胡 晖,王 强
(中国农业科学院 农产品加工研究所,农业部农产品加工综合性重点实验室,北京100193)
以35.5 kDa亚基缺失为研究点,对比了亚基缺失和未缺失花生球蛋白相对分子质量分布、热稳定性、加热聚集性和流体回转半径,明确了35.5 kDa亚基缺失对花生球蛋白受热行为影响。结果表明:35.5 kDa亚基缺失导致花生球蛋白存在形式不同;亚基缺失造成花生球蛋白热稳定性变性协同性增强;亚基缺失和未缺失花生球蛋白在60℃热处理可形成可溶性聚集体,90℃和120℃则形成共价聚集;加热会导致花生球蛋白分子结构松散,松散程度亚基缺失花生球蛋白大于未缺失花生球蛋白。该研究将为筛选适宜热加工花生蛋白提供依据,并为热单元中定向调控提供一定指导。
花生球蛋白;亚基缺失;相对分子质量分布;热稳定性;热聚集行为
花生(ArachishypogaeaL.)隶属于豆科植物,主要起源于南美洲热带亚热带地区,为世界第四大油料作物,我国花生种植地域广泛,产量居于世界首位[1]。花生仁中含有24%~36%的蛋白质,大部分为盐溶性蛋白(90%),其中花生球蛋白占比高达73%[2],因此花生球蛋白功能特性研究显得尤为重要。
花生种质间蛋白质亚基缺失多有报道[3-5]。蛋白质的功能性质与亚基大小及其组成密切相关[6],因此特定亚基的缺失将有利于蛋白质某些功能性质的发挥。热处理是花生蛋白加工业中不可或缺的操作单元,热处理过程会对蛋白质及其制品的功能性质,如凝胶性、溶解性、乳化性等具有较大影响[7-9]。
目前花生蛋白研究多停留于花生组分功能性质[2],在亚基角度鲜有报道。本文以自然变异缺失和未缺失35.5 kDa亚基的花生品种为实验材料,对比研究亚基缺失对花生球蛋白热特性的影响,明确缺失和未缺失花生球蛋白在受热过程中性质和结构变化,将有助于定向操控蛋白质基的食品加工环节以生产所需性质食品,这对开发优异的蛋白质基食品及食品配料具有重要的现实意义。
1 材料与方法
1.1 实验材料
1.1.1 原料与试剂
本实验所用花生品种为:花育25(Huayu No.25,35.5 kDa亚基缺失品种)和白沙1016(Baisha No.1016,35.5 kDa亚基未缺失品种)。
磷酸二氢钠、磷酸氢二钠、硫酸铵、福林酚B液,分析纯;牛血清蛋白(BSA)、丙烯酰胺、N,N′-甲叉双丙烯酰胺、过硫酸铵、四甲基乙二胺、三羟基甲基氨基甲烷、溴酚蓝、β-巯基乙醇(β-ME)、甘氨酸、十二烷基硫酸钠,Sigma公司。
1.1.2 仪器与设备
冷冻离心机,冷冻干燥机,差示扫描量热仪,Bio-Rad 电泳仪,十八角度激光光散射仪。
1.2 实验方法
1.2.1 花生球蛋白样品制备
花生去壳去红衣,常温下正己烷脱脂两次,残留溶剂于空气中挥干,制得花生脱脂粉。脱脂粉与磷酸盐缓冲液(10 mmol/L PBS,pH 7.9)按1∶12混合,高速分散,离心,上清液用40%的饱和硫酸铵沉淀,于4℃下静置4 h,10 000 ×g离心20 min收集沉淀。将沉淀装入透析袋内纯净水透析48 h(4℃,搅拌),冻干,得花生球蛋白备用。
1.2.2 花生球蛋白样品热处理
将花生球蛋白用磷酸盐缓冲液(10 mmol/L PBS,pH 7.9)配制为质量分数1.5%溶液,分别在60、90℃(恒温水浴锅)和120℃(高压灭菌锅)加热20 min,冷却备用。
1.2.3 聚丙烯酰胺凝胶电泳分析
加热处理前后的缺失和未缺失花生球蛋白亚基组成均采用SDS-PAGE分析。根据杜寅[4]的方法,略有调整,其中变性电泳添加β-ME,非变性电泳不含β-ME。浓缩胶5%,分离胶13%,电泳进样前,将2.0 mg样品与0.5 mL样品缓冲液振荡混匀,煮沸5 min,迅速冷却并离心5 min,电泳上样量为4.0 μL。凝胶电泳于恒压下进行,在浓缩胶中电压为80 V,进入分离胶后增至110 V。等电泳前沿跑至距玻璃板边缘1 cm左右时停止电泳。将凝胶胶片取出放入适量的考马斯亮蓝R250染色液中1 h,再用甲醇和醋酸混合液脱色,期间换脱色液2~3次,至蛋白质谱带清晰时为止。
1.2.4 相对分子质量分布和流体回转半径测定
采用十八角度激光光散射仪测定蛋白质样品相对分子质量分布。流动相采用50 mmol/L 磷酸盐缓冲液(pH 7.0),用前通过0.22 μm水系膜超滤,其后超声20 min。待测蛋白质用50 mmol/L磷酸盐缓冲液(pH 7.0)配制1 mg/mL分散溶液,用前过0.2 μm 膜。TSK柱: TSKG4000 SWXL(日本TOSOH公司)。激光光散射装置:L2130泵,L2400紫外检测器。检测流速为0.5 mL/min。标准蛋白选用牛血清蛋白单体对检测器信号进行处理。相对分子质量和流体回转半径利用ASTRA软件对信号处理得到。
1.2.5 热稳定性测定
参照Feng等[10]的方法略有改动。采用差示扫描量热仪(DSC)测定缺失和未缺失花生球蛋白热特性。称取2.0 mg的样品,置于铝盒,并向其中加入10 μL磷酸盐缓冲液(10 mmol/L, pH 7.9)。压盘密封,以空密封铝盒作为对照。保护气氮气的速率设为30 mL/min;扫描速率为10℃/min;温度扫描范围为20~125℃。通过所得DSC曲线,采用Universal Analyzer 2000软件计算蛋白质的变性温度(Td)和变性焓值(ΔH)。
1.2.6 溶解性测定
参照Liu等[11]的方法。2 mg花生球蛋白样品溶解于20 mL 磷酸盐缓冲液(10 mmol/L, pH 7.9)。室温下磁力搅拌0.5 h,10 000×g离心20 min,用福林酚法测定上清液中蛋白质含量。以牛血清蛋白(BSA)为标准蛋白做标准曲线。
1.2.7 数据处理
数据处理采用Microsoft Excel 2010、SigmaPlot和SAS 9.2软件。其中,显著性分析采用t检验,检验水平为P≤0.05。
2 结果与讨论
2.1 两种花生球蛋白亚基组成和相对分子质量分布
图1、表1分别为未缺失品种(Baisha No.1016)和缺失品种(Huayu No.25)花生球蛋白的SDS-PAGE图谱和相对分子质量分布。
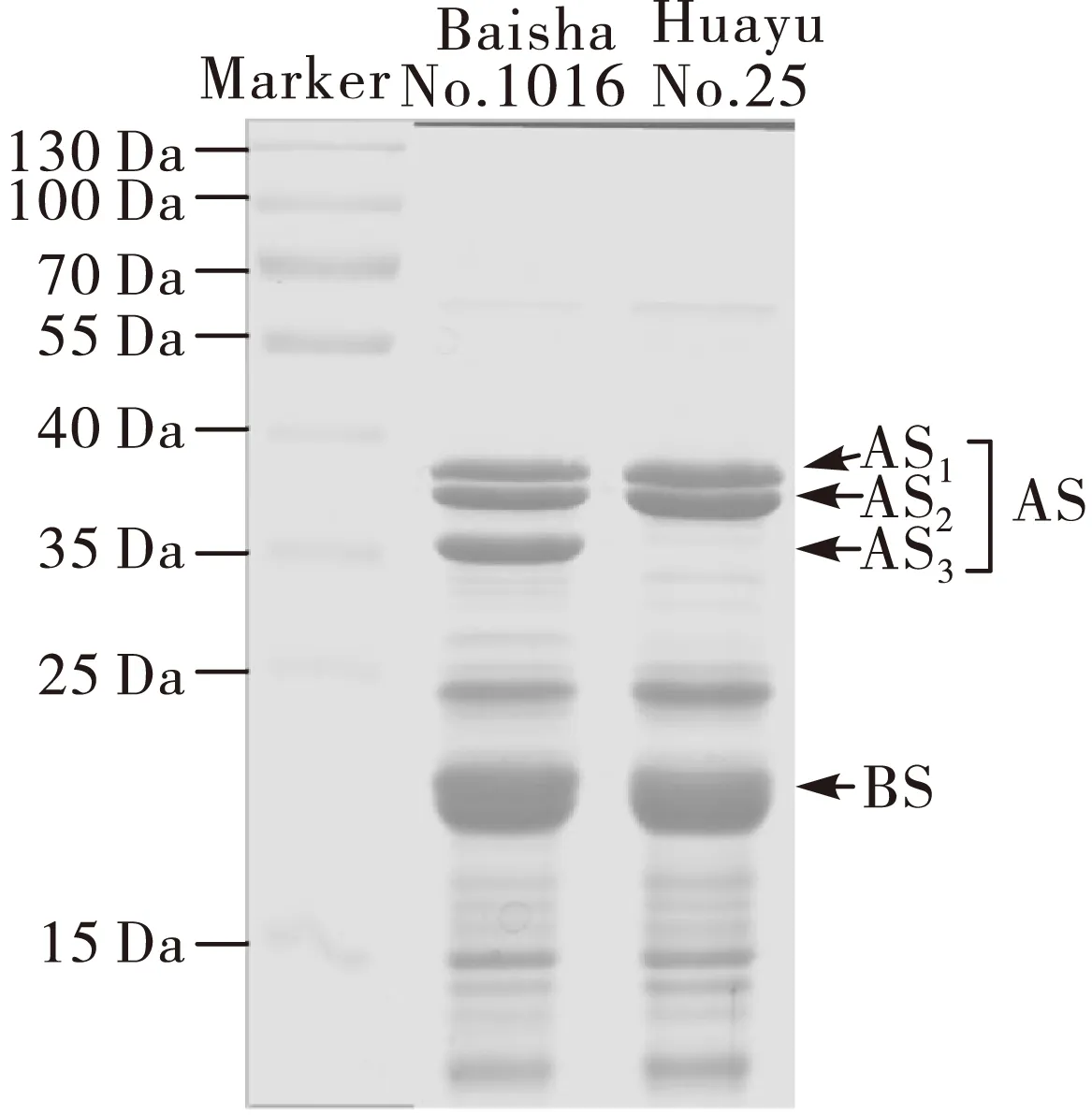
注:AS.酸性亚基;BS.碱性亚基。 图1 不同花生品种的SDS-PAGE图谱 表1 缺失和未缺失花生球蛋白相对分子质量分布
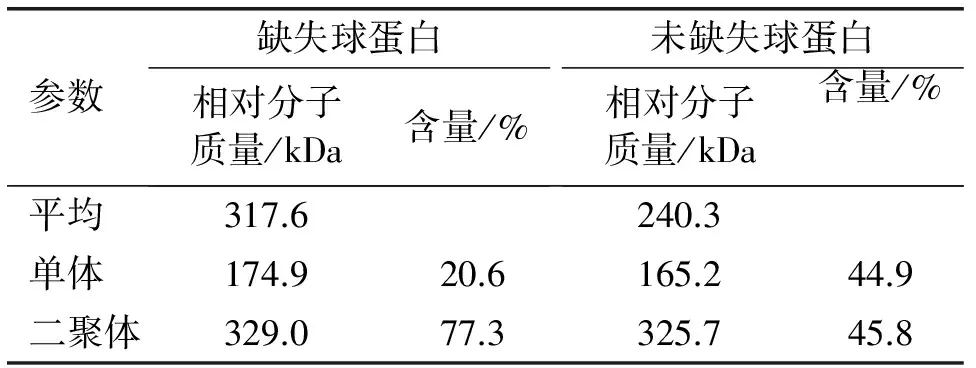
参数缺失球蛋白相对分子质量/kDa含量/%未缺失球蛋白相对分子质量/kDa含量/%平均317.6240.3单体174.920.6165.244.9二聚体329.077.3325.745.8
由图1可知,未缺失花生球蛋白含有全部亚基条带(AS1,AS2,AS3,BS),而缺失花生球蛋白只含有3个条带(AS1,AS2,BS),缺少AS3条带,即缺失35.5 kDa亚基。Liang等[3]和Shokraii等[5]已分别报道了AS3条带的缺失。由表1可知,花生球蛋白存在单体(monomar)和二聚体(dimer)形式,且相对分子质量与Yamada等[12]和Bhushan等[13]所报道基本一致。缺失和未缺失花生球蛋白在分子组成上存在明显差异。缺失花生球蛋白平均相对分子质量远大于未缺失花生球蛋白;缺失和未缺失花生球蛋白中单体和二聚体比例不同,缺失花生球蛋白主要以二聚体形式存在,而在未缺失花生球蛋白中二者比例相差不大。
2.2 亚基缺失对花生球蛋白热特性影响
缺失和未缺失花生球蛋白DSC参数见表2。
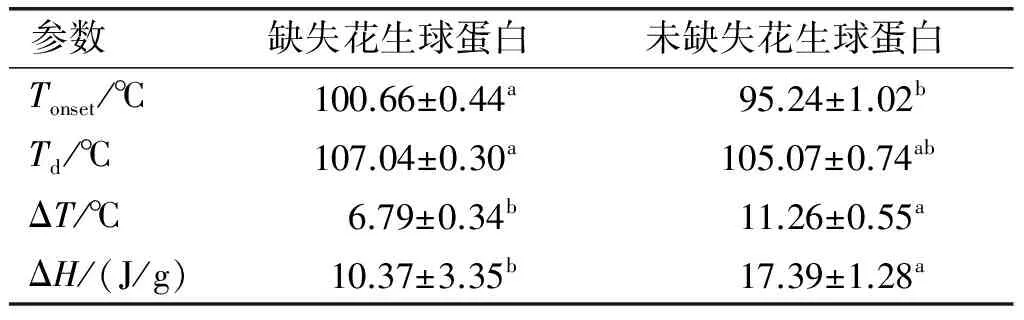
表2 缺失和未缺失花生球蛋白DSC参数
由表2可知,未缺失花生球蛋白初始变性温度(Tonset)为95.24℃,缺失花生球蛋白则为100.66℃,说明相比于缺失花生球蛋白,未缺失花生球蛋白更易发生热变性[14]。缺失花生球蛋白热变性温度(Td107.04℃)和未缺失花生球蛋白(105.07℃)在0.05水平上差异并不显著,但该结果趋势同Tonset结果一致。变性焓值(ΔH)在一定程度上代表了一种蛋白质有序结构的含量,蛋白质结构越有序,ΔH越高,在热处理前非变性蛋白质所占比例越大,ΔH也越高[15]。未缺失花生球蛋白的ΔH(17.39 J/g)显著高于缺失的(10.37 J/g),表明未缺失品种热变性所需要外界提供的能量更高,其蛋白质的有序程度高于缺失花生球蛋白。半峰宽(ΔT)主要反映蛋白质在热变性过程中的协同性[16],未缺失花生球蛋白的半峰宽显著高于缺失的,表明35.5 kDa亚基缺失导致花生球蛋白在较窄的温度范围内达到完全变性,变性协同性增强。
2.3 亚基缺失对花生球蛋白的加热溶解性影响(见图2)
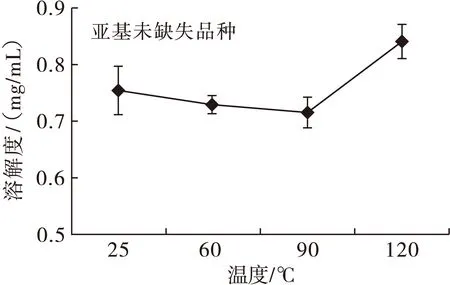
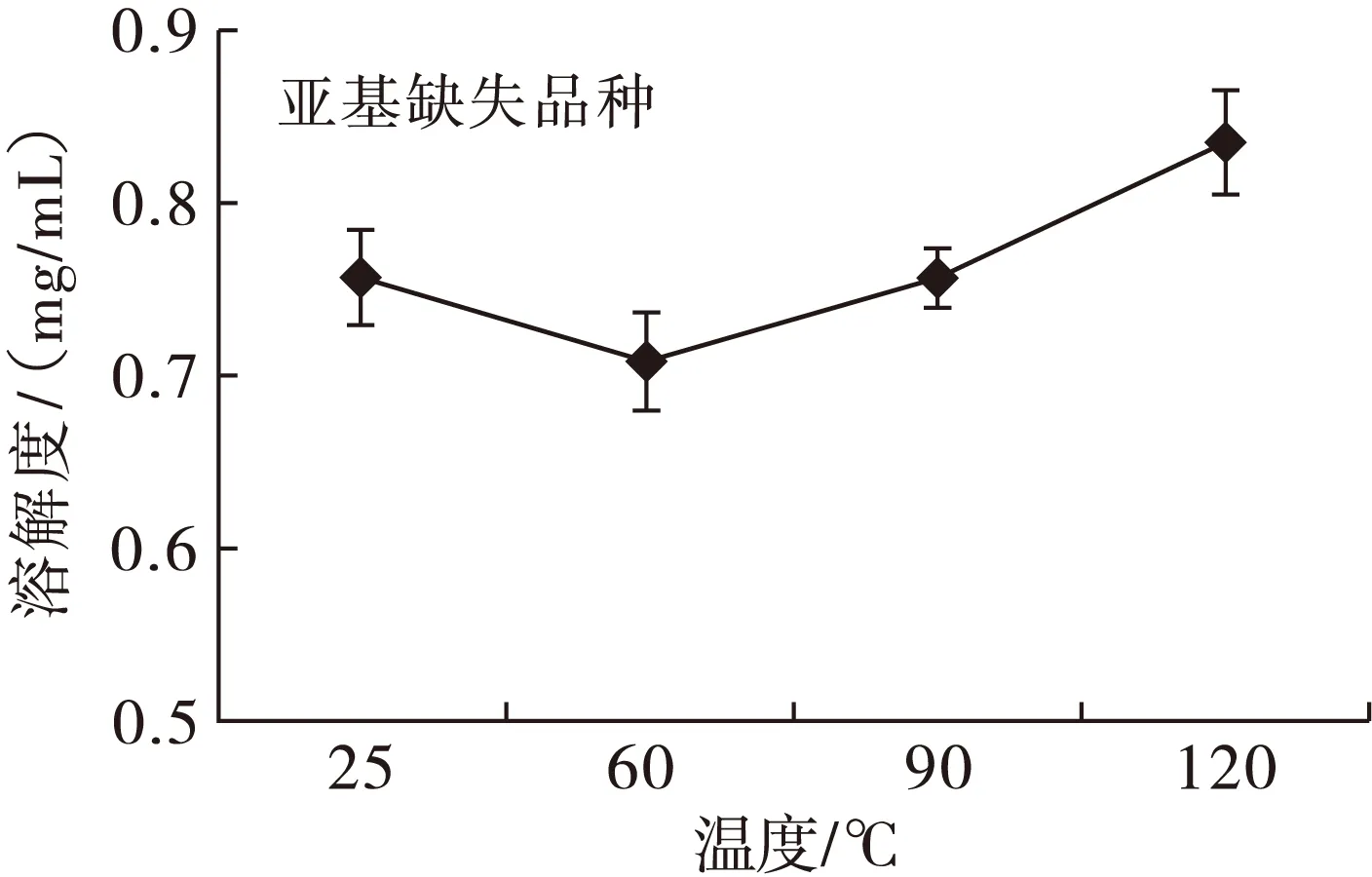
图2 亚基未缺失和缺失品种加热溶解性
由图2可知,对于缺失品种,60℃溶解度最低,90℃溶解度略有上升;对于未缺失品种,60℃和90℃均会导致溶解度下降,溶液浊度明显上升。在120℃,亚基缺失和未缺失花生球蛋白溶解度均出现较明显上升,这与王金梅[17]发现喷射蒸煮(120℃)可以导致热变性蛋白质增溶的结果相一致。有聚集体生成,蛋白质粒径增大,导致溶解度下降,说明在60℃和90℃热处理均能导致花生球蛋白发生热聚集。同时由DSC结果(见表2)得知,花生球蛋白的初始变性温度均大于95℃,因此推断:低于95℃热处理,蛋白质发生非变性聚集;而120℃热处理,蛋白质聚集则为变性聚集。
2.4 亚基缺失对花生球蛋白加热蛋白组成影响
球蛋白热处理的电泳结果见图3。从热处理温度角度,60℃加热处理并不会对球蛋白的变性/非变性SDS-PAGE结果产生影响,图谱的条带没有增加或消减,而在图2中表明该热处理条件下会导致浊度增加和溶解度降低,因此有一定的可溶性聚集体产生,可以被SDS解聚,说明该聚集行为为非共价性作用力作用,主要由疏水相互作用所主导[18]。在90℃热处理条件下,可在胶的顶端观察到明显的条带产生,同时52 kDa条带消失(或变浅),但在加入β-ME的SDS-PAGE图谱上,90℃热处理和25℃处理并无差异,说明在非变性胶顶端生成的大分子聚集和46 kDa条带是由于二硫键作用形成的共价聚集,可以通过还原剂打断共价连接。在120℃的热处理条件下,非变性电泳原条带基本消失,在胶顶端出现条带,意味着大聚集体生成,经过β-ME处理后,部分还原成原有亚基条带,说明该聚集也是由于二硫键而生成;同时泳道小相对分子质量(<24 kDa)部分出现颜色加深,推测可能是由于120℃处理强度大,导致部分蛋白质分子肽链发生断裂,生成系列小分子物质。无论是90℃还是120℃热处理,未缺失花生球蛋白胶顶端的不溶性聚集体明显多于缺失的花生球蛋白。
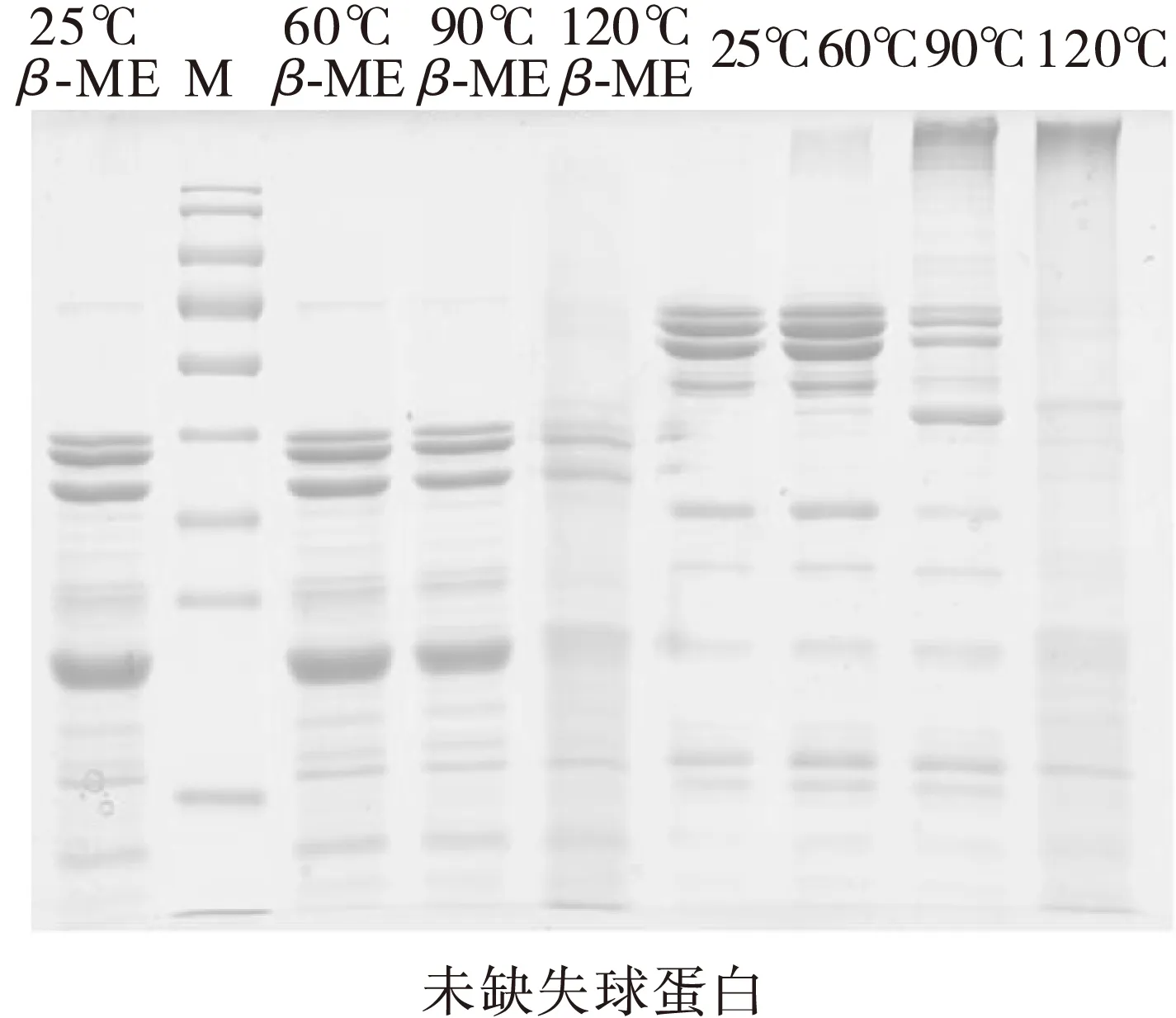
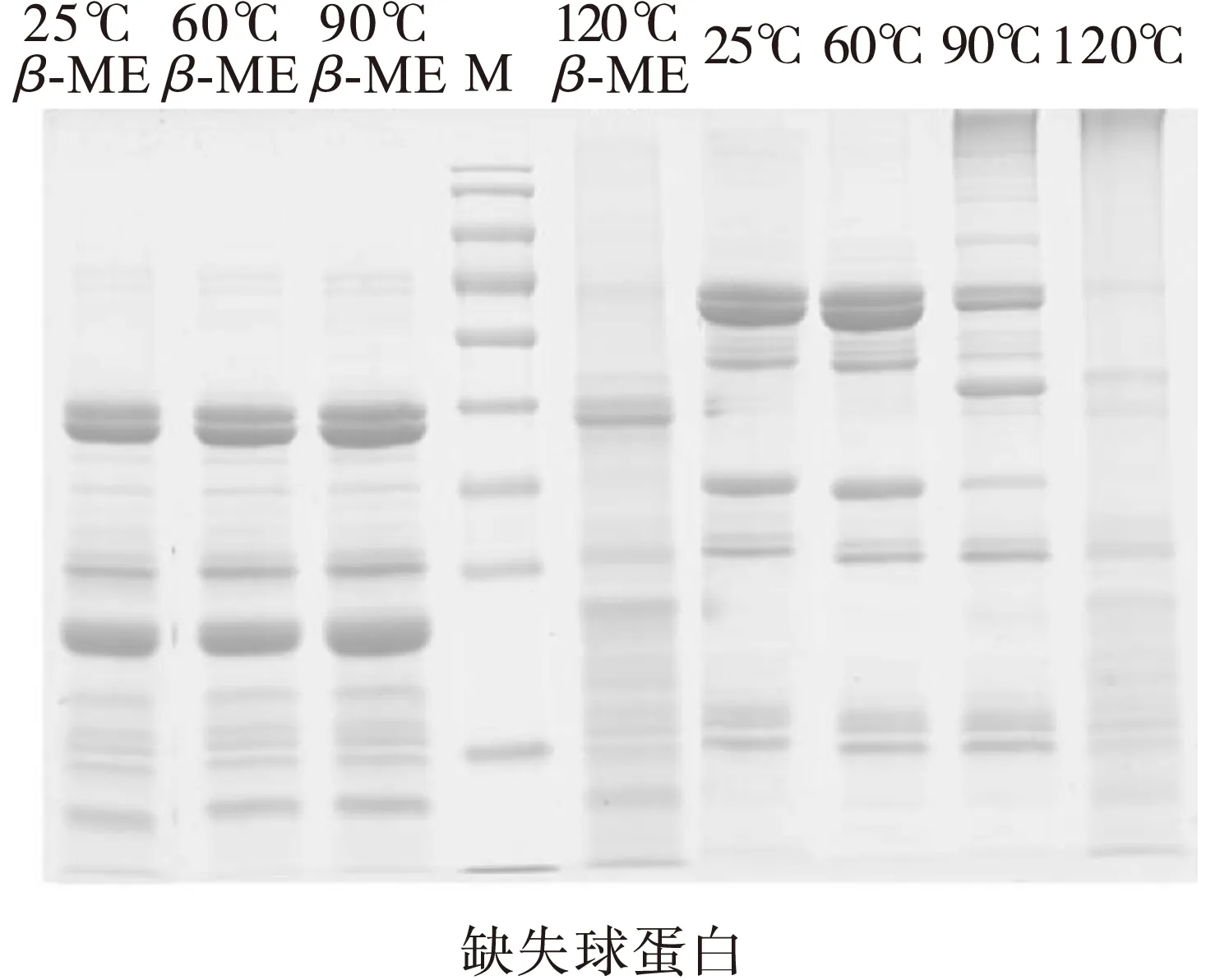
注:M.Marker,相对分子质量从上到下依次为130、100、70、55、40、35、25、15、10 kDa;β-ME.添加β-巯基乙醇。
图3 不同加热条件下未缺失和缺失花生球蛋白SDS-PAGE图谱
2.5 亚基缺失对花生球蛋白受热流体回转半径影响(见图4)
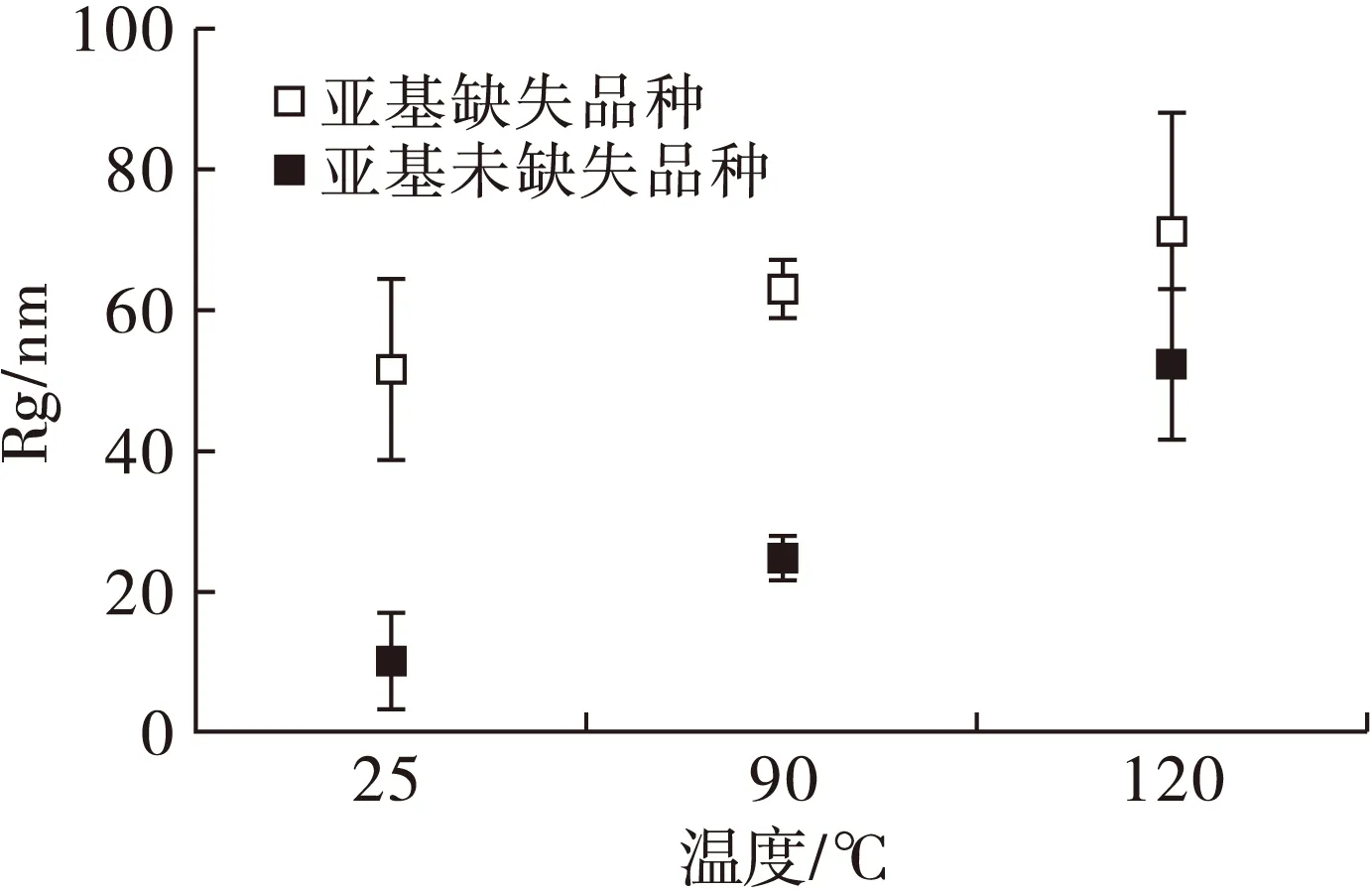
图4 亚基缺失和未缺失花生球蛋白在不同 加热温度下的回转半径
由图4可知,在25℃下缺失花生球蛋白的回转半径(Rg)显著高于未缺失花生球蛋白,表明常温条件下缺失球蛋白的结构相较于未缺失花生球蛋白结构更加松散;当温度升高时,缺失花生球蛋白和未缺失花生球蛋白的Rg均发生不同程度增大,说明在加热过程中,花生球蛋白结构不同程度展开,结构更加松散,且缺失花生球蛋白结构相对于未缺失花生球蛋白结构更加伸展,更利于聚集行为的发生。
3 结 论
本文采用自然变异花生品种作为实验材料分离纯化得到花生球蛋白,明确了两类蛋白质相对分子质量分布及受热行为特征,并阐释了亚基缺失与热行为两者间的关系。得出以下结论:
(1)亚基缺失花生球蛋白主要以二聚体形式存在;亚基未缺失花生球蛋白的二聚体和单体两种形式均存在。
(2)亚基未缺失花生球蛋白初始变性温度和热变性温度均低于亚基缺失花生球蛋白,表明未缺失花生球蛋白更易发生热变性;但未缺失花生球蛋白变性焓值和半峰宽均大于缺失花生球蛋白,表明在升温变性过程中未缺失花生球蛋白需要外界提供更大的能量才能导致完全变性,变性协同性更差。
(3)亚基缺失和未缺失花生球蛋白在60℃加热过程中可形成可溶性聚集体,主要为次级键作用;而在90℃热处理可形成共价聚集,主要是由于二硫键共价作用产生;120℃热处理可共价形成不可逆聚集体,同时高温高压作用下肽链断裂生成一系列小分子物质,其不溶性聚集体由共价诱导聚集和化学降解诱导聚集共同作用。
(4)加热过程会造成花生球蛋白分子结构松散,但整体未缺失花生球蛋白分子结构更加紧密。
[1] 王丽,王强,刘红芝,等. 花生加工特性与品质评价研究进展[J]. 中国粮油学报,2011,26(10):122-128.
[2] 徐飞,刘丽,石爱民,等. 亚基水平上花生蛋白组成、结构和功能性质研究进展[J]. 食品科学,2016,37(7):264-269.
[3] LIANG X Q, LUO M, HOLBROOK C C, et al. Storage protein profiles in Spanish and runner market type peanuts and potential markers[J]. BMC Plant Biol, 2006, 6: 24.
[4] 杜寅. 花生蛋白主要组分的制备及凝胶特性研究[D]. 北京:中国农业科学院,2012.
[5] SHOKRAII E H, ESEN A, MOZINGO R W. Relation of a 36,000-dalton arachin subunit to blanchability in peanuts (ArachishypogaeaL.)[J]. J Agric Food Chem, 1985, 33(6): 1114-1116.
[6] 涂宗财,汪菁琴,刘成梅,等. 动态超高压均质制备纳米级蛋白及其功能特性的研究[J]. 食品工业科技,2007,28(2):89-91,95.
[7] 迟玉杰,鲍志杰,程缘. 蛋清蛋白质热处理改性及其热聚集行为的研究进展[J]. 食品安全质量检测学报,2014,5(11):3951-3954.
[8] 袁德保,李芬芳,杨晓泉,等. 大豆蛋白的热处理改性及热聚集行为研究进展[J]. 现代食品科技,2012,28(12):1829-1833,1838.
[9] 王长远,郝天舒,张敏. 干热处理对米糠蛋白结构与功能特性的影响[J]. 食品科学,2015,36(7):13-18.
[10] FENG X L, LIU H Z, SHI A M, et al. Effects of transglutaminase catalyzed crosslinking on physicochemical characteristics of arachin and conarachin-rich peanut protein fractions[J]. Food Res Int, 2014, 62: 84-90.
[11] LIU Y, ZHAO G, ZHAO M, et al. Improvement of functional properties of peanut protein isolate by conjugation with dextran through Maillard reaction[J]. Food Chem, 2012, 131(3): 901-906.
[12] YAMADA T, AIBARA S, MORITA Y. Dissociation-association behavior of arachin between dimeric and monomeric forms[J]. Agric Biol Chem, 1979, 43(12): 2549-2556.
[13] BHUSHAN R, AGARWAL R. Investigation of arachin and its molecular species[J]. Proc Natl Acad Sci India Sect A-Phys Sci,2007,77:71-77.
[14] TANG C H, SUN X, YIN S W. Physicochemical, functional and structural properties of vicilin-rich protein isolates from threePhaseoluslegumes: effect of heat treatment[J]. Food Hydrocoll, 2009, 23(7): 1771-1778.
[15] CHOI S M, MINE Y, MA C Y. Characterization of heat-induced aggregates of globulin from common buckwheat (FagopyrumesculentumMoench)[J]. Int J Biol Macromol, 2006, 39(4): 201-209.
[16] YIN S W , TANG C H, CAO J S, et al. Effects of limited enzymatic hydrolysis with trypsin on the functional properties of hemp (CannabissativaL.) protein isolate [J]. Food Chem, 2008, 106: 1004-1013.
[17] 王金梅. 大豆蛋白热聚集行为及界面、乳化性质研究[D].广州:华南理工大学,2012.
[18] CHANDRA B R S, PRAKASH V, RAO M S N. Association-dissociation of glycinin in urea, guanidine hydrochloride and sodium dodecyl sulphate solutions[J]. J Biosci, 1985, 9(3/4): 177-184.
Effect of 35.5 kDa subunit lacking on heating behavior of arachin
XU Fei, LIU Li, SHI Aimin, LIU Hongzhi, YANG Ying,HU Hui, WANG Qiang
(Key Laboratory of Agro-Products Processing, Ministry of Agriculture,Institute of Agro-Food Science and Technology, Chinese Academy of Agricultural Sciences, Beijing 100193, China)
The relative molecular weight distribution, thermal stability, heat-induced aggregation and radius of gyration of 35.5 kDa subunit lacking arachin were compared with those of normal arachin to study the effect of 35.5 kDa subunit lacking on heating behavior of arachin. The results showed that different molecular species existed in the 35.5 kDa subunit lacking arachin. The lacking of 35.5 kDa subunit could increase thermal stability and denature-cooperativity of arachin. Soluble aggregation formed at 60℃ in subunit lacking and normal arachin, while covalent aggregation formed at 90℃and 120℃. Heat treatment could lead to a looseness of arachin molecular structure and that of subunit lacking arachin was much more loosen than that of normal arachin.The study could provide the basis for screening protein which was suit for heating and the guidance for directed regulation in thermal processing.
arachin; subunit lacking; relative molecular weight distribution; thermal stability; heat-induced aggregation
2016-04-10;
2016-10-12
中国农业科学院科技创新工程(CAAS-ASTIP-201X-IAPPST);公益性(农业)行业科研专项(201303072);粮食公益性行业科研专项(HY15138713)
徐 飞(1989),女,硕士,研究方向为食品科学(E-mail)love_faith@163.com。
王 强,研究员,博士生导师(E-mail)wangqiang06@caas.cn。
TS222;TQ936.2
A
1003-7969(2017)01-0084-05
