中医药调控心衰细胞PKC信号通路的现状及思考*
2017-01-11薛一涛焦华琛刘鹏刘广志陈炜崔文竹
薛一涛焦华琛刘 鹏刘广志陈 炜崔文竹
(1.山东中医药大学附属医院,山东 济南 250000;2.山东中医药大学,山东 济南 250000)
·综 述·
中医药调控心衰细胞PKC信号通路的现状及思考*
薛一涛1焦华琛1刘 鹏2刘广志2陈 炜2崔文竹2
(1.山东中医药大学附属医院,山东 济南 250000;2.山东中医药大学,山东 济南 250000)
近年来,随着对疾病发生发展机制研究的不断深入,中医药对于心衰的临床研究已经从单纯的临床观察,证型分类,逐渐深入到中医药对于细胞分子生物学影响的研究上。DAG/PKC信号转导通路在细胞内信号调控网络中具有重要作用,是参与细胞生长、增殖、分裂调控的重要信号通路之一。当发生心衰时会不同程度地刺激细胞内PKC信号通路的表达,激活心脏的肥大信号传导加重心衰。
中医药 PKC 信号通路 心衰
心力衰竭(CHF)是指各种心脏结构或功能性疾病导致心室充盈及(或)射血能力受损而引起的一组综合征[1]。目前认为多种因素参与了心衰的发生发展,如神经内分泌学说、细胞凋亡学说、细胞信号通路等。随着研究的不断深入,发现PKC信号通路的过度激活影响着心肌重构加重心衰,但现有研究证据表明PKC信号通路抑制剂多为非特异性,且副作用大,而特异性PKC信号通路抑制剂尚在研究中,且迄今无成功应用到临床的先例。故应用中药来干预PKC信号通路的研究正在逐步展开,并且近年来显示出独特的优势并取得了一定成果。现综述如下。
1 PKC信号转导途径结构、激活、表达
1.1 PKC结构 PKC家族丝/苏氨酸激酶的原型被Nishizuka等在1977年首次发现。PKC参与了大量细胞功能和信号转导系统,调控细胞的增殖、分化和细胞死亡。其由一条肽链组成[2],相对分子质量在80~90 kDa之间,按分子结构分为保守区和可变区,按功能分为调节区和催化区 。目前已发现12种PKC的同工酶,根据其结构特点和辅因子不同可大致分为3类[3](见图1):1)对Ca2+和DAG两者均敏感的经典型PKC(cPKC),包括α、βI、βII、γ,依赖磷脂酰丝氨酸(PS)、Ca2+、DAG或其类似物佛波酯(PMA)激活;2)对Ca2+不敏感而对DAG敏感的新型PKC(novel,nPKCs),由δ、ε、η、和θ组成,激活只依赖DAG,不需要Ca2+参与;3)对Ca2+和DAG均不敏感的非典型PKC(atypical aPKCs),由ξ、ι、λ组成,需磷脂类物质激活而不依赖Ca2+、DAG及PMA[4]。
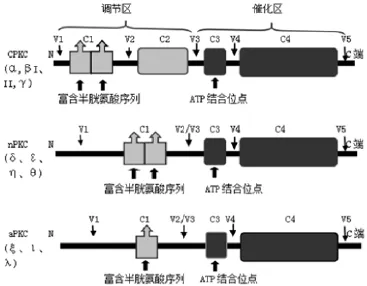
图1 PKC结构简图
1.2 PKC信号通路的激活表达 在生理状态下PKC主要是由DAG激活[5-6]。它可直接激活PKC,DAG与被激活的PKC的C1位结合,C2位与磷脂酰丝氨酸结合后转位到细胞膜,在膜磷脂的作用下,构象发生改变,PDK1磷酸化PKC苏氨酸位点来使PKC的处于激活构象[7]。此时酶被激活,从而细胞内生物信息的代谢,调节基因表达、影响细胞周期和细胞凋亡、控制神经传导等[8]。然而由PLC催化水解产生的DAG会迅速被代谢掉,用来维持PKC长期效应DAG主要由PLC催化质膜上的磷脂酰胆碱断裂产生[9]。上述激活过程通常是可逆的。PKC激活后还需要进一步转位与蛋白激酶C受体(RACKS)等结合来发挥催化作用[10]。每个PKC亚型都有自己的特定RACK序列。此过程可能使PKC处于持续激活状态,产生长期细胞反应[11]。PKCδ的激活与细胞周期的抑制作用有关,是介导促凋亡信号通路的重要亚型[12]。

图2 DAG/PKC信号通路激活过程
2 中药对心衰细胞PKC的影响
已有研究证实,单味中药及其提取物(如黄芪提取液、人参皂苷、姜黄素[12]等)及一些中药复方(益气活血复方、葶苈生脉方、参元丹)对PKC信号通路有良好的抑制作用,能够提高胞液PKC信号通路活性,降低胞膜PKC信号通路活性,使胞液与胞膜PKC活性比显著提高,抑制PKC基因过度表达,预防心室重构。
2.1 单味中药对心衰细胞PKC的影响 近来诸多学者广泛开展单味中药提取物对心衰细胞中PKC信号通路影响的研究,并探讨其发生机制,发现单味中药及其提取物能够通过抑制心肌细胞中PKC各种亚型的过量表达,来改善因药物及缺血造成的心肌细胞损伤,效果显著。在充血性心力衰竭中,分布在膜、核-细胞骨架部分的ε、β1和β2-PKC活性明显增加[13]。在扩张性心肌病和缺血性心肌病引起的心衰中α、β1和β2-PKC活性提高,ε-PKC未见明显改变[14]。抑制α-PKC其能够增加心肌收缩力并防止心肌梗死后心力衰竭的发生[15]。β2-PKC参与心衰与心室肥厚的发病中[16-17]。Ferreir等亦发现在人和实验动物中都发现心肌细胞发生衰竭时β2-PKC活性显著增加[18]。β2-PKC选择性抑制剂能够抑制病理性心脏重构,改善心衰大鼠心脏射血分数,保护心脏的功能[19]。目前基本证实β2-PKC参与心肌肥厚与心衰过程。过去普遍认为ε-PKC参与心肌缺血预处理中心肌保护作用的调节。然而,最近研究表明ε-PKC还参与心室增厚与心衰的发病[20],在心力衰竭进展中ε-PKC与心肌增厚、β2-PKC与心衰有关。如孙宇田等采用结扎左冠状动脉前降支(LAD)的方法建立心肌梗死后心室重塑模型,将术后24 h存活的36只大鼠分为假手术组 (给予生理盐水2 mL/d腹腔注射)、模型组(给予生理盐水2 mL/d腹腔注射)和黄芪治疗组(给予黄芪注射液6 g/d,即2 mL/d腹腔注射)。6周后采用Western bloting法检测心肌细胞中PKCα和PKCε的表达水平,发现黄芪注射液梗死后大鼠的心室重塑具有改善作用,其机制可能通过上调PKCε、抑制PKCα表达而实现的[21]。张英妮通过Langendorff离体灌流装置,观察离体心脏在排除神经、体液因素影响的条件下人参皂苷对阿霉素造成的心肌损伤的保护作用,采用RT-PCR对PKC mRNA序列检测,继而使用Western Blot方法对其蛋白表达进行检测,最终得出阿霉素对心肌毒性作用主要表现在使心肌细胞内PKC信号通路介导的钙离子超负载,造成心肌细胞内原钙离子的动态平衡被打乱造成心肌损伤,长期作用导致心衰。而人参皂苷对损伤的心肌细胞具有保护作用,并且首次证明了人参二醇皂苷单体Rb1对由阿霉素造成的心肌毒性损伤具有良好的保护[22]。杨竞发现白藜芦醇(Res)对链脲佐菌素(STZ)所致糖尿病心肌病的PKC-β2的表达具有抑制作用[23]。陈炬发现白屈菜红碱 (是传统天然药用植物白屈菜的主要有效成分之)能够抑制高糖诱导的乳鼠心肌细胞形态和功能的改变,并且抑制PKC-α、PKC-β2的表达和活性,对高糖环境中的心肌细胞具有保护作用。与正常心肌细胞比较,心衰肌细胞中PKC的活性明显增加[24]。
2.2 中药复方对心衰细胞PKC的影响 同样研究者通过对临床治疗心衰的经验效方进行深入研究发现,中药组方能够下调PKC水平影响其传导通路,以此来改善和纠正心衰。研究中药组方主要集中在益气、温阳[25]、活血方面。如张艳采用结扎健康雄性SD大鼠冠状动脉配合饥饿、游泳等方法造成慢性心衰的动物模型,采用ABC免疫组化方法测定心肌组织中AngⅡ和PKC的含量。结果显示采用益气活血复方(黄芪40 g,人参15 g,红花15 g,丹参15 g,三七5 g,益母草20 g组成)干预的慢性心衰大鼠心肌组织血管紧张素Ⅱ(AngⅡ)和蛋白激酶C(PKC)表达量降低,说明益气活血复方可能通过降低AngⅡ水平达到抑制RAS系统作用,下调PKC水平影响其传导通路,以此来改善和纠正心衰[26]。周桦等研究益气温阳的葶苈生脉方(红参、葶苈子、五味子、麦冬、赤芍、生黄芪、益母草、丹参、红花组成)对心衰大鼠心肌细胞中AT1受体及PKC的影响。以免疫组化法观察心肌组织中AT1受体和传导因子PKC的表达,发现葶苈生脉方可以下调心肌组织中AT1与PKC受体的表达,抑制RAS系统的过度激活,以达到抗心力衰竭的作用[27]。尚菊菊等应用免疫组化法观察PKC及HSP70表达,发现参元丹(党参、元参、丹参、地龙、土元、水蛙、元胡组成)能够代替心绞痛的缺血、缺氧的刺激,减小心肌梗死面积,具有心脏保护作用。在假性缺血预处理组的心肌组织中偶见微弱的一处表达。缺血预处理组和药物预处理+缺血预处理组的大鼠心肌组织中PKC大量的表达,药物预处理组大鼠心肌组织的PKC表达充分,提示PKC在参元丹的药理性预适应样心肌保护过程中起作用[28]。王峰同样也发现芪桂益脉灵[黄茂、桂枝、党参、五味子、炒枣仁苦参、三七(单包)、黄连、龙齿等十味中药组成]能够提高细胞膜上蛋白激酶C的活性表达,对大鼠心肌缺血再灌注损伤具有保护作用[29]。PKC过度表达降低了心肌收缩功能,导致了心肌肥厚和心力衰竭[30]。在心肌肥厚形成过程中总ε-PKC量增高,过渡为慢性心衰后总PKC显著减少,PKC抑制剂干预后,PKC趋于恢复正常水平,提示PKC活性增强能促进心肌肥厚的形成,PKC具有刺激“生理性”生长的潜力、维持心肌收缩功能的作用,而在心衰进展中PKC可能起负向调节和保护心脏的作用[31]。
综上研究表明,单味中药及其提取物对心肌细胞损伤确实有改善作用,研究者对于各药物及组方的作用机制也有相应的分析、讨论,通过事实证明中药可以直接或间接抑制心肌细胞中PKC信号通路的表达,与PKC抑制剂的理论符合。例如:灯盏花素(Scutellarin)是一个非竞争性蛋白激酶C抑制剂[32],可抑制心肌细胞的Ca2+内流,同时开放心室肌细胞的K+通道,促进K+外流,心肌细胞产生负性肌力作用,减慢心率,同时可以抑制基因Caspase-3 mRNA的表达,在心肌缺血-再灌注过程中保护心肌细胞。并且有扩张血管、增加血流量、降低外周血管阻力、对抗垂体后叶素所致的心肌缺血缺氧等多种作用。
3 结语与展望
PKC信号通路与心衰的发生发展有着千丝万缕的联系,研究PKC信号通路与心衰的相互联系目的在于临床应用PKC抑制剂来防治心衰。目前,对PKC信号通路抑制剂的研究取得一定的进展,研究也在不断深入。但特异性PKC信号通路抑制剂的研究尚在实验验证中,非特异性PKC抑制剂副作用大[33],使得长期研究、应用PKC抑制剂受到限制。相比之下,中医学有着自己独特的医疗体系,立足于整体观念,采用辨证论治的方法对机体进行系统全面的调节,来维持人体阴阳平衡。随着中医学对于心衰的不断认识,对心力衰竭的研究已经从单纯的临床观察,证型分类,逐渐深入到中医药对于细胞分子生物学影响的的研究上,发现中医药能够正向影响心衰心肌细胞中分子机制。
心力衰竭的发生发展是一个繁杂的过程,有多种细胞信道转导途径协同参与,各种信号途径之间存在交互联系,互相影响,各种信号通路之间是如何影响的,是否所有通路可以共同组成一个大的通路来作用于心力衰竭的发病中,有待于深入研究。我们要应用日新月异发展的现代化血管病学理论和技术,继承开发和研究有效的传统医学理论和经验,以提高临床医疗水平和科学技术水平,融入世界医药学。
[1] 中华医学会心血管病学分会,中华心血管病杂志编辑委员会.慢性心力衰竭诊断治疗指南[J].中华心血管病杂志,2007,36(12):1076-1095.
[2] Azzi A,Boscoboinik D,Hensey C.The protein kinase C family[J].Eur J Biochem 1992,208(3):547-557.
[3] Koya D.Dual protein kinase C alpha and beta inhibitors and diabetic;kidney disease:a revisited therapeutic;target for future clinical trials[J].Diabet Investig,2014,5(2):47-48.
[4] Steinberg SF,Goldberg M.Rybin V0.Protein kinase C isoform diversity in the heart[J].J Mol Cell Cardiol,1995,27:141.
[5] Rosen DM,Das K,Grimes KV.Protein kinase C,an elusive therapeutic;target[J].Nat Rev Drug Discov,2012,11(12):937-957.
[6] Way KJ,Katai N,King GL.Protein kinase C and the development of diabetic;vascular complivations[J].Diabet Med,2001,18(12):941-959.
[7] Bynagari-Settipalli YS,Chari R,Kilpatrick L,et al.Protein kinase C-possible therapeutic target to treat cardiovascular diseases[J].Cardiovasc Hematol Disord Drug Targets,2010,10(4):292-308.
[8] Zheng H,Liu,J,Liu C,et al.Calcium-sensing receptor activating phosphorylation of PKC delta translocation on mitochondria to induce cardiomyocyte apoptosis during ischemia/ reperfusion[J].Molecular and Cellular Biochemistry,2011,358(1-2):335-343.
[9] 何华.心肌肥厚、肥厚-逆转和慢性心力衰竭心肌中PKCε信号复合物的蛋白质组学研究[J].中国协和医科大学,2006,48(9):101-102.
[10]陈文政,柏树令.蛋白激酶C(PKC)与心衰[J].解剖科学进展,2001,7(2):141.
[11]孙宇田,刘聪聪,徐萌,等.黄芪对心肌梗死后大鼠心室重塑的改善作用及其对蛋白激酶C表达的影响[J].吉林大学学报,2015,41(4):769-773.
[12]Zheng H,Liu,J,Liu C,et al.Calcium-sensing receptor activating phosphorylation of PKC delta translocation on mitochondria to induce cardiomyocyte apoptosis during ischemia/ reperfusion[J].Molecular and Cellular Biochemistry,2011,358(1-2):335-343.
[13]Gu X,Sanford PB.Increased protein kinase C and isozyme redistribution in pressure-oberbad cardiac hypertrophy in the rat[J].Circ Res,1994,75:926.
[14]Nancy B,Richard A,Walsh MD,et al.Increased protein kinase C activity and expression of Ca2+-senditive isoforms in failing human heart[J].Circulation,1999,26(3):384
[15]Hambleton M,York A,Sargent MA,et al.lnducible and myocytespecific inhibition of 1PKCalpha enhances cardiac contractility and protests against infarction-induced heart failure[J].Am J 1Physiol Heart Circ Physiol,2007,293(6):113768-113771
[16]Wakasaki H,Koya D,Schoen FJ,et al.Targeted overexpression of protein kinase C beta 2 isoform in myocardium causes cardiomyopathy [J].Prod Natl Acad Sci USA,1997,94:9320-9325.
[17]Bowling N,Walsh RA,Song G,et al.Increased protein kinase C activity and expression of Ca2+-sensitive isoforms in the failing human heart[J].Circulation,1999,99(3):384-391.
[18] Ferreira JCB,Boer BN,Grinberg M,et al.Protein quality control disruption by PKC beta II in heart failure;rescue by the selective PKC betaⅡInhibitor,betaⅡV5-3[J].PLOS One,2012,7(3):e33175
[19]Palaniyandi SS,Batista Ferreira JC,Brum PC,et al.PKC beta 11 inhibition attenuates myocardial infarction induced heart failure and is associated with a reduction of fibrosis and proinflammatory responses[J],Journal of Cellular and Molecular Medicine,2011,15(8):1769-1777.
[20]Inagaki K,Iwanaga Y,Sarai N,et al.Tissue angiotensin II during progression or ventricular hypertrophy to heart failure in hypertensive rats;differential effects on PKC epsilon and PKC beta[J].J Mel Cell Cardiol,2002,34(10):1377-1385.
[21]孙宇田,刘聪聪,徐萌,等.黄芪对心肌梗死后大鼠心室重塑的改善作用及其对蛋白激酶C表达的影响[J].吉林大学学报:医学版,2015,57(4):76.
[22]张英妮.阿霉素导致大鼠心肌钙紊乱损伤及人参皂甙Rb1单体对其的保护作用[D].长春:东北师范大学,2008.
[23]杨竞.白藜芦醇抗糖尿病心肌病心肌纤维化作用及机制研究[D].遵义:遵义医学院,2013.
[24]陈炬,张文斌,王敏,等.白屈菜红碱对高糖培养的乳鼠心肌细胞形态和功能的影响[J].浙江医学,2009,31(8):42.
[25]杨学伟,郭云良,崇卓,等.四逆汤(附子、干姜、甘草)对肾血管性高血压大鼠血压调节作用的实验研究[J].中华高血压杂志,2007,15(3):206-209.
[26]张艳,杨硕,庞敏,等.益气活血复方对慢性心衰大鼠心肌组织AngⅡ及PKC的影响[J].中华中医药杂志,2008,23(11):999-1001.
[27]郭秋红,彭雪梅,赵淑明,等.葶苈生脉方对心衰大鼠AngⅡ及其受体信号传导的影响[J].中药新药与临床药理,2010,21(3):260-262.
[28]尚菊菊,李爱勇,杨洪志,等.参元丹药理预适应对大鼠缺血再灌注心肌梗死面积、蛋白激酶C及热休克蛋白70的影响[J].中华中医药杂志,2011,126(8):1730-1733.
[29]王峰.芪桂益脉灵对急性缺血再灌注大鼠心肌细胞蛋白激酶C的影响[D].哈尔滨:黑龙江中医药大学,2009.
[30]高玖鸣,宋昌旭,张军,等.腺病毒介导的心肌蛋白激酶Cε基因转移导致心肌损害[J].中国分子心脏病学杂志,2004,4(4):216-220.
[31]何华,高玖鸣,王文,等.心肌肥厚、肥厚-逆转和慢性心力衰竭心肌中PKε信号复合物的蛋白质组学研究[J].中国医药,2009,4(9):655-658.
[32]周莉.灯盏花素的心脑血管药理及临床研究进展[J].中医药信息,2013,30(6):134-136.
[33]李鑫,董朝侠,蔡兰英,等.中药干预糖尿病鼠肾脏蛋白激酶C信号通路的研究进展[J].中国实验方剂学杂志,2015,21(6):230-234.
R285
A
1004-745X(2016)12-2298-04
10.3969/j.issn.1004-745X.2016.12.027
2015-07-31)
国家自然科学基金项目(81273703)
