唐山地区一种新发番茄病害的病原菌分离与鉴定
2017-01-09张运峰
张运峰
(唐山师范学院生命科学系,河北 唐山 063000)
唐山地区一种新发番茄病害的病原菌分离与鉴定
张运峰
(唐山师范学院生命科学系,河北 唐山 063000)
在唐山地区发现一种危害越来越严重的番茄病害,该病害与文献报道的溃疡病和青枯病类似。对其病原进行分离和鉴定,关系到对该病害的预测预报和防治。从该病害的典型病株上分离获得2种细菌TSK-1和TSK-2,分别接种健康植株,TSK-1能够产生典型症状,TSK-2没有产生致病性。通过形态学鉴定和16S rDNA测序鉴定表明,该病菌为密执安棒形杆菌密执安亚种(Clavibactermichiganensissubsp.michiganensis)。因此,唐山地区的种新发番茄病害为番茄溃疡病,而不是番茄青枯病。该研究结果将为控制该病害的发生起到决定性作用。
番茄溃疡病;病原菌分离;形态学鉴定;16S rDNA测序鉴定
在唐山地区新发生一种病害,该病害危害严重,发病速度快,其症状表现为蒸腾作用较强时植株萎蔫,夜间蒸腾作用较弱时又和正常植株没有明显区别,错过最佳防治时期后,造成大面积枯萎,明显减产甚至绝收,病原细菌可经病残体和病土壤带菌传染,这些症状类似番茄溃疡病和青枯病[1-4]。据报道,番茄溃疡病和番茄青枯病是番茄生产上最为严重的病害,二者最佳防治时期和技术手段不同[5],因此,明确其该病害种类是控制该病害危害的前提。
近年来,分子生物学技术成为快速、准确鉴定微生物的重要方法。16S rDNA 普遍存在于原核生物细胞内, 其序列具有保守性和特异性相结合的特点, 保守区为所有细菌所共有, 细菌间无差异; 可变区在不同细菌之间存在有不同程度的差异, 具有属或种的特异性[6],因此,利用16SrDNA进行未知微生物的鉴定已得到广泛的认可,成为微生物鉴定的一种有效手段。该技术已在放线菌[7]、布鲁氏菌[8]和假单胞菌[9]等微生物鉴定中得到成功的应用,但是单纯的16S rDNA技术存在一定的缺陷,由于进行细菌16S rDNA PCR 的引物通常为细菌通用引物,因此需要致病微生物的纯培养物,在分离菌株初期不能直接进行鉴定。
本试验将在病原菌分离、纯化的基础上,通过回接试验获得符合柯赫法则的病菌菌株,然后利用形态学鉴定和16S rDNA测序鉴定,明确其病害种类,为控制该病害的危害提供依据。
1 材料与方法
1.1 供试材料
番茄病例植株样本取自河北唐山市番茄种植区。
1.2 试剂
齐氏石碳酸复红染液:A 液:碱性复红0.3 g 溶于10 mL 95 %酒精中;B 液:石碳酸5 g 溶于95 mL 蒸馏水中。以上两液混合,摇匀。
革兰氏染色液:①草酸铵结晶紫染液。A 液:结晶紫2 g 溶于20 mL 95 %酒精中;B 液:草酸铵0.8 g 溶于80 mL 蒸馏水中。以上2种液体混合,摇匀。②95 %乙醇;③卢戈氏碘液:将2 g 碘化钾溶解在少量水中,再将1 g 碘片溶解在碘化钾溶液中,待碘全溶后,加水至300 mL。
番红复染液:将配好的10 mL 番红乙醇溶液(2.5 g 番红溶于100 mL 蒸馏水中)与80 mL 蒸馏水混合均匀。
硝酸银鞭毛染色液。A 液:单宁酸5 g;FeCl31.5 g;蒸馏水100 mL;15 %福尔马林1 mL;1 % NaOH 1 mL。B 液:2 g AgNO3溶于100 mL 蒸馏水中;TE 缓冲液(pH8.0):10 mmol/L Tris-HCl,1 mmol/L EDTA。
细菌DNA提取试剂盒和TA克隆试剂盒购自艾萊德试剂公司。PMD-18 T vector 试剂盒购自大连宝生物公司。16S rDNA序列测定由上海生工(BBI)完成,选用的16S rDNA通用引物为16S rDNA-F(5′-GCGAATAAGCCCATATCAA3′)和16S rDNA-R(5′CGTCAGGAGG TCGCTAATA-3′[10]),M13通用引物为M13-R(5′-A GAGTTTGATCCT GGCTCAG3′)和M13-F(5′A AGGAGGTGAT CCAGAAGC-3′)。SDS、乙醇、甘油、蛋白酶K、葡萄糖、MgCl2、平衡酚、氯仿、乙醇、异戊醇等试剂均为国产分析纯。
1.3 番茄发病样本的采集和病原菌分离[11]
取一段约3 cm长的病枝,用无菌超纯水冲洗3次,再用75 %的酒精浸泡消毒30 s,然后用无菌水冲1次;剥去外表皮,将组织团块周边组织切掉,然后将组织置于LB平板上;每个平板放置3块,最后置于30 ℃培养。将病株组织周围出现的菌落进行连续划线和稀释涂布,直到出现单个菌落,挑取单个菌落即得病菌纯培养物。
1.4 病原菌的形态观察
用吕氏美蓝染液对菌体进行简单染色[12];然后用革兰氏染色[13],最后进行鞭毛银染[14]。生物显微镜下观察,Motic images plus2.0软件下拍照。
1.5 致病菌的回接试验鉴定[15]
在花盆中栽种番茄10株,生长株高30 cm。将分离获得的纯培养物接种于LB培养基中,37 ℃震荡培养至OD600=0.5,利用微量注射法将10 μl病原菌液处理植株地面以上3 cm的植株颈部,35 ℃、湿度60 %以上培养。
1.6 细菌DNA的提取和16S rDNA测序
按照细菌DNA 提取试剂盒说明书提取纯培养物的基因组DNA,使用16S rDNA通用引物扩增16S rDNA片段[16],连接到PMD-18T载体中,将30 μl(50 ng/μl)质粒PMD-18T-16SrDNA送生工(上海)有限公司测序。
1.7 TSK-1菌株16S rDNA序列比对
将TSK-1菌株测序获得的16S rDNA序列在GenBank中进行检索和比对,将相似度最高的序列和TSK-116S rDNA序列通过DANMAN软件进行多序列比对分析。
2 结果与分析
2.1 番茄发病植株样本的观察
番茄发病植株初期表现为白天蒸腾作用较强时植株萎蔫,夜间蒸腾作用较弱时植株表现为正常,与正常番茄植株没有明显区别,且番茄植株茎段局部位置出现干皮现象,腋芽位置出现干燥点,腋芽消失;随着病情的发展,番茄植株整株缓慢枯萎,茎段部分维管束部位中空(图 1),初步判断为溃疡病或青枯病菌。
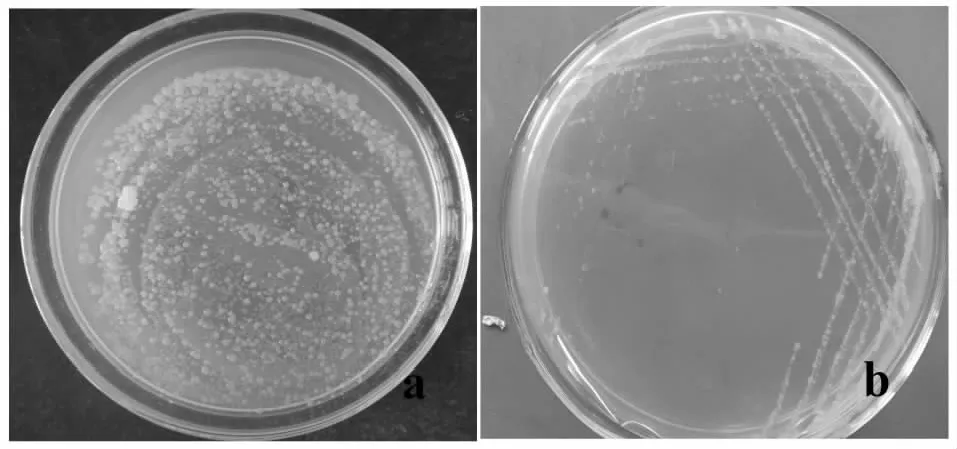
图2 TSK-1菌落(a)、TSK-2菌落(b)形态Fig.2 TSK-1 colony (a), TSK-2 colonies (b)

a: TSK-1侵染植株结果;b: TSK-2侵染植株形态图3 TSK-1(a)和TSK-2(b)分别侵染番茄茎的植株形态 Fig.3 Tomato plant morphology infected by TSK-1 (a) and TSK-2 (b)
2.2 番茄溃疡病病原菌的分离及纯化培养
样本组织接种在LB培养基上,经过培养以后,围绕组织周围出现细菌菌苔,然后将菌苔进行纯化培养,获得2个细菌菌株,TSK-1和TSK-2。,菌落形态特征分别为黄色菌落TSK-1和小型、湿润、粘稠、圆形乳白色菌落TSK-2(图2)。
2.3 病原菌的回接鉴定
利用微量注射法分别在番茄植株上接种TSK-1和TSK-2,然后将接种菌株放置于30 ℃的温室中,湿度控制在80 %以上,接种5 d以后。TSK-1接种的番茄植株接种部位(图4a)和叶柄基部(图4b)均出现明显病斑,并且茎段横向解剖结构显示植株茎段为中空(图4c),纵切面解剖结构显示植株茎段内维管系统变为胶水状(图4d)。而TSK-2接种植株表现为正常,茎段坚挺; TSK-1接种的番茄植株表现为明显的溃疡病症状(图3),因此,确定TSK-1为致病病原菌。由于TSK-1菌株在LB培养基上呈浅黄色,初步推断为溃疡病菌。

a:侵染茎段接种部位;b: 侵染茎段叶芽位置;c:侵染茎段的横切;d:侵染茎段的纵切图4 TSK-1侵染番茄茎的解剖结果Fig.4 Tomato stem growth of canker infection after TSK-1 strain
2.4 TSK-1溃疡病病原菌的形态学鉴定
TSK-1菌株石炭酸复红染色后为无芽孢的弯曲形杆状细菌;经革兰氏染色后呈蓝紫色,鉴定为革兰氏阳性菌。经硝酸银鞭毛染色后不具有鞭毛(图5),这与青枯病菌的具有鞭毛、产芽孢等特征不相符合[17],而符合溃疡病菌的基本态特征。
2.5 TSK-1病原菌的16S rDNA鉴定
利用16SrDNA通用引物,病菌DNA为模板进行PCR扩增,获得1500 bp左右的片段,把该片段连接到载体PMD-18T vector 上,将测得的序列登陆NCBI(http:/ /www. ncbi. nlm. nih. gov/blast)进行Blast比对,其中有1471 bp与Clavibactermichiganensissubsp.michiganensis菌株DSM46364(Access AM410696)的16S rDNA 序列的相似度达99.80 %(图6),由此进一步确定,该病菌为番茄溃疡病病原菌,其病原为密执安棒形杆菌密执安亚种(Clavibactermichiganensissubsp.michiganensis)。
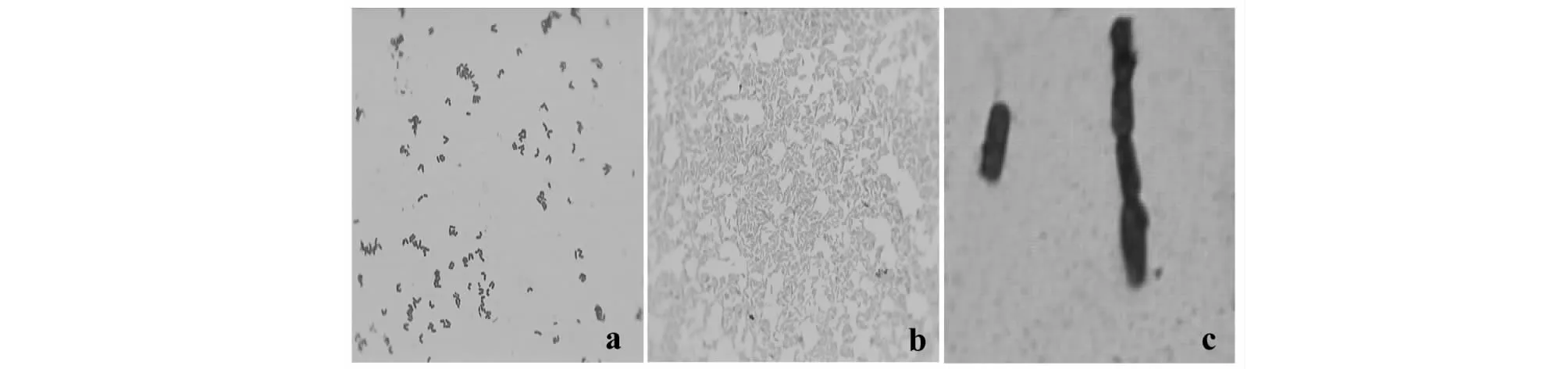
图5 TSK-1齐氏石炭酸复红简单染色制片(a)、革兰氏染色制片(b)和硝酸银鞭毛染色制片(c)Fig.5 TSK-1 Sarkozy′s carbolfuchsin simple staining producer (a) , Gram Films (b) and flagella producer of silver nitrate (c)

图6 试验分离菌株与溃疡病菌DMS46364的16S rDNA序列比对结果Fig.6 The 16S RDNA sequence alignment results between pathogens strains isolated and DMS 46364
3 讨论与结论
传统微生物形态鉴定技术具有设备和技术要求较低,但是存在实验步骤繁琐、实验周期较长的缺点。16SrDNA技术用于微生物的菌菌株鉴定具有快速、简便、精确的优点,但单一的16SrDNA技术存在样本纯度要求高等缺陷。随着技术的发展,近年来,研究人员发展形成了免疫血清学[17]、荧光定量PCR技术[18]、质谱PCR[19]技术和EMA-real-time PCR[20],但这些试验手段多用于已知微生物的检测,且设备和试验技术条件要求较高。本试验通过采用微生物传统鉴定手段和16SrDNA结合的方法对致病菌进行了准确鉴定,确定了该病菌为溃疡病病菌,表明了该技术可以用于溃疡病病原菌的鉴定,该技术与传统鉴定方法相比具有操作简单、鉴定周期短和准确度高等特点,且设备和人员技术的要求低、费用较少。
经过与GenBanK中的序列比对,与密执安棒形杆菌密执安亚种同源性高达99.80 %,从唐山地区分离得到得TSK-1是一株番茄溃疡病菌菌株,该病菌16SrDNA与模型菌株溃疡病菌DMS46364没有形成明显的差异,推测该病菌属于引入型,虽然引起了大面积病害的发生,但应该是初期在唐山地区形成番茄病害,这一特点与本地区首次发现该病害相契合。进一步在本地区开展该类病害的防治研究奠定了基础。
[1]刘泮华,张 乐.番茄溃疡病鉴定研究[J].植物检疫,1989,3(1):31-32.
[2]赵廷昌,王 克,白金铠,等.东北地区番茄细菌性溃疡病的发生和病原菌鉴定研究[J].植物病理学报,1993,23(1):29-34.
[3]罗来鑫,赵廷昌,李健强,等.番茄细菌性溃疡病研究进展[J].中国农业科学,2004,37(8):1144-1150.
[4]郝志军.番茄溃疡病和青枯病的鉴别与防治[J].植物保护,2012(5):32-33.
[5]张爱军,常顺强,胡秀凤,等.番茄溃疡病病原菌生物学特征的观察[J].内蒙古农业科技, 2007(1):53-54.
[6]何 亮,陈 群,曾忠铭,等.通过特异 PCR 扩增和16S rDNA 序列分析检测动弯杆菌[J]. 微生物学报, 2005, 45(1):27-30.
[7]李永欣,张 栋,张晓瑜,等. 土壤放线菌分离与16S rDNA系统发育分析[J]. 河南农业科学,2014,43(3):75-80.
[8]汤 旭,姜 海,赵鸿雁, 等.16SrDNA序列分析在鉴定布鲁氏菌中的应用[J]. 微生物学通报,2013, 40(7):1290-1296.
[9]代晓航,魏 超,郭灵安.16SrDNA 方法对新鲜番茄中细菌分布的调查[J].西南农业学报,2015,28(2):797-800.
[10]Edwards U, Rogall T, Blöcker H, et al. Isolation and direct complete nucleotide determination of entire genes. Characterization of a gene coding for 16S ribosomal RNA [J]. Nucleic Acids Res.,1989,17(19):7843-53.
[11]方中达.植病研究方法[M].北京:中国农业出版社,1998:124-125.
[12]刘晓焱,姚文琴,徐晓青.细菌芽胞两种染色法最佳实验条件观察[J]. 现代预防医学,2008,35(24):4862-4865.
[13]黄元桐,崔 杰.革兰氏染色三步法与质量控制[J].微生物学报,1997,36(1):76-78.
[14]沈 萍,范秀容,李广武.微生物学实验[M].北京:高等教育出版社, 2002.
[15]叶云峰.内生细菌B47菌株的生物学特性及其对番茄青枯病的防治研究[D].南宁:广西大学,2005.
[16]黎志坤,朱红惠. 一株番茄青枯病生防菌的鉴定与防病、定殖能力[J]. 微生物学报,2010,50(3):342-349.
[17]De Leon L,Siverio F,Rodriguez A.Detection ofClavibactermichiganensissubsp.michiganensisin tomato seeds using immunomageticseparation[J].Journal of Microbiological Methods,2006, 67:141-149.
[18]王念武,王 婷,沈建国,等.基于锁式探针的番茄溃疡病菌实时荧光PCR快速检测[J].中国农业科学,2014,47(5):903-911.
[19]刘 伟,王腾蛟,唐海琳,等. 高通量细菌鉴定方法研究进展[J].微生物学通,2014, 41(12):2501-2509.
[20]Wang L, Mustapha A. EMA-real-time PCR as a reliable method for detection of viableSalmonellain chicken and eggs[J]. Journal of Food Science,2010,75(3):134-139.
(责任编辑 李 洁)
Isolation and Identification of Novel Tomato Disease in Tangshan
ZHANG Yun-feng
(Department of Tangshan Normal University, Hebei Tangshan 063000, China)
A novel tomato disease similar to tomato canker or bacterial wilt has been found more and more serious in the Tangshan area. The isolation and identification of its pathogen is the first thing for the forecast and control of the disease. From typical symptom of the disease, the two kinds of bacteria were isolated:TSK-1 and TSK-2. However, only TSK-1 could produce typical symptoms after inoculated into healthy tomato plants. TSK-2 did not have any pathogenicity. By morphological identification and 16s rDNA sequencing identification, we found that the bacteria isolate TSK-1 wasClavibactermichiganensissubsp.michiganensis. Therefore, the novel tomato disease is tomato canker other than tomato bacterial wilt, which will be helpful to control the disease in Tangshan area.
Tomato canker; Pathogen isolation; Morphological identification; 16S rDNA sequencing identification
1001-4829(2016)12-2854-05
10.16213/j.cnki.scjas.2016.12.016
2015-08-06
河北省自然科学基金(C2014105067);唐山市科技支撑计划项目(14120208a);唐山师范学院科学研究基金(2015C07)
张运峰(1982-),男,石家庄人,讲师,硕士,主要从事植物病理学研究。
S436.412
A
