NaCl胁迫对菜用大豆光合作用及叶绿体抗氧化系统的影响
2017-01-09刘艳华董永义杨恒山马玉露贾俊英包金花
王 聪, 刘艳华, 董永义, 杨恒山,马玉露, 贾俊英, 包金花, 郑 毅
(1.内蒙古民族大学农学院,内蒙古 通辽 028042; 2. 内蒙古赤峰市农牧业水利局农业技术推广站,内蒙古 赤峰 024000)
NaCl胁迫对菜用大豆光合作用及叶绿体抗氧化系统的影响
王 聪1, 刘艳华2, 董永义1, 杨恒山1,马玉露1, 贾俊英1, 包金花1, 郑 毅1
(1.内蒙古民族大学农学院,内蒙古 通辽 028042; 2. 内蒙古赤峰市农牧业水利局农业技术推广站,内蒙古 赤峰 024000)
本文采用蛭石栽培,选用菜用大豆盐敏感品种‘理想高产95-1’(LX)和耐盐品种‘绿领特早’(LL)为试材,设对照和NaCl胁迫2个处理,对照根部浇灌营养液,NaCl胁迫处理根部浇灌溶有NaCl的营养液。结果表明,NaCl胁迫显著降低了2品种菜用大豆的净光合速率(Pn),降低了2品种菜用大豆的过氧化物酶(POD)、抗坏血酸过氧化物酶(APX)、脱氢抗坏血酸还原酶(DHAR)、谷胱甘肽还原酶(GR)、谷胱甘肽过氧化物酶(GPX)的活性,显著提高了H2O2含量;耐盐品种LL维持了相对较高的Pn及APX、DHAR、GR、GPX活性和相对较低的H2O2含量。本试验表明,保持叶绿体AsA-GSH循环持续快速、有效运转,降低叶绿体膜系统受伤害程度,维持叶肉细胞较强的光合活性,可能是耐盐品种LL维持较高Pn的重要生理基础之一。
NaCl胁迫;叶绿体;光合作用; 抗氧化系统
盐胁迫是人类目前面临的主要环境问题之一。盐胁迫通过影响光合作用抑制植物生长发育是导致作物减产甚至死亡的重要原因。研究表明,盐胁迫可显著降低黄瓜[1]、玉米[2]、燕麦[3]、木薯[4]等的光合速率,进而减少干物质积累。盐胁迫下植物光合作用的减弱是由多种因素引起的,如光合色素含量变化、气孔限制以及影响叶肉细胞光合活性的非气孔限制因素等。然而,无论是哪种因素,均与植物的抗盐能力相关[5]。
叶绿体是光合作用的场所,也是细胞中对盐最敏感的细胞器[6]。盐胁迫会导致植物叶绿体中H2O2含量大幅增加[7-8],致使膜脂过氧化,进而影响植物光合作用的正常进行[9]。可见,叶绿体内抗氧化系统的活性是影响叶肉细胞光合活性的重要的非气孔限制因素之一。本研究以耐盐性不同的两菜用大豆品种为试材,对NaCl胁迫下菜用大豆的光合特性及叶绿体抗氧化系统活性进行比较研究,以期探明叶绿体活性氧代谢对光合作用的影响及引起耐盐性差异的原因,为植物耐盐机理的深入研究及耐盐品种的选育提供参考。
1 材料与方法
1.1 供试试材
菜用大豆[Glycinemax(L.) Merr.]选用盐敏感品种‘理想高产95-1’(LX),耐盐品种‘绿领特早’(LL),试验于2014年4月至6月在内蒙古民族大学试验基地日光温室内进行。干种子直播于上直径25 cm、下直径15 cm、高20 cm的塑料盆中,蛭石作基质,浇灌日本园试营养液[10],每盆定苗4株。子叶完全展开、第1片真叶露出后每3 d浇1/4浓度日本园试营养液1次,每盆浇液0.5 L。
1.2 NaCl处理
试验设对照(CK)和NaCl胁迫(T)2个处理。对照根部浇灌营养液,NaCl胁迫处理根部浇灌溶有NaCl的营养液。每处理15盆,3次重复。NaCl处理的适宜浓度为100 mmol·L-1[11]。
第1片3出复叶完全展开后进行NaCl处理,NaCl溶于1/4浓度日本园试营养液,均匀浇入基质中,每3 d浇液1次,浇液量同上。
1.3 测定项目及方法
1.3.1 测定时期 NaCl处理0 d开始测定,以后每3 d测定1次,共测定6次。以完全展开的3出复叶顶叶为测试对象。处理15 d(T处理植株叶片出现明显褪绿、黄化症状)后测幼苗全株干重。
1.3.2 光合参数 用GFS-3000光合仪(德国WALZ公司生产)于上午9:00-11:30测定。气孔导度(Gs)、胞间CO2浓度(Ci)及净光合速率(Pn)由光合测定系统直接读出。测定过程中光强约为800 μmol·m-2·s-1,大气温度范围为(25±2) ℃,大气CO2浓度范围为(487±10) μmol·L-1。每次测定重复10次。
1.3.3 叶绿体制备 参照孙锦[12]的方法提取,在Takeda等[13]的基础上略作改动。10 g去叶脉的新鲜叶片加20 mL提取缓冲液(50 nmol·L-1、pH 6.1的一水吗啉乙磺酸(MES),含0.33 mol·L-1山梨糖醇,10 mol·L-1NaCl,2 mol·L-1MgCl2,2 mol·L-1乙二胺四乙酸铁钠盐(EDTA),0.5 mol·L-1KH2PO4,2 mol·L-1AsA-Na,AsA-Na使用前现配现加)快速研磨,使叶片碎成绿豆粒大小,4层纱布过滤,滤液2000 r/min离心3 min,倒出上清液,沉淀用l mL提取缓冲液漂洗表面悬浮物;然后用1 mL悬浮液(50 mmol·L-1、pH 7.6的4-羟基哌嗪乙磺酸(HEPES),含0.33 mmol·L-1山梨糖醇,10 mmol·L-1NaCl,2 mmol·L-1MgCl2,2 mmol·L-1EDTA,0.5 mrnol·L-1KH2PO4,2 mmol·L-1AsA-Na,AsA-Na使用前现配现加)将沉淀悬浮。为保证叶绿体纯度,用Percoll试剂进行梯度离心,完整率可达90 %。
1.3.4 酶活性、H2O2及蛋白质含量测定 过氧化物酶(POD)、抗坏血酸过氧化物酶(APX)、脱氢抗坏血酸还原酶(DHAR)、谷胱甘肽还原酶(GR)、谷胱甘肽过氧化物酶(GPX)活性及H2O2、蛋白质含量均采用试剂盒测定(购自苏州科铭生物技术有限公司)。以试剂盒提供的提取液悬浮叶绿体后,按试剂盒所述方法测定。
测定原理:POD催化H2O2氧化特定底物后在470 nm下有特定吸收峰,通过测定470 nm光吸收度的变化值计算POD的活性[14];APX催化H2O2氧化AsA,通过测定265 nm光吸收下AsA氧化速率来计算APX活性[15];DHAR催化GSH还原DHA生成AsA,通过测定265 nm光吸收下DHA减少速率,计算DHAR活性[16];GR能催化NADPH还原GSSG再生GSH,同时NADPH脱氢生成NADP+,NADPH在340 nm有特征吸收峰,而NADP+在该波长下无吸收峰,通过测定340 nm吸收度下降速率来测定NADPH脱氢速率,从而计算GR活性[17];GPX催化H2O2氧化GSH,产生GSSG,GR能催化NADPH还原GSSG再生GSH,通过测定340 nm吸收度下降速率来计算GPX活性[18];H2O2与硫酸钛生成黄色过氧化钛复合物,在415 nm有特征吸收,吸光度与H2O2成正比[19];蛋白质含量采用BCA法测定[20]。
1.3.5 叶绿素含量测定 以丙酮悬浮叶绿体后,按Arnon[21]的方法测定。
1.4 数据处理
应用SPSS分析软件对试验数据进行统计分析。
2 结果与分析
2.1 NaCl胁迫对菜用大豆干重的影响
由图1可知,NaCl胁迫使两品种菜用大豆在胁迫15 d时的干重均显著下降,其中LX的降幅为28 %,LL的降幅为19 %。表明NaCl胁迫显著抑制了菜用大豆干质量的增加,但耐盐品种LL的受抑制程度相对较低。
2.2 NaCl胁迫对菜用大豆光合参数的影响
2.2.1 净光合速率(Pn) 图2显示,NaCl胁迫显著降低了LX在胁迫第6~15 天时的Pn,降幅分别为37 %、45 %、51 %、53 %;显著降低了LL在整个胁迫期间的Pn,降幅分别为13 %、23 %、39 %、46 %、42 %。可见耐盐品种LL在NaCl胁迫中、后期维持了相对较高的Pn。
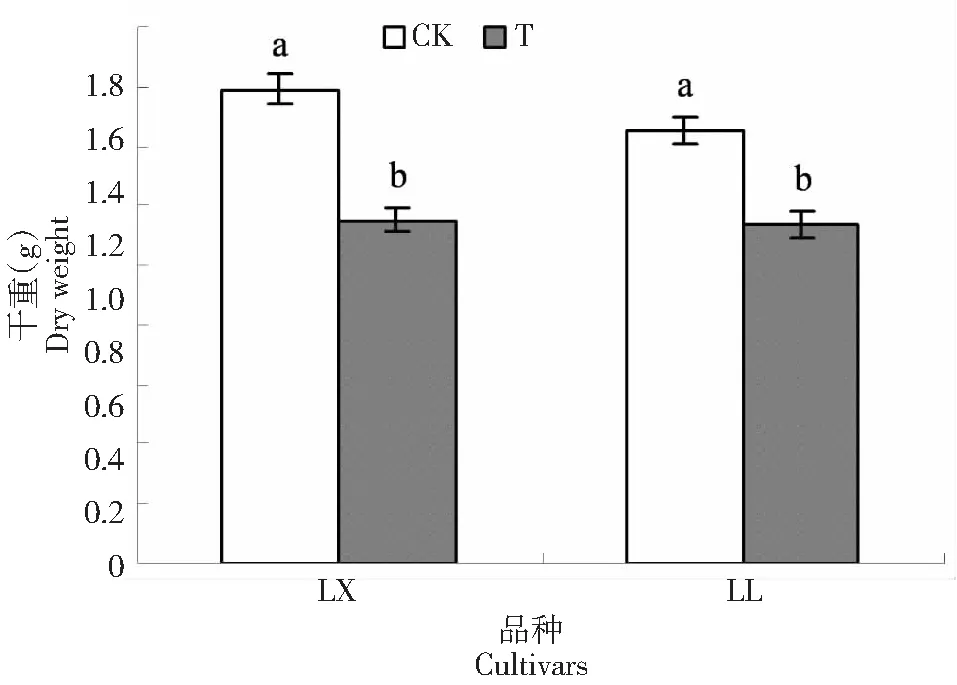
不同小写字母表示差异显著(P﹤5 %)Different lowercase letters indicate significant difference at 0.05 level图1 NaCl胁迫对菜用大豆干重的影响Fig.1 Effect of NaCl stress on dry weight of vegetable soybean
2.2.2 气孔导度(Gs) NaCl胁迫显著降低了LX在胁迫第6~15 天时及LL在整个胁迫期间的Gs,且LL的降幅均大于同期的LX。表明NaCl胁迫下LL的Gs受到了相对较强的抑制作用(图3a)。
2.2.3 胞间CO2浓度(Ci) 由图3b可见,NaCl胁迫使LX在胁迫第6 、15天时的Ci显著升高,其余时期未见显著影响;使LL在胁迫第3~12天的Ci显著下降,第15 天时较对照显著升高。
2.3 NaCl胁迫对菜用大豆叶绿体H2O2含量的影响


图例中数字1表示LX,2表示LL; *表示LX两处理同期的差异显著(P﹤5 %),×表示LL两处理同期的差异显著(P﹤5 %),下同The number 1 in the legend indicates LX, and the 2 indicates LL; *indicates significant differences at 0.05 level between different treatments at the same time of LX, and × indicates that of LL, the same as below图2 NaCl胁迫对菜用大豆净光合速率(Pn)的影响Fig.2 Effect of NaCl stress on net photosynthetic rate (Pn) of vegetable soybean
2.4 NaCl胁迫对菜用大豆叶绿体抗氧化系统的影响
2.4.1 POD活性 POD 是植物细胞内重要的保护酶,在清除H2O2中起重要作用。图5显示,NaCl胁迫显著降低了LX在胁迫第6~15 天时的POD活性,其中第15 天的降幅达36 %;LL在第3天时的POD活性显著升高,之后均受到显著抑制,至第15

图3 NaCl胁迫对菜用大豆气孔导度(Gs)(a)和胞间CO2浓度(Ci) (b)的影响Fig.3 Effect of NaCl stress on stomatal conductance (Gs)(a)and intercellular CO2 concentration(Ci) (b) of vegetable soybean

图4 NaCl胁迫对菜用大豆叶绿体H2O2含量的影响Fig.4 Effect of NaCl stress on H2O2 content of vegetable soybean chloroplast
天时较对照的降幅达17 %,低于同期的LX,而其余时期2品种的降幅相近。表明耐盐品种LL在胁迫前期、末期维持了相对较高的POD活性。
2.4.2 APX活性 APX可以AsA为电子供体直接清除H2O2。由图6a可知,NaCl胁迫下,2品种菜用大豆叶绿体的APX 活性均呈先升后降的趋势变化。LX在胁迫第6~15天时的APX活性受到显著抑制,较对照的降幅分别为23 %、46 %、30 %、22 %;LL在胁迫第12、15 天时的活性显著下降,降幅为27 %、19 %,低于同期的LX。可见耐盐品种LL在NaCl胁迫期间维持了相对较高的APX活性。
2.4.3 DHAR活性 DHAR催化脱氢抗坏血酸(DHA)还原形成AsA,是AsA-GSH循环的关键酶。图6b显示,2品种菜用大豆叶绿体DHAR活性在各处理下均呈先升后降的趋势变化。其中LX的DHAR活性在NaCl胁迫6~15 d期间显著下降,降幅分别达37 %、35 %、34 %、38 %;LL的活性在胁迫第3 天时显著升高,胁迫第12、15 天时受到显著抑制,降幅均为35 %。表明耐盐品种LL在NaCl胁迫末期(12 d)与LX的DHAR活性相近,其余较长时期内均维持了较高的活性。

图5 NaCl胁迫对菜用大豆叶绿体POD活性的影响Fig.5 Effect of NaCl stress on POD activity of vegetable soybean chloroplast
2.4.4 GR活性 GR催化氧化型谷胱甘肽(GSSG)还原形成GSH,是AsA-GSH循环的关键酶。NaCl胁迫下,LX的GR活性呈逐渐下降的趋势变化;LL的活性先大幅下降,第6 天后趋于平缓(图7a)。2品种的GR活性在整个胁迫期间均受到显著抑制,其中LX的降幅分别达21 %、22 %、34 %、43 %、56 %,LL的降幅在胁迫第9、12、15天时小于同期的LX。说明耐盐品种LL在NaCl胁迫中后期维持了较高的GR活性。
2.4.5 GPX活性 GPS是机体抗氧化防御体系中的重要酶之一,它以GSH为底物清除H2O2。由图7b可看出,NaCl胁迫下,2品种菜用大豆的GPX活性均呈逐渐下降的趋势变化。其中,LX的活性在整个胁迫期间均较对照显著降低,第15 天时的降幅达51 %;LL的GPX活性在胁迫3~12 d期间均较对照显著升高,至第15 天时受到显著抑制,但降幅低于同期的LX。可见耐盐品种LL在整个胁迫期间均维持了相对较强的GPX活性。

图6 NaCl胁迫对菜用大豆叶绿体APX(a)和DHAR(b)活性的影响Fig.6 Effect of NaCl stress on APX(a)and DHAR (b) activity of vegetable soybean chloroplast

图7 NaCl胁迫对菜用大豆叶绿体GR(a)和GPX(b)活性的影响Fig.7 Effect of NaCl stress on GR(a)and GPX (b) activity of vegetable soybean chloroplast
3 讨 论
盐胁迫是导致ROS过量产生,进而导致植物次生氧化损伤的重要诱因之一。本研究结果表明,NaCl胁迫下2品种菜用大豆的净光合速率、干质量显著降低,但耐盐品种LL的降幅均低于同期的盐敏感品种LX。可见NaCl胁迫对菜用大豆的光合作用产生了显著的抑制作用,致使其干物质的积累受到阻碍,而LL显示了较强的抗盐能力。
研究表明,植物Pn变化的原因可分为气孔因素(主要是受气孔导度的影响)和非气孔因素(受叶肉细胞光合活性的影响)。一般地,Pn、Gs和Ci均下降,则Pn的下降主要由气孔限制引起;Pn和Gs下降,Ci上升或无显著变化,则Pn的下降主要由非气孔限制引起[22-26]。本研究中,盐敏感品种在胁迫第6、15 d时Pn、Gs显著下降,Ci显著升高;胁迫第9、12 d时Pn、Gs显著下降,Ci无显著变化,说明非气孔限制是导致其Pn下降的主要原因。这与盐胁迫条件下黑麦草[27]、玉米[28]等的结果相近。耐盐品种LL在胁迫第3~12 天时表现为Pn、Gs、Ci均下降;胁迫第15 天时表现为Pn、Gs下降,Ci升高,说明LL在胁迫第3~12 天时Pn的下降主要是由气孔限制引起,第15 天时主要是非气孔限制所致。这与李海波等[29]的研究结果不同,可能与不同种类植物抗盐能力差异较大有关。上述结果表明,NaCl胁迫对耐盐性不同的菜用大豆光合作用的抑制途径不同。

叶绿体是光合作用的场所,叶绿体膜系统过氧化程度直接关系到叶肉细胞的光合活性,因此,叶绿体膜系统的伤害程度是影响Pn变化的重要的非气孔因素。较盐敏感品种LX而言,尽管耐盐品种LL的Gs在整个NaCl胁迫期间均受到了较强的抑制,但其仍维持了较高的Pn,这可能与其在胁迫期间维持了较低的H2O2含量,叶绿体膜系统受伤害程度较轻,叶肉细胞保持了较强的光合活性密切相关。由此推断,盐胁迫下叶肉细胞的光合活性,即非气孔因素对维持较高Pn可能起着关键作用。NaCl胁迫下,耐盐品种LL叶绿体由于能够保持AsA-GSH循环持续快速、有效运转,过量产生的H2O2被及时清除,叶绿体膜系统受伤害程度较轻,使叶肉细胞维持了较强的光合活性,这可能是其维持较高Pn的重要生理基础之一。
4 结 论
(1)NaCl胁迫导致2品种菜用大豆叶绿体POD活性及AsA-GSH循环运转效率降低,致使H2O2含量升高,Pn降低,进而导致干质量下降。
(2)保持叶绿体AsA-GSH循环持续快速、有效运转,降低叶绿体膜系统受伤害程度,维持叶肉细胞较强的光合活性,可能是耐盐品种LL维持较高Pn的重要生理基础之一。
[1]严 蓓, 孙 锦, 束 胜, 等. 外源钙对胁迫下黄瓜幼苗叶片光合特性及碳水化合物代谢的影响[J]. 南京农业大学学报, 2014, 37(1):31-36.
[2]侯 楠, 宋玉伟. 盐胁迫对玉米幼苗叶片光合荧光和抗氧化酶活性的影响[J]. 现代农业科技, 2014, 24:36,40.
[3]刘建新, 王金成, 王瑞娟, 等. 盐碱胁迫对燕麦幼苗光合作用的影响[J]. 干旱地区农业研究, 2015, 33(6):155-160.
[4]安飞飞, 简纯平, 杨 龙, 等. 木薯幼苗叶绿素含量及光合特性对盐胁迫的响应[J]. 江苏农业学报, 2015,31(3):500-504.
[5]潘世驹, 李红宇, 姜玉伟,等. 寒地水稻幼苗期耐盐资源筛选[J]. 南方农业学报, 2015, 46(10):1775-1779.
[6]Cheeseman J M. Mechanism of salinity tolerance in plants[J]. Plant Physiology, 1988, 87:547-550.
[7]钱琼秋, 宰文珊, 朱祝军, 等. 外源硅对盐胁迫下黄瓜幼苗叶绿体活性氧清除系统的影响[J]. 植物生理与分子生物学学报, 2006,32(1):107-112.
[8]华 春, 王仁雷, 刘友良. 外源AsA对盐胁迫下水稻叶绿体活性氧清除系统的影响[J]. 作物学报, 2004, 30(7):692-696.
[9]孙 妮, 曹广霞, 彭 娟. 盐胁迫对栅藻SP-01抗氧化酶和代谢产物的影响[J]. 南方农业学报, 2014, 45(9):1574-1578.
[10]蒋先明. 蔬菜栽培学总论[M]. 北京:中国农业出版社, 2004:191.
[11]王 聪, 朱月林, 杨立飞, 等. 菜用大豆耐盐品种的筛选及其耐盐生理特性[J]. 江苏农业学报, 2009, 25(3):621-627.
[12]孙 锦. 菠菜对海水胁迫响应的生理机制研究[D]. 南京农业大学, 2009:61-62.
[13]Takeda K, Otaubo T, Konda N. Participation of hydrogen peroxide in the inactivation of Calvin-cycle GSH enzyme in SO2-furmugated spinach leaves[J]. Plant and Cell Physiology, 1982, 23:1009-1018.
[14]陈建勋, 王晓峰. 植物生理学实验指导[M]. 广州:华南科技大学出版社, 2002:120-121.
[15]Nakano Y, Asada K. Hydrogen Peroxide is scavenged by ascorbate specific peroxidase in spinach chloroplasts[J]. Plant and Cell Physiologe,1981,22:867-880.
[16]Krivosheeva A, Tao D L, Ottander C, et al. Cold acclimation and photoinhibition of photosynthesis in Scots pine[J]. Planta, 1996, 200(3):296-305.
[17]Foyer C H, Halliwwll B. The presence of glutathione and glutathione reductase in chloroplasts:a proposed role in ascorbic acid metabolism[J]. Planta, 1976, 133:21-25.
[18]荣征星, 刘慧中, 鲍景奇, 等. 小鼠全血中谷胱甘肽过氧化物酶活力的微量测定[J]. 生物化学与生物物理进展, 1994, 21:362-366.
[19]Uchida A, Andre T J, Takashi H. Effects of hydrogen peroxide and nitric oxide on both salt and heat stress tolerance in rice[J]. Plant Science, 2002, 163:515-523.
[20]吴冠芸. 生物化学与分子生物学实验常用数据手册[M]. 北京:科学出版社, 1999:166.
[21]Arnon D I. Copper enzymes in isolated chloroplasts:polyphenol oxidase in Beta vulgaris[J]. Plant Physiology, 1949, 24:1-5.
[22]Farquhar G D, Sharkey T D. Stomatal conductance and photosynthesis[J]. Annual Review of Plant Physiology, 1982, 33:317-345.
[23]Khan W M, Prithiviraj B, Smith D L. Effect of foliar application of chitin and chitosan oligosaccharides on photosynthesis of maize and soybean[J]. Photosynthetica, 2002, 40(4):621-624.
[24]寇伟锋, 刘兆普, 陈铭达, 等. 不同浓度海水对油葵幼苗光合作用及叶绿素荧光特性的影响[J]. 西北植物学报, 2006,26(1):73-77.
[25]尹赜鹏, 刘雪梅, 商志伟, 等. 不同干旱胁迫下欧李光合及叶绿素荧光参数的响应[J]. 植物生理学报, 2011, 47(5):452-458.
[26]Wong S C, Cowan I R, Farquhar G D. Leaf conductance in relation to rate of CO2assimilation. Ⅱ. Influences of water stress and photoinhibition[J].Plant Physiology, 1985, 78:830-834.
[27]刘建新, 胡浩斌, 王 鑫. 硅对盐胁迫下黑麦草幼苗活性氧代谢和光合参数的影响[J]. 中国草地学报, 2008, 30(5):25-30.
[28]车永梅, 唐 静, 陈 康, 等. 一氧化氮对盐胁迫下玉米幼苗叶绿素荧光特性及光合作用的影响[J]. 玉米科学, 2009, 17(3):91-94.
[29]李海波, 陈温福, 李全英. 盐胁迫下水稻叶片光合参数对光强的响应[J]. 应用生态学报, 2006, 17(9):1588-1592.
[30]Cakmak I. Activity of ascorbate-pendent H2O2scavenging enzymes and leaf chlorosis are enhanced in magnesium and potassium deficient leaves, but not in phosphorus deficient leaves[J]. Journal of Experiment Botany, 1994, 45:1259-1266.
[31]秦爱国, 于贤昌. 马铃薯抗坏血酸含量及其代谢相关酶活性关系的研究[J]. 园艺学报, 2009, 36(9):1370-1374.
[32]Foyer C H, Noctor G. The molecular biology and metabolism of glutathione[A].//In:Grill D, Tausz M, De Kok L J, et al. Significance of glutathione in plant adaptation to the environment[M]. Kluwer Academic Publishers, 2001:27-57.
[33]Arthur J R. The glutathione peroxidase[J]. Cell Molecular Life Science, 2000, 57(13-14):1825-1835.
[34]Berczi A, Moller I M. Redox enzymes in the plant plasma membrane and their possible roles[J]. Plant Cell & Environment, 2000, 23(12):1287-1302.
[35]王菲菲, 丁明全, 邓澍荣, 等. 胡杨谷胱甘肽过氧化物酶基因的克隆及转化植株耐盐性分析[J]. 基因组学与应用生物学, 2012, 31(3):231-239.
[36]Povero T,Loreti E, Pucciariello C, et al. Transcript profiling of chitosan-treatedArabidopsisseedlings[J]. Journal of Plant Research, 2011, 124:619-629.
(责任编辑 陈 虹)
Effects of NaCl Stress on Photosynthesis and Chloroplast Antioxidant System of Vegetable Soybean
WANG Cong1, LIU Yan-hua2, DONG Yong-yi1, YANG Heng-shan1, MA Yu-lu1, JIA Jun-ying1, BAO Jin-hua1, ZHENG Yi1
(1.College of Agriculture, Inner Mongolia University for Nationalities, Tongliao, Inner Mongolia 028042, China; 2.Agricultural Technology Extension Station, Chifeng City, Inner Mongolia of Water Conservancy Bureau of Agriculture and Animal Husbandry, Inner Mongolia Chifeng 024000, China)
In this paper, the experiment was implemented by adopting vermiculite culture and with two treatments:(i) control:the roots were fed with the nutrient solution; (ii) NaCl stress treatment:the roots were fed with nutrient solution under NaCl. Vegetable soybean salt sensitive cultivar ‘lixianggaochan 95-1’ (LX) and salt tolerant cultivar ‘lvlingtezao’ (LL) were selected as tested materials. The results showed that NaCl stress significantly reduced net photosynthetic rate (Pn), reduced the activities of peroxidase (POD), corbate peroxidase(APX), dehydroascorbate reductase (DHAR), glutathione reductase (GR) and glutathione peroxidase (GPX) of two vegetable soybean cultivars and significantly increased their H2O2content meanwhile. Salt tolerant cultivar LL maintained a relatively higherPnand APX, DHAR, GR and GPX activity and a relatively lower H2O2content compared with those of LX. The result of this experiment indicated that the maintaining rapid and effective operation of the chloroplast AsA-GSH cycle to reduce the damage of chloroplast membrane system and keeping the strong photosynthetic activity of mesophyll cells might be one of the important physiological basis of LL to maintain the highPnof salt tolerant varieties.
NaCl stress; Chloroplast; Photosynthesis; Antioxidant system
1001-4829(2016)12-2824-06
10.16213/j.cnki.scjas.2016.12.011
2016-01-20
国家自然科学基金项目(31260472, 31260483 )
王 聪 (1968-),男,博士,教授,硕士研究生导师,主要从事蔬菜生理生态和生物技术研究,E-mail:tongliaowangcong@163.com。
S643.7
A
