菌核净在芹菜中的降解规律
2017-01-05陈雪苏频吴进斌吴小毛
陈雪,苏频,吴进斌,吴小毛
(1.贵阳市白云区蔬菜生产技术服务中心,贵州贵阳550025;2.贵州大学农学院,贵州贵阳550025)
菌核净在芹菜中的降解规律
陈雪1,苏频1,吴进斌1,吴小毛2
(1.贵阳市白云区蔬菜生产技术服务中心,贵州贵阳550025;2.贵州大学农学院,贵州贵阳550025)
为了探明菌核净的残留污染风险,在田间试验条件下,采用气相色谱-质谱法研究了菌核净在芹菜中的降解规律。结果表明,菌核净在芹菜中的降解动态符合一级动力学方程,降解半衰期为6.9 d;菌核净在芹菜中的残留量随施药量的增加和收获时间的缩短而增高;40%菌核净WP在芹菜旺盛生长期以低剂量(360 g/hm2)和高剂量(720 g/hm2)施药3次,距最后一次施药14 d后菌核净的残留量均小于0.60 mg/kg。菌核净在芹菜中的降解转化途径是光解(或水解)和脱氯作用。
菌核净;芹菜;残留;降解
菌核净(Dimetachlone)化学名称为N-(3,5-二氯苯基)丁二酰亚胺,是一种亚胺类低毒杀菌剂,对油菜、芹菜、辣椒菌核病,烟草赤腥病,水稻纹枯病,番茄灰霉病等具有良好防效[1-3]。菌核净属于低毒类农药,但具有雌激素和抗雄激素双重内分泌干扰作用[4],同时对人体的肾脏有危害[5]。近年来,菌核净已得到了大范围的应用,有关菌核净残留的研究主要集中在分析方法及其在土壤和生菜、烤烟中的降解方面[6-13],但目前尚未见有关菌核净在芹菜中的降解与转化的相关报道。
为了探明菌核净的残留污染风险,本试验采用气相色谱-质谱法(GC-MS)对菌核净在芹菜上的降解规律进行研究,旨在为芹菜上的安全合理使用及制订芹菜中菌核净最大残留限量(MRL)提供参考。
1 材料和方法
1.1 材料
1.1.1 药品及试剂菌核净标样(99.1%),国家农药质量监督检验中心提供;40%菌核净WP(山东恒利达生物科技有限公司);丙酮、乙酸乙酯、二氯甲烷、无水硫酸钠、活性炭、氟罗里硅土等试剂均为分析纯,丙酮、乙酸乙酯、二氯甲烷使用前经全玻璃重蒸系统重蒸。
1.1.2 仪器及设备7890A-5975C GC/MS联用仪、6890N气相色谱(带μECD检测器)、HP-5石英毛细管柱(30 m×0.32 mm,0.25 μm)(美国Agilent),AL104电子分析天平(瑞士梅特勒),SHZ-82恒温振荡器(常州澳华仪器有限公司),RE-52A型旋转浓缩蒸发仪(上海亚荣生化仪器厂)。
1.2试验方法
2014年在贵阳市花溪区芹菜田旺盛生长期按照《农药登记残留田间试验标准操作规程》[14-15]进行降解动态试验、最终残留试验。小区面积20 m2,小区四周设置15 cm长的隔离带,按每公顷对水750 L采用喷雾法进行施药,施药剂量及取样时间列于表1,每处理重复3次。随机取样法采集芹菜样品,每小区不少于2 kg,样品带回实验室低温贮存于-20℃冰箱中备测。

表140 %菌核净WP残留试验的施药剂量及取样时间
1.3 残留分析方法
1.3.1 样品提取称取鲜芹菜10.0 g,剪碎,加入250 mL三角瓶中,用50 mL二氯甲烷-丙酮(2∶1,V/V)振荡萃取2 h,抽滤后将滤液转移到250 mL分液漏斗中,加入100 mL 2%硫酸钠水溶液,振荡后去丙酮及水溶性杂质。水相再用二氯甲烷30 mL分配2次,合并3次有机相,浓缩至近干,待净化。
1.3.2样品净化在层析柱(15 mm×300 mm)两端装入2 cm无水NaSO4,中间装入6.0 g弗罗里硅土和0.2g活性炭的混合物;先用10mL二氯甲烷淋洗,加入浓缩样品;打开活塞,弃去流出液;用20 mL二氯甲烷/丙酮(9∶1,V/V)洗脱,收集洗脱液浓缩至近干,氮气吹干,用丙酮定容5 mL,待测定。
1.3.3 GC条件检测器温度:280℃;进样口温度:260℃;柱温200℃(保持1 min),以10℃/min升至270℃,保持20 min;氮气流速1.2 mL/min,分流比为10∶1;进样量1 μL;保留时间约为6.0 min。
1.3.4 GC-MS条件汽化室温度250℃;柱温:初始温度50℃,保留2min,以5℃/min升温至300℃,保持30 min;高纯He(99.999%)流量1.0 mL/min;柱前压7.62 psi;进样量1 μL;溶剂延迟时间:5 min。EI离子源,离子源温度230℃;四极杆温度150℃;接口温度280℃;电子能量70 eV;倍增器电压1124 V;发射电流34.6 μA;质量范围20~550 amu。
2 结果与分析
2.1 方法准确度、精密度和灵敏度
由图1可知,在设定GC条件下,菌核净在芹菜中能得到较好的分离,没有杂质的干扰。采用外标法峰面积定量,菌核净在芹菜中的最低检出限为0.002 mg/kg。芹菜中菌核净的回收率为83.46%~96.29%,变异系数为3.46%~5.68%(表2),符合农药残留分析的要求[15]。

表2 芹菜中菌核净的加标回收率与精密度

2.2 菌核净在芹菜中的降解动态

在田间按720 g/hm2施用40%菌核净WP后,菌核净在芹菜中的原始沉积量为3.89 mg/kg,施药后1~3 d降解较快,随着时间的延长而逐渐下降(图2)。菌核净在1 d的降解率为57.33%,3 d后为76.61%,28 d后达到了96.66%。菌核净在芹菜中的降解动态符合一级动力学,回归方程为Ct=2.539e-0.101t(R2=0.948),降解半衰期为6.9 d。
2.3 菌核净在芹菜中的最终残留
菌核净在芹菜中的最终残留量如表3所示,随菌核净施用量增大,菌核净在芹菜中的残留量也相应增高,随施药间隔期的增加,芹菜样品中菌核净的残留量则相应降低。40%菌核净WP在芹菜旺盛生长期以低剂量(360 g/hm2)和高剂量(720 g/hm2)施药3次,距最后一次施药14 d后菌核净的残留量均小于0.60 mg/kg。

表3 菌核净在芹菜中的最终残留量
2.4 菌核净在芹菜中的降解机理
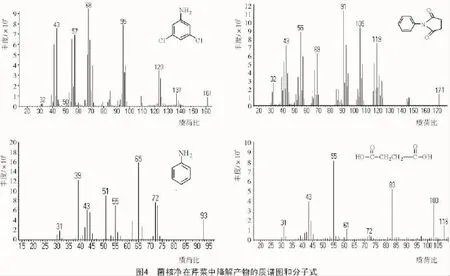
菌核净在芹菜中降解产物的总离子流如图3所示,降解产物可能有A,B,C,D 4种,其保留时间分别为27.07,29.70,12.84,15.26 min,质荷比(m/z)分别为161,171,93,116,相应的质谱图和分子结构如图4所示。其他峰的质荷比(m/z)有的大于菌核净的相对质量244,有的则不合理。对比空白样品的结果可知,除了上述4种代谢产物外,其余的物质可能是芹菜本身提取的物质。
解析并对比菌核净在芹菜中降解产物的分子结构及菌核净母体的分子特征,可初步推测,菌核净在芹菜中的主要降解途径是通过水解(或光解)、脱氯作用,转化为苯胺和丁二酸。推测的降解途径如下:途径1,菌核净分子N位上酰胺键水解或光解,生成3,5-二氯苯胺和丁二酸,3,5-二氯苯胺进一步脱氯生成苯胺;途径2,菌核净分子C3,C5位上脱氯生成N-苯丁二酰亚胺,N-苯丁二酰亚胺进一步水解生成苯胺和丁二酸。

3 结论与讨论
本试验结合芹菜的特点及菌核净的特性,建立了芹菜中菌核净残留的气相色谱分析方法,该法简便快速,灵敏度高,适用于芹菜中菌核净残留量的测定。
农药在植株上的降解与其理化特性、环境因素以及植株的吸收、转化代谢有关。本试验结果表明,除了光照、温度、降雨等环境因素外,菌核净在芹菜上的降解还受到其化学性质的稳定性、芹菜生长过程的稀释作用以及在芹菜体内降解转化作用的影响[16-20]。因此,菌核净在芹菜中的降解应该是上述因素综合影响的结果。
最终残留试验结果显示,菌核净在芹菜中的残留量与收获期、施药剂量有关,时间越短、剂量越高,残留量越高,距最后1次施药14 d后,残留量均未超过0.6 mg/kg。目前,我国和其他国家及地区还未对菌核净的MRL作出明确规定,由此建议40%菌核净WP在芹菜上的安全使用标准:喷施时最好避开芹菜苗期,推荐剂量为720 g/hm2,施用3次,安全间隔期为7 d。
根据菌核净代谢产物的分子结构及其母体的分子特征,推测菌核净在芹菜中的可能降解途径主要是被水解(或光解)和脱氯作用。
近年来由于设施栽培的发展,我国南方菜区温室大棚栽培的蔬菜如芹菜、辣椒、番茄、莴苣、胡萝卜等也陆续发现菌核病,且有逐渐加重的趋势。菌核净作为防治菌核病的主要药剂,在蔬菜保护地中广泛使用,它们进入蔬菜田后会产生怎样的环境效应,对土壤微生物种群和功能产生何种影响,这些问题目前尚不十分清楚。因此,有关菌核净残留在蔬菜田土壤中的环境行为和生态毒理效应还有待进一步研究。
[1]余子林.“菌核净”农药简介[J].湖北植保,1996(6):28-29.
[2]涂勇.不同药剂对烟草赤星病的防治效果研究[J].西昌学院学报:自然科学版,2011,25(2):4-5.
[3]周乐聪,周必文,徐琪,等.菌核净系列新农药防治油菜菌核病的效果及机理[J].农药,1994,33(3):40-42.
[4]陈江,章荣华,毛光明,等.菌核净内分泌干扰作用研究[J].卫生研究,2009,38(1):24-27.
[5]张国军,郑一凡,祝慧娟,等.菌核净的抗雄激素作用及机制的研究[J].中华劳动卫生职业病杂志,2004,22(1):15-18.
[6]蒋丽君.菌核净在生菜中残留分析方法的研究[J].上海农业科技,2012(2):25-26.
[7]刘蓉蓉,刘贤进,刘媛.菌核净残留免疫分析半抗原的制备和鉴定[J].食品科学,2007,28(2):223-226.
[8]刘媛,刘蓉蓉,刘贤金,等.时间分辨荧光免疫分析方法检测烟草中菌核净残留[J].分析化学,2012,40(7):1114-1117.
[9]阮淑呈,杨亚玲,黄海涛.超声波辅助分散液相微萃取-气相色谱联用分析菌核净[J].分析实验室,2010,29(1):111-114.
[10]肖少怀,杨仁斌,傅强,等.番茄和土壤中菌核净残留量的高效液相色谱测定方法[J].农药,2013,52(4):275-277.
[11]蒋丽君,陆贻通.菌核净在生菜和土壤中的残留动态[J].上海交通大学学报:农业科学版,2012,30(4):47-51.
[12]吴小毛,李荣玉,李明,等.菌核净在植烟土壤及烟叶中的消解动态[J].农药学学报,2013,15(1):65-72.
[13]Columá A,Cárdenas S,Gallego M,et al.Simplified method for the determination of chlorinated fungicides and insecticides in fruits by gas chromatography[J].J Chromatogr A,2000,882(1/2):193-203.
[14]农业部农药检定所.农药登记残留田间试验标准操作规程[M].北京:中国标准出版社,2007.
[15]中华人民共和国农业部.NY/T 788—2004农药残留实验准则[S].北京:中国标准出版社,2004.
[16]张亚,何可佳,刘薇.烟叶及土壤中菌核净残留分析方法及消解规律[J].农药,2009,48(9):677-679.
[17]张余杰,张亚,刘薇.菌核净在土壤和烟草中残留消解动态研究[J].农药科学与管理,2010,31(1):34-37.
[19]WangX,XiangZ,Yan X,et al.Dissipation rate and residual fate of thiamethoxam in tobacco leaves and soil exposed to field treatments [J].Bulletin of Environmental Contamination and Toxicology,2013,91:246-250.
[20]Wu XM,LongY H,Li J H,et al.Degradation of metolachlor in tobacco field soil[J].Soil and Sediment Contamination,2015,24(4):398-410.
Degradation Rule of Dimetachlone in Celery
CHENXue1,SUPin1,WUJinbin1,WUXiaomao2
(1.Vegetable Production Technique Service Center,Baiyun District of Guiyang City,Guiyang550025,China;2.College of Agronomy,Guizhou University,Guiyang550025,China)
To explore residual contamination risk of dimetachlone,degradation rule of dimetachlone in celery leaf were investigated under field condition using gas chromatography-mass spectrometry(GC-MS).The results showed that degradation of dimetachlone in celery fitted to the first-order kinetics,and the half-life was 6.9 d.Residues of dimetachlone in celery appeared to increase with increasing the application dose and shortening the harvest time.The 40%dimethachlone WP was applied with the dosage of360,720 g/hm2for 3 times in vigorous growth stage of celery,after 14 days application,residues of dimethachlone in celery were less than 0.60 mg/kg. The degradation transformation pathways of dimetachlone in celery were photolysis(or hydrolysis)and dechlorination.
dimetachlone;celery;residue;degradation
S482.2
A
1002-2481(2016)11-1692-04
10.3969/j.issn.1002-2481.2016.11.27
2016-06-23
贵州省农业攻关项目(黔科合NY字[2012]3010号)
陈雪(1980-),女,贵州安顺人,农艺师,主要从事蔬菜病虫害防治及质量安全研究工作。吴小毛为通信作者。
