一株产菌核曲霉的分离鉴定及生物学特性研究
2017-04-14宁露娟韩建荣敖新宇
宁露娟,韩建荣,敖新宇
(1.西南林业大学生命科学学院,云南昆明650224;2.山西大学生命科学学院,山西太原030006)
一株产菌核曲霉的分离鉴定及生物学特性研究
宁露娟1,韩建荣2,敖新宇1
(1.西南林业大学生命科学学院,云南昆明650224;2.山西大学生命科学学院,山西太原030006)
从20种森林土样中共分离出78株曲霉,其中,从四川省南充市西充县华光乡柏树根部土壤中分离得到产菌核曲霉N1菌株;通过对菌落形态、个体形态特征观察及ITSrDNA序列分析,将N1菌株鉴定为黄曲霉原变种(Aspergillus flavus var.flavus)。生物学特性研究结果表明,CYA和CA为N1菌株产菌核的最适培养基,N1菌株的最适产菌核温度为30℃,最适产菌核pH值是6;培养基的碳氮源对菌核生物量有一定影响,最优碳源为蔗糖,最优氮源为蛋白胨,培养基中含碳量在9.88~39.53 g/L、含氮量在0.42~0.84 g/L时,菌核生物量最大;无机盐对N1菌株菌核生物量也具有明显的影响作用。
曲霉;菌核;ITS;生物学特性
曲霉(Aspergillus)属于半知菌亚门(Deuteromycotina)丝孢纲(Hyphomycetes)丝孢目(Moniliates)丛梗孢科(Moniliaceae),其广泛分布在谷物、空气、土壤和各种有机物品上,是引起多种物质霉腐的主要微生物之一,主要作用是酿酒、制醋等。曲霉在幼小而活力旺盛时,菌丝体产生大量的分生孢子梗,分生孢子梗顶端膨大成为顶囊,一般呈球形。顶囊表面长满1层或2层辐射状小梗(初生小梗与次生小梗),其中,最上层小梗瓶状,顶端着生成串的球形分生孢子[1],孢子呈绿、黄、橙、褐、黑等颜色。这些都是菌种鉴定的依据[2]。曲霉属的某些种能产生菌核结构。
菌核[3]是真菌生长到一定阶段,菌丝体不断地分化,相互纠结在一起形成的颜色较深而坚硬的菌丝体组织颗粒,同时它又是糖类和脂类等营养物质的储藏体。菌核形态多样,色泽和大小差异也很大,大菌核可达15 kg,而小菌核只有小米粒大小或者更小。
由于能形成菌核的丝状真菌中有很多是很重要的植物病原体,因而其在农业科学方面引起了十分广泛的研究。同时,在生物科学方面,丝状真菌菌核的形成也引起了众多学者的兴趣,这是因为它们被看作是菌核形态变异简单形式的代表,这使得它们成为研究菌核形态变异这个生物现象的重要模型,而菌核形态变异的机制也为代替传统有毒杀菌剂提供了新的可能。通常,这些真菌在不利的环境条件下可以存活很长时间,具有较强的耐化学性和抗生物降解性[4-6]。产菌核真菌为了抵御来自自然环境中各种各样导致氧胁迫的不良因素,就会形成菌核,并进化出一套有效的抗氧化系统来维持细胞内氧化还原的动态平衡[7]。因而,一般情况下,菌核具有较高的抗氧化活性,可以为利用产菌核曲霉开发相关天然抗氧化剂产品提供一定理论依据。
本试验对20种不同森林土壤样品中的产菌核曲霉进行了选择性分离,并对分离到的菌株运用形态特征观察、核糖体内转录间隔区(ITS)序列分析进行分类鉴定和生物学特性研究,旨在发现更多的产菌核曲霉,并初步确定其产菌核的适宜条件。
1 材料和方法
1.1 土样采集
土壤样品分别采自四川省南充市、云南省昆明市、山西省忻州市和太原市、贵州省都匀市和安顺市、黑龙江省佳木斯市等20个地区针叶林根部表面10~20 cm处土壤。
1.2 分离和形态观察培养基[8-9]
曲霉分离培养基为马丁氏培养基。
采用查氏酵母膏琼脂培养基(CYA)、麦芽汁琼脂培养基(MEA)、查氏琼脂培养基(CA)、马铃薯葡萄糖琼脂培养基(PDA)、25%甘油硝酸盐琼脂培养基(G25N)作为形态观察培养基。
1.3 产菌核曲霉的分离纯化及形态观察
将土壤样品梯度稀释,涂布法均匀涂布于马丁氏平板上,每梯度3个平板,倒置于25℃的恒温培养箱中培养3~5 d后挑取曲霉三点式接种于CA平板上,14 d后筛选出产菌核曲霉菌株,经多次分离纯化得到纯菌株,编号并保存于4℃冰箱。将产菌核曲霉三点式分别接种到CYA,MEA,CA,PDA和G25N平板上,于25℃培养箱内倒置培养14 d,按照文献[1,10]的方法,观察产菌核曲霉的菌落形态特征,显微镜检其分生孢子头、顶囊及菌核等个体形态特征。
1.4 产菌核曲霉的ITS序列分析与分类鉴定
配制CA培养基,待培养基凝固后向培养基表面平整地铺入玻璃纸,在玻璃纸上接种产菌核曲霉,于25℃培养箱内倒置培养3~5 d,收集玻璃纸上的菌丝体,烘干备用。使用Ezup柱式真菌基因组DNA抽提试剂盒(上海生工生物工程股份有限公司)提取产菌核曲霉的DNA,通用引物ITS1和ITS4作为rDNA ITS区段PCR扩增的引物,PCR反应体系及PCR循环条件列于表1,2。扩增完成后,取0.5 μL PCR产物,与1.5 μL含有Mg2+的Loading Buffer混合,Marker 5 μL,1%琼脂糖电泳,150 V,100 mA,20 min后用UV凝胶成像系统电泳观察并保存图片。PCR产物送至生工生物工程(上海)股份有限公司进行测序,将获得的结果在GenBank数据库进行BLAST比对和同源性分析。

表1 PCR反应体系

表2 PCR循环条件
1.5 产菌核曲霉的生物学特性研究[11-13]
1.5.1 最适培养基测定 配制CYA,MEA,CA,PDA和G25N培养基,将产核曲霉的单个菌核三点式接种法接种到上述5种平板上,于25℃培养箱内倒置培养14 d,观察菌落生长情况,测量菌落大小,测定菌核干质量,确定产菌核的最适培养基。
1.5.2 最适产菌核温度测定[8]将产菌核曲霉单个菌核三点式接种到CYA平板上,培养温度分别设定为15,20,25,30,35℃,培养14 d后收集菌核并测定菌核干质量,确定产菌核的最适温度。
1.5.3 最适产菌核pH值测定 用1 mol/L NaOH和1 mol/L HCl调节CYA的pH值,使其pH值分别为4,5,6,7,8,9,10。将产菌核曲霉的单个菌核三点式接种到配制好的CYA平板上,倒置于30℃培养箱内培养14 d,观察记录菌落的生长状况并收集测定菌核干质量,确定产菌核的最适pH值。
1.5.4 最适碳源、氮源测定 分别用葡萄糖、乳糖、麦芽糖、可溶性淀粉和果糖代替CA中的蔗糖;分别用硝酸铵、硫酸铵、氯化铵、蛋白胨和酵母膏代替CA中的硝酸钠。将产菌核曲霉的单个菌核三点式接种到配制好的平板上,倒置于30℃培养箱内培养14 d并测定菌核干质量,确定最适宜产菌核的碳、氮源。
1.5.5 最适碳源、氮源浓度测定 在CA中分别加入蔗糖11.735,23.47,46.94,93.88,187.76 g/L,使得CA中含碳量分别为4.94,9.88,19.76,39.53,79.06 g/L,C/N分别为10∶1,20∶1,40∶1,80∶1,160∶1。在CA中分别加入硝酸钠10.23,5.11,2.56,1.70,1.02 g/L,使得CA中含氮量分别为1.69,0.84,0.42,0.28,0.17 g/L,C/N分别为7.5∶1,15∶1,30∶1,45∶1,75∶1。将产菌核曲霉的单个菌核三点式接种到配制好的平板上,倒置于30℃培养箱内培养14 d并测定菌核干质量,确定产菌核的最适碳源、氮源浓度和C/N。
1.5.6 无机盐利用试验 将CA中的磷酸氢二钾、硫酸镁、氯化钾和硫酸亚铁按照不同组合进行添加,将产菌核曲霉的单个菌核三点式接种到配制好的平板上,倒置于30℃培养箱内培养14 d并测定菌核干质量,观察不同无机盐组合形式对产菌核曲霉生长情况及菌核生物量的影响作用。
1.6 菌核干质量测定
用自来水冲洗平板,将曲霉菌株的孢子冲去并刮洗所形成的菌核,将菌核反复冲洗干净后放置于60℃烘箱烘干,记录菌核干质量。
1.7 数据分析
以上试验均设3次重复,数据用SPSS 17.0进行处理;取3次数据的平均值,结果以平均值±标准差表示;用Duncan多重比较法[14]进行多个均数间两两比较的显著性检验。
2 结果与分析
2.1 产菌核曲霉的分离结果
从20种土壤样品中共分离得到78株曲霉菌株,其中,产菌核霉菌一株,命名为N1。该菌株分离自四川省南充市西充县华光乡的柏树根部土壤样品,采集地点东经106°1′4.27″、北纬37°48′12.78″,海拔395 m。
2.2 N1菌株的菌落形态和个体形态观察结果
N1菌株在CYA培养基上于25℃培养6 d后,菌落直径为58~63 mm,菌落中央灰绿色呈絮状突起,菌落表面聚集大量墨绿色分生孢子,菌落边缘为白色菌丝,孢子底部间隙处有黑色菌核产生,菌核表面有渗出液,菌落边缘可见大量白色未成熟菌核(图1-A);培养基背面可见菌落腐蚀培养基形成放射状沟纹,菌落中心形成菌核处显现黑褐色斑点(图1-A′)。培养第14天,菌落直径59~69 mm,菌落表面均匀分布完全成熟的黑色菌核,渗出液消失(图2-A);培养基背面均匀分布大量黑褐色斑点,有放射状沟纹(图2-A′)。
Nl菌株在MEA培养基上于25℃培养6 d后,菌落直径为52~58 mm,深绿色絮状突起,菌落中央可见少量黑色菌核,无渗出液,菌落边缘为白色菌丝夹杂白色未成熟菌核(图1-B);菌落背面平坦,显现大量白色斑点,菌落边缘分布密集(图1-B′)。培养第14天,菌落直径为53~64 mm,菌落表面均匀分布完全成熟的黑色菌核及未完全成熟的深褐色菌核,未成熟菌核有渗出液(图2-B);培养基背面平坦,较第6天时颜色变深呈浅褐色,白色斑点变少(图2-B′)。
N1菌株在PDA培养基上于25℃培养6 d后,菌落直径为43~48 mm,菌落中央为环形白色絮状突起,菌落表面聚集大量深绿色分生孢子,菌落中心可见少量深褐色未成熟菌核,有渗出液,菌落边缘为白色菌丝夹杂白色未成熟菌核(图1-C);培养基背面平坦,菌落边缘分布白色斑点(图1-C′)。培养第14天,菌落直径为52~60 mm,菌落边缘及菌落中心絮状环带处分布少量完全成熟的黑色菌核及未完全成熟的深褐色菌核,未成熟菌核有渗出液(图2-C);培养基背面平坦,较第6天时颜色略深呈浅黄褐色(图2-C′)。
N1菌株在CA培养基上于25℃培养6 d后,菌落直径为37~42 mm,菌落表面中心聚集黄绿色分生孢子,菌落表面形成大量黑褐色菌核,伴随有浅褐色渗出液,菌落中心渗出液形成小液珠,菌落边缘可见白色菌丝夹杂少量未成熟菌核(图1-D);培养基背面平坦,颜色为浅黄褐色(图1-D′)。培养第14天,菌落直径为39~48 mm,菌落中心聚集大量黄绿色分生孢子,菌落边缘可见白色菌丝,渗出液消失(图2-D);菌落背面平坦,颜色较第6天时加深呈淡黄褐色(图2-D′)。
N1菌株在G25N培养基上于25℃培养6 d,生长缓慢,菌落直径为11~15 mm,呈长毛状突起,菌落中心可见少量淡黄色分生孢子,未见菌核产生(图1-E);培养基背面可见菌落中心形成环状沟纹(图1-E′)。培养第14天,菌落直径为24~33 mm,深黄绿色菌丝呈絮状突起,菌落边缘为黄色菌丝,未产生菌核(图2-E);菌落背面可见放射状沟纹(图2-E′)。
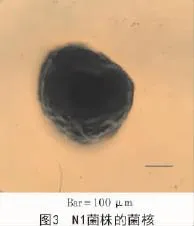
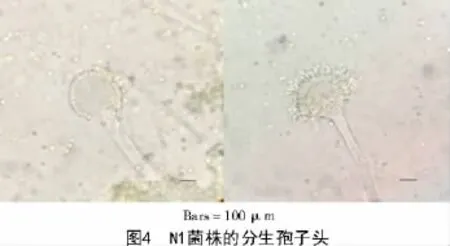
N1菌株在CYA,MEA,PDA及CA培养基上生成的菌核多为近球形(图3),直径为476~520 μm。N1菌株的分生孢子头呈辐射形,291~342 μm;分生孢子梗直径10.8~13.3 μm,壁粗糙,具小刺;顶囊球形或烧瓶形,直径29.7~33.5 μm,产孢结构单层或双层;分生孢子为球形或近球形,3.5~3.8 μm(图4)。


2.3 N1菌株的ITS序列分析与分类鉴定
N1菌株的rDNA ITS区段PCR扩增得到1条单一的目的条带(图5),N1菌株的ITS序列长度大于500 bp。
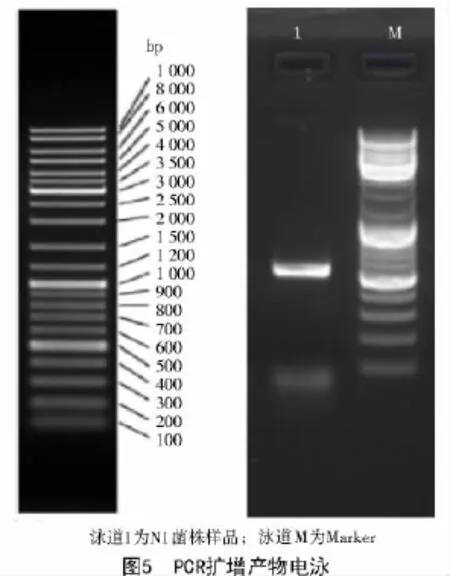
N1菌株rDNA ITS区段测序后,经编辑,长度为568 bp,在GenBank数据库进行比对显示,N1菌株ITS序列与黄曲霉原变种和米曲霉原变种的同源性都为100%。结合N1菌株的形态学特征,根据中国真菌志[8]中的描述,并将N1菌株鉴定为黄曲霉原变种(Aspergillus flavus var.flavus)。登录号:KX572367。
2.4 N1菌株的生物学特性确定
2.4.1 最适培养基 N1菌株在CYA,MEA,PDA上生长迅速,培养6 d时,菌落直径都在60 mm左右,在CA上菌核出现及成熟的时间最短,而在G25N培养基上生长最缓慢并且没有菌核产生。从表3可以看出,在CYA和CA上形成的菌核量较大,所以本试验条件中,将CYA和CA作为N1菌株的最适培养基及最适产菌核培养基。
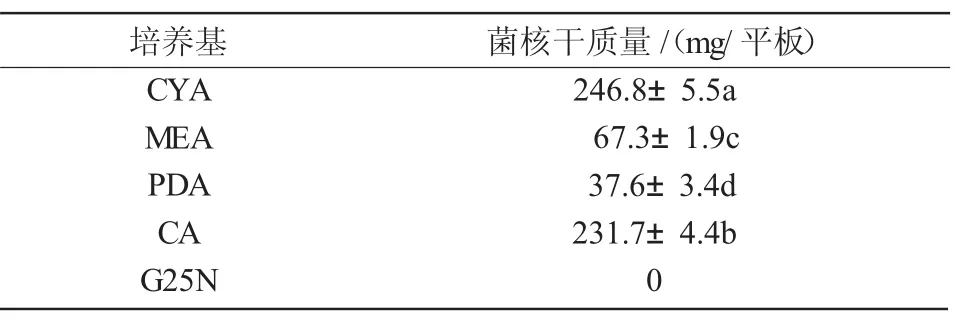
表3 N1菌株在CYA,MEA,PDA,CA,G25N培养14 d的菌核生物量
2.4.2 最适产菌核温度 N1菌株在15~35℃温度范围内均能生长,在25~35℃生长较快,30℃时生长最快。从表4可以看出,20~35℃范围内,N1菌株均能形成菌核,30℃时形成菌核的时间最短,3 d即有成熟菌核产生,且菌核生物量最高;15~20℃菌株生长缓慢,20℃时9~10 d出现菌核;15℃时未形成菌核。可见,温度过低不利于菌落生长及菌核的形成,N1菌株最适产菌核温度为30℃。
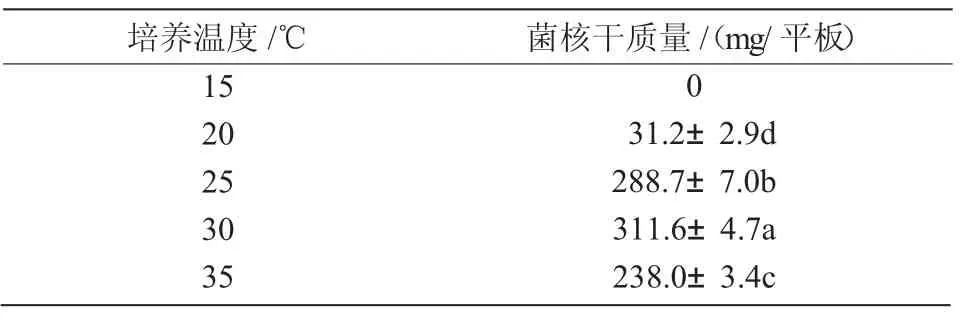
表4 不同培养温度对N1菌株菌核生物量的影响
2.4.3 最适pH值 N1菌株在pH值为4~10的范围内均能生长且产生菌核,其中,pH值为4时培养基呈液体,有菌核产生;pH值为5时培养基呈半固体,菌落生长迅速,产生大量菌核;pH值为6~8时菌株生长最快,菌核成熟时间最短;pH为9和10时,菌落表面分生孢子很少,菌核成熟速度较快。pH值为6~7时,菌核生物量最大(表5),说明中偏酸性的pH条件有利于N1菌株生长发育且形成大量菌核。
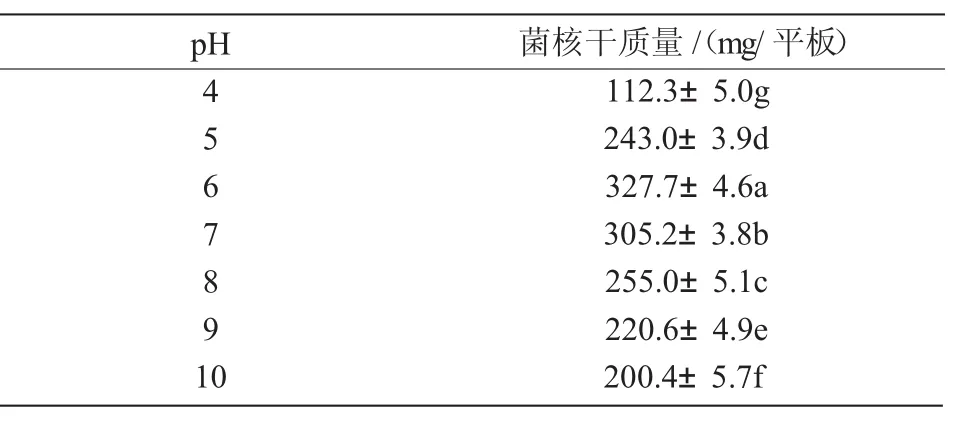
表5 不同pH值对N1菌株菌核生物量的影响
2.4.4 碳氮源利用 由表6可知,CA中不同的碳源、氮源对菌核生物量有一定影响,在试供的6种碳源中,使N1菌株菌核生物量最高的是蔗糖,最低的是乳糖;在6种氮源中,使N1菌株菌核生物量最高的是蛋白胨,当硫酸铵或氯化铵作为培养基的唯一氮源时,菌落生长缓慢,且无菌核产生。所以在本试验条件下,葡萄糖为N1菌株最适碳源,蛋白胨为N1菌株最适氮源。

表6 不同碳源、氮源对N1菌株菌核生物量的影响
从表7可以看出,当CA中氮源浓度保持不变、改变碳源浓度时,菌核生物量有所变化,不同碳源浓度均能使N1菌株形成菌核,在含碳量为9.88~39.53 g/L,C/N为(20∶1)~(80∶1)范围内,菌核生物量较高;同样,在碳源浓度保持不变、改变氮源浓度的情况下,N1菌株的菌核生物量也各不相同,当含氮量为0.42~0.84 g/L,C/N为(30∶1)~(15∶1)时,N1菌株可以形成大量菌核。综上可知,含碳量及含氮量过高或过低时,都不利于菌核形成;培养基中含碳量在9.88~39.53 g/L、含氮量在0.42~0.84 g/L时,N1菌株可以形成大量菌核。2.4.5 无机盐利用 由表8可知,无机盐对N1菌株菌核生物量具有明显的影响作用,除CA原配方外,在不同的添加组合中,K2HPO4+MgSO4,K2HPO4+MgSO4+KCl,K2HPO4+MgSO4+FeSO4菌核生物量较大,说明培养基中必须同时有K2HPO4和MgSO4才能产生大量菌核,表明K2HPO4和MgSO4是N1菌株产菌核所必需的无机盐,在没有MgSO4的条件下,FeSO4与K2HPO4同时存在亦能产生少量菌核,而其余添加组合均未形成菌核。
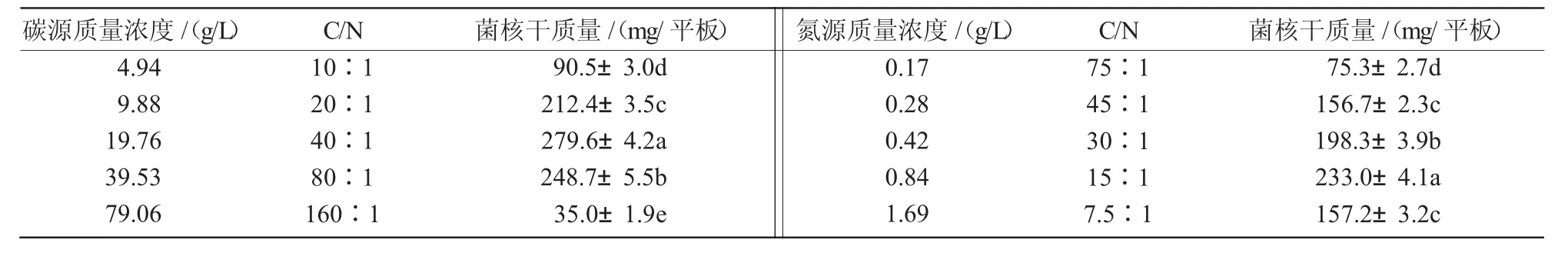
表7 不同碳源浓度和氮源浓度对菌核生物量的影响

表8 无机盐对N1菌株菌核生物量的影响
3 讨论
N1菌株在CYA,PDA,CA培养基上生长时,未成熟菌核表面有渗出液,当菌核完全成熟后渗出液消失。霉菌菌株渗出液中含有无机盐离子、蛋白质、葡萄糖及一些酶类[15],由此猜想,N1菌株渗出液的某些物质是否与菌核发育有关,尚待深入研究。
韩建荣等[16-18]分离得到能产生橙红色菌核的汤姆青霉PT95菌株和能产生橘红色菌核的汤姆青霉Q1菌株,其产生的菌核内可以积累类胡萝卜素。N1菌株所产生的黑色菌核是否也积累某种生物活性物质,还需要对N1菌株菌核中的色素进行分离提取和鉴定。
菌核具有较强的抵抗不良环境的能力,菌核的形成有助于该真菌在没有能力降低由不良环境条件导致氧胁迫的情况下度过不良的生长环境。CHET等[19]做了诸多环境因素对菌核萌发影响的实验,结果证明,菌丝体在与化学物质相接触或与其他微生物相互作用时,容易导致菌核的形成。GEORGIOU等[20-21]对菌核分化进行了深入研究,证明了真菌的菌核分化过程中伴随着高度的脂质过氧化,活性氧(ROS)可以诱导菌核的分化。我们在培养基中添加能导致氧胁迫的外源物质,是否会对N1菌株的菌核分化有所影响以及是否可以进一步提高菌核生物量,还有待进一步研究。
[1]齐祖同.曲霉的分类鉴定[J].酿酒科技,1981,3(7):18-20.
[2]武汉大学,复旦大学.微生物学 [M].北京:人民教育出版社,1980.
[3]ROBERT K ANTIBUS.Formation and structure of sclerotia and scleotium-specific proteins in Hygrophoropsis aurantiaca[J].Mycologia,1989,81(6):905-913.
[4]KUO M J,ALEXANDER M.Inhibition of the lysis of fungi by melanins[J].Journal ofBacteriology,1967,94:624-629.
[5]COLEY-SMITH J R,COOKE R C.Survival and germination offungal sclerotia[J].Annual Reviews ofPhytopathology,1971,9:65-92.
[6]WILLETTS H J.The survival of fungal sclerotia under adverse environmental conditions[J].Biological Reviews,1971,46:387-407.
[7]EVANS J D,ARONSTEIN K,CHEN Y P,et a1.Immune pathways and defence mechanisms in honey bees Apis mellifera[J].Insect Molecular Biology,2006,15(5):645-656.
[8]沈萍,范秀荣,李广武.微生物学实验[M].北京:高等教育出版社,1996.
[9]赵文婧,张泽请,龙丹丹,等.汤姆青霉PT95和Q1菌株产菌核培养基筛选[J].山西大学学报,2013,36(4):622-627.
[10]齐祖同,孔华忠.中国真菌志(第五卷)[M].北京:科学出版社,1997.
[11]李智伟.一株产菌核青霉的分离鉴定及生物学特性研究[D].太原:山西大学,2010.
[12]徐军,崔丽霞,韩建荣.无机盐和碳氮源对青霉PT95类胡萝产率的影响[J].微生物学通报,2003,30(4):77-81.
[13]韩建荣,李智伟,王宇,等.一株产菌核青霉的生物学特性研究[J].山西大学学报,2009,32(4):634-639.
[14]杜荣骞.生物统计学[M].北京:高等教育出版社,1985.
[15]韩建荣,姚鹏,戚敬,等.青霉PT95菌株渗出液的产生及理化性质的研究[J].山西大学学报,2007,30(2):274-278.
[16]韩建荣,王肖娟,原香娥.青霉PT95菌株菌核内产类胡萝卜素的研究[J].微生物学通报,1998,25(6):319-321.
[17]韩建荣,徐军.青霉PT95菌株固态发酵产生类胡萝卜素的研究[J].微生物学报,1999,39(2):148-153.
[18]张泽清.氧胁迫和硒对汤姆青霉菌核分化和抗氧化性的影响研究[D].太原:山西大学,2014.
[19]CHET I,HENIS Y.Sclerotial morphogenesis in fungi[J].Annual Review ofPhytopathology,1975,13:169-192.
[20]GEORGIOU C D,PETROPOULOU K P.Effect of the antioxidant ascorbic acid on sclerotial differentiation in Rhizoctonia solani[J]. Plant Pathology,2001,50:594-600.
[21]SIDERI M,GEORGIOU C D.Differentiation and hydrogen peroxide production in Sclerotium rolfsii are induced by the oxidizing growth factors,light and iron[J].Mycologia,2000,92:1033-1042.
Study on Isolation and Identification of One Aspergillus Strain Producing Sclerotia and Analysis of Its Biological Characteristics
NINGLujuan1,HANJianrong2,AOXinyu1
(1.College ofLife Science,Southwest Forestry University,Kunming 650224,China;2.College ofLife Science,Shanxi University,Taiyuan 030006,China)
Seventy-eight Aspergillus strains were isolated from 20 forest soil samples.One of them could produce sclerotia,which was isolated from the cypress trees soil in Huaguang township,Xichong county,Nanchong city,Sichuan province,named N1.By observing the colonial,individual characteristics and the analysis of ITSrDNA sequence,N1 strain was initially identified to Aspergillus flavus var.flavus.The result ofbiological characteristics showed that the suitable medium for N1 strain producing sclerotia was CYA and CA.The optimum culture temperature for strain N1 was 30℃and the optimum pH was 6.Carbon and nitrogen sources in medium had certain effect on sclemtial biomass of strain N1.The best carbon source was sucrose and the best nitrogen source was peptone.The medium containing 9.88~39.53 g/L carbon and 0.42~0.84 g/L nitrogen,the sclerotia biomass of strain N1 was the largest.Inorganic salts also had obvious effects on sclerotial biomass ofstrain N1.
Aspergillus;sclerotium;ITS;biological characteristics
TQ925+.7
A
1002-2481(2017)03-0365-07
10.3969/j.issn.1002-2481.2017.03.12
2016-10-19
云南省优势特色重点学科生物学一级学科建设项目(50097505)
宁露娟(1991-),女,山西太原人,在读硕士,研究方向:生物化学与分子生物学。敖新宇为通信作者。
