水溶性紫杉醇类前药的研究进展
2017-01-05逯海龙杨金诚刘晓红
逯海龙,杨金诚,刘晓红*
水溶性紫杉醇类前药的研究进展
逯海龙1,杨金诚2,刘晓红2*
本文简要介绍了广谱抗癌药物紫杉醇的发展历史,紫杉醇具有良好的抗肿瘤活性,但其水溶性差影响了临床应用,开发水溶性紫杉醇前体药物具有重要意义。本文分类介绍了高分子和水溶性有机盐两种紫杉醇前药策略。
紫杉醇;前药;合成;水溶性
0 引言
紫杉醇(Paclitaxel,PTX)是从太平洋红豆杉树的树皮中分离出的一种天然产物。Wani和Wall于1963年首次从美国西部森林的太平洋红豆杉(Pacific Yew)树皮和木材中分离到了紫杉醇的粗提物。1971年,Wani和Wall同McPhail[1-2]合作,通过X-射线衍射等手段,确证了粗提物活性成分的确切化学结构-一种骨架为三环二萜的化合物,具体结构为5β,20-环氧-1,2α,4,7β,10β,13α-六羟基紫杉烷-11-烯-9-酮-4,10-二乙酸酯-2-苯甲酸酯-13[(2′R,3′S)-N-苯甲酰-3-苯基异丝氨酸酯](图1),分子量853.92,分子式为C47H51NO14,并将其命名为紫杉醇(Taxol)。紫衫醇具有良好的抗癌活性,成为继阿霉素和顺铂后的第三代抗肿瘤药物,相继被FDA批准用于治疗卵巢癌、乳腺癌、肺癌、前列腺癌等癌症[3]。
紫杉醇的作用机制是促进微管聚合,并能稳定已聚合微管[4]。实验表明,紫杉醇只作用于聚合的微管,不与未聚合的微管相互作用。紫杉醇被肿瘤细胞摄取后,微管在胞内大量积累,有丝分裂停止,肿瘤细胞增殖被阻断。紫杉醇最初主要用于治疗乳腺癌和卵巢癌,Ⅱ~Ⅲ期临床研究表明,其对肺癌、大肠癌、黑色素瘤、头颈部癌、淋巴瘤、脑瘤也有广谱的疗效。

图1 紫杉醇结构
紫杉醇的不足之外:一是来源有限,分离效率低,在人工半合成未成功前,临床应用极大受限;二是水溶性极差(约0.25 μg/mL),给药困难,阻碍了紫杉醇初期的研究和应用。目前,通过半合成的方式,紫杉醇的来源问题已得到了有效解决[5]。但水溶性问题尚没有理想的解决方案。市售处方以无水乙醇与聚氧乙烯蓖麻油(Cremphor EL)的等体积混合溶液来提高紫杉醇的溶解度,注射给药时,仍需要以5%葡萄糖液或生理盐水稀释[6]。而聚氧乙烯蓖麻油降解时,使机体释放组胺,患者使用后,会产生面红、心跳过速、呼吸困难等严重过敏反应[7-8]。为提高紫杉醇的水溶性,降低其不良反应作用,研究者对紫杉醇的2′-OH,7-OH 衍生化,增加亲水性基团,改善水溶性;或通过功能化片段的嵌合,在肿瘤组织高氧、低pH值或特异性的酶作用下,释放出紫杉醇。
1 水溶性紫杉醇前药
目前,增加紫杉醇水溶性的前体药物主要包括两种:水溶性高分子类前药和有机酸碱盐类前药。
1.1 水溶性高分子前药 水溶性高分子负载的紫杉醇前药,是近年来的研究热点。将水溶性高分子聚合物与紫杉醇共价键结合,可以获得优良的药动性能:如缓慢释放,提高药物稳定性,减缓降解,减少排出,实现紫杉醇在血液中的长循环,同时,通过EPR效应,增强其在实体瘤中的蓄积作用。载体高分子在体内易降解,可以被水解吸收,或者排出体外,从而改善药效。
1.1.1 聚乙二醇(PEG)类紫杉醇前药 目前研究者已合成了多种类型的PEG类紫杉醇前药,PEG通过羧化后的羧基或氨基酸与紫杉醇结合。PEG是获得FDA批准的药用合成聚合物之一,其具有直链型结构,有良好的水溶性和生物相容性,无毒、无抗原性,当PEG被连接到药物分子上时,增加了药物的水溶性,并可对药物分子进行柔性的包裹,通过减少药物与体内介质相互作用,减缓药物降解速度,实现缓控释作用。基于上述特点,早在1996年,Greenwald等[9]合成了一系列的紫杉醇-PEG水溶性前体药物(图2),探讨了其聚合物分子量(6 000~40 000,含紫杉醇)与其溶解度的关系,当分子量约为40 kDa,载药量约为4%,体内循环的半衰期大于前药水解的半衰期。在其体内活性实验中,该类型紫杉醇前药延长了P-388处理的小鼠的寿命。Xin等[10]合成了紫杉醇类PEG前药PTX-ANG-PEG-NP,提高了母药通过血脑屏障等向肿瘤组织传递的效率,其抗神经胶质瘤活性明显优于原药紫杉醇,静脉注射剂量为100 mg/kg时,无显著血液、肝脏、肾脏及脑组织急性毒性。
Zhang等[11]通过3步反应合成了(α-Fmoc-ε-Boc-lysine)-PEG-PTX前药。该类前药稳定性良好,系统性毒性较低,载药能力强(36%),并可在体内达到缓释效果,(α-Fmoc-ε-Boc-lysine)-PEG-PTX最大耐受剂量可达120 mg/kg,高于已有的制剂,同时在体内也表现出较原药紫杉醇更优秀的抗肿瘤活性,具有良好的临床开发前景。
Desai等[12]对紫杉醇2′-位的羟基以丁二酸酯化,另一端羧基与聚乙二醇结合,得到2′-酯基紫杉醇前体药物,分子量达5 000,该药物大大提高了原药在水中的稳定性,其半衰期长达74 d。
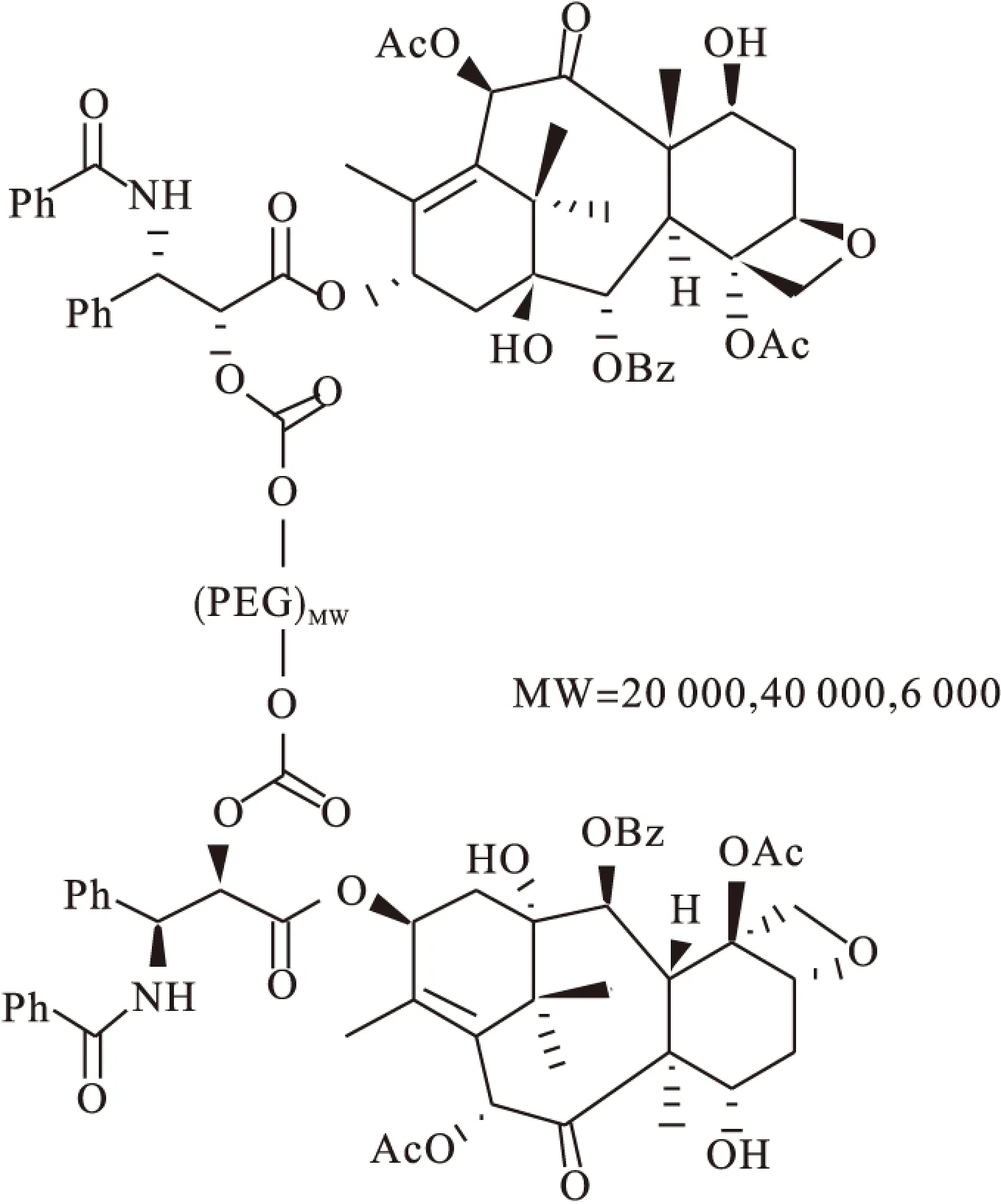
图2 紫杉醇-PEG水溶性前体药物
Lu等[13]发现,紫杉醇-丁二酸-PEG5000前药在水中具有良好的溶解性和稳定性,在MCF-7人乳腺癌细胞中的摄取优于聚乙二醇-聚乳酸紫杉醇前药,利用体内造影技术可见,该前药在肿瘤组织的聚集程度明显优于紫杉醇原药注射。10 mg/kg母药当量给药条件下,小鼠体重无明显下降,增加剂量至15 mg/kg时,前药明显优于紫杉醇原药给药。Gu等[14]合成了聚乙二醇-聚丙烯酸-紫杉醇前药,载药量最高可达42.8 wt%,前药在pH=7.4的磷酸缓冲盐中可以自组装成单分散胶束,MTT法测试前药对HeLa子宫颈癌细胞株和A549肺癌细胞株IC50值,分别为0.18、0.9 μg PTX/mL,较市售制剂活性有较大提高。Arpicco等[15]以末端氨基修饰不同聚合度的NH2-mPEG,并以丁二酸为原料合成了分子量5~20 kDa的紫杉醇前药,但其在MCF-7人乳腺癌细胞和HT-29人结肠癌细胞中只表现出了弱于紫杉醇的细胞毒性。Zou等[16]合成了新型紫杉醇-聚乙二醇-磷酸酯类前药,并在其紫杉醇-磷酸酯结构单元中加入了酸敏感和还原敏感的单硫键片段,实现了53 wt%的高载药量,其水中溶解度也达到了0.68 mg/mL,在肿瘤组织酸性环境中,该前药的释放速度明显优于紫杉醇原药。经测试,前药对人卵巢癌细胞株OVCAR-3、小鼠单核巨噬细胞白血病细胞株raw 264.7的细胞毒性较原药提高了5~8倍。
PEG、PLA等聚合物紫杉醇前药通常可以改善紫杉醇的水溶性和生物利用度,但其在体内快速水解释放出紫杉醇,难以达到理想的母药组织分布效果。Tam等[17]发现,其对7-OH修饰的聚乳酸前药具有更好的稳定性,对A549人肺癌细胞株的IC50值达2.3 nM,与紫杉醇相当。在对小鼠给药时,前药对小鼠体重影响较紫杉醇小。为改善紫杉醇制剂在小鼠肺中的有效分布,Luo等[18]利用点击化学的方法,合成了PEG600-2000的双紫杉醇前药,其在体外磷酸盐缓冲液中的半衰期超过了72 h,同时,对B16-F10小鼠黑色素瘤细胞株和LL/2Lewis肺癌细胞株的活性较市售紫杉醇制剂均有下降。Greenwald等[19]首次通过对7-位羟基修饰,将PEG-紫杉醇前药的溶解度提高到0.1 mmol/mL,在低聚条件下的PE/PEG(聚合度350/750),溶解度仍明显高于原药。以HPLC法分析该类药物,保留时间与紫杉醇差别不大。
Feng等[20]合成了紫杉醇2′-OH与氨基酸成酯后连接PEG链(图3),应用MTT法测定高分子对MCF-7、PG-49、L1210肿瘤细胞株的细胞毒性。与原型药物紫杉醇相比,PEG高分子的水溶性与体外活性均有提高。

图3 PEG-AA-Taxol 前体药
1.1.2 HPMA类前药 1975年,研究者将聚马来酸(HPMA)与小分子药物进行共价结合,但前药迅速水解无法控制母药的释放。在HPMA与母药之间增加氨基酸或寡肽接片段,可有效调节原药的释放速率,达到了更好的效果。PNU166945[21]是紫杉醇-HPMA通过组织蛋白酶可裂解的肽 (GLY-PHE-LEU-GLY)间接结合成酯的前体药物(图4),其水溶性达到了原药的20 000倍,PNU166945在体内经酸和酶作用水解释放紫杉醇,其Ⅰ期临床研究结果表明,水溶性及抗肿瘤活性均增加,但是由于低剂量时即表达了较强的神经毒性,目前临床试验已终止[22]。
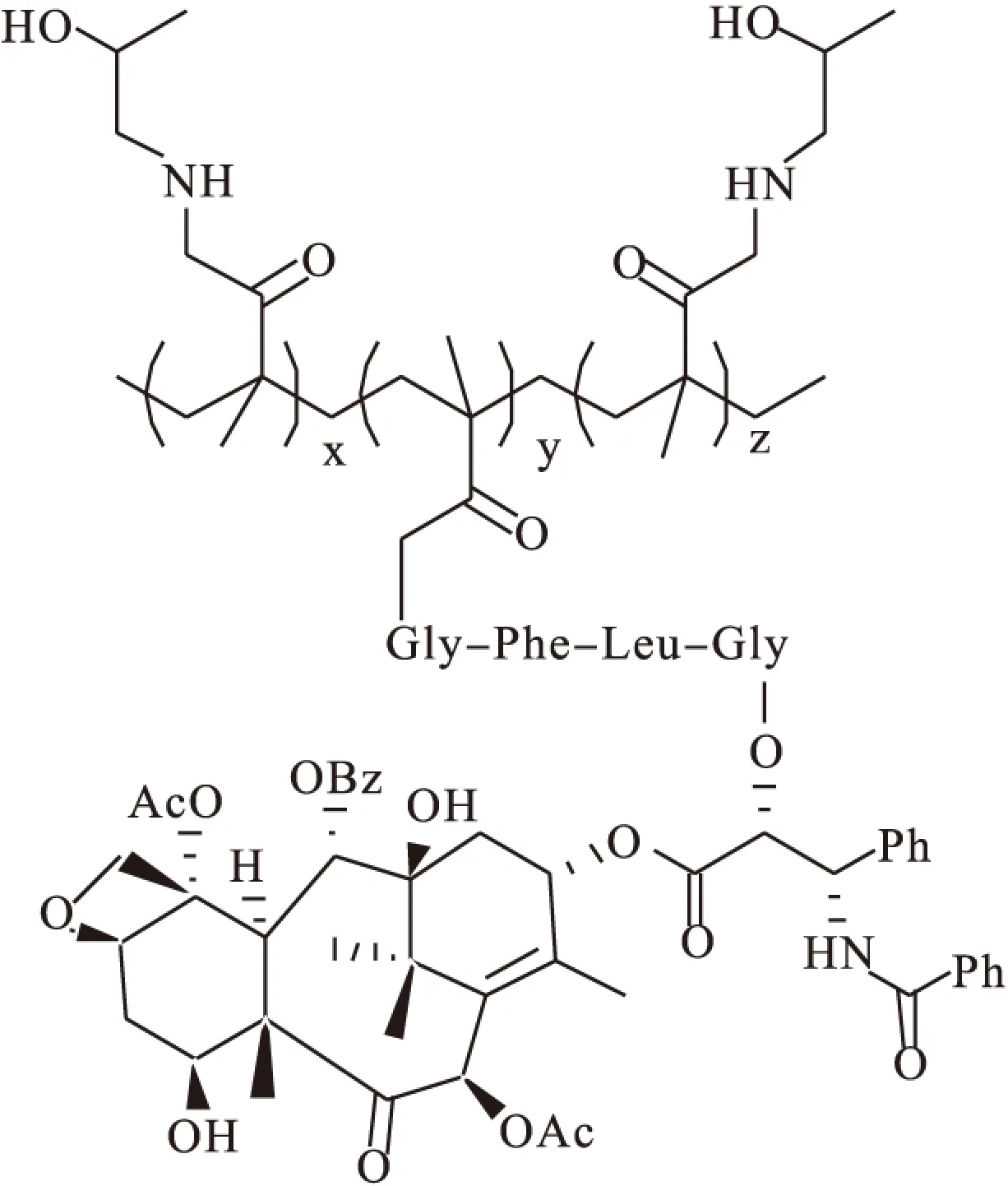
图4 PNU166945结构图
1.1.3 紫杉醇-聚谷氨酸(PG)前药 CT-2103是多聚谷氨酸盐紫杉醇前药[23],也是在紫杉醇2′-OH与聚谷氨酸(PG)成酯(图5)。PG是一个优良水溶性的聚谷氨酸高分子载体,多羧基结构与紫杉醇成酯可提高载药量。PG在体内可被降解,安全吸收。谷氨酸钠盐还降低了紫杉醇的神经毒性,因此前药的使用剂量也得到了有效提高。2006年,PG-TAX和放疗被临床用于协同治疗食管癌和胃癌,效果显著。

图5 CT-2103结构图
2011年,Eldar-Boock等[24]合成了功能化的聚谷氨酸链可溶性紫杉醇前药,对4T1肿瘤细胞IC50值为0.04。近年来聚谷氨酸类紫杉醇前药研究进展迅速,PG-TAX已有2个Ⅲ期临床研究(非小细胞肺癌,卵巢癌)和4个Ⅱ期临床研究(非小细胞肺癌:与放射和卡铂结合,与培美曲塞结合,与前列腺和转移乳腺癌结合及与卡培他滨结合)[25-26]。
透明质酸(HA)是细胞间质的主要成分之一,对细胞的增殖和迁移有重要影响,在肿瘤组织中,HA可以激活激酶信号通路,调节肿瘤组织血管生长[27],一些肿瘤细胞还存在高表达的HA受体如CD44、RHAMM等,因此,HA在前药分子改善水溶性、增强靶向性等方面应用广泛[28]。Luo等[29]合成了紫杉醇-透明质酸(HA)轭合的高分子化合物(图6),紫杉醇与透明质酸以丁二酸-酰腙-己二酸-酰腙的酸敏感键连接,在增强其水溶性和稳定性的同时,HA可以与肿瘤细胞中高表达的CD44受体结合,提高了母药的靶向性。
水溶性树枝状大分子聚酰胺-胺(PAMAM)[30]易于官能团化修饰,可控制聚合度,是合成水溶性前药的理想材料之一,其生物安全性[31]近年也得到了证实。Satsangi等[32]设计将紫杉醇与PAMAM以可被组织蛋白酶B断裂的GFLG四肽连接,合成了前药PGD,评价其对异种移植人源乳腺癌细胞小鼠的体内活性,在组织蛋白酶B高表达的模型中,PGD显示了良好的细胞毒性,而低浓度组织蛋白酶B模型中的结果则相反。PGD给药2~3周后,肿瘤体积与原型药物紫杉醇单独给药对比减小34%~48%。

图6 HA-paclitaxel Bioconjugates
1.2 有机酸、碱、盐类 与高分子前药相比,紫杉醇的有机酸、碱、盐类前药主要提高了其溶解度及稳定性[33-34]。Nicolaou等[35]对紫杉醇2′-羟基修饰合成了2′-(N-甲基吡啶乙酸盐)紫杉醇(图7)。其在固体和水溶液中表现了较高的稳定性,固态下可稳定存在30 d以上。生理环境中缓慢降解,在磷酸缓冲液(PBS)或醋酸铵缓冲液中,该化合物也能稳定存在,但在人血浆中(37 ℃条件下)会迅速降解为紫杉醇。2′-(N-甲基吡啶乙酸盐)紫杉醇对人淋巴瘤、转移性黑色素瘤、宫颈癌细胞表现出了较好的细胞毒性,具有较好的应用前景。
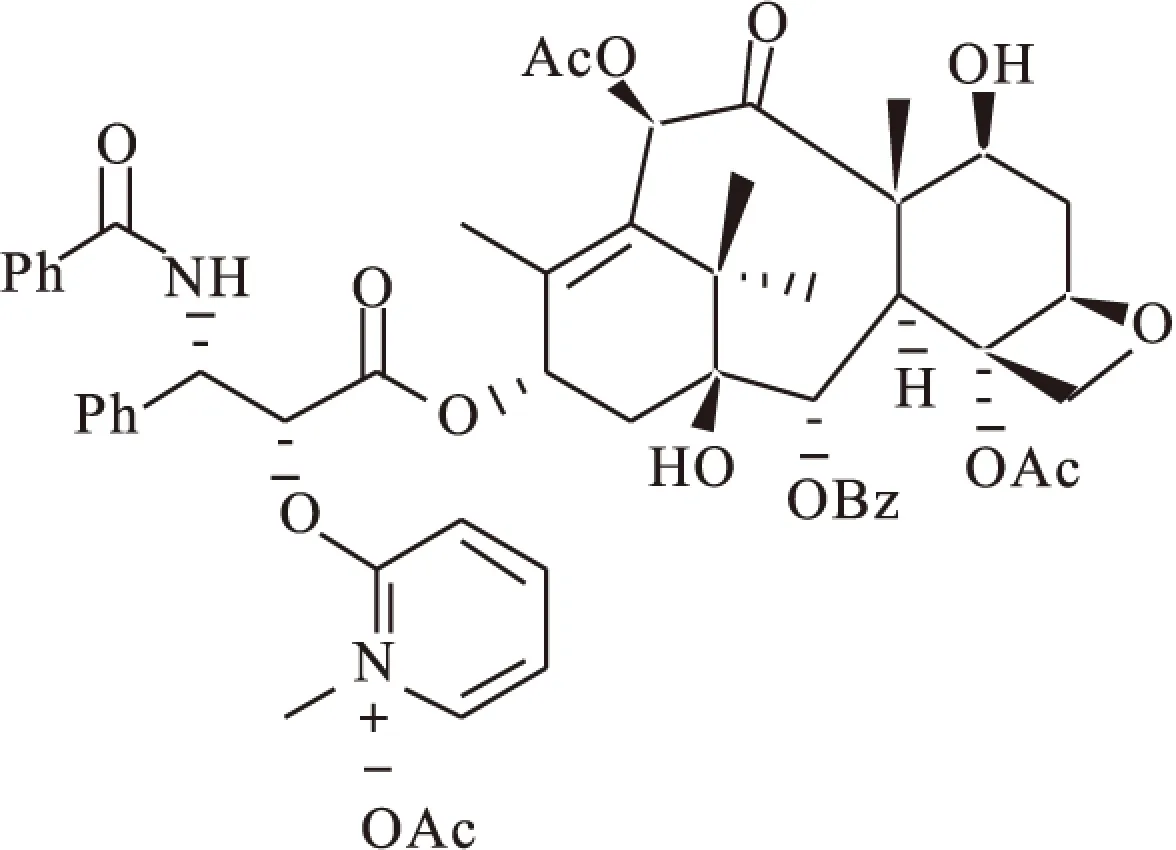
图7 Nicolaou′s taxol-2′-methylpyridinium acetates
Kingston等[36]对紫杉醇的7-位羟基和2′-位羟基进行修饰(图8),与邻苯二甲酸酐反应,再用阳离子交换树脂中和反应,改进了其水溶性和稳定性。以M109小鼠测定其生物活性。
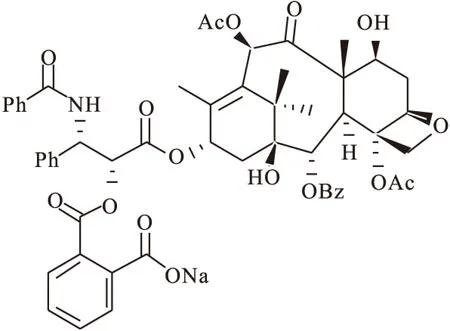
图8 Kingston′s sodium taxol-2′-phthalate
Hostetler等[37]合成了紫杉醇的甲基化、酰基化、磷酸盐衍生物(图9),通过提高其水溶性,促进药物吸收,紫杉醇的磷酸盐衍生物的水溶性较原药显著提高。
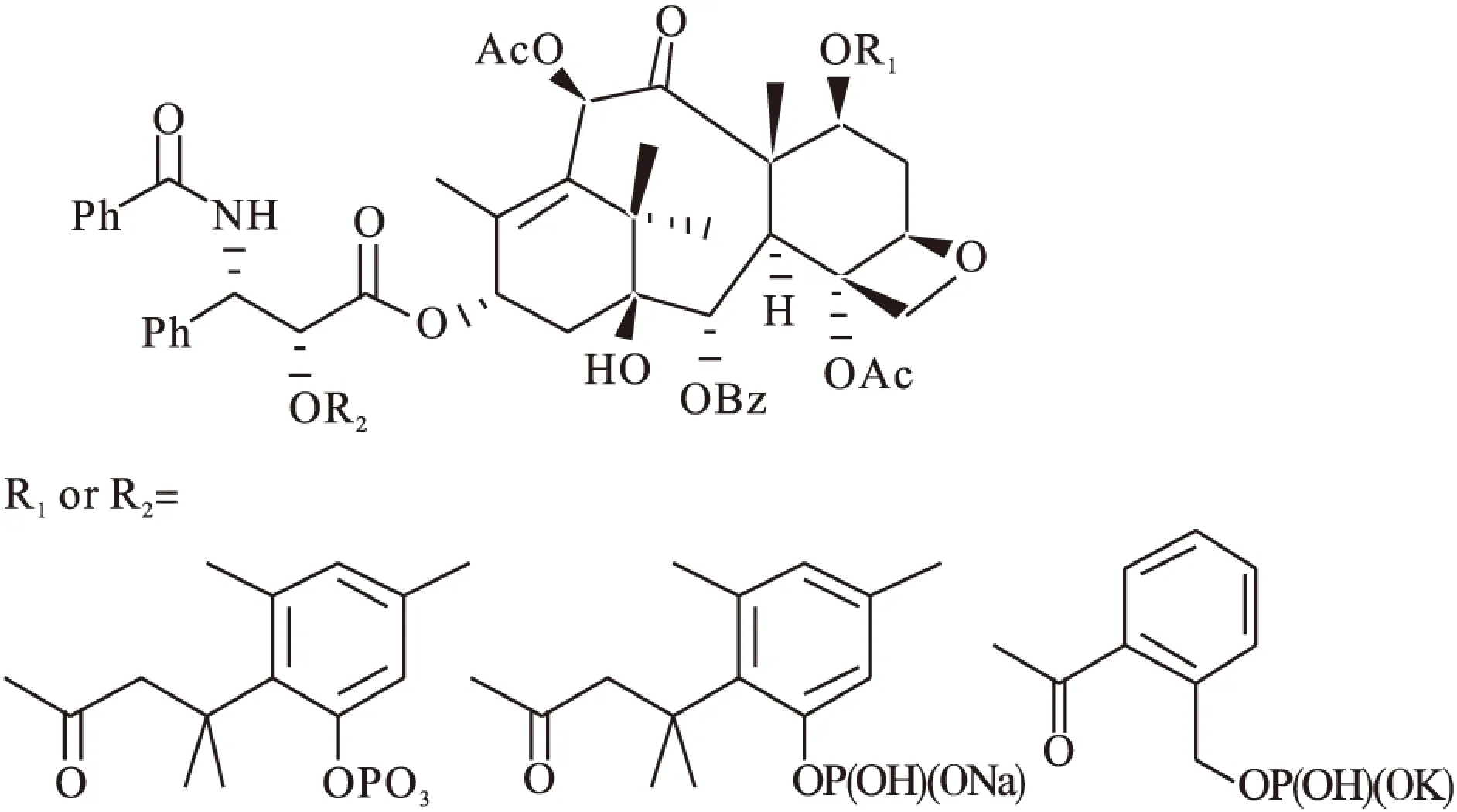
图9 Hostetler′s taxol-2′or 7-phosphate
Lee等[38]等合成了一系列7-位羟基和2′-位羟基与叶酸/谷氨酸成酯的前药化合物,体外细胞毒性实验选取了A-549 肺癌细胞、MCF-7 乳腺癌细胞和HT-29结肠癌细胞为对象,该类药物延长了小鼠的寿命,但活性低于紫杉醇原药。
de Groot等[39]合成了紫杉醇的2′-氨基甲酸酯和碳酸酯前体药物(图10),使其体内稳定性大大提高;测试了前药对7个人类肿瘤细胞系的体外活性,并选取了其中活性较好的化合物进一步开展体内活性研究。

图10 de Groot′s taxol-2′carbamates
2 展望
紫杉醇具有独特的作用机制及广谱的抗癌活性[40-41],但其水溶性差的特点影响了临床应用。设计、合成、开发新的紫杉醇类前体药物,改善其水溶性,对多种恶性肿瘤的治疗具有重要的意义。
[1] Wani MC,Taylor HL,Wall ME,et al.Plant antitumor agents.VI.Isolation and structure of taxol,a novel antileukemic and antitumor agent from Taxus brevifolia[J].J Am Chem Soc,1971,93(9):2325-2327.
[2] Stierle A,Strobel G,Stierle D.Taxol and taxane production by Taxomyces andreanae,an endophytic fungus of Pacific yew[J].Science,1993,260(5105):214-216.
[3] Kinghorn AD.Review of anticancer agents from natural products[J].J Nat Products,2015,78(9):2315.
[4] Prota AE,Bargsten K,Zurwerra D,et al.Molecular mechanism of action of microtubule-stabilizing anticancer agents[J].Science,2013,339(6119):587-590.
[5] Mendoza A,Ishihara Y,Baran PS.Scalable enantioselective total synthesis of taxanes[J].Nat Chem,2012,4(1):21-25.
[6] Khanna C,Rosenberg M,Vail DM.A review of paclitaxel and novel formulations including those suitable for use in dogs[J].J Vet Intern Med,2015,29(4):1006-1012.
[7] Kim YN,Kim JY,Kim JW,et al.The hidden culprit:a case of repeated anaphylaxis to cremophor[J].Allergy Asthma Immunol Res,2016,8(2):174-177.
[8] Castells MC.Anaphylaxis to chemotherapy and monoclonal antibodies[J].Immunol Allergy Clinics North Am,2015,35(2):335-348.
[9] Greenwald RB,Gilbert CW,Pendri A,et al.Drug delivery systems:water soluble taxol 2′-Poly (ethylene glycol) ester prodrugs design and in vivo effectiveness[J].J Med Chem,1996,39(2):424-431.
[10]Xin H,Sha X,Jiang X,et al.Anti-glioblastoma efficacy and safety of paclitaxel-loading angiopep-conjugated dual targeting PEG-PCL nanoparticles[J].Biomaterials,2012,33(32):8167-8176.
[11]Zhang P,Huang Y,Liu H,et al.A PEG-Fmoc conjugate as a nanocarrier for paclitaxel[J].Biomaterials,2014,35(25):7146-7156.
[12]Desai NP,Soon-Shiong P,Sandford PA,et al.Methods for in vivo delivery of substantially water insoluble pharmacologically active agents and compositions useful therefor[P].U.S.Patent:5,439,686,1995-8-8.
[13]Lu J,Chuan X,Zhang H,et al.Free paclitaxel loaded PEGylated-paclitaxel nanoparticles:preparation and comparison with other paclitaxel systems in vitro and in vivo[J].Int J Pharm,2014,471(1):525-535.
[14]Gu Y,Zhong Y,Meng F,et al.Acetal-linked paclitaxel prodrug micellar nanoparticles as a versatile and potent platform for cancer therapy[J].Biomacromolecules,2013,14(8):2772-2780.
[15]Arpicco S,Stella B,Schiavon O,et al.Preparation and characterization of novel poly (ethylene glycol) paclitaxel derivatives[J].Int J Pharm,2013,454(2):653-659.
[16]Zou J,Zhang F,Zhang S,et al.Poly (ethylene oxide)-block-polyphosphoester-graft-paclitaxel conjugates with acid-labile linkages as a pH-sensitive and functional nanoscopic platform for paclitaxel delivery[J].Adv Healthcare Mater,2014,3(3):441-448.
[17]Tam YT,Gao J,Kwon GS.Oligo (lactic acid) n-paclitaxel prodrugs for poly (ethylene glycol)-block-poly (lactic acid) micelles:loading,release,and backbiting conversion for anticancer activity[J].J Am Chem Soc,2016,138(28):8674-8677.
[18]Luo T,Magnusson J,Préat V,et al.Synthesis and in vitro evaluation of polyethylene glycol-paclitaxel conjugates for lung cancer Therapy[J].Pharm Res,2016:1-11.
[19]Greenwald RB,Pendri A,Bolikal D.Highly water soluble taxol derivatives:7-polyethylene glycol carbamates and carbonates[J].J Organic Chem,1995,60(2):331-336.
[20]Feng X,Yuan YJ,Wu JC.Synthesis and evaluation of water-soluble paclitaxel prodrugs[J].Bioorg Med Chem Letters,2002,12(22):3301-3303.
[21]Singh AV,Raichur AM,Dyawanapelly S.Conjugates,polymer-drug:targeted cancer treatment[A].In:Mishra M.Encyclopedia of biomedical polymers and polymeric biomaterials[M].Boca Raton:CRC Press,2015.
[22]Kratz F,Abu Ajaj K,Warnecke A.Anticancer carrier-linked prodrugs in clinical trials[J].Expert Opin Invest Drugs,2007,16(7):1037-1058.
[23]Mohanty AK,Dilnawaz F,Mohanta GP,et al.Polymer-drug conjugates for targeted drug delivery[A].In:Targeted drug delivery:concepts and design[M].Springer International Publishing,2015:389-407.
[24]Eldar-Boock A,Miller K,Sanchis J,et al.Integrin-assisted drug delivery of nano-scaled polymer therapeutics bearing paclitaxel[J].Biomaterials,2011,32(15):3862-3874.
[25]Langer CJ,O′Byrne KJ,Socinski MA,et al.Phase III trial comparing paclitaxel poliglumex (CT-2103,PPX) in combination with carboplatin versus standard paclitaxel and carboplatin in the treatment of PS 2 patients with chemotherapy-naive advanced non-small cell lung cancer[J].J Thoracic Oncol,2008,3(6):623-630.
[26]Marchal S,El Hor A,Millard M,et al.Anticancer drug delivery:an update on clinically applied nanotherapeutics[J].Drugs,2015,75(14):1601-1611.
[27]Dosio F,Arpicco S,Stella B,et al.Hyaluronic acid for anticancer drug and nucleic acid delivery[J].Adv Drug Delivery Rev,2016,97:204-236.
[28]Yang X,Singh A,Choy E,et al.MDR1 siRNA loaded hyaluronic acid-based CD44 targeted nanoparticle systems circumvent paclitaxel resistance in ovarian cancer[J].Sci Rep,2015,5:8509.
[29]Luo Y,Ziebell MR,Prestwich GD.A hyaluronic acid-taxol antitumor bioconjugate targeted to cancer cells[J].Biomacromolecules,2000,1(2):208-218.
[30]Kesharwani P,Banerjee S,Gupta U,et al.PAMAM dendrimers as promising nanocarriers for RNAi therapeutics[J].Materials Today,2015,18(10):565-572.
[31]Tomalia DA,Christensen JB,Boas U.Dendrimers,dendrons,and dendritic polymers:discovery,applications,and the future[M].Cambridge University Press,2012.
[32]Satsangi A,Roy SS,Satsangi RK,et al.Design of a paclitaxel prodrug conjugate for active targeting of an enzyme upregulated in breast cancer cells[J].Molecular Pharmaceutics,2014,11(6):1906-1918.
[33]Ma P,Mumper RJ.Paclitaxel nano-delivery systems:a comprehensive review[J].J Nanomed Nanotech,2013,4(2):1000164.
[34]Vemula PK,Wiradharma N,Ankrum JA,et al.Prodrugs as self-assembled hydrogels:a new paradigm for biomaterials[J].Curr Opin Biotech,2013,24(6):1174-1182.
[35]Nicolaou KC,Guy RK,Pitsinos EN,et al.A water-soluble prodrug of taxol with self-assembling properties[J].Angewandte Chemie International Edition in English,1994,33(15-16):1583-1587.
[36]Kingston DG I,Liang J.Water soluble analogs and prodrugs of taxol[P].U.S.Patent:5,411,984,1995-5-2.
[37]Hostetler KY,Sridhar NC.Prodrugs for oral administration containing taxol or substituted taxol covalently bound to a phospholipid[P].U.S.Patent:5,484,809,1996-1-16.
[38]Lee JW,Lu JY,Low PS,et al.Synthesis and evaluation of taxol-folic acid conjugates as targeted antineoplastics[J].Bioorganic Med Chem,2002,10(7):2397-2414.
[39]de Groot FM H,van Berkom LWA,Scheeren HW.Synthesis and biological evaluation of 2′-carbamate-linked and 2′-carbonate-linked prodrugs of paclitaxel:selective activation by the tumor-associated protease plasmin[J].J Med Chem,2000,43(16):3093-3102.
[40]Wawiak J,Zaprutko L.A brief history of taxol[J].J Med Sci,2016,83(1):47-52.
[41]Priyadarshini K.Paclitaxel against cancer:a short review[J].Med Chem,2012,2:139-141.
Development of water-solubable taxol prodrug
LU Hai-long1,YANG Jin-cheng2,LIU Xiao-hong2*
(1.Ningxia Food & Drug Administration,Yinchuan 750001,China;2.Shenyang Pharmaceutical University,Shenyang 110016,China)
This paper briefly introduces the development history of anti-cancer drug paclitaxel widely used in clinics,which has remarkable anti-tumor activity but has very poor water solubility.To improve its poor solubility,different prodrug strategies have been developed by many research groups.We discuss both macro-molecular and organic-salts strategies of paclitaxel prodrugs that are currently used to make taxol more effective.
Paclitaxel;Prodrug;Synthesis;Water solubility
2016-08-31
1.宁夏食品药品审评认证中心,银川 750001;2.沈阳药科大学,沈阳 110016
*通信作者
10.14053/j.cnki.ppcr.201612031
