大黄素甲醚对胰腺癌SW1990细胞的杀伤作用及其机制
2017-01-05杨勇
杨 勇
大黄素甲醚对胰腺癌SW1990细胞的杀伤作用及其机制
杨 勇*
目的 观察大黄素甲醚对胰腺癌SW1990细胞增殖、细胞周期及凋亡的影响,并探讨其作用机制。方法 Western印迹检测不同浓度大黄素甲醚干预后PI3K/Akt信号通路蛋白水平,MTT检测不同浓度、时间下,大黄素甲醚对SW1990细胞增殖的影响。流式细胞术检测大黄素甲醚对SW1990周期及凋亡的影响。结果 与NC组比较,Physcion组mTOR及p-Akt表达水平呈剂量依赖性下降,Akt表达呈剂量依赖性上升,其中5、50 μmol/L组与NC组比较差异有统计学意义(P<0.05);Physcion组细胞存活率呈时间依赖性下降,在48、72、96 h时,与NC组比较差异有统计学意义(P<0.05)。Physcion组SW1990存活率呈剂量依赖性下降,其中0.5、5、50 μmol/L组与NC组比较差异有统计学意义(P<0.05);与NC组比较,Physcion组停留在G1、G2期细胞比例减少,S期细胞比例升高(P<0.05);Physcion组凋亡率高于NC组(P<0.01)。结论 大黄素甲醚通过抑制Akt磷酸化,调控PI3K/Akt通路,降低胰腺癌细胞存活率,促进其凋亡。
胰腺癌;大黄素甲醚;凋亡
0 引言
胰腺癌的发病率在全球呈现逐年上升及年轻化的趋势,是消化系统恶性肿瘤中预后最差的肿瘤之一,5年生存率低于5%,大部分胰腺癌发现时均失去手术机会[1]。目前的化疗药物及靶向药物对于不能手术的胰腺癌及转移复发的胰腺癌治疗效果较差,而且较容易发生耐药,中药治疗胰腺癌从以往的复方用药发展到现在的单药治疗,取得了一定的研究进展[2]。PI3K/Akt信号通路是肿瘤细胞内重要传导通路之一,该通路被激活后,会抑制肿瘤细胞凋亡,促进肿瘤细胞增殖,调控肿瘤的发生发展[3]。中药大黄在前列腺癌、结肠癌及乳腺癌等恶性肿瘤中应用的研究表明,大黄中的成分如大黄素及蒽醌类可以抑制恶性肿瘤细胞增殖,促进其凋亡,具有一定的抗肿瘤作用[4]。对大黄含有的单剂成分的研究是抗癌中药的研究方向。大黄素乙醚是近期在掌科大黄根中提取出来的,具有对人体低毒低反应的特点。有研究显示,其对结直肠癌及乳腺癌具有抑癌作用[5],但其在胰腺癌中的作用尚无相关报道。本研究采用大黄素乙醚干预胰腺癌细胞,观察细胞增殖、凋亡及细胞周期变化,目的在于观察大黄素乙醚单剂对胰腺癌细胞的杀伤作用,探讨其机制,为临床应用提供实验依据。
1 材料与方法
1.1 材料 人胰腺癌细胞株SW1990购自中科院上海细胞库,采用贴壁细胞培养法,加入含100 U/mL的青霉素及链霉素,在37 ℃、5% CO2饱和湿度培养箱中培养。以0.25%胰蛋白酶消化传代,取对数生长期细胞进行以下实验,所有实验均重复3次,取平均值进行统计分析。大黄素甲醚(CAS No:521-61-9)购自南京景竹生物科技有限公司,DAB显色试剂盒、ECL发光试剂盒及BCA定量试剂盒购自南京凯基生物公司,mTOR多克隆抗体、p-Akt多克隆抗体及Akt多克隆抗体购自美国Santa Cruz生物技术公司,MTT试剂盒购自美国Invitrogen公司,Annexin V-FITC/PI试剂盒购自美国GeneCopoeia公司。实验细胞分为给予大黄素甲醚干预的Physcion组及不给予干预的正常对照组(NC组)。
1.2 方法
1.2.1 Western印迹 Physcion组以5、10、15、20、25 μmol/L浓度梯度的大黄素甲醚分别作用48 h,NC组不给予干预培养48 h,按照蛋白提取试剂盒说明书进行不同浓度梯度大黄素甲醚细胞及NC组细胞的蛋白提取,10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离蛋白,电转移至PVDF膜。5%脱脂奶粉室温下封闭90 min后分别加入不同一抗,孵育过夜加入相应二抗,再次孵育后采用化学发光法进行显色,以β-actin作为内参照。应用BioRad图像分析系统测定蛋白条带吸光度,目标蛋白吸光度/内参照蛋白吸光度=蛋白相对表达量。
1.2.2 MTT法检测不同浓度、不同时间大黄素甲醚干预后的细胞存活率 两组细胞以6×104/mL加入96孔板,培养6 h。细胞贴壁后,Physcion组加入0.05、0.5、5、50 μmol/L浓度梯度的大黄素甲醚,作用48 h;NC组给予DMSO干预,培养48 h,作为加药组,进行平行对照,每个浓度均设3个复孔。48 h后,于每孔内加入5 mg/L的10% MTT液,于37 ℃温箱中孵育4 h,弃上清,加入150 μL DMSO,震荡20 min后测定光密度值(OD值),计算细胞存活率。另取细胞,待贴壁后,Physcion组加入5 μmol/L大黄素甲醚,NC组给予DMSO作为平行对照,分别在细胞培养24、48、72、96 h后进行MTT检测,测定细胞在不同时点的存活率。
1.2.3 流式细胞术检测细胞周期及凋亡 Physcion组(5 μmol/L大黄素甲醚干预24 h)及NC组SW1990培养48 h,移至EP管,1 mL预冷后PBS洗涤,加1 mL预冷70%乙醇,4 ℃条件下固定24 h。1 100 g离心5 min后弃上清。每个样品PBS重悬,加0.5% PI 30 μL、15 μL RNase A (10 mg/mL),4 ℃避光温浴30 min。流式细胞仪检测细胞周期。另取培养48 h的Physcion干预细胞及NC组细胞,依照Annexin V-FITC/PI试剂盒说明书步骤检测细胞凋亡,应用软件Cell Quest分析,计算早期凋亡阳性细胞比例。

2 结果
2.1 大黄素甲醚干预后相关蛋白的表达 Western blot检测不同浓度大黄素甲醚干预前后PI3K-Akt-mTOR信号通路相关蛋白变化,与NC组对比,Physcion组mTOR、p-Akt表达水平呈剂量依赖性下降,在5、50 μmol/L时差异有统计学意义(P<0.05,P<0.01);Akt表达呈剂量依赖性上升,在5、50 μmol/L时差异有统计学意义(P<0.05,P<0.01),见图1。

图1 Western blot检测PI3K-Akt-mTOR信号通路相关蛋白表达
2.2 大黄素甲醚干预后SW1990细胞的存活率 MTT显示,在不给予干预条件下,Physcion组(5 μmol/L)及NC组SW1990细胞培养24、48、72、96 h后,Physcion组细胞存活率呈时间依赖性下降趋势,与NC组比较,在48、72、96 h差异有统计学意义(P<0.05,P<0.01),见图2。Physcion组加入0.05、0.5、5、50 μmol/L的大黄素甲醚作用48 h后,与NC组(Physcion浓度为0)对比,SW1990存活率呈剂量依赖性下降,在浓度0.5、5、50 μmol/L时差异有统计学意义(P<0.05,P<0.01),见图3。
2.3 大黄素甲醚干预后SW1990细胞周期变化 流式细胞仪检测Physcion组(5 μmol/L)及NC组培养48 h后SW1990细胞周期变化。与NC组比较,Physcion组停留在G1及G2期的比例减少,在S期的比例升高,差异有统计学意义(P<0.05),见表1。

图2 不同时间大黄素甲醚(5 μmol/L)处理后细胞存活率

图3 不同浓度大黄素甲醚处理后(培养48 h)细胞存活率
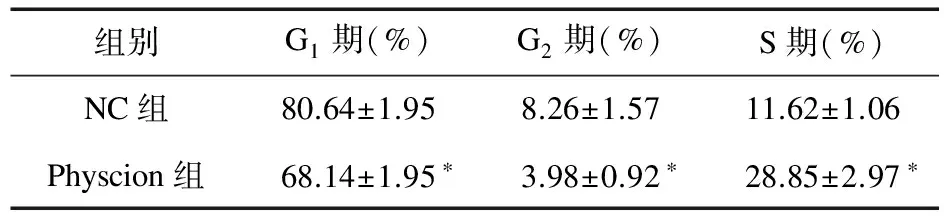
组别G1期(%)G2期(%)S期(%)NC组80.64±1.958.26±1.5711.62±1.06Physcion组68.14±1.95∗3.98±0.92∗28.85±2.97∗
注:*与NC组比较,P<0.05
2.4 大黄素甲醚干预后SW1990细胞凋亡变化 流式细胞仪检测Physcion组(5 μmol/L)及NC组培养48 h后SW1990细胞凋亡变化,结果显示,Physcion组凋亡率高于NC组(42.65% vs.24.81%),差异有统计学意义(P<0.01),见图4。

图4 流式细胞仪检测SW1990凋亡
3 讨论
胰腺癌在确诊时,大部分患者已失去手术时机,以手术为基础的综合治疗在70%的患者中不能实现[6]。化疗及靶向治疗药物对胰腺癌的敏感性差,易发生耐药,中药在胰腺癌的治疗中取得了一定进展,由复方制剂转为单剂治疗是中西医结合治疗的方向[7]。大黄对恶性肿瘤的抑制作用已经在多项研究中证实,但是其成分中起主要抗癌作用的单剂,目前还不清楚。Chen等[8]研究表明,大黄中的大黄素甲醚可以通过下调EMMPRIN表达诱发结直肠癌细胞凋亡,降低存活率,且此作用呈剂量、时间依赖性。EMMPRIN是PI3K/Akt信号通路下游靶基因之一,与多种肿瘤相关,如肺癌、结肠癌、乳腺癌、胰腺癌及子宫内膜癌等[9]。
本研究显示,大黄素甲醚干预后,mTOR及p-Akt表达呈剂量依赖性下降,Akt表达呈现剂量依赖性上升,说明大黄素甲醚对Akt磷酸化具有抑制作用。有研究认为,mTOR活性与Akt Ser473位点磷酸化有关,Akt磷酸化会影响mTOR表达,调控PI3K-Akt信号通路,决定恶性肿瘤细胞的生物行为[10]。本研究显示,大黄素甲醚对胰腺癌细胞存活率具有时间及剂量依赖性抑制作用,随着大黄素甲醚作用时间的延长或剂量的增加,胰腺癌细胞存活率会下降,表明大黄素甲醚能够抑制胰腺癌细胞增殖,降低存活率。大黄素甲醚干预的胰腺癌细胞停留在G1期及G2期比例降低,在S期比例升高,细胞凋亡率也明显增高,表明大黄素甲醚对细胞周期具有调控作用,能够促进更多肿瘤细胞停止分裂增殖,进入程序化死亡过程。Yu等[10]研究认为,mTOR过表达会通过改变蛋白合成、异常调节细胞周期及抑制细胞凋亡等途径促进肿瘤的发生和发展。而大黄素甲醚通过抑制Akt磷酸化,导致mTOR的过表达而抑制肿瘤细胞增殖,促进更多细胞停留在G1期,进入程序化死亡。Xie等[11]通过对大黄素甲醚对肺癌A549细胞作用的研究也显示,大黄素甲醚能够诱导细胞增殖停顿,凋亡增加。刘素华等[12]研究认为,大黄的另一种蒽醌类提取物大黄素葡萄糖苷通过调节Bcl-2水平诱导卵巢癌SKOV3细胞凋亡,Bcl-2也是PI3K/Akt信号通路的主要下游靶基因之一,该通路迅速短暂被激活后,通过多种途径减少肿瘤细胞受损,维持细胞存活,促进DNA损伤修复。Hong等[13]在乳腺癌细胞中的研究也显示,大黄素甲醚可以通过下调Cyclin D1、Cyclin A、CDK4、CDK2及c-Myc表达,抑制Rb蛋白磷酸化,从而使乳腺癌细胞增殖停滞,细胞更容易受损,存活率降低,VEGF释放降低,肿瘤血管减少,血管内皮细胞更容易被破坏,促进肿瘤组织中微血管血栓形成,从而导致肿瘤坏死,发挥抗肿瘤活性。
目前,联合放疗、化疗及中药治疗是胰腺癌综合治疗的探索方向[14],而大部分中药提取物单剂的药理作用目前尚不明确,但是为了发挥中药的药效,减少毒副作用,单剂是目前中药研究的热点课题。本研究显示,在体外试验中,大黄素甲醚能够通过PI3K/Akt信号通路抑制胰腺癌细胞增殖,促进凋亡,对胰腺癌细胞具有杀伤作用,可能作为胰腺癌治疗的中药单剂之一,其抗肿瘤作用需进一步在体试验论证。
[1] Pourhoseingholi MA,Vahedi M,Baghestani AR.Burden of gastrointestinal cancer in Asia-an overview[J].Gastroenterol Hepatol Bed Bench,2015,8(1):19-27.
[2] 潘会君,聂绪强,刘朵,等.4种中药单体对人胰腺癌PANC-1细胞移植瘤生长的影响及分子机制探讨[J].中国中药杂志,2013,38(2):245-248.
[3] Xie HX,Xu ZY,Tang JN,et al.Effect of Huaier on the proliferation and apoptosis of human gastric cancer cells through modulation of the PI3K/AKT signaling pathway[J].Exp Ther Med,2015,10(3):1212-1218.
[4] 赵一俊,邓刚,马立彬,等.大黄素前列腺癌抗肿瘤作用机制研究进展[J].医学研究杂志,2013,42(1):17-19.
[5] Han YT,Chen XH,Gao H,et al.Physcion inhibits the metastatic potential of human colorectal cancer SW620 cells in vitro by suppressing the transcription factor SOX2[J].Acta Pharmacol Sin,2016,37(2):264-275.
[6] Ansari D,Gustafsson A,Andersson R.Update on the management of pancreatic cancer:surgery is not enough[J].World J Gastroenterol,2015,21(11):3157-3165.
[7] 方靖,阮善明,沈敏鹤.胰腺癌中医临床治疗研究概况[J].中医学报,2015,30(3):316-318.
[8] Chen X,Gao H,Han Y,et al.Physcion induces mitochondria-driven apoptosis in colorectal cancer cells via downregulating EMMPRIN[J].Eur J Pharmacol,2015,764:124-133.
[9] Zhao D,Sui Y,Zheng X.miR-331-3p inhibits proliferation and promotes apoptosis by targeting HER2 through the PI3K/Akt and ERK1/2 pathways in colorectal cancer[J].Oncol Rep,2016,35(2):1075-1082.
[10]Yu G,Huang B,Chen G,et al.Phosphatidylethanolamine-binding protein 4 promotes lung cancer cells proliferation and invasion via PI3K/Akt/mTOR axis[J].J Thorac Dis,2015,7(10):1806-1816.
[11]Xie QC,Yang YP.Anti-proliferative of physcion 8-O-β-glucopyranoside isolated from Rumex japonicus Houtt.on A549 cell lines via inducing apoptosis and cell cycle arrest[J].BMC Complement Altern Med,2014,14(10):377.
[12]刘素华.大黄素-8-O-β-D-葡萄糖苷对人卵巢癌细胞系SKOV3细胞凋亡及Bcl-2表达的影响[J].中华医学杂志,2015,95(43):3541-3544.
[13]Hong JY,Chung HJ,Bae SY,et al.Induction of cell cycle arrest and apoptosis by physcion,an anthraquinone Isolated from rhubarb (rhizomes of rheum tanguticum),in MDA-MB-231 human breast cancer cells[J].J Cancer Prev,2014,19(4):273-278.
[14]李荣,李称才,何涛,等.联合手术、术中后区域化疗、中药治疗胰腺癌临床研究[J].中国医药科学,2013,11:186-187.
Mechanism and inhibitory effect of physcion on pancreatic cancer cell SW1990
YANG Yong*
(Department of Emergency,Benxi Central Hospital,Benxi 117022,China)
Objective To observe the effect of physcion on proliferation and apoptosis of pancreatic cancer cell SW1990 and discuss the mechanism.Methods The PI3K-Akt-mTOR signaling pathway was detected by western blot;the proliferation of SW1990 interfered with different concentration of physcion at different time points was observed by MTT assay;the cell cycle and apoptosis affected by physcion was detected by flow cytometry.Results Compared with NC group,the expression of mTOR and p-Akt in physcion groups was dose-dependently decreased,while the expression of Akt was dose-dependently increased;there were significant differences at 5 μmol/L and 50 μmol/L (P<0.05).The cell viability in physcion groups was decreased in a time-dependent or dose-dependent manner,the differences being significant at 48,72 and 96 h (P<0.05) or 0.5,5 and 50 μmol/L(P<0.05).Physcion group has fewer cells staying in phase G1and G2and more cells staying in phase S than NC group (P<0.05) with higher apoptosis rate (P<0.01).Conclusion Physcion decreases the cell viability of pancreatic cancer and promotes the apoptosis by inhibiting the phosphorylation of Akt and controlling the PI3K/Akt pathway.
Pancreatic cancer;Physcion;Apoptosis
2016-04-02
本溪市中心医院急诊科,辽宁 本溪 117022
*通信作者
10.14053/j.cnki.ppcr.201612007
