胼胝体压部可逆性病变的MRI诊断与临床分析
2017-01-04董晓宇高岩张琼予佡剑非
董晓宇 高岩 张琼予 佡剑非
胼胝体压部可逆性病变的MRI诊断与临床分析
董晓宇 高岩 张琼予 佡剑非
目的 探讨胼胝体压部(splenium of the corpus callosum,SCC)可逆性病变的MRI表现及临床特点。方法 回顾性分析8例脑MRI表现为单纯胼胝体压部可逆性病变患者的临床和影像学资料。结果 8例患者的SCC可逆性病变均为继发性,原发病分别为脑内感染5例,肝豆状核变性、低血糖脑病及脑外伤各1例。8例患者均急性起病,临床表现为发热、头痛5例,急性意识障碍2例,肌张力增高2例,颈强2例,均符合原发病的临床表现。8例均行脑MRI检查,均表现为T1低或等信号,T2及FLAIR序列高信号,DWI高信号(提示细胞源性水肿),其中4例行增强扫描未见强化。8例患者均于临床症状好转或消失后复查MRI提示病灶消失。结论 SCC可逆性病变在多种疾病中均可出现,无该病变相关的特异性临床表现,MRI表现提示病灶为细胞源性水肿可能。
胼胝体压部;磁共振波谱学;弥散加权
1996年,Chason等[1]首次描述了在口服抗癫痫药物患者中出现MRI上胼胝体压部(splenium of the corpus callosum SCC)可逆性病变这一现象,之后文献也多以病例报告形式出现[2-5]。SCC可逆性病变的病因各异,多种疾病均可以出现,但其确切的病理生理机制目前仍不清楚。本文对作者医院院经临床及颅脑MRI确诊的8例单纯SCC可逆性病变患者的临床资料回顾性总结分析,期望有助于提高对本病的认识。
1 对象和方法
1.1 观察对象 2009-03至2014-08期间作者医院收治的经临床及脑MRI诊断的单纯SCC可逆性病变患者8例,其中男5例、女3例,年龄17岁~54岁,平均年龄(35.5±12.5)岁。SCC可逆性病变诊断参照Garcia-Monco等[6]的标准:患者伴有神经系统症状、体征;脑MRI提示胼胝体压部(可同时伴有胼胝体压部以外病变);随诊神经系统症状及体征好转,复查颅脑MRI提示病灶消失或影像学改善。8例患者均急性起病,发病至完成颅脑MRI检查时间间隔为1~5 d,中位数(上、下四分位数)为3.5(2.25,4.0)d。
1.2 方法 回顾性分析8例患者的临床表现、实验室检查、影像学表现、治疗及随访资料。实验室检查包括血常规、血生化(肝肾功能及电解质)检查,血清铜、尿铜、血铜蓝蛋白(肝豆状核变性患者),类风湿因子(RF)、抗“O”抗体及C反应蛋白,病毒抗体系列、支原体、衣原体抗体,腰穿查脑脊液,头颅MRI及MRA检查。磁共振采用德国Philips Achieva 3.0 T超导型MRI扫描仪,使用头部表面线圈及相控阵线圈,应用自旋回波序列行横断面T1WI:重复时间(TR) 530 ms,回波时间(TE)7.2 ms;T2WI:TR 5200 ms,TE120 ms扫描,层厚4 mm,层间距2 mm,距阵512×512;液体衰减反转恢复(fluid attenuated inversion recovery,FLAIR):TR 8000 ms,TE 160 ms,翻转角180°,反转时间(time inversion,TI) 2500 ms,层厚4 mm,层间距2 mm,矩阵512×512,视野(field of view,FOV)24 cm×24 cm;扩散加权成像(diffusion weighted imaging,DWI):TR 4200 ms,TE 63 ms,层厚5 mm,层间距3 mm,矩阵256×256,FOV 23 cm×23 cm,b值 1000 s/mm2,常规采用矢状面和横断面成像,部分采用冠状面成像,扫描层厚4 mm,间隔0~3 mm。MRA采用三维时间飞跃(three-dimensional time-of-flight,3D TOF)成像方法,TR 17.24 ms,TE 6.23 ms,FOV 260 mm×260 mm,层厚1.9 mm,层间距0.95 mm,距阵256×256。
2 结果
2.1 临床表现及实验室检查 8例患者的SCC可逆性病变均为继发性,原发病分别为脑内感染5例(其中病毒性脑炎3例、支原体肺炎合并支原体脑炎2例),肝豆状核变性、低血糖脑病及脑外伤各1例(表1)。(1)5例颅内感染患者临床表现均出现发热、头痛,其中1例支原体感染患者伴有恶心、呕吐, 2例病毒性脑炎患者神经科查体出现颈强直。腰穿查脑脊液提示压力分别为170、210、260、150、300 mmH2O(1 mmH2O=0.0098 kPa),脑脊液常规白细胞分别为8×106/L、19×106/L、30×106/L、7×106/L、40×106/L,生化及细菌学涂片均正常(表1病例1,2,3,5,6)。2例支原体感染患者肺CT提示肺间质性炎性反应,肺炎支原体抗体IgM阳性,支原体抗体IgG分别为1︰640、1︰1280,诊断考虑支原体脑炎,其余3例诊断为病毒性脑炎未行脑脊液病原学检查。(2)肝豆状核变性1例,该患者既往慢性肝病史3年,此次入院查谷丙转氨酶325 U/L(正常值0~40 U/L),谷草转氨酶147 U/L(正常值5~31 U/L),血清铜41.40 μg/dL(正常值70~140 ug/dL),铜蓝蛋白0.026 g/L(正常值0.27~0.47 g/L),尿铜8688 ug/24 h(正常值10~60 ug/24 h),入院后经过静脉点滴二硫基丙磺酸钠及保肝治疗好转,诊断肝豆状核病性依据充分。(3)低血糖脑病1例,该患者既往有糖尿病病史10余年,间断口服格列美脲4 mg/d,平素血糖波动较大,此次主因家属发现其嗜睡、周身无力1 d入院,急诊查指血血糖2.2 mmol/L(正常参考值范围3.9~6.4 mmol/L),予静脉推注50%葡萄糖40 mL,并24 h连续静脉滴注葡萄糖溶液治疗,经治疗8 h患者临床症状缓解。(4)脑外伤1例,该患者主因脑外伤后昏迷2 d入院,患者2 d前摩托车外伤后于当地医院治疗,效果不佳后转入作者医院。患者家属描述该患者1周前曾有“感冒”病史,但无发热,为除外颅内感染行腰穿查脑脊液,结果示脑脊液为压力120 mmH2O,细胞数10×106/L,生化及细菌学涂片均正常。
2.2 颅脑MRI检查 8例患者均行脑MRI及MRA检查,其中4例行增强MR扫描。8例患者均为单纯SCC受累,其中5例颅内感染病例SCC中心区呈局限性T1低信号或等信号,T2、FLAIR及DWI呈高信号,肝豆状核变性、低血糖脑病患者及脑外伤患者表现为SCC中心区局限性T1低信号,T2、FLAIR及DWI高信号(图1-4及表1)。8例患者颅脑MRA检查均未见异常改变。
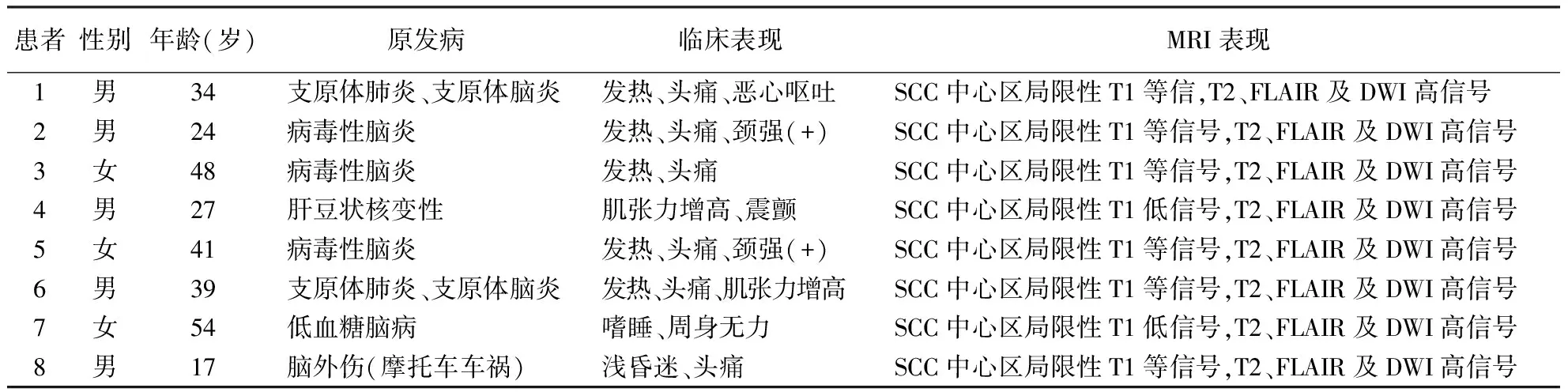
表1 8例SCC病变患者临床及影像学资料
注:SSC.胼胝体压部
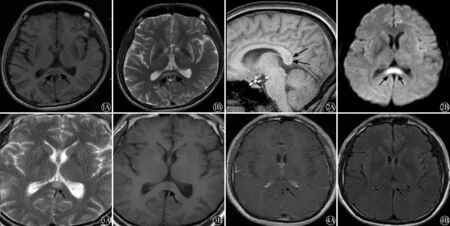
图1 肝豆状核变性患者头部MRI(轴位)表现:SCC中心点T1WI相呈低信号(A),T2WI呈卵圆形局限性高信号(B) 图2 低血糖脑病患者头部MRI表现:SCC处T1加权矢状位呈局限性低信号(A),DWI相呈卵圆形局限性高信号(B) 图3 脑外伤患者头部MRI表现:T2WI相呈局限性高信号(A),SCC中心部位T1WI相呈圆形局限性稍低信号(B) 图4 1例支原体脑炎患者头部MRI表现: SCC中心区T1WI增强扫描病灶无增强效应(A),FLAIR相呈圆形局限性高信号(B)
2.3 治疗及预后 8例患者在院期间均按照原发病诊断予对因治疗。(1)颅内感染患者:支原体感染2例,其中1例予静脉滴注阿奇霉素500 mg/次,1次/d×2周,出院后继续口服阿奇霉素500 mg/天,连续口服1个月,共治疗6周,患者头痛恶心症状消失,门诊复查颅脑MRI显示胼胝体病灶消失;另1例静脉应用阿奇霉素500 mg/次,1次/d×2周,治疗后头痛发热症状缓解出院,家属出院前未同意复查颅脑MRI,发病第12周门诊查MRI显示病灶消失。3例病毒性脑炎患者均予静脉滴注更昔洛韦250 mg/次,2次/d,分别治疗14 d、15 d、18 d,同时根据患者颅内压情况给予降颅压等治疗后,头痛、发热症状缓解,分别在发病第17、19、20天复查颅脑MRI检查,结果显示原SCC病变消失。(2)低血糖患者急诊给予静脉注射葡萄糖治疗纠正低血糖后嗜睡症状改善,转入病房后继续静脉补充葡萄糖治疗,并根据血糖水平调整降糖药物,监测血糖避免低血糖再次发生,在入院后第14天复查颅脑MRI提示原病灶消失。(3)肝豆状核变性给予静脉注射二硫基丙磺酸钠500 mg/次,1次/d,同时给予保肝药物治疗,口服氯硝安定2 mg/次,2次/d口服改善症状。治疗15 d后患者肌张力障碍及震颤症状好转,复查脑MRI提示SCC病灶消失。(4)颅脑外伤患者给予静脉注射甘露醇脱水降颅压、奥拉西坦营养神经及对症治疗,入院第4天神志恢复正常,但一直有头痛症状,治疗18 d后患者头痛症状好转后查脑MRI显示病灶消失。
8例出院3个月后通过门诊及电话进行随访,5例颅内感染及1例低血糖病例临床症状消失,1例外伤患者留有神经性头痛症状,1例肝豆状核变性患者仍表现为肢体肌张力增高,轻度震颤。
3 讨论
SCC局限性可逆性病变由Chason等[1]于1996年首次报道后,Kim等[7]也报道类似病例。之后的10余年间,国外已有多例报道,病因多样,目前报道SCC局限性可逆性病变多见于颅内感染患者,包括轮状病毒性脑炎、埃可病毒性脑炎及其他非特异性病毒感染[3],其他疾病包括小脑炎[2]、颅脑手术术后[8]、低分化胶质瘤[9]、低血糖脑病[10]及溶血性尿毒综合征[11]等。
SCC局限性病变患者缺乏该病变相关的特异性临床表现,多表现为原发性疾病的神经系统症状体征,本组8例患者神经系统症状、体征包括头痛5例,急性意识障碍2例,肌张力增高2例,颈强2例,患者定位诊断考虑均与SCC病变无关,治疗上也均按照原发病治疗,经治疗后患者临床症状缓解同时复查颅脑MRI均提示病灶消失,这与Conti等[12]的研究结论基本一致。
SCC局限性病变在脑CT检查中阳性率低,在脑MRI上主要表现为T2加权及FLAIR成像高信号,T1加权像稍低信号或等信号,病灶增强扫描无强化效应。根据病变范围及形态分为两种:一种为圆形或卵圆形,边界清楚,位于SCC中心位置,另一种病灶范围较前一种扩大,病灶形态不规则或累及整个SCC,病灶均具有可逆性。目前这种影像学改变的发生机制还不十分清楚,既往研究多数认为可能与应用抗癫痫药物有关,是抗癫痫药物产生的一种毒性反应,导致SCC出现一过性的脱髓鞘改变。(1)本组中5例为颅内感染患者(3例病毒性脑炎、2例为支原体脑炎),结合国内黄招君等[13]报道的病例,考虑此种改变与髓鞘水肿有关,颅内感染患者均伴有发热症状,发热、多汗及进食减少等情况导致血清钠水平下降,其水电解质失衡的自身调节保护机制可能不足,SCC水含量与周围组织相比较多,可能比其他部位更易发生细胞毒性水肿。此5例患者中4例治疗过程中出现低钠血症,也与既往文献报道一致。(2)低血糖患者脑内影像学表现多样,但导致SCC局限性可逆性病变临床较为少见。国外有报道导致这一影像学改变的机制仍可能与颅内脑组织渗透压改变有关,脑组织有效渗透压决定自由水在细胞内外的流动,在渗透压性脱髓鞘疾病中起重要作用,有效渗透压约等于血清Na+浓度×2+血清葡萄糖浓度/18[10],因此,当机体出现低钠血症、低血糖时,SCC细胞周围的晶体渗透压降低,自由水进入细胞增多,最终导致细胞毒性水肿,而SCC水含量多,可能更容易受到渗透压改变的影响。(3)本例车祸颅脑外伤患者也出现SCC局限性病灶,既往未见此类病例报道,但Panciani等[8]曾报道1例颅脑手术患者有类似影像学表现。本例患者颅脑增强MRI无病灶强化,DWI表现为局限性细胞源性水肿,此表现最多见于缺血缺氧等情况,分析此例患者可能是由于颅脑外伤后SCC缺血、缺氧,导致钠-钾泵功能下降或细胞外液Na+浓度下降时,使细胞内水含量增多,细胞外液布朗运动减少导致细胞源性水肿发生。(4)楼海燕等[14]曾报道肝豆状核变性患者基底节区出现一过性DWI高信号改变,其原因可能为肝豆状核变性进展过程出伴有局部脑组织水肿及局部代谢水平降低;唐业斌等[15]对93例肝豆状核变性患者的颅脑MRI表现进行分析,其中4例患者出现胼胝体DWI高信号改变,推测可能是铜在脑血管周围的异常沉积而致局部缺血脑组织水肿,导致神经系统细胞变性及神经纤维脱髓鞘改变。综上可见DWI在SCC局限性高信号改变可能与颅内渗透压变化导致SCC髓鞘水肿、缺血缺氧导致胼胝体局部钠-钾泵功能下降以及铜在脑血管周围的异常沉积导致局部缺血及中枢神经细胞变性有关。
本研究中8例患者均在临床症状好转或缓解后复查MRI提示病灶消失,其中6例患者2~3周复查MRI即提示病灶消失,另2例诊断支原体感染的患者经治疗后临床症状迁延,分别第6周及第12周,发热、头痛症状缓解后,复查颅脑MRI发现SCC局限性病灶消失。可见,大部分患者影像学改变与临床缓解一致,影像学表现基本能反映患者当时的临床状态。
目前已知可以累及SCC的疾病包括中枢神经系统淋巴瘤、急性脑梗死、多发性硬化等,以上疾病颅脑MRI均可表现为SCC局限性病灶,但在随诊复查过程中,很少出现SCC局限性可逆性转化这一现象,并且这些疾病也可通过其特有的影像学特点对原发病的诊断提供线索。SCC局限性可逆性需注意与Marchiafava-Bignami病(MBD)相鉴别,MBD由Marchiafava和Bignami在1903年第一次被描述,其最常见于有酗酒史的中老年男性。病变范围以胼胝体的中间部分(中间层)均匀变性为主,有时半卵圆中心和其他白质也可能受到影响[16]。绝大多数学者认为MBD系由B族维生素缺乏引起,部分患者通过补充B族维生素而使临床症状得到改善。MBD患者MRI可表现为SCC病变,并且一般无增强效应,影像学上病灶可以为可逆性改变,但MBD患者影像学病灶的可逆性变化必须在足量维生素治疗使临床症状得到一定的缓解后出现。
综上可见,SCC可逆性病变在多种疾病中均可出现,且无该病变相关的特异性临床表现,颅脑MRI显示病灶为细胞源性水肿,其确切发病机制目前仍不清楚,考虑可能与精氨酸升压素(AVP)功能紊乱或抗癫痫药物作用有关。SCC可逆性病变的治疗以原发病为主,患者大多预后良好。
[1]Chason DP,Fleckenstein JL, Ginsburg MI. Transient Splenial Edema in Epilepsy: MR Imaging Evaluation[A].Proceedings of the 34th annual meeting of the American Society of Neuroradiology, Seattle,WA,USA[C]. Chicago: Old Smith Printers,1996, 7:21-27.
[2]Kato Z, Kozawa R, Hashimoto K, et al. Transient lesion in the splenium of the corpus callosum in acute cerebellitis[J]. J Child Neurol, 2003, 18(4):291-292.
[3]Kobata R, Tsukahara H, Nakai A, et al. Transient MR signal changes in the splenium of the corpus callosum in rotavirus encephalopathy: value of diffusion-weighted imaging [J]. J Comput Assist Tomogr, 2002, 26(5):825-828.
[4]Takahashi Y, Hashimoto N, Tokoroyama H, et al. Reversible splenial lesion in postpartum cerebral angiopathy: a case report[J]. J Neuroimaging, 2014, 24(3): 292-294.
[5]De Greef J, Jaumotte C, Quivron B, et al.Reversible splenial lesion in auto-immune thyroid disease: a case report[J].Acta Clin Belg, 2014, 69(3):208-209.
[6]Garcia-Monco JC, Cortina IE, Ferreira E, et al. Reversible splenial lesion syndrome (RESLES): what’s in a name? [J]. J Neuroimaging, 2011, 21(2):e1-e14.
[7]Kim SS, Chang KH, Kim ST, et al. Focal lesion in the splenium of the corpus callosum in epileptic patients: antiepileptic drug toxicity?[J]. Am J Neuroradiol, 1999, 20(1):125-129.
[8]Panciani PP, Roca E, Lodoli G, et al. Sudden worsening after subdural haematoma surgery: will there be a corpus callosum injury?[J].BMJ Case Rep, 2014, 26(5):2014.
[9]Assencio-Ferreira VJ, Mussi ML, Guirado VM, et al. Transient lesion in the splenium of the corpus callosum in epileptic child with cerebral low grade glioma[J]. Arq Neuropsiquiatr, 2005, 63(1):171-172.
[10]Malik AM. The reversible corpus callosum splenium lesion associated with hypoglycemic encephalopathy[J]. Neurohospitalist, 2013, 3(3):169.
[11]Ogura H, Takaoka M, Kishi M, et al. Reversible MR findingS of hemolytic uremic syndrome with mild encephalopathy[J].Am J Neuroradiol, 1998, 19(6):1144-1145.
[12]Conti M, Salis A, Urigo C, et al. Transient focal lesion in the splenium of the corpus callosum: MR imaging with an attempt to clinical-physiopathological explanation and review of the literature [J]. Radiol Med, 2007, 112(6):921-935.
[13]黄招君,周美鸿,王博,等. 可逆性胼胝体压部病变综合征3例患者临床特点分析[J]. 中国神经免疫学和神经病学杂志, 2014, 21(1): 16-19.
[14]楼海燕,漆剑频,王承缘,等. MR扩散加权成像和波谱联合应用诊断肝豆状核变性[J]. 中华放射学杂志, 2005,39(2): 136-139.
[15]唐业斌,赵科伕,卢琦,等. 肝豆状核变性的临床特征与颅脑MRI表现的相关性分析[J]. 临床放射学杂志,2009,28(9):1220-1223.
[16]Tung CS, Wu SL, Tsou JC, et al. Marchiafava-Bignami disease with widespread lesions and complete recovery[J]. Am J Neuroradiol, 2010, 31(8):1506-1507.
(本文编辑:邹晨双)
Splenium of the corpus callosum lesions-MRI diagnosis and clinical analysis
DONGXiaoyu,GAOYan,ZHANGQiongyu,NAOJianfei*.
*DepartmentofNeurology,ShengJingHospitalAffiliatedtoChinaMedicalUniversity,ShenyangLiaoning110004,China
Corresponding author:NAO Jianfei,Email:dongxy@sj-hospital.org
Objective To investigate the MRI findings and clinical features of reversible lesions in splenium of the corpus callosum (SCC). Methods A retrospective analysis of clinical and imaging datawas adoptedamong 8 cases with pure SCC reversible lesions. Results All SCC reversible lesions of8 patientswere secondary, the primary diseases were: intracranial infection(5 cases), liver degeneration, hypoglycemia encephalopathy and traumatic brain injury(1 case,respectively). All patients had acute onsetand the clinical manifestationsincludingfever, headache(5 cases), acute disturbance of consciousness(2 cases), hypermyotonia(2 cases), neck stiffness(2 cases), were all in accordance with the primary diseases. 8 cases underwent brain MRI. MRI showed low or equal signals on T1WI,high signalonT2WI, FLAIRand DWI(suggested cell-derived edema), there were no enhancement in 4 patients’ enhanced scan. Follow-up MRI showed normalresultswhen clinical symptoms improved or disappeared in 8 patients. Conclusions Reversible lesions of SCC can appear in a variety of diseases,and there are no specific clinical manifestations associated with the disease. MRI shows the lesions may becell-derived edema.
splenium of the corpus callosum;magnetic resonance imaging;diffusion-weighted imaging
10.3969/j.issn.1006-2963.2016.06.005
110004 中国医科大学附属盛京医院神经内科
佡剑非,Email:dongxy@sj-hospital.org
R742.8+9;R816.1
A
1006-2963(2016)06-0403-05
2014-11-11)
