喀纳斯景区山地草甸不同退化阶段群落共有种的生态化学计量特征研究
2017-01-03唐高溶郑伟王祥朱亚琼吴燕锋
唐高溶,郑伟,2*,王祥,朱亚琼,吴燕锋
(1.新疆农业大学草业与环境科学学院,新疆 乌鲁木齐 830052;2.新疆维吾尔自治区草地资源与生态重点实验室,新疆 乌鲁木齐830052)
喀纳斯景区山地草甸不同退化阶段群落共有种的生态化学计量特征研究
唐高溶1,郑伟1,2*,王祥1,朱亚琼1,吴燕锋1
(1.新疆农业大学草业与环境科学学院,新疆 乌鲁木齐 830052;2.新疆维吾尔自治区草地资源与生态重点实验室,新疆 乌鲁木齐830052)
通过在新疆喀纳斯景区山地草甸群落中对不同退化阶段4个典型样点进行样方调查与采样,结合室内分析,探究了不同退化阶段山地草甸群落共有植物及土壤的碳(C)、氮(N)、磷(P)化学计量特征及其内在联系,揭示了山地草甸生态系统养分循环规律和系统稳定机制。研究结果表明,1) 3种群落共有植物的重要值、盖度、密度和生物量都随着草地的退化加剧而上升,平均高度和叶绿素相对含量随着退化的加剧而降低。2) 随着草地退化程度的增加,群落共有种C、N、P含量均下降,草甸早熟禾C∶N则先降低后升高,其余2种共有种均上升;群落Ⅰ中3种共有植物叶片的N∶P都在14和16之间,剩余3个群落中,草甸早熟禾叶片N∶P高于16,而千叶蓍和短柄苔草叶片的N∶P均小于14。3)叶绿素相对含量与植物的N含量呈显著的正相关,植物盖度与其化学计量比的相关性不显著,植物的高度、密度、生物量与其化学计量比相关性的显著性取决于物种和生境。4)土壤的C、N、P含量均影响植物的C、N、P含量,呈显著的线性正相关。喀纳斯景区未退化阶段的植物生长受N、P双重元素的限制或者均不受限,退化阶段的植物生长主要受N的限制。因此,喀纳斯景区山地草甸土壤生态化学特征对退化山地草甸的植被恢复有着重要影响。
山地草甸;退化阶段;共有种;生态化学计量;营养限制
生态化学计量学结合了生物学和化学等基本原理,是研究生态系统能量平衡和多重化学元素(主要是碳、氮、磷)平衡的科学[1]。碳(carbon, C)是植物各种生理生化过程的底物与能量来源,也是衡量生态系统有机物质储量的一个主要指标[2];氮(nitrogen, N)、磷(phosphorus, P)是植物生长的主要限制因子,并且这种限制作用可以通过植物的N、P含量及N∶P反映出来[3-4]。Redfield第一次把化学计量学引入到生态学的研究中,他发现了海洋浮游植物的C∶N∶P=106∶16∶1,被称为Redfield比率,很好地解释了海洋浮游植物种群增长与环境养分供应间的关系[5]。因此,生态化学计量学有助于科学解释植物和生态系统养分供应与需求平衡等方面的难题,其优点是通过分析生态系统组成部分的元素含量及其比值关系,能更加深入地认识养分耦合循环特征、驱动力及其机制等问题[6]。
植物对环境表现出适应性,在土壤资源和利用方式存在差异的生境中,植物体的生态化学计量特征也会呈现一定的分异规律[7-8]。植物体的营养元素与土壤养分相互回馈、相互耦合[9],向土壤中添加N、P,植物器官(叶片)的N、P浓度也会随之增加[10-11]。那么由于放牧、刈割、围封等措施导致的生境差异,是否影响了植物的营养元素与土壤养分间的耦合呢?雒明伟等[12]研究发现,青藏公路筑路取土迹地叶片N含量与土壤全氮相关性不显著,叶片P含量与土壤全磷含量显著正相关,筑路取土迹地恢复群落比天然群落更容易受到P元素的限制。徐沙等[13]比较了围封、放牧和割草3种利用方式下草地优势植物的生态化学计量特征,发现放牧增加了植物N、P的含量,围封样地土壤更加缺N,而放牧样地更加缺P;适度放牧能提高土壤养分的含量,有利于植物的生长。植物群落的不同演替阶段甚至是植物的不同生长阶段对植物体生态化学计量特征的分异规律也有影响[14-16]。刘万德等[14]对云南普洱地区不同生长阶段的植物化学计量特征研究表明:N含量、C含量、C∶N、N∶P及C∶P均主要受植物生长阶段的影响,而P含量主要受物种与生长阶段的交互作用影响。青烨等[15]对若尔盖高寒退化湿地土壤生态化学计量特征研究表明:鼠类洞穴密度与碳磷比、全磷具有极显著的正相关,而土层深度与所有碳、氮、磷化学计量特征都具有极显著的负相关性。银晓瑞等[16]对内蒙古典型草原不同恢复演替阶段植物生态化学计量特征研究发现:植物叶的N∶P和C∶N表现为严重退化群落最低,与退化程度呈负相关;严重退化群落植物相对于P而言,总体上表现为缺N;而恢复群落相对于N而言,更为缺P,或同时缺N和P。Elser等[17]和Liu等[18]总结了植物生长与营养元素供给之间的关系,认为当N∶P小于14,植物生长受N限制;当N∶P大于16,植物生长受P限制;当N∶P在14与16之间,植物生长受N、P双重元素的限制或者均不受限。由此可见,从植物生态化学计量特征的角度去阐释植物适应生境的生态策略变化具有重要理论意义。
喀纳斯景区山地草甸是景区草地的重要组成部分,是景区重要景点维系青山绿水、五彩花海和草原“原生态”游牧的重要物质保障[19]。但在旅游和放牧干扰的双重作用下,山地草甸群落植物向“低矮化、伴人化”方向发展[20-21],土壤理化性质恶化[22]。这种生境的改变与植物表型的变化是否会削弱植物营养元素与土壤养分间的耦合关系?现有的研究关注较多的是群落优势种的生态化学计量特征[7],而对不同退化阶段群落共有种的生态化学计量特征研究尚不多见。另外,关于不同退化阶段群落共有种叶片叶绿素含量、数量特征(高度、盖度、密度、生物量)及地位变化(重要值)与植物叶片C、N、P化学计量学特征的关系的研究也较少。因此,本研究以喀纳斯景区山地草甸的4个不同退化阶段群落共有种为研究对象,试图:1)揭示喀纳斯景区不同退化草地群落共有物种与土壤的C、N、P化学计量格局;2)探索不同草地群落的共有种叶片叶绿素相对含量、群落数量特征(高度、盖度、密度、生物量等)、重要值与植物叶片C、N、P化学计量学特征的关系;3)分析“土壤源”与“植物库”之间N、P化学计量学特征的相关性;4)分析“植物源”与“土壤库”的C含量、C贮存之间的内在联系。以期利用山地草甸群落共有种生态化学计量特征的变化揭示其退化程度,深入认识山地草甸生态系统养分循环规律和系统稳定机制,丰富草地生态系统化学计量学研究内容。
1 材料与方法
1.1 研究区概况
本研究选在新疆维吾尔自治区喀纳斯景区内,地理坐标:N 48°35′-49°11′,E 86°54′-87°54′。景区总面积25万hm2,海拔在1064~3147 m之间。研究区大陆性气候特征明显,多年平均降水量1065.4 mm,蒸发量约1097 mm,两者大致持平。年平均气温-0.2 ℃,≥5 ℃和≥10 ℃年积温分别为1790.4和1595.4 ℃。春秋温暖,全年无夏季,冬季长达7个月,最冷月1月均温为-16 ℃,最热月7月均温为15 ℃,无霜期为80~108 d。景区草地主要由高山草甸、亚高山草甸、山地草甸组成。研究区草地植被类型为山地草甸的杂类草-禾草草甸,分布在海拔1300~1800 m的河谷阶地、缓斜坡地、坡地及谷地上,草层高度为25~70 cm,草层盖度56%~99%。土壤类型为草甸黑钙土,有机质含量在10%~25%之间[22]。喀纳斯草地植物种类组成丰富,本研究主要选择了喀纳斯4个典型的群落:Ⅰ)以地榆(Sanguisorbaofficinalis)和草甸早熟禾(Poapratensis)为优势种的结构稳定的群落;Ⅱ)以无芒雀麦(Bromusinermis)和草甸早熟禾为优势种的轻度退化的草地群落;Ⅲ)以短柄苔草(Carexpediformis)和千叶蓍(Achilleamillefolium)为优势种的中度退化草地群落;Ⅳ)以千叶蓍和药用蒲公英(Taraxacumofficinale)为优势种的重度退化草地群落,研究样地物种组成及利用方式见表1。
表1 研究样地概况
Table 1 Description of the experiment sites

群落代号Communitycode地理位置Geographicallocation群落组成Community退化状态Degradedstates利用方式UtilizationmodesⅠE87°02'10″N48°37'52″地榆+草甸早熟禾S.officinalis+P.pratensis未退化Non-degraded轻度放牧+割草Lightgrazing+mowingⅡE87°01'49″N48°42'49″无芒雀麦+草甸早熟禾B.inermis+P.pratensis轻度退化Lightdegraded中度放牧ModerategrazingⅢE87°02'07″N48°39'33″短柄苔草+千叶蓍C.pediformis+A.millefolium中度退化Mediumdegraded旅游+中度放牧Tourism+moderategrazingⅣE87°01'19″N48°41'39″千叶蓍+药用蒲公英A.millefolium+T.officinale重度退化Heavy-degraded旅游+重度放牧Tourism+heavygrazing
1.2 样品的采集与测定
本研究所需样品均采集于2015年8月上旬(植物生长旺季),在每个典型群落内随机设置10个1 m×1 m的样方。分种记录样方内的植物种类、群落盖度、各物种的分盖度、密度、高度,齐地面分种刈割收集样方内植物,测定生物量后带回。在分种样方内每种植物选择5~10株,在距离叶基部1/2处,用SPAD-502puls便携式叶绿素仪(柯尼卡美能达,日本)分别测定其叶绿素相对含量。在植物样品采集完毕后,再分别采集每个样方下0~5 cm、5~10 cm、10~20 cm、20~30 cm 4个深度层次的土壤,同一样地取同层的混合样。植物样品带回实验室后,首先放置在烘箱内,以105 ℃下杀青15 min,65 ℃烘干至恒重,冷却后用球磨仪研磨待测。土壤样品装入自封袋中带回实验室风干,研磨后过100目(150 μm)筛,进一步分析样品的总氮、总磷及土壤等指标。各指标的测定方法如下:植物和土壤样品的有机碳(C)、全氮(N)测定采用碳氮元素分析仪(Elementar Analyzer 3000,意大利),植物样品测定全磷(P)采用钒钼黄比色法,而土壤样品测定全磷(P)采用钼锑抗比色法[23]。
1.3 数据分析
采用Excel 2013对数据进行预处理。用SPSS 20.0对不同退化群落共有种叶片的C、N、P含量、相对叶绿素含量、生态化学计量比、土壤的C、N、P含量及生态化学计量比进行单因素方差分析(One-way ANOVA),并采用LSD多重比较分析不同群落间的差异,利用Pearson相关系数进行相关分析。实验数据均表示为平均值±标准误差。
2 结果与分析
2.1 不同退化群落共有物种的数量特征
由表2可知,4个典型群落的共有种分别为草甸早熟禾、短柄苔草和千叶蓍。整体上,3种群落共有植物的重要值、盖度、密度和生物量都随着草地的退化加剧而上升(表3)。平均高度和叶绿素相对含量却随着退化的加剧而降低。从群落Ⅰ到群落Ⅳ,3种群落共有植物高度分别下降了49.84%,65.15%,73.44%;叶绿素相对含量分别下降了29.85%,48.29%,62.23%。草甸早熟禾的重要值、盖度、密度和生物量分别上升了108.25%,363.33%,171.11%,89.84%;短柄苔草分别上升了185.88%,392.86%,542.61%,644.89%;千叶蓍分别上升了683.02%,158.33%,598.15%,188.89%。由此可知,千叶蓍高度和叶绿素相对含量的下降速率在3种群落共有植物中最高,重要值和密度上升的速率最高。短柄苔草在盖度和生物量上升速率最高。
表2 研究区4个典型群落物种及其重要值
Table 2 Species and important values of four typical communities in the study area
注:表中符号“-”表示研究样地中没有该植物。
Note: The Table symbol “-” indicates no plant in the sample.
2.2 不同退化群落共有物种叶片的C、N、P含量及化学计量比
由表4可知,4个群落的共有种C、N、P含量都随着草地退化的加剧而降低,群落Ⅰ的C、N、P含量均显著高于群落Ⅳ(P<0.05)。从群落Ⅰ到群落Ⅳ,草甸早熟禾叶片的C、N、P含量分别下降了3.64%,16.17%,38.89%(变异系数分别为1.63%,27.97%,13.72%);短柄苔草叶片的C、N、P含量分别下降了3.48%,45.11%,31.25%(变异系数分别为1.54%,13.54%,20.07%);千叶蓍叶片的C、N、P含量分别下降了3.07%,42.43%,41.67%(变异系数分别为1.54%,23.79%,18.14%)。
3种群落共有植物的C∶N、C∶P、N∶P均随着草地退化的加剧而上升,群落Ⅳ的草甸早熟禾叶片C∶N、C∶P显著高于其他3个群落(P<0.05)。群落Ⅰ中3种共有植物叶片的N∶P都在14和16之间,在剩下3个群落中,草甸早熟禾叶片N∶P高于16,而千叶蓍和短柄苔草叶片的N∶P均小于14。
表3 不同退化群落中共有种的数量特征
Table 3 Quantitative characteristics of common species in different degraded communities
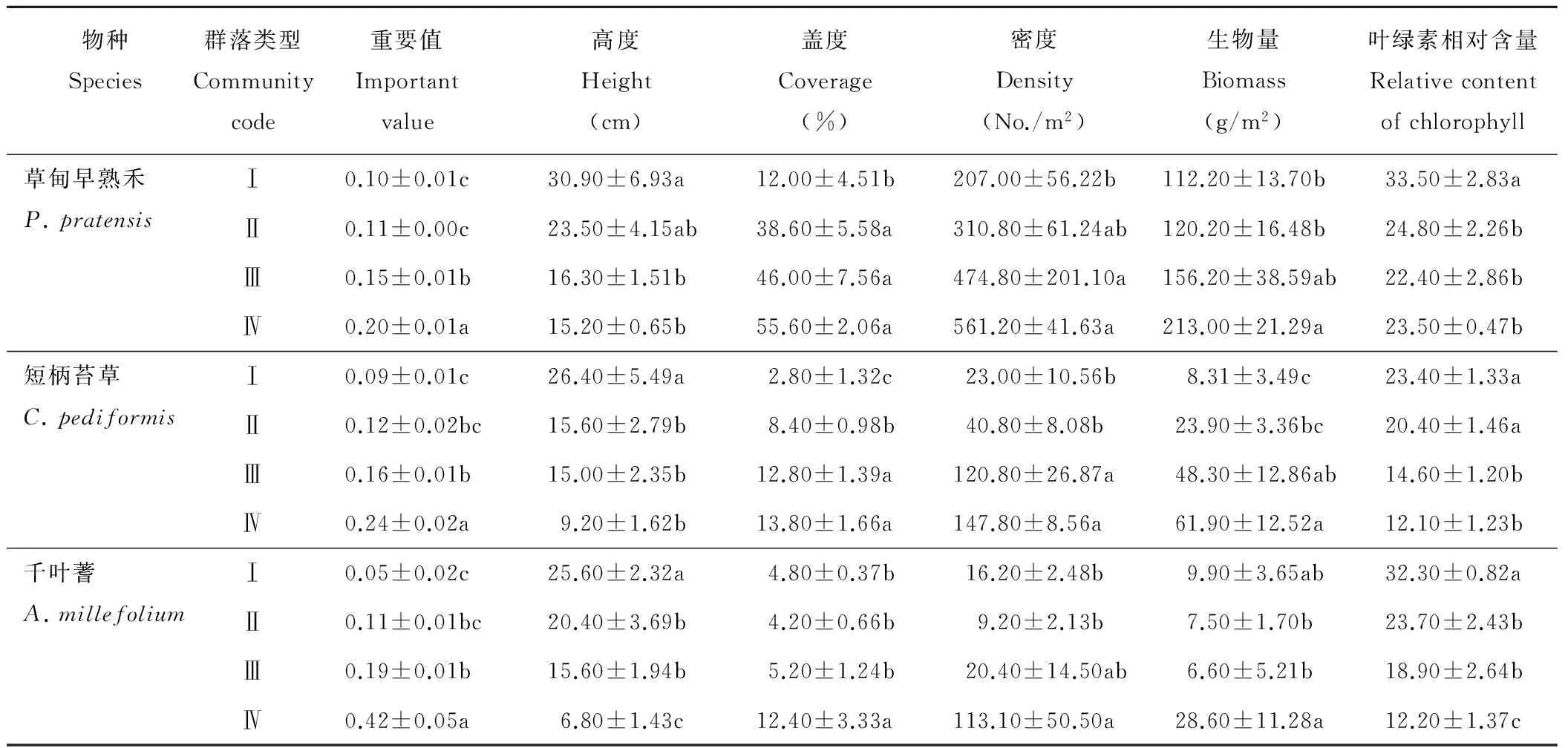
物种Species群落类型Communitycode重要值Importantvalue高度Height(cm)盖度Coverage(%)密度Density(No./m2)生物量Biomass(g/m2)叶绿素相对含量Relativecontentofchlorophyll草甸早熟禾P.pratensisⅠ0.10±0.01c30.90±6.93a12.00±4.51b207.00±56.22b112.20±13.70b33.50±2.83aⅡ0.11±0.00c23.50±4.15ab38.60±5.58a310.80±61.24ab120.20±16.48b24.80±2.26bⅢ0.15±0.01b16.30±1.51b46.00±7.56a474.80±201.10a156.20±38.59ab22.40±2.86bⅣ0.20±0.01a15.20±0.65b55.60±2.06a561.20±41.63a213.00±21.29a23.50±0.47b短柄苔草C.pediformisⅠ0.09±0.01c26.40±5.49a2.80±1.32c23.00±10.56b8.31±3.49c23.40±1.33aⅡ0.12±0.02bc15.60±2.79b8.40±0.98b40.80±8.08b23.90±3.36bc20.40±1.46aⅢ0.16±0.01b15.00±2.35b12.80±1.39a120.80±26.87a48.30±12.86ab14.60±1.20bⅣ0.24±0.02a9.20±1.62b13.80±1.66a147.80±8.56a61.90±12.52a12.10±1.23b千叶蓍A.millefoliumⅠ0.05±0.02c25.60±2.32a4.80±0.37b16.20±2.48b9.90±3.65ab32.30±0.82aⅡ0.11±0.01bc20.40±3.69b4.20±0.66b9.20±2.13b7.50±1.70b23.70±2.43bⅢ0.19±0.01b15.60±1.94b5.20±1.24b20.40±14.50ab6.60±5.21b18.90±2.64bⅣ0.42±0.05a6.80±1.43c12.40±3.33a113.10±50.50a28.60±11.28a12.20±1.37c
注:同列不同字母表示均值间差异显著(P<0.05),下同。
Note: Different letters within the same column mean significant differences (P<0.05), the same below.
表4 不同退化群落共有种叶片生态化学计量学特征
Table 4 Ecological stoichiometry characteristics of leaf in different degraded communities
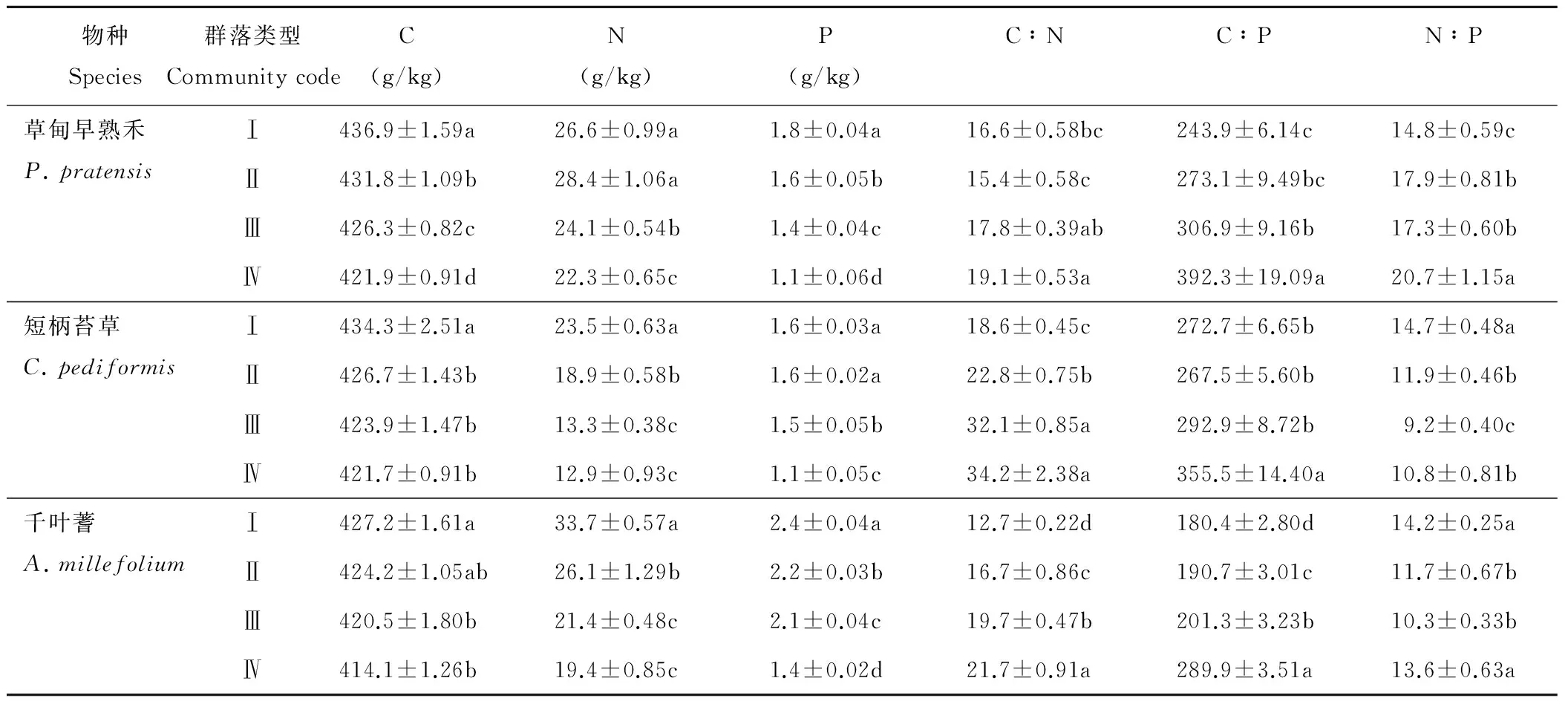
物种Species群落类型CommunitycodeC(g/kg)N(g/kg)P(g/kg)C∶NC∶PN∶P草甸早熟禾P.pratensisⅠ436.9±1.59a26.6±0.99a1.8±0.04a16.6±0.58bc243.9±6.14c14.8±0.59cⅡ431.8±1.09b28.4±1.06a1.6±0.05b15.4±0.58c273.1±9.49bc17.9±0.81bⅢ426.3±0.82c24.1±0.54b1.4±0.04c17.8±0.39ab306.9±9.16b17.3±0.60bⅣ421.9±0.91d22.3±0.65c1.1±0.06d19.1±0.53a392.3±19.09a20.7±1.15a短柄苔草C.pediformisⅠ434.3±2.51a23.5±0.63a1.6±0.03a18.6±0.45c272.7±6.65b14.7±0.48aⅡ426.7±1.43b18.9±0.58b1.6±0.02a22.8±0.75b267.5±5.60b11.9±0.46bⅢ423.9±1.47b13.3±0.38c1.5±0.05b32.1±0.85a292.9±8.72b9.2±0.40cⅣ421.7±0.91b12.9±0.93c1.1±0.05c34.2±2.38a355.5±14.40a10.8±0.81b千叶蓍A.millefoliumⅠ427.2±1.61a33.7±0.57a2.4±0.04a12.7±0.22d180.4±2.80d14.2±0.25aⅡ424.2±1.05ab26.1±1.29b2.2±0.03b16.7±0.86c190.7±3.01c11.7±0.67bⅢ420.5±1.80b21.4±0.48c2.1±0.04c19.7±0.47b201.3±3.23b10.3±0.33bⅣ414.1±1.26b19.4±0.85c1.4±0.02d21.7±0.91a289.9±3.51a13.6±0.63a
2.3 不同退化群落土壤的C、N、P含量及化学计量特征
由表5看出,4个主要群落的土壤C、N、P含量都随着深度的增加而降低。同区域0~30 cm土层深度,4个群落C含量依次下降了31.81%,33.29%,33.82%和26.57%,下降速率为群落Ⅲ>群落Ⅱ>群落Ⅰ>群落Ⅳ。群落Ⅳ不同土层之间的C含量差异显著(P<0.05),群落Ⅱ和群落Ⅲ在5~10 cm和10~20 cm这2个土层间差异不显著(P>0.05)。群落Ⅰ和群落Ⅱ各层次间土壤的N含量差异不显著(P>0.05),但都显著高于同层次的另外2个群落(P<0.05)。除了群落Ⅳ外,20~30 cm土层的N含量都显著低于0~20 cm各层(P<0.05)。4个群落土壤的P含量在1.2~2.4 g/kg之间,群落Ⅳ各个土层深度的P含量都显著低于前3个群落(P<0.05),同群落的不同土层深度间的P含量依次下降了8.33%,12.50%,21.74%和20.00%。
同群落不同土壤层次间的C∶N、N∶P差异不显著(P>0.05),C∶P群落Ⅱ的20~30 cm土层显著低于同群落其他土层(P<0.05),其他同群落不同土层深度的C∶P差异不显著(P>0.05)。从群落角度分析,4个群落各个土壤层次的N∶P差异都不显著(P>0.05)。群落Ⅲ的C∶P在5~10 cm土层显著低于群落Ⅰ和Ⅳ(P<0.05),其他各土壤层次间群落间的差异不显著(P>0.05)。在0~5 cm和5~10 cm土层,群落Ⅳ的C∶N都显著高于群落Ⅱ和群落Ⅲ(P<0.05),其余各个土层群落间的C∶N差异都不显著(P>0.05)。
表5 不同群落土壤的C、N、P含量及生态化学计量特征
Table 5 Different communities of soil C, N and P content and ecological stoichiometry
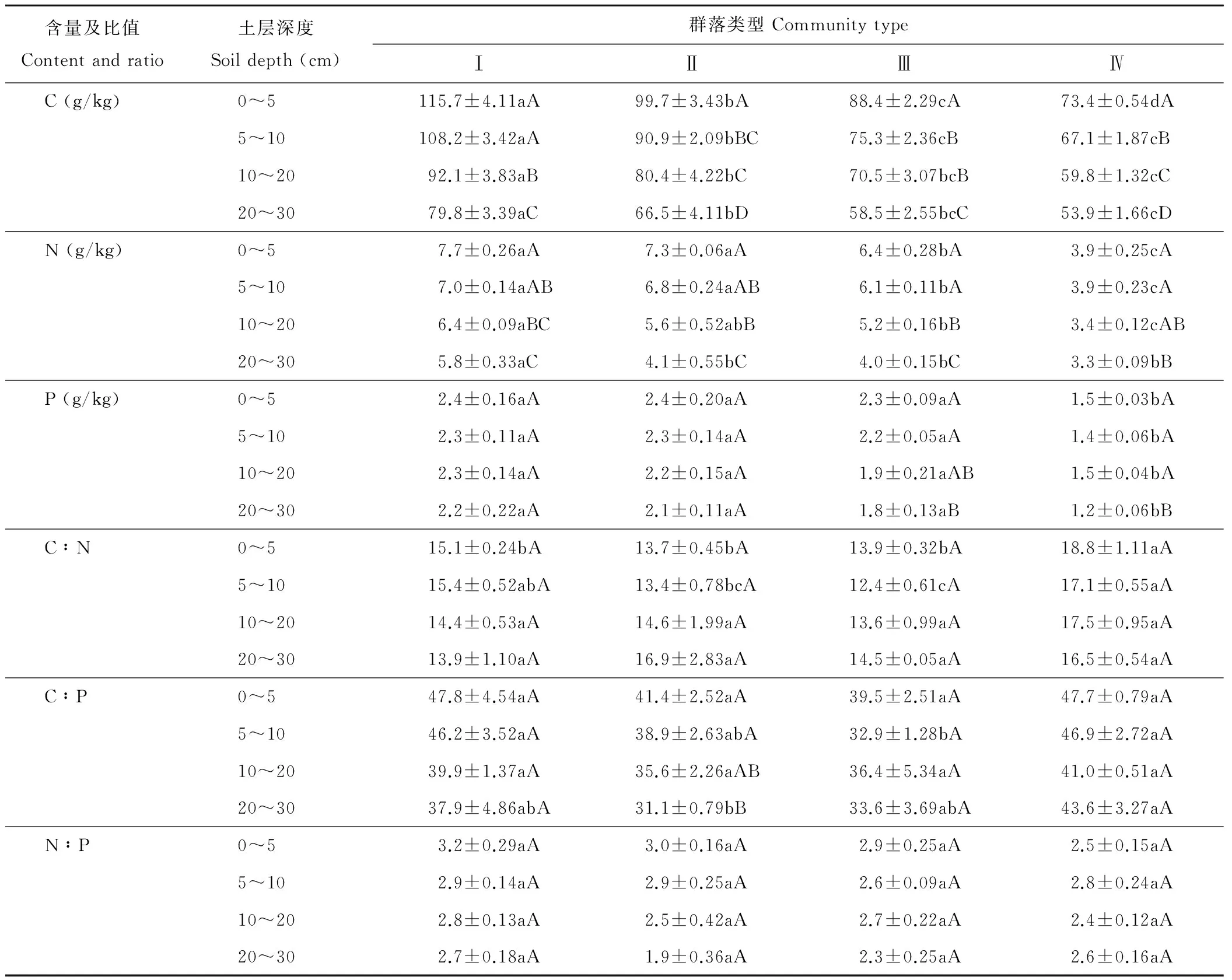
含量及比值Contentandratio土层深度Soildepth(cm)群落类型CommunitytypeⅠⅡⅢⅣC(g/kg)0~5115.7±4.11aA99.7±3.43bA88.4±2.29cA73.4±0.54dA5~10108.2±3.42aA90.9±2.09bBC75.3±2.36cB67.1±1.87cB10~2092.1±3.83aB80.4±4.22bC70.5±3.07bcB59.8±1.32cC20~3079.8±3.39aC66.5±4.11bD58.5±2.55bcC53.9±1.66cDN(g/kg)0~57.7±0.26aA7.3±0.06aA6.4±0.28bA3.9±0.25cA5~107.0±0.14aAB6.8±0.24aAB6.1±0.11bA3.9±0.23cA10~206.4±0.09aBC5.6±0.52abB5.2±0.16bB3.4±0.12cAB20~305.8±0.33aC4.1±0.55bC4.0±0.15bC3.3±0.09bBP(g/kg)0~52.4±0.16aA2.4±0.20aA2.3±0.09aA1.5±0.03bA5~102.3±0.11aA2.3±0.14aA2.2±0.05aA1.4±0.06bA10~202.3±0.14aA2.2±0.15aA1.9±0.21aAB1.5±0.04bA20~302.2±0.22aA2.1±0.11aA1.8±0.13aB1.2±0.06bBC∶N0~515.1±0.24bA13.7±0.45bA13.9±0.32bA18.8±1.11aA5~1015.4±0.52abA13.4±0.78bcA12.4±0.61cA17.1±0.55aA10~2014.4±0.53aA14.6±1.99aA13.6±0.99aA17.5±0.95aA20~3013.9±1.10aA16.9±2.83aA14.5±0.05aA16.5±0.54aAC∶P0~547.8±4.54aA41.4±2.52aA39.5±2.51aA47.7±0.79aA5~1046.2±3.52aA38.9±2.63abA32.9±1.28bA46.9±2.72aA10~2039.9±1.37aA35.6±2.26aAB36.4±5.34aA41.0±0.51aA20~3037.9±4.86abA31.1±0.79bB33.6±3.69abA43.6±3.27aAN∶P0~53.2±0.29aA3.0±0.16aA2.9±0.25aA2.5±0.15aA5~102.9±0.14aA2.9±0.25aA2.6±0.09aA2.8±0.24aA10~202.8±0.13aA2.5±0.42aA2.7±0.22aA2.4±0.12aA20~302.7±0.18aA1.9±0.36aA2.3±0.25aA2.6±0.16aA
注:同列不同大写字母和同行不同小写字母表示差异显著(P<0.05)。
Note:Different capital letters within the same column and peer different small letters mean significant differences (P<0.05).
2.4 共有种植物生态化学计量特征与生境、植物种群特征的关系
2.4.1 不同退化群落共有种叶片化学计量比与其数量特征的关系 由表6可知,草甸早熟禾的数量特征、叶绿素含量与其叶片C、N、P含量及化学计量比的相关性均不显著(P>0.05)。短柄苔草的高度与C含量极显著正相关(P<0.01),密度和生物量均与N含量、N∶P显著正相关(P<0.05),与C∶N显著负相关(P<0.05),叶绿素含量与其N含量极显著正相关(P<0.01),与C∶P显著正相关(P<0.05)。千叶蓍的高度与P含量显著正相关(P<0.05),与C∶P显著负相关(P<0.05),叶绿素含量与N、P含量显著正相关(P<0.05),与C∶N、C∶P显著负相关(P<0.05)。
表6 不同退化群落共有种数量特征与叶片化学计量比的关系
Table 6 The relationship between the quantitative characteristics of different degraded communities and the stoichiometric ratio of leaves
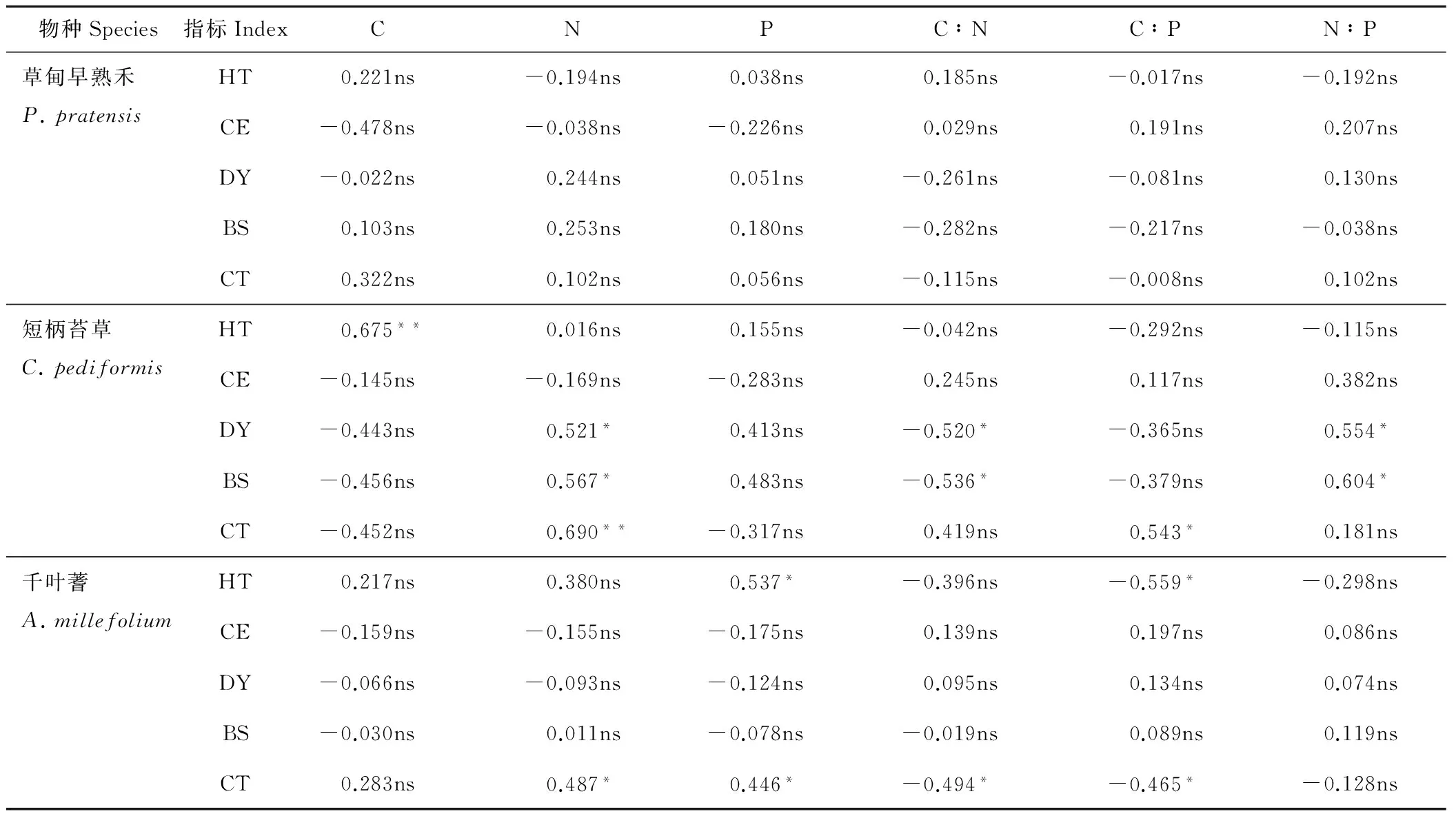
物种Species指标IndexCNPC∶NC∶PN∶P草甸早熟禾P.pratensisHT0.221ns-0.194ns0.038ns0.185ns-0.017ns-0.192nsCE-0.478ns-0.038ns-0.226ns0.029ns0.191ns0.207nsDY-0.022ns0.244ns0.051ns-0.261ns-0.081ns0.130nsBS0.103ns0.253ns0.180ns-0.282ns-0.217ns-0.038nsCT0.322ns0.102ns0.056ns-0.115ns-0.008ns0.102ns短柄苔草C.pediformisHT0.675**0.016ns0.155ns-0.042ns-0.292ns-0.115nsCE-0.145ns-0.169ns-0.283ns0.245ns0.117ns0.382nsDY-0.443ns0.521*0.413ns-0.520*-0.365ns0.554*BS-0.456ns0.567*0.483ns-0.536*-0.379ns0.604*CT-0.452ns0.690**-0.317ns0.419ns0.543*0.181ns千叶蓍A.millefoliumHT0.217ns0.380ns0.537*-0.396ns-0.559*-0.298nsCE-0.159ns-0.155ns-0.175ns0.139ns0.197ns0.086nsDY-0.066ns-0.093ns-0.124ns0.095ns0.134ns0.074nsBS-0.030ns0.011ns-0.078ns-0.019ns0.089ns0.119nsCT0.283ns0.487*0.446*-0.494*-0.465*-0.128ns
HT:高度Height;CE:盖度Coverage;DY:密度Density;BS:生物量Biomass;CT:叶绿素相对含量Relative content of chlorophyll; ns:没有显著相关性No significant correlation;*:P<0.05水平下显著相关Significant correlation underP<0.05 level;**:P<0.01水平下极显著相关Highly significant correlation underP<0.01 level.
2.4.2 不同退化群落共有种叶片和土壤的化学计量比间的关系 由图1可知,短柄苔草的C、N、P含量在4个不同退化群落中均与对应土壤的C、N、P含量极显著正相关(P<0.01),相关系数在C、N中最高的是群落Ⅱ,在P中最高的是群落Ⅰ。千叶蓍叶片的C含量在群落Ⅱ、Ⅲ中与对应土壤的C含量相关性不显著(P>0.05);叶片的N含量在群落Ⅳ中与对应的土壤N含量相关性不显著(P>0.05);叶片的P含量在群落Ⅰ、Ⅲ中与对应的土壤P含量相关性不显著(P>0.05)。草甸早熟禾叶片的C、P含量分别在群落Ⅳ、Ⅱ中与土壤相关性不显著(P>0.05),其N含量在不同的4个退化群落中均与土壤N极显著正相关(P<0.01)。整体上,不同群落3种共有植物叶片的C、N、P含量大多与土壤的C、N、P含量极显著正相关(P<0.01)。由图2~4可知,从化学计量特征来看,3种共有植物叶片C∶N与土壤C∶N均显著正相关(P<0.05),千叶蓍和草甸早熟禾的C∶P在群落Ⅱ中与土壤的C∶P相关性均不显著(P>0.05)。草甸早熟禾和短柄苔草的N∶P与土壤均呈显著相关(P<0.05),而千叶蓍只在群落Ⅲ中与土壤的N∶P显著相关(P<0.05)。
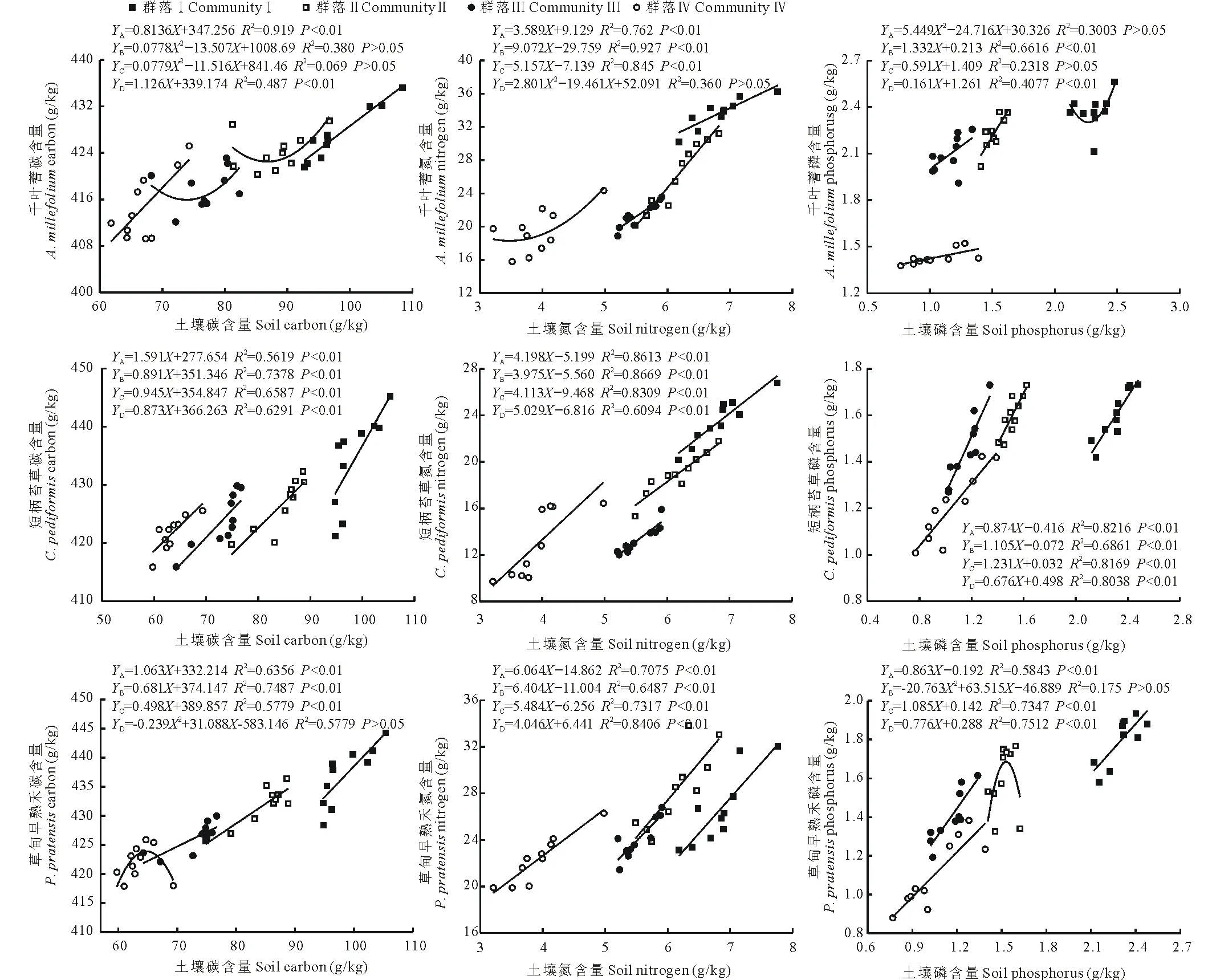
图1 不同群落共有种叶片碳、氮、磷含量与土壤碳、氮、磷含量之间的关系Fig.1 The relationship between the C, N and P contents in soil and leaf among common species in different degraded communities 图中YA表示群落Ⅰ中植物叶片与土壤的相关方程;YB表示群落Ⅱ中植物叶片与土壤的相关方程;YC表示群落Ⅲ中植物叶片与土壤的相关方程;YD表示群落Ⅳ中植物叶片与土壤的相关方程。下同。 YA (the correlation equation of leaves and soil in Community Ⅰ); YB (the correlation equation of leaves and soil in Community Ⅱ); YC (the correlation equation of leaves and soil in Community Ⅲ); YD (the correlation equation of leaves and soil in Community Ⅳ). The same below.

图2 不同群落共有种叶片C∶N与土壤C∶N之间的关系Fig.2 The relationship between the C∶N in soil and leaf among common species in different degraded communities
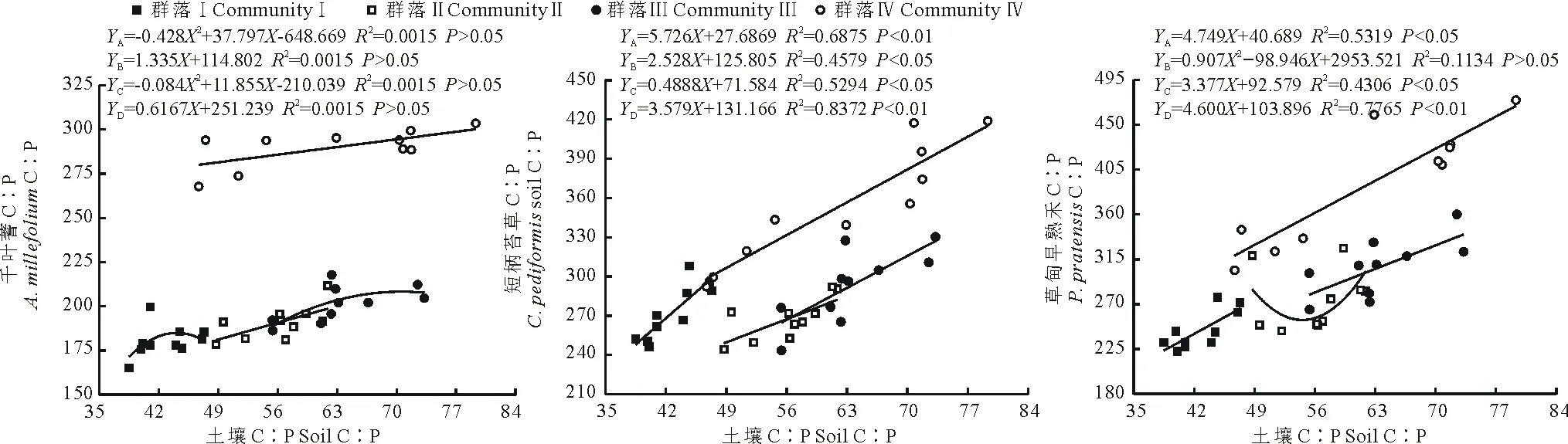
图3 不同群落共有种叶片C∶P与土壤C∶P之间的关系Fig.3 The relationship between the C∶P in soil and leaf among common species in different degraded communities
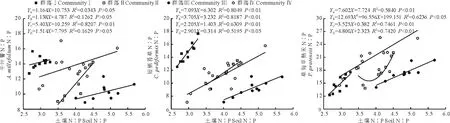
图4 不同群落共有种叶片N∶P与土壤N∶P之间的关系Fig.4 The relationship between the N∶P in soil and leaf among common species in different degraded communities
3 讨论
3.1 喀纳斯景区不同退化阶段山地草甸群落共有种化学计量特征
许多研究表明,植物体内结构性物质C受环境影响较小,含量相对稳定,而功能性物质N、P的含量受环境影响变化较大。本研究中,与未退化的群落Ⅰ相比,3种群落共有植物叶片的C含量在轻度、中度和重度退化的群落中变异较小,略有变化,这与上述规律较为一致。未退化的群落Ⅰ和轻度退化的群落Ⅱ的3种共有植物的N含量要明显高于其他2个群落,这可能是因为在适度放牧条件下牲畜排出的粪便通过土壤的分解,增加了植物的营养来源。这与徐沙等[13]研究得到的适度放牧能够增加植物叶片的N、P含量的结果相一致。在有旅游活动的群落Ⅲ、Ⅳ中,由于游客践踏和采摘,植物群落生物量和凋落物降低,从而降低了植物的重吸收率,加之人为干扰对植物体的破坏,使得植物的N、P含量降低,但仍高于全球平均水平[24-25]。这一研究结果与前人提出的低温胁迫及其抗性生理理论相吻合,研究区植物在低温胁迫下,通过“奢侈消费”改变其叶片的生理特征,即提高叶片N、P元素的含量,用来抵消低温下光合速率下降的效应[26]。
植物体内C、N代谢是植物正常生长发育和产量形成的物质基础,植物C∶N代表其吸收N时同化C的能力,反映了其N利用效率和固C效率的高低,因此,C∶N是反映植株体内生理代谢状态的一项重要指标[13]。放牧干扰下,随着放牧强度的增加可食牧草C∶N值往往先降低,后上升,适度放牧使可食牧草C∶N 减小,生长速率增加[27]。本研究中草甸早熟禾的C∶N符合上述规律,而其他2种植物则是随着退化程度的增加其C∶N也增加,未见下降趋势。短柄苔草和千叶蓍适口性较差,植株低矮,受放牧、游客采摘的概率较小,而草甸早熟禾适口性较好,被放牧概率较大。因此,适度干扰有利于适口性较好的牧草加快生长。
生态化学计量学应用的一个重要方面是可根据植物叶片的N∶P值判断环境对植物生长养分供应的状况。研究区采集的样品中,有58%叶片的N∶P小于14,有32%叶片N∶P大于16,有10%的N∶P处于14和16之间,说明不同退化阶段草地群落共有种的生长多受N的限制。具体来看,草地群落Ⅰ较少受到外界干扰,草地植被处于未退化阶段,N∶P在14和16之间,植物生长受N、P双重元素的限制或者均不受限。草地群落Ⅱ受到放牧的中度干扰,草甸早熟禾的N∶P大于16,植物生长受P限制。短柄苔草和千叶蓍N∶P小于14,植物生长受N限制。群落Ⅲ受旅游和放牧双重干扰,植被退化严重,但N∶P反映的规律与轻度退化的群落Ⅱ一致。这说明植物叶片的N∶P受物种和生境双重因素影响。植物叶片的C∶P、C∶N可以反映植物的生长速率,一般认为植物具有较低C∶P、C∶N时,分配到rRNA中P的增加,用以满足核糖体快速地合成蛋白质以支持植物快速生长的需要,但是在群落水平上则不能简单地用C∶P、C∶N高低来预测植物的生长速率。
3.2 喀纳斯景区山地草甸群落共有种化学计量特征与植物种群特征的关系
本研究中,群落共有种短柄苔草叶片的叶绿素含量与其N含量极显著正相关(P<0.01),千叶蓍叶绿素含量与N、P含量显著正相关(P<0.05),草甸早熟禾叶绿素含量与N、P含量相关性均不显著(P>0.05)。此外,3种群落共有种的叶绿素含量均与其N∶P没有显著的相关性(P>0.05)。王文杰等[28]的研究发现,使用不同的叶绿素测定仪以及植物生长处于不同的时期,都会对植物叶片N含量和叶绿素含量的相关性产生较大影响。而关于叶绿素含量与植物叶片生态化学计量特征的研究尚不多见,因此,对不同生长时期植物叶片叶绿素含量和化学计量学特征进行研究是下一步工作的重点。肖遥等[29]的研究表明荒漠植物在生长过程中,叶片N、P化学计量发生改变,叶片化学计量特征与生物量指标的相关性较弱。但闫帮国等[30]观察水分、养分以及二者的交互作用对6种植物生长的促进作用,发现植物化学计量学特征的变化与植物生物量具有显著相关性。本研究中短柄苔草的生物量均与N含量、N∶P显著正相关(P<0.05),与C∶N显著负相关(P<0.05),而另外2种共有种的生物量与植物叶片的C、N、P含量及化学计量特征相关性均不显著(P>0.05)。因此,植物生物量与其叶片化学计量特征相关的显著性取决于植物的种类和所处的生境。植物的盖度与其叶片化学计量特征的相关性较低,这在本研究和前人的研究中都得到了验证[13]。很少有学者研究植物的高度和其叶片生态化学计量学特征的相关性。本研究发现短柄苔草的高度与C含量极显著正相关(P<0.01),千叶蓍的高度与P含量显著正相关(P<0.05),与C∶P显著负相关(P<0.05)。因此,植物高度与叶片化学计量特征也存在着内在联系。
3.3 喀纳斯景区山地草甸群落共有种化学计量特征与生境变异的关系
土壤是陆地植物生长的最主要基质,土壤N∶P可用作N饱和的诊断指标,并常被用于确定养分限制的阈值。本研究得出大多数群落土壤的C、N、P含量与群落植物叶片的C、N、P含量显著线性相关,说明研究区植物生存的土壤状况能直接反映植物的营养状况,存在耦合关系。这与林丽等[31]和罗亚勇等[32]的研究结果相一致。研究区土壤的N含量与其他研究区相差不大,C含量要高于其他研究区域,这受土壤母质性质、成土过程和大尺度环境影响[32-33]。土壤中的P含量在1.15~2.75 g/kg之间,高于我国高寒草甸土壤的P平均含量0.85 g/kg[34]。土壤的C∶N和C∶P高于高寒草甸土壤,但是N∶P要低于其他研究区域。因此,植物生长受N限制的原因并非是由于土壤中N的供给不足所致,而是植物对环境长期适应形成的策略。
植物叶片化学计量特征的影响因素随生态系统类型和研究尺度的不同而不同[33]。在局域(小)尺度上,物种组成和土壤是主要控制因素[35]。如阿拉善荒漠植物叶片N、P含量及N∶P的主要影响因素是物种[36];云南普洱区的常绿阔叶林演替系列植物叶片化学计量特征受土壤和物种双重因素影响[14];黄土高原的植物N、P含量主要影响因素为土壤养分[7];松嫩平原草甸植物叶片N、P浓度基本不受土壤N、P含量的影响[37]。也有研究发现生态系统的营养级(食物网)和植物多样性控制着植物化学计量特征[38];还有学者认为微地形(坡位、坡向)是影响植物叶片C、N、P含量和化学计量特征的主要因素[30]。在草地生态系统的大尺度研究中,我国典型草原优势植物功能群氮磷含量的主要影响因素是物种与生境[39],北方荒漠及荒漠化地区植物叶片的N、P含量的主要影响因素是多年平均降水量[24]。本研究中,物种的特性(种群特征)与土壤养分均与植物叶片化学计量特征显著相关,因此,喀纳斯山地草甸植物生态化学计量特征受物种与土壤双因素控制。
4 结论
本研究选取了喀纳斯景区山地草甸4个典型不同退化阶段群落共有种为对象,分析了群落共有物种数量特征、叶绿素含量、土壤生态化学计量特征对群落共有种叶片的化学计量特征的影响,得到以下结论:1)喀纳斯景区山地草甸群落共有种C、N、P含量均随着草地退化的加剧而降低,未退化的草地群落植物生长受N、P双重元素的限制或者均不受限,退化的草地植物的生长主要受N的限制。2)叶绿素含量与植物的N含量相关性较高;群落植物的高度、密度、生物量与其化学计量比相关性的显著性取决于物种和生境;植物盖度与其化学计量比相关性不显著。3)土壤的C、N、P含量均影响植物的C、N、P含量,呈显著的线性正相关,因此,不同退化阶段群落共有种的生态化学计量特征是植物种群与土壤养分耦合的结果。4)喀纳斯山地草甸植物生态化学计量特征受物种与土壤双因素控制。
[1] Hu N, Li H, Tang Z,etal. Community size, activity and C∶N stoichiometry of soil microorganisms following reforestation in a Karst region. European Journal of Soil Biology, 2016, 73: 77-83.
[2] Li Y, Li Q, Guo D,etal. Ecological stoichiometry homeostasis ofLeymuschinensisin degraded grassland in western Jilin Province, NE China. Ecological Engineering, 2016, 90: 387-391.
[3] Wei Q W, Sardans J, Wang C,etal. Ecological stoichiometry of C, N, and P of invasivePhragmitesaustralisand nativeCyperusmalaccensisspecies in the Minjiang River tidal estuarine wetlands of China. Plant Ecology, 2015, 216(6): 1-14.
[4] Mi Z, Huang Y, Gan H,etal. Leaf P increase outpaces leaf N in an Inner Mongolia grassland over 27 years. Biology Letters, 2015, 1(14): 1-5.
[5] Villacorte L O, Ekowati Y, Neu T R,etal. Characterisation of algal organic matter produced by bloom-forming marine and freshwater algae. Water Research, 2015, 73: 216-230.
[6] Li C J, Xu X W, Sun Y Q,etal. Stoichiometric characteristics of C, N, P for three desert plants leaf and soil at different habitats. Arid Land Geography, 2014, 37(5): 996-1004.
[7] Li D F, Yu S L, Wang G X,etal. Environmental heterogeneity and mechanism of stoichiometry properties of vegetative organs in dominant shrub communities across the Loess Plateau. Chinese Journal of Plant Ecology, 2015, 39(5): 453-465.
[8] Yan Z, Kim N, Han W,etal. Effects of nitrogen and phosphorus supply on growth rate, leaf stoichiometry, and nutrient resorption ofArabidopsisthaliana. Plant and Soil, 2015, 388(1/2): 147-155.
[10] Carrillo Y, Ball B A, Molina M. Stoichiometric linkages between plant litter, trophic interactions and nitrogen mineralization across the litter-soil interface. Soil Biology & Biochemistry, 2016, 92: 102-110.
[11] Huang J Y, Lai R S, Yu H L,etal. Responses of plant and soil C∶N∶P stoichiometry to N addition in a desert steppe of Ningxia, Northwest China. Chinese Journal of Ecology, 2013, 32(11): 2850-2856.
[12] Luo M W, Mao L, Li Q Q,etal. C, N and P stoichiometry of plant and soil in the restorable plant communities distributed on the Land Used for Qinghai-Tibet Highway Construction in the Qinghai-Tibetan Plateau, China. Acta Ecologica Sinica, 2015, 35(23): 7832-7841.
[13] Xu S, Gong J R, Zhang Z Y,etal. The ecological stoichiometry of dominant species in different land uses type of grassland. Acta Prataculturae Sinica, 2014, 23(6): 45-53.
[14] Liu W D, Su J R, Li S F,etal. Leaf carbon, nitrogen and phosphorus stoichiometry at different growth stages in dominant tree species of a monsoon broad-leaved evergreen forest in Pu’er, Yunnan Province, China. Chinese Journal of Plant Ecology, 2015, 39(1): 52-62.
[15] Qing Y, Sun F D, Li Y,etal. Analysis of soil carbon, nitrogen and phosphorus in degraded alpine wetland, Zoige, southwest China. Acta Prataculturae Sinica, 2015, 24(3): 38-47.
[16] Yin X R, Liang C Z, Wang L X,etal. Ecological stoichiometry of plant nutrients at different restoration succession stages in typical steppe of Inner Mongolia, China. Chinese Journal of Plant Ecology, 2010, 34(1): 39-47.
[17] Elser J J, Sterner R W, Gorokhova E,etal. Biological stoichiometry from genes to ecosystems. Ecology Letters, 2000, 3(6): 540-550.
[18] Liu L, Zhou X Y, Zhao L J,etal. Effect of nitrogen and phosphorus ratios on the growth of cyano-bacteria and chlorophyte. Journal of Shanghai Ocean University, 2014, 23(4): 573-581.
[19] Zheng W. Evaluation of mountain meadow ecosystem resilience based on plant diversity of Kanas Scenic Area. Acta Agrestia Sinica, 2012, 20(3): 393-400.
[20] Zheng W, Zhu J Z, Pan C D. Effect of tourism disturbance intensity on plant species diversity of meadow community in Kanasi Nature Reserve. Acta Agrestia Sinica, 2008, 16(6): 624-630.
[21] Zheng W, Zhu J Z, Pan C D. Effect of grazing disturbance on plant functional group and community structure of meadow community in Kanas Scenic Area. Chinese Journal of Grassland, 2010, 32(1): 92-98.
[22] Zheng W. Relationship between soil physical and chemical properties and plant diversity-productivity of upland meadow in Kanas Scnic Area. Pratacultural Science, 2013, 30(12): 1933-1943.
[23] Bao S D. Soil Analysis in Agricultural Chemistry[M]. Beijing: China Agriculture Press, 2000.
[24] Zhang W Y, Fan J W, Zhong H P,etal. The nitrogen: phosphorus stoichiometry of different plant functional groups for dominant species of typical steppes in China. Acta Agrestia Sinica, 2010, 18(4): 503-509.
[25] Reich P B, Oleksyn J. Global patterns of plant leaf N and P in relation to temperature and latitude. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(30): 11001-11006.
[26] Ding X H, Luo S Z, Liu J W,etal. Longitude gradient changes on plant community and soil stoichiometry characteristics of grassland in Hulunbeirt. Acta Ecologica Sinica, 2012, 32(11): 3467-3476.
[27] Zhang T, Weng Y, Yao F J,etal. Effect of grazing intensity on ecological stoichiometry ofDeyeuxiaangustifoliaand meadow soil. Acta Prataculturae Sinica, 2014, 23(2): 20-28.
[28] Wang W J, Li X Y, Wang H M,etal. Application of portable meter for measuring leaf nitrogen and chlorophyll content in the process of leaf autumn senescence. Scientia Silvae Sinicae, 2006, 42(6): 20-25.
[29] Xiao Y, Tao Y, Zhang Y M. Biomass allocation and leaf stoichiometric characteristics in four desert herbaceous plants during different growth periods in the Gurbantünggüt Desert, China. Chinese Journal of Plant Ecology, 2014, 38(9): 929-940.
[30] Yan B G, Liu G C, Fan B,etal. Relationships between plant stoichiometry and biomass in an arid-hot valley, Southwest China. Chinese Journal of Plant Ecology, 2015, 39(8): 807-815.
[31] Lin L, Li Y K, Zhang F W,etal. Soil nitrogen and phosphorus stoichiometry in a degradation series ofKobresiahumulismeadows in the Tibetan Plateau. Acta Ecologica Sinica, 2013, 33(17): 5245-5251.
[32] Luo Y Y, Zhang Y, Zhang J H,etal. Soil stoichiometry characteristics of alpine meadow at its different degradation stages.Chinese Journal of Ecology, 2012, 31(2): 254-260.
[33] Zeng Q C, Li X, Dong Y H,etal. Ecological stoichiometry characteristics and physical-chemical properties of soils at different latitudes on the Loess Plateau. Journal of Natural Resources, 2015, 30(5): 870-879.
[34] De K J, Zhang D G, Wang W,etal. Effects of fertilizers on the alpine meadow plant and soil N, P, K contents. Acta Agrestia Sinica, 2014, 22(2): 299-305.
[35] Tao Y, Zhang Y M. Leaf and soil stoichiometry of four herbs in the Gurbantunggut Desert, China. Chinese Journal of Applied Ecology, 2015, 26(3): 659-665.
[36] Zhang K, Chen Y L, Gao Y H,etal. Stoichiometry characteristics of leaf nitrogen and phosphorus of different plant functional groups in Alashan desert region. Journal of Desert Research, 2014, 34(5): 1261-1267.
[37] Ding F, Lian P Y, Zeng D H,etal. Characteristics of plant leaf nitrogen and phosphorus stoichiometry in relation to soilnitrogen and phosphorus concentrations in Songnen Plain meadow. Chinese Journal of Ecology, 2011, 30(1): 77-81.
[38] Borer E T, Lind E M, Ogdahl E J,etal. Food-web composition and plant diversity control foliar nutrient content and stoichiometry. Journal of Ecology, 2015, 103(6): 1432-1441.
[39] He J S, Liang W, Dan F B F,etal. Leaf nitrogen: phosphorus stoichiometry across Chinese grassland biomes. Oecologia, 2008, 155(2): 301-310.
[6] 李从娟, 徐新文, 孙永强, 等. 不同生境下三种荒漠植物叶片及土壤C、N、P的化学计量特征. 干旱区地理, 2014, 37(5): 996-1004.
[7] 李单凤, 于顺利, 王国勋, 等. 黄土高原优势灌丛营养器官化学计量特征的环境分异和机制. 植物生态学报, 2015, 39(5): 453-465.
[11] 黄菊莹, 赖荣生, 余海龙, 等. N添加对宁夏荒漠草原植物和土壤C∶N∶P生态化学计量特征的影响. 生态学杂志, 2013, 32(11): 2850-2856.
[12] 雒明伟, 毛亮, 李倩倩, 等. 青藏高原筑路取土迹地恢复植物群落与土壤的碳氮磷化学计量特征. 生态学报, 2015, 35(23): 7832-7841.
[13] 徐沙, 龚吉蕊, 张梓榆, 等. 不同利用方式下草地优势植物的生态化学计量特征. 草业学报, 2014, 23(6): 45-53.
[14] 刘万德, 苏建荣, 李帅锋, 等. 云南普洱季风常绿阔叶林优势物种不同生长阶段叶片碳、氮、磷化学计量特征. 植物生态学报, 2015, 39(1): 52-62.
[15] 青烨, 孙飞达, 李勇, 等. 若尔盖高寒退化湿地土壤碳氮磷比及相关性分析. 草业学报, 2015, 24(3): 38-47.
[16] 银晓瑞, 梁存柱, 王立新, 等. 内蒙古典型草原不同恢复演替阶段植物养分化学计量学. 植物生态学报, 2010, 34(1): 39-47.
[18] 刘莲, 周小玉, 赵良杰, 等. 氮磷比率对两种蓝藻和两种绿藻生长的影响. 上海海洋大学学报, 2014, 23(4): 573-581.
[19] 郑伟. 基于植物多样性的喀纳斯景区山地草甸生态系统恢复力评价. 草地学报, 2012, 20(3): 393-400.
[20] 郑伟, 朱进忠, 潘存德. 旅游干扰对喀纳斯景区草地植物多样性的影响. 草地学报, 2008, 16(6): 624-630.
[21] 郑伟, 朱进忠, 潘存德. 放牧干扰对喀纳斯草地植物功能群及群落结构的影响. 中国草地学报, 2010, 32(1): 92-98.
[22] 郑伟. 喀纳斯景区山地草甸土壤理化性质与植物多样性-生产力关系. 草业科学, 2013, 30(12): 1933-1943.
[23] 鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 2000.
[24] 张文彦, 樊江文, 钟华平, 等. 中国典型草原优势植物功能群氮磷化学计量学特征研究. 草地学报, 2010, 18(4): 503-509.
[26] 丁小慧, 罗淑政, 刘金巍, 等. 呼伦贝尔草地植物群落与土壤化学计量学特征沿经度梯度变化. 生态学报, 2012, 32(11): 3467-3476.
[27] 张婷, 翁月, 姚凤娇, 等. 放牧强度对草甸植物小叶章及土壤化学计量比的影响. 草业学报, 2014, 23(2): 20-28.
[28] 王文杰, 李雪莹, 王慧梅, 等. 便携式测定仪在测定叶片衰老过程中氮和叶绿素含量上的应用. 林业科学, 2006, 42(6): 20-25.
[29] 肖遥, 陶冶, 张元明. 古尔班通古特沙漠4种荒漠草本植物不同生长期的生物量分配与叶片化学计量特征. 植物生态学报, 2014, 38(9): 929-940.
[30] 闫帮国, 刘刚才, 樊博, 等. 干热河谷植物化学计量特征与生物量之间的关系. 植物生态学报, 2015, 39(8): 807-815.
[31] 林丽, 李以康, 张法伟, 等. 高寒矮嵩草群落退化演替系列氮、磷生态化学计量学特征. 生态学报, 2013, 33(17): 5245-5251.
[32] 罗亚勇, 张宇, 张静辉, 等. 不同退化阶段高寒草甸土壤化学计量特征. 生态学杂志, 2012, 31(2): 254-260.
[33] 曾全超, 李鑫, 董扬红, 等. 陕北黄土高原土壤性质及其生态化学计量的纬度变化特征. 自然资源学报, 2015, 30(5): 870-879.
[34] 德科加, 张德罡, 王伟, 等. 施肥对高寒草甸植物及土壤N, P, K的影响. 草地学报, 2014, 22(2): 299-305.
[35] 陶冶, 张元明. 古尔班通古特沙漠4种草本植物叶片与土壤的化学计量特征. 应用生态学报, 2015, 26(3): 659-665.
[36] 张珂, 陈永乐, 高艳红, 等. 阿拉善荒漠典型植物功能群氮、磷化学计量特征. 中国沙漠, 2014, 34(5): 1261-1267.
[37] 丁凡, 廉培勇, 曾德慧, 等. 松嫩平原草甸三种植物叶片N、P化学计量特征及其与土壤N、P浓度的关系. 生态学杂志, 2011, 30(1): 77-81.
Ecological stoichiometry characteristics of common species in mountain meadows at different stages of degraded succession in the Kanas Scenic Area
TANG Gao-Rong1, ZHENG Wei1,2*, WANG Xiang1, ZHU Ya-Qiong1, WU Yan-Feng1
1.CollegeofPrataculturalandEnvironmentalScience,XinjiangAgriculturalUniversity,Urumqi830052,China; 2.XinjiangKeyLaboratoryofGrasslandResourcesandEcology,Urumqi830052,China)
The overall aim of this research was to analyze nutrient cycling and the ecosystem stability mechanisms of mountain meadows. We analyzed the stoichiometry characteristics of carbon (C), nitrogen (N), and phosphorus (P) in three common species (Poapratensis,Carexpediformis,Achilleamillefolium) and soil in mountain meadows at different stages of degradation in the Kanas Scenic Area, Xinjiang Uygur Autonomous Region. The results showed that: 1) the importance values, coverage, density, and biomass of the three species increased with increasing degrees of degradation of the mountain meadows, but the average plant height and chlorophyll content of leaves decreased. 2) The C, N, and P contents of common species decreased with increasing degradation. The C∶N ofP.pratensisincreased from community Ⅰ to Ⅱ and then decreased. The C∶N of other common species increased with increasing degradation. The N∶P of three common species ranged from 14 to 16 in communityⅠ. In other communities, the N∶P exceeded 16 inP.pratensis, but was lower than 14 inA.millefoliumandC.pediformis. 3) There was a positive relationship between chlorophyll content and leaf N content. There was no correlation between coverage and the stoichiometric ratio of leaves and soil. The significance of correlations between plant height, density, biomass, and stoichiometric ratios depended on the species and habitats. 4) There were positive, significant, linear correlations between C, N, P contents in soil and in leaves. Plant growth in non-degraded meadows was mainly restricted by soil N and P or not restricted, and it was mainly restricted by soil N in degraded meadows. Together, these results show that soil nutrient stoichiometry has important effects on vegetation recovery in mountain meadows.
mountain meadow; degraded stages; common species; ecological stoichiometry; nutrient limitation
10.11686/cyxb2016047
http://cyxb.lzu.edu.cn
2016-01-25;改回日期:2016-04-19
国家自然科学基金项目(31460636)和中国科学院战略性先导科技专项(XDA05050405)资助。
唐高溶(1990-),男,湖南石门人,在读硕士。E-mail:tgrhq99@163.com*通信作者Corresponding author. E-mail: zw065@126.com
唐高溶, 郑伟, 王祥, 朱亚琼, 吴燕锋. 喀纳斯景区山地草甸不同退化阶段群落共有种的生态化学计量特征研究. 草业学报, 2016, 25(12): 63-75.
TANG Gao-Rong, ZHENG Wei, WANG Xiang, ZHU Ya-Qiong, WU Yan-Feng. Ecological stoichiometry characteristics of common species in mountain meadows at different stages of degraded succession in the Kanas Scenic Area. Acta Prataculturae Sinica, 2016, 25(12): 63-75.
