氢溴储能电池结构的优化和运行条件对电池性能的影响
2016-12-29史继诚徐洪峰
史继诚 徐洪峰,* 卢 璐 高 俊
(1大连交通大学环境与化学工程学院,辽宁省新能源电池重点实验室,辽宁大连116028;2黑龙江大庆炼化公司,黑龙江大庆163411)
氢溴储能电池结构的优化和运行条件对电池性能的影响
史继诚1徐洪峰1,*卢 璐1高 俊2
(1大连交通大学环境与化学工程学院,辽宁省新能源电池重点实验室,辽宁大连116028;2黑龙江大庆炼化公司,黑龙江大庆163411)
研究了氢溴电池的电池结构、正极氢溴酸和溴电解质浓度、负极的氢气压力、质子交换膜厚度对氢溴电池的性能和电池效率的影响。对氢溴电池结构进行改进,单电池实现了200 mA·cm-2电流密度恒流充放电,电池库伦效率100%。溴电极电化学反应受浓差极化控制,提高氢溴酸浓度,电池充电性能提高,同时,溴在氢溴酸的溶解度增大,电池放电性能也提高,氢溴酸浓度由0.5 mol·L-1提高至1 mol·L-1,电流密度200 mA·cm-2,电池的能量效率和电压效率提高27.9%。氢溴电池充电过程,降低电池负极氢出压力,有利于提高充电性能,但膜透酸严重,放电过程中最佳的氢出压力是维持氢在碳纸憎水催化层的单层吸附,充放电过程氢出压力均为40.0 kPa,电池的能量效率80.2%。膜厚度与膜电阻极化和膜透酸密切相关,充电过程,膜由50.0 μm降至15.0 μm,膜透酸严重,负极电化学活性比表面积下降,电池充电性能降低。膜厚度对放电性能的影响还与电流密度有关,电流密度较低时,膜透酸造成负极电化学比表面积下降居主导地位,50.0 μm Nafion膜放电性能更高;电流密度超过200 mA·cm-2时,膜电阻极化居主导电位,15.0 μm Nafion膜性能更高。采用20.0 μm质子交换膜,在200 mA·cm-2电流密度循环充放电五次,电池的能量效率和电压效率达到85.3%,库伦效率100%。
氢溴电池;膜电极;质子交换膜;膜透酸;电池效率
1 引言
节约化石能源,提高化石能源的利用率,开发风能、太阳能、潮汐能等可再生能源,已成为我国可持续发展的重要战略1。可再生能源发电具有不连续、不稳定的特点,迫切需要建立大规模高效储能技术,来解决可再生能源发电并网的问题。在现有的化学储能方式中,液流电池因存储容量大、安全、循环寿命长而被认为最适宜规模化储能。目前已对液流电池体系做了许多研究,如Fe-Cr体系2,3、全钒体系4,5、锌-溴体系6,7、多硫化钠-溴体系8,9、铁-钒体系10,11等,但是这类电池仍然存在电池功率密度低、成本高等方面的挑战,其广泛应用尚未实现。与以上电池体系相比较,氢溴电池的电-电转化效率高达80%,电池具有成本低、能量密度和功率密度高等突出优势,是目前最具竞争力的大规模储能技术之一12。但是溴和氢溴酸具有高毒性和强腐蚀性,对电极材料密封要求高和实验条件苛刻。国内对于氢溴储能电池的研究很少,需要在氢溴电池储能技术方面有所突破和创新,为氢溴电池的商业化做好技术储备。
氢溴电池电极反应式如下:
充电:正极 2HBr=Br2+2H++2e
负极 2H++2e=H2
放电:正极 Br2+2H++2e=2HBr
负极 H2=2H++2e (Eϴ=1.09 V)
国外对氢溴电池研究较早,但最近的研究成果较少,Lin等13在氢溴电池中采用Nafion/聚偏二氟乙烯电纺复合膜,掺氮功能化的铂铱催化剂,以碳纳米管为基体的溴电极,通过这些措施,降低了传统氢溴电池的材料成本,并解决铂催化剂被HBr和Br2的腐蚀问题。Cho等14认为碳电极氧化为CO2和充电过程中溴化物从正极向负极的穿流,是影响氢溴电池循环性能的关键因素。国内在一些电池的研究方面涉及到溴电极,Wang等15采用双模版法制备了一种高度有序的双峰介孔材料,材料存在5 nm的介孔和在介孔壁上形成的2 nm孔道,这种结构缩短了传质距离和传质阻力,并有利于Br2的吸附,增加了Br2/Br-反应的活性位点。Zhang等16认为锌溴电池工作电流密度低的原因是溴电极的电化学活性低和电池的内电阻高,其中溴的吸附是溴电极电化学反应的速率控制步骤,如将高比表面积的活性碳负载到膜上,可有效降低电池内阻和提高溴电极电化学反应活性。另外,氢溴电池的电池结构是决定电池是否高效运行的关键,Höhne和Starbeck17发明一种氢溴燃料电池结构,电池端板采用石墨,溴电极和氢电极流场为石墨毡,氢电极在石墨上镀铂,这种电池结构存在催化活性差、接触电阻大的缺点,并且解决不了溴的穿流问题。Braff等18报道了无隔膜结构的氢溴层流电池,在200 mW·cm-2功率密度下,电池的电压效率达到90%,库伦效率为66%,能量效率为60%,这种无隔膜电池结构,能量效率低于80%,显然不适合商业化应用。
本文通过氢溴电池结构的优化,在国内首次使电池的能量效率达到了商业化应用的要求,即大于80%,并且研究了多种条件如酸浓度、氢气压力和质子交换膜厚度对电池能量效率的影响,更重要的是采用新的电池结构,解决了膜透酸问题,在氢溴电池的商业化应用方面,迈出了坚实的一步。
2 实验部分
2.1 氢溴电池的工艺装置和电池结构
目前,氢溴电池用电解质膜主要有两种,一种是全氟磺酸(Nafion)膜,另一种是纳米多孔膜。Nafion膜由于电导率高,结构稳定而广泛应用于质子交换膜燃料电池和固体聚合物电解质水电解池中19-24。Nafion膜中质子的传导依赖于水的传递,磺酸基团与水结合后将球形面打开提供质子通道,没有带电荷的物质(如Br2)也可以从通道穿过25-28。因此,在氢溴电池中使用高浓度的电解液时,Nafion膜不能完全阻止溴离子和溴的渗透而吸附在氢电极上,使铂催化剂中毒导致氧化还原活性下降。
本文在氢溴电池工艺方面采取了以下措施:一,在氢溴电池的氢气进出口处各设置一个排酸罐,氢气经减压阀首先进入排酸罐,由排酸罐出口进入氢溴电池的负极,负极渗入的酸液由氢气吹扫排入另一排酸罐。二,适当提高负极侧氢气压力,减少正负极之间的压力差,避免膜透酸的同时,起到保护膜电极的作用。三,对催化剂负载膜电极(CCM膜电极)进行改进,负极碳纸扩散层经憎水处理后,负载催化剂。图1是氢溴电池的工艺装置,氢溴酸由氢溴酸储槽经磁力泵打入氢溴电池的进口,电池出口的氢溴酸经冷却后进入储槽。
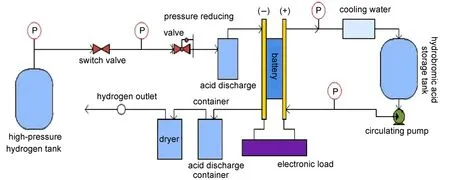
图1 氢溴电池工艺装置图Fig.1 Craftwork device diagram of the hydrogen bromine battery
氢溴电池的第一种结构如图2所示,Nafion 212膜(厚度50.0 μm,美国杜邦)作为电池隔膜;Nafion膜和聚丙烯腈基碳毡(厚5.0 mm,上海力硕复合材料科技有限公司)均负载Nafion树脂(美国杜邦)和1 mg·cm-2导电炭黑(BP2000,美国卡博特),构成氢溴电池的正极;Nafion膜的另一侧负载Nafion树脂和0.4 mg·cm-250%Pt/C(日本TANAKA),构成氢溴电池的负极;膜电极面积186 cm2。
氢溴电池的另一种电池结构如图3所示,在氢溴电池负极的碳纸扩散层上,建立憎水催化层,即负载聚四氟乙烯(PTFE)和0.2 mg·cm-250%Pt/C;Nafion膜负极亲水催化层组成为Nafion树脂和0.2 mg·cm-250%Pt/C;正极的组成同第一种电池结构的正极,膜电极面积186 cm2。
氢溴电池测试的实验条件如表1所示,氢溴酸(40%(质量分数),天津市北联精细化学品开发有限公司)稀释后浓度为0.5 mol·L-1,在电流密度为200 mA·cm-2时,经计算,氢溴酸的最低流量是0.048 L·min-1,受氢溴酸泵出口阀的开度限制,实际氢溴电池入口酸流量为0.183 L·min-1。
2.2 氢溴酸浓度和溴浓度对电池放电性能的影响
本文改变电解液中氢溴酸和溴的浓度,研究了氢溴酸和溴传质对氢溴电池性能的影响。将电解液中氢溴酸浓度由0.5 mol·L-1提高至1 mol·L-1,进行单电池测试,并计算电池的能量效率、库伦效率和电压效率;向氢溴酸浓度1 mol·L-1的电解液中加入溴素(单质溴,分析纯,山东祥瑞化工有限公司),将电解液中溴素浓度提高至0.2和0.4 mol·L-1,进行200 mA·cm-2电流密度电池充放电测试。
2.3 氢溴电池的氢气出口压力对电池性能的影响
对于氢溴电池,充电过程电池负极产生氢气,而放电过程,电池负极消耗氢气,所以在一个充放电循环中,充电和放电过程对氢气压力的要求不同。氢溴电池测试平台仪表盘所显示的氢出压力,实际由氢入口压力手动调压阀控制,即通过调节电池的氢气入口压力来改变电池的氢气出口压力。电解液中氢溴酸和溴素浓度分别是2和0.4 mol·L-1;在充放电循环过程中改变氢出压力值。表2是氢溴电池在充放电循环过程中的氢出压力。
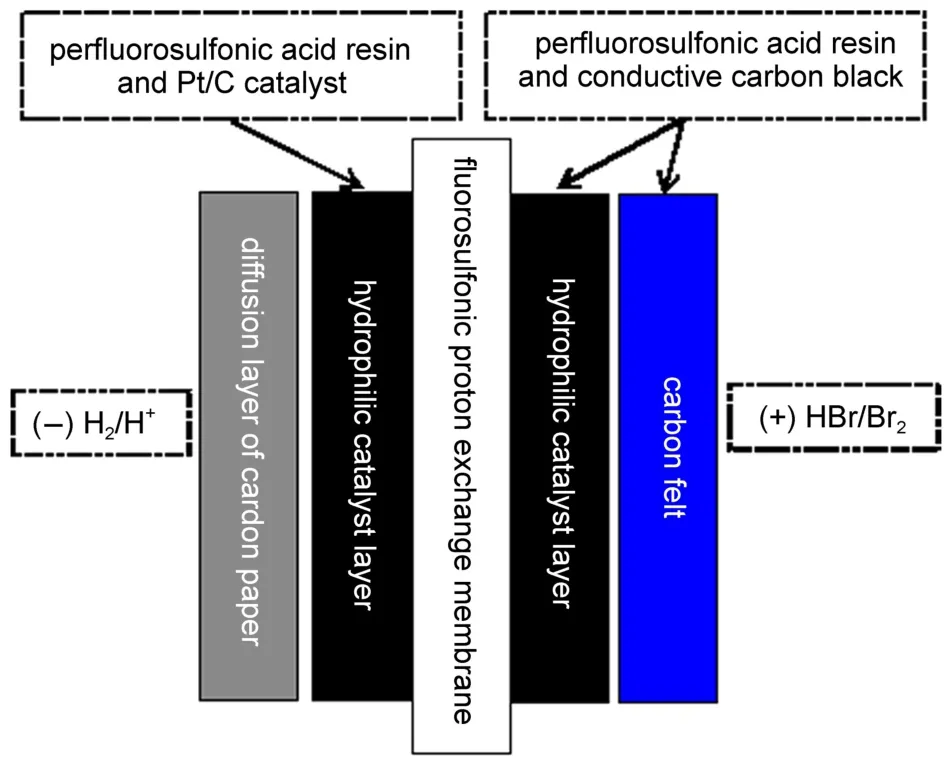
图2 氢溴电池的第一种电池结构Fig.2 The first structure of the hydrogen bromine battery
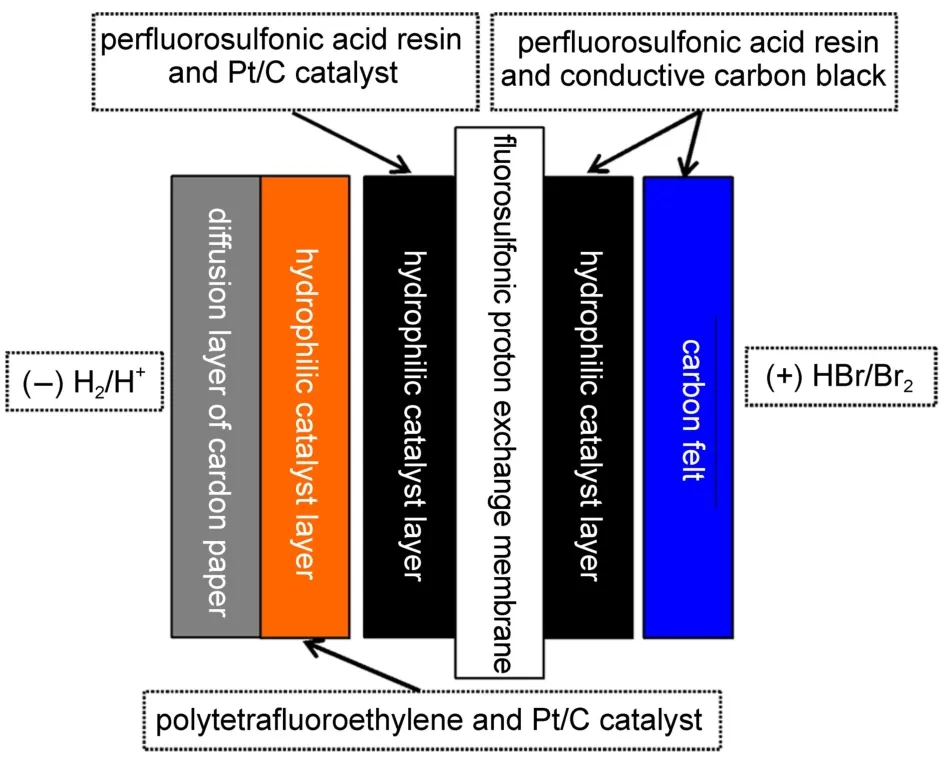
图3 氢溴电池的第二种电池结构Fig.3 Thesecondstructureofthehydrogenbrominebattery

表1 氢溴单电池测试实验条件Table 1 Experimental conditions of the hydrogen bromine single cells
2.4 质子交换膜厚度对氢溴电池能量效率的影响
质子交换膜厚度影响电池的膜电阻,尤其在电流密度较大的情况下,膜电压降很显著,通过降低电池的膜厚度,可减小电池的内阻电压降,相应提高氢溴电池的能量效率和电压效率。本文进一步在两方面对氢溴电池测试系统进行了改进:一,将电解液组成由2 mol·L-1氢溴酸和0.4 mol·L-1溴大幅提高至3 mol·L-1氢溴酸和5 mol·L-1溴;二,氢溴电池所使用的Nafion膜厚度,由50.0 μm降至20.0和15.0 μm。
2.5 电池能量效率(ηe)、库伦效率(ηc)、电压效率(ηv)的计算
(1)能量效率
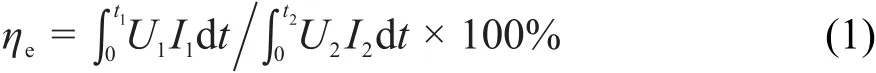
式中:ηe是能量效率;U1、U2分别是放电、充电电压(V);I1、I2分别是放电、充电电流(A);t1、t2分别是放电、充电时间(s)。
由于恒流放电和恒流充电的电流I1=I2=200 mA·cm-2,所以能量效率为
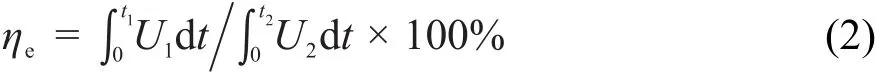
(2)库伦效率
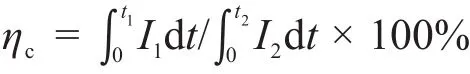
由于恒流放电和恒流充电的电流I1=I2=200 mA·cm-2,所以库伦效率为

(3)电压效率


表2 氢溴单电池的氢出压力Table 2 Hydrogen outlet pressure of the hydrogen bromine single cells
3 结果与讨论
3.1 氢溴电池结构对电池性能的影响
图4(a)和(b)分别是两种电池结构的氢溴电池极化曲线和功率曲线。如图4(a)所示,第二种电池的充电电压较第一种电池明显降低,放电电压较第一种电池略有升高,在电流密度为200 mA·cm-2时,第二种电池的充电电压较第一种电池降低117 mV,放电电压高于第一种电池3 mV;由图4(b)功率密度曲线,也反映出这种电池结构的改变,对充电过程影响最大,电流密度越大,充电电压之间的区别越显著,而对放电过程影响较小。
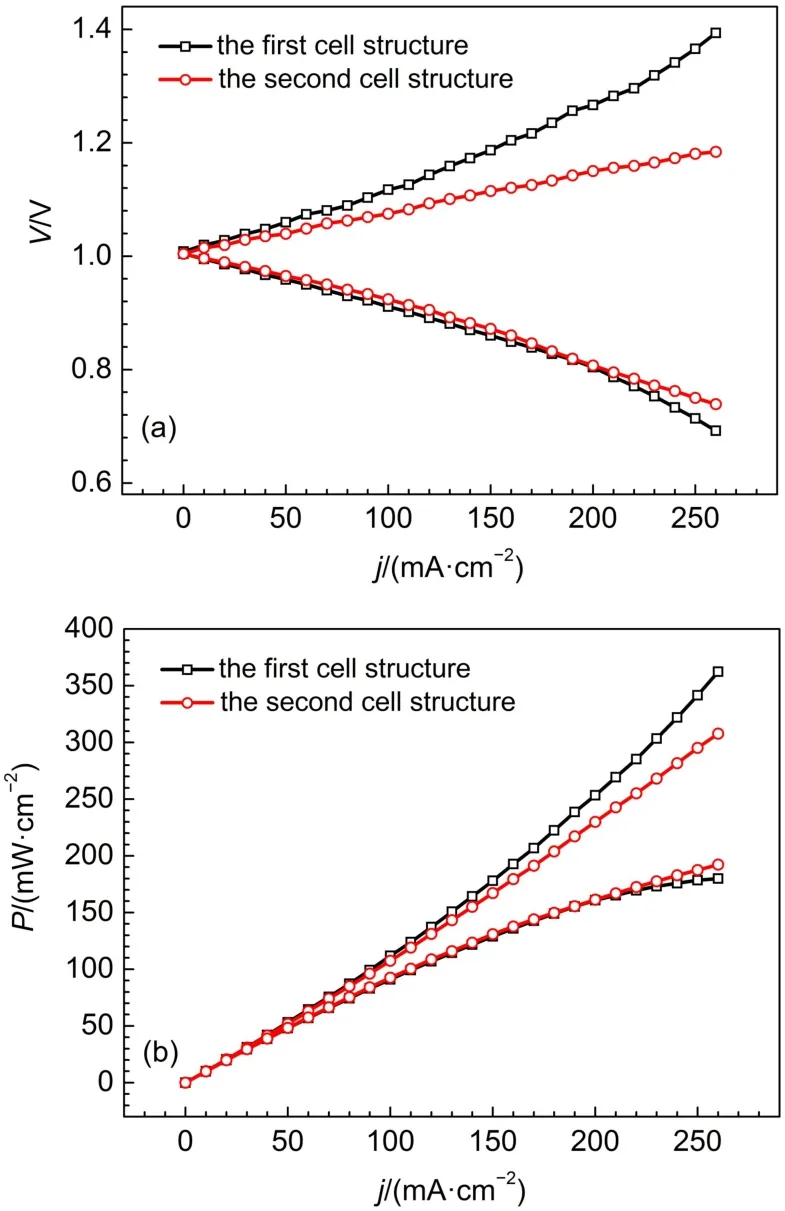
图4 两种电池结构的氢溴电池极化曲线(a)和功率曲线(b)Fig.4 Polarization curves(a)and power curves(b)of the hydrogen bromine battery with different cell structures
充电过程,氢离子由正极向负极传递,随氢离子共同传递的还有氢溴酸和溴,这导致质子交换膜负极的氢离子还原有效催化面积减小,并且透过的酸液还会对铂催化剂造成腐蚀,使催化剂的电化学比表面积下降。而第二种电池的碳纸扩散层由于具有憎水性,加上氢气的吹扫作用,利于膜透酸液的排出,有效降低了酸液渗透所造成的负面作用,并且利于氢气的脱附,所以第二种电池的充电电压较第一种电池大幅降低了一百多毫伏。放电过程中,氢离子经膜由负极向正极传递,膜透酸量甚微,并且由于氢气的吹扫作用,膜透酸易于排出,第二种电池的放电电压略高于第一种电池,主要原因是第二种电池结构具有憎水性,利于氢气的传质29。
由图4(a)极化曲线,第一种电池结构的电池,在电流密度200 mA·cm-2时,充电电压1.267 V,放电电压0.804 V,由于充电电压大于1.2 V,所以该电池不适合在200 mA·cm-2充电运行。而第二种电池结构的电池,在电流密度200 mA·cm-2时,充电电压1.150 V,放电电压0.807 V,可以在200 mA·cm-2电流密度下运行。图5是在200 mA·cm-2电流密度下,由第二种电池组装的单电池的恒流充放电曲线,由公式(2-4),计算出该电池前三次恒流充放电的能量效率和电压效率分别为49.2%、44.2%、42.8%。由于充放电电流和充放电时间均相同,所以电池的库伦效率为100%,这正是由于溴电极电化学反应高度可逆,电化学反应速率快的原因。
3.2 电解液中氢溴酸浓度和溴浓度对电池放电性能的影响
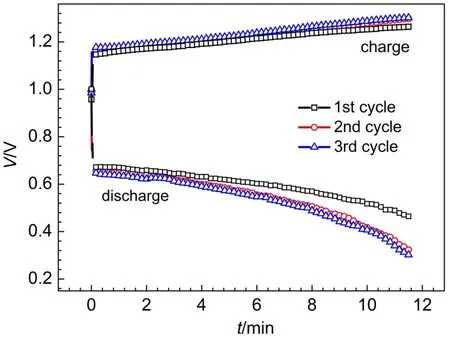
图5 在电流密度为200 mA·cm-2时第二种电池结构的氢溴电池恒流充放电曲线Fig.5 Charge and discharge curves of the hydrogen bromine battery with the second kind of cell structure at 200 mA·cm-2current density
采用第二种电池结构,将电解液中氢溴酸浓度由0.5 mol·L-1提高至1 mol·L-1,组装单电池进行测试。如图6(a)所示,在电流密度200 mA·cm-2,电解液为0.5 mol·L-1氢溴酸的电池,充电电压为1.150 V,当电解液浓度提高至1 mol·L-1,充电电压降低了80 mV。这是因为溴电极电化学反应速度快,电极界面附近氢溴酸浓度会迅速降低,容易出现浓差极化,而提高电解液中氢溴酸浓度,加快了氢溴酸传质速率,降低了溴电极的浓差极化。由放电极化曲线,电流密度小于170 mA·cm-2,电解液浓度为0.5 mol·L-1HBr的氢溴电池放电电压较高。在大电流密度放电时,电解液为1 mol·L-1HBr的电池性能较好,在电流密度为200 mA·cm-2时,放电电压为0.825 V,较电解液浓度为0.5 mol·L-1HBr的电池,放电电压提高了18 mV。图6(b)是电流密度200 mA·cm-2,两种电解液浓度的氢溴电池恒流充放电曲线,经计算,1 mol·L-1HBr电池的能量效率和电压效率为77.1%,较0.5 mol·L-1HBr氢溴酸电池的能量效率和电压效率提高27.9%。
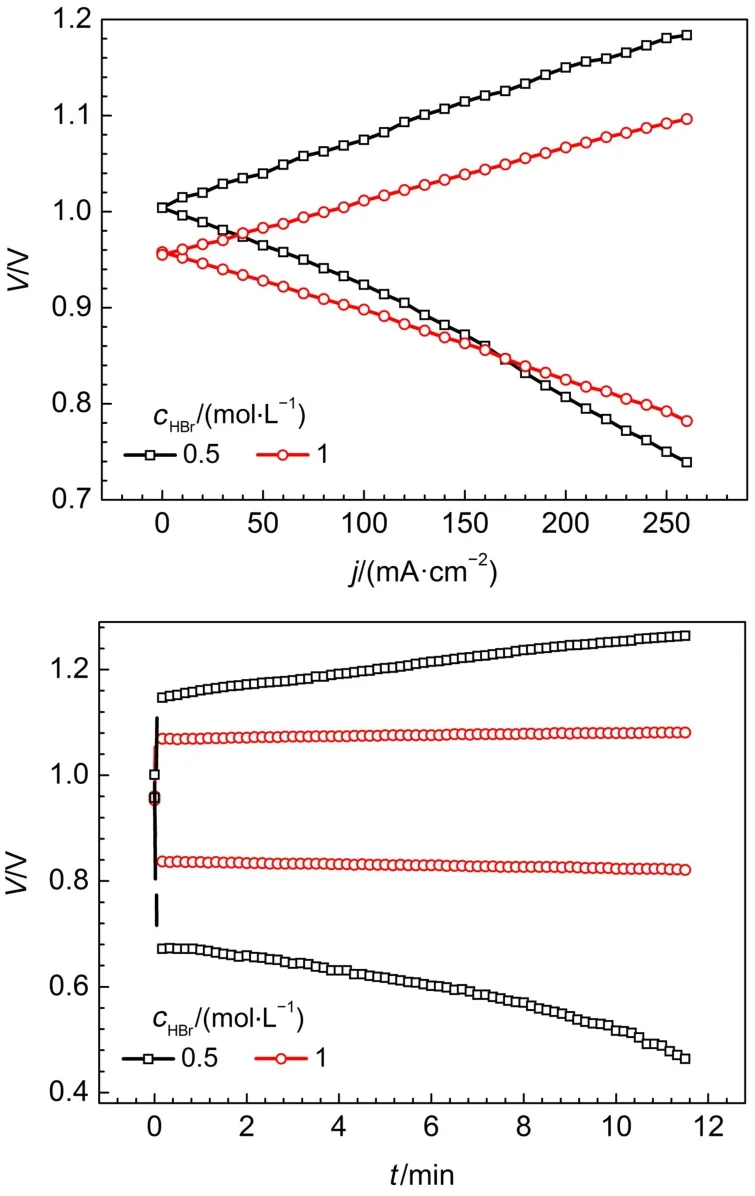
图6 在电流密度为200 mA·cm-2时氢溴电池极化曲线(a)和恒流充放电曲线(b)Fig.6 Polarization curves(a)and charge and discharge curves(b)of the hydrogen bromine battery at 200 mA·cm-2current density
放电过程的电压高低不仅取决于电解液中的溴浓度,也与氢溴酸浓度和溴在电解液中的传质快慢有关。同样在200 mA·cm-2电流密度下充电相同时间,1 mol·L-1氢溴酸和0.5 mol·L-1氢溴酸所生成的溴物质的量是相同的,在平衡状态下,由能斯特方程,1 mol·L-1氢溴酸电解液的电极电势将低于0.5 mol·L-1氢溴酸电解液的电极电势;在开路状态下,以1 mol·L-1氢溴酸作为电解液的电池电压低于0.5 mol·L-1氢溴酸为电解液的电池电压,如图6(a)所示。由于氢溴酸是溴的良好溶剂,溴在1 mol·L-1氢溴酸中的溶解性高于0.5 mol·L-1的氢溴酸,所以溴在1 mol·L-1氢溴酸电解液中向电极的传质较快。在低电流密度区,电化学反应速率较慢,不会出现浓差极化;而在高电流密度区,电极界面溴反应速率加快,浓差极化影响严重30,所以在图6(a)极化曲线中,0.5 mol·L-1氢溴酸电池的电压在大电流密度区较低。图6(b)中,溴在1 mol·L-1氢溴酸电解液中溶解度较高,传质较快,浓差极化较小,所以电池放电电压较高;随放电时间延长,也发现0.5 mol·L-1氢溴酸电池的电压下降趋势变快,出现了明显的浓差极化。Huskinson和Aziz31建立了氢溴电池电极极化模型,认为溴电极的电化学极化和传质极化是影响电池性能的关键因素,在高电流密度下,溴电极的传质极化影响更大,电解液浓度升高,传质极化缓解。
电解液中氢溴酸浓度为1 mol·L-1,向电解液中添加单质溴,使电解液中溴浓度提高至0.2和0.4 mol·L-1,在200 mA·cm-2电流密度下进行恒流充放电测试,如图7所示。电解液中氢溴酸浓度不变,加入溴素,对电池的充电性能影响很小。但电池的放电电压变化明显,添加0.4 mol·L-1单质溴的电池,放电性能明显高于单质溴浓度为0.2 mol·L-1和无溴的单电池。计算电池的能量效率,单质溴浓度由零提高至0.2、0.4 mol·L-1,电池的能量效率分别是77.1%、78.2%和79.0%。
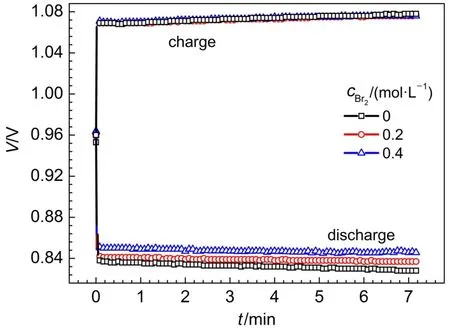
图7 在电流密度为200 mA·cm-2时改变电解液中单质溴浓度的氢溴电池恒流充放电曲线Fig.7 Charge and discharge curves of the hydrogen bromine battery at 200 mA·cm-2current density with different bromine concentration in the electrolyte
电解液中氢溴酸浓度是影响电池充电电压高低的主要因素,所以向电解液中添加单质溴,并没有显著影响充电过程。而对于放电过程,向电解液中添加单质溴,溴电极电化学还原反应速度加快、电化学极化减小,同时溴传质加快,减小了浓差极化,所以电池的放电电压提高,电池的能量效率和电压效率均明显提高32。
3.3 氢溴电池的氢气出口压力对电池性能的影响
电解液中氢溴酸浓度为2 mol·L-1,溴浓度为0.4 mol·L-1,在电流密度为200 mA·cm-2进行电池恒流充放电测试,在充放电过程的不同步骤中,采用不同的氢出压力,实验结果如图8所示。
由图8数据计算出每个循环在不同氢出压力下电池的能量效率,如图9所示。可见在充电过程中,随氢出压力的减小,电池能量效率显著提高,氢出压力为零时,电池能量效率达到80.0%。这是因为充电过程中负极产生氢气,降低电池的氢出压力,有利于负极氢气的产生、逸出,降低催化剂表面氢气的吸附,相应增大了催化剂的有效催化面积。但是充电过程中,降低氢出压力,这将增大电池正负极之间的压力差,使质子交换膜由正极向负极的透酸现象更严重。膜透酸使负极Pt/C催化剂性能衰减,不利于电池的长期稳定运行,所以充电过程中,负极需要维持一定的氢出压力,以解决膜透酸的问题。
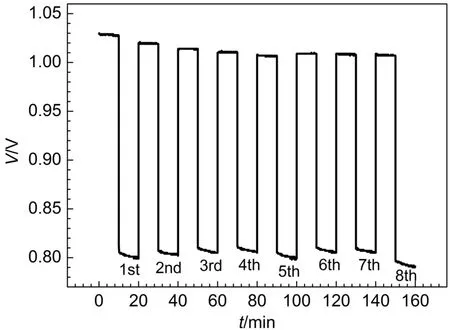
图8 在电流密度为200 mA·cm-2时不同氢出压力下氢溴电池恒流充放电测试Fig.8 Charge and discharge experiment for the hydrogen bromine battery under different hydrogen pressures at 200 mA·cm-2current density
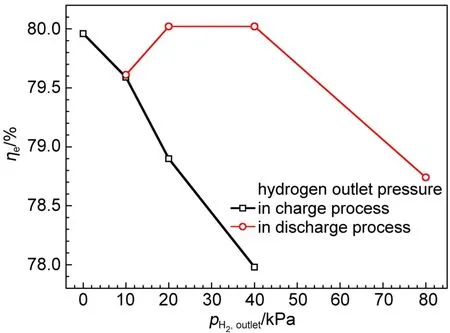
图9 氢出压力对氢溴电池能量效率的影响Fig.9 Effect of hydrogen pressure on the energy efficiency(ηe)of the hydrogen bromine battery
在放电过程中,氢出压力过大或过小,电池的能量效率均较低。氢出压力小,将影响氢气传质,使浓差极化增大,放电电压降低,相应电池效率会降低。而氢气压力过大,由于氢气的电化学氧化反应速度有限,将增大氢气在催化剂表面的吸附,影响催化层的质子传导。放电过程,理想的氢气压力是可维持氢气在催化剂表面的单层吸附,所以放电过程中,氢出压力控制在20.0-40.0 kPa较合适,此范围的能量效率和电压效率为80.0%。经反复实验,确定在氢溴电池充电和放电过程中,电池的氢出压力均控制在40.0 kPa;并且氢溴电池测试平台的氢出口尾排阀全开,可以满足氢溴电池在充电和放电过程中对氢气压力控制的不同需求。始终维持氢溴电池氢侧有一定的压力,这样可以延迟或避免质子交换膜透酸现象的发生,并且使电池具有较高的效率。
3.4 质子交换膜厚度对氢溴电池能量效率的影响
电解质溶液中氢溴酸和溴浓度分别是3和5 mol·L-1,分别使用50.0、20.0和15.0 μm的质子交换膜组装氢溴单电池,进行充放电性能测试。图10(a)和(b)分别是三种膜厚度的氢溴单电池极化曲线和功率曲线,由图10(a),膜厚度由50.0 μm降至20.0 μm,充电电压明显下降,这正是由于膜减薄后膜电阻降低的原因。膜厚度降低至15.0 μm,发现电池的充电电压较20.0 μm的Nafion膜又明显增大,这是由于膜薄,虽然膜电阻会降低,但是膜由正极向负极透酸现象更严重,造成Pt/C催化剂性能衰减,电化学极化增大,充电电压反而升高。
比较放电过程,在小电流密度放电时,降低膜厚度,虽可降低膜电阻极化,但此时,膜透酸所造成的负极Pt/C催化剂性能衰减是影响电池性能的主要因素,厚膜对于阻止膜透酸更具优势,所以具有更高的放电电压。只有在大电流密度放电时,如超过200 mA·cm-2,膜电阻极化成为影响电池放电性能的主要因素,所以,此时薄的质子交换膜具有更高的放电电压和功率密度,如图10 (b)所示。
所以氢溴电池在超过200 mA·cm-2电流密度运行时,降低膜厚度有效降低膜电阻极化,对放电过程更有利。但充电过程,降低膜厚度,随氢离子的传递,膜透酸现象更严重,所以膜不能太薄,厚度20.0 μm的质子交换膜更有利于充电过程。Tucker等33认为膜的性质对于氢溴电池的性能和效率具有重要影响,电池的运行应权衡膜的导电性和溴与水分子的穿流两因素,在高电流密度区,导电性制约电池效率的提升;而在低电流密度区,溴和水分子的穿流限制了电池效率的提高。
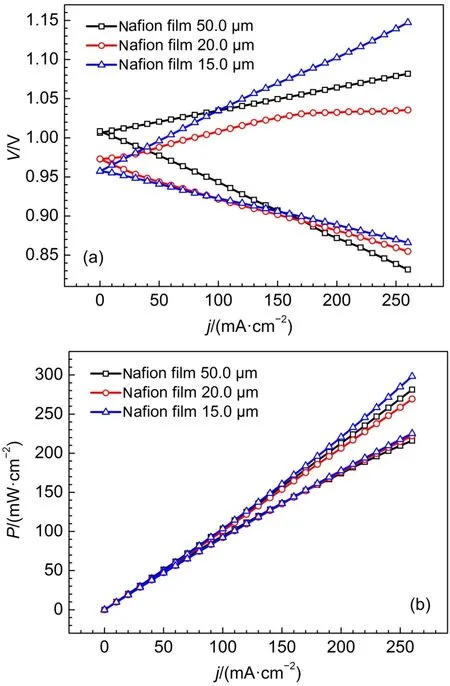
图10 不同膜厚度的氢溴单电池测试极化曲线(a)和功率曲线(b)Fig.10 Polarization curves(a)and power curves(b)of the hydrogen bromine battery with different membrane thickness
图11(a,b,c)分别是在电流密度为200 mA·cm-2时,分别使用50.0、20.0和15.0 μm质子交换膜的氢溴电池,前五次恒流充放电曲线,如图11(a)和图11(b)所示。随循环次数增加,50.0 μm Nafion膜和20.0 μm Nafion膜的氢溴电池充电电压下降,这可能是由于随循环次数的增加,溴电极表面润湿程度增大,尤其是碳毡的多孔网络结构与氢溴酸电解液充分接触,催化反应活性面积增大,电化学反应速度加快,电化学极化和浓差极化均减小所致。而如图11(c)所示,随循环次数增加,充电电压升高,这可能是由于膜太薄,正极向负极透酸现象严重,负极Pt/C催化剂的催化活性下降,负极电化学极化增大所致。在放电过程中,三种膜厚度的电池,均表现出随循环次数增加,放电电压下降的趋势,这是由于随循环次数增加,溴电极表面的不可逆吸附,会使电极的有效催化活性面积下降,电化学极化增大;并且膜透酸也会造成负极Pt/C催化剂腐蚀,使负极电化学比表面积下降,电化学极化增大。

图11 不同质子交换膜厚度的氢溴电池恒流充放电曲线Fig.11 Charge and discharge curves of the hydrogen bromine battery with different thickness proton exchange membrane
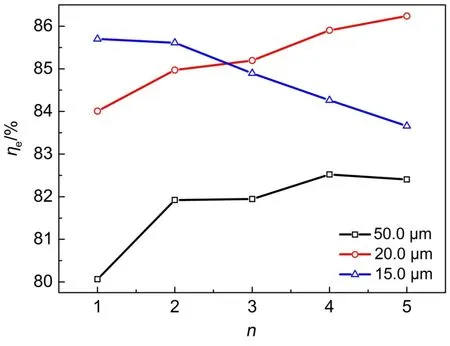
图12 不同厚度膜的氢溴电池能量效率曲线Fig.12 Energy efficiency of the hydrogen bromine battery with different thickness of the membrane
由恒流充放电曲线,计算出三种膜厚度的氢溴电池前五次循环的能量效率,如图12所示。20.0 μm Nafion膜氢溴电池的前五次循环平均能量效率为85.3%,高于15.0 μm Nafion膜的氢溴电池,50.0 μm Nafion膜的氢溴电池前五次循环平均能量效率最低,仅为81.8%。Livshits等32以纳米多孔质子传导膜为隔膜,电解液1 mol·L-1HBr和0.9 mol·L-1Br2,电极面积5 cm2,溴电极负载1 mg 30%Pt/C,电池的能量效率接近90%。本实验的膜电极面积为186 cm2,溴电极碳毡负载的是导电炭黑BP 2000,对溴的催化能力远低于Pt/C催化剂,所以电池的能量效率仅达到约85%。
对于50.0和20.0 μm Nafion膜的氢溴电池,发现随循环次数增加,前五次循环能量效率有增大的趋势,这是因为虽然循环次数增加,溴电极的不可逆吸附也会增大,但是溴电极的润湿性也在逐渐改善。如图11(a)和(b),恒流放电前五次循环,虽然电池放电性能逐渐降低,但电池充电性能却在逐渐提高,表现在充电电压逐渐降低,所以50.0和20.0 μm Nafion膜的氢溴电池,前五次循环,电池的能量效率是提高的。对于15.0 μm Nafion膜氢溴电池,虽然循环次数增大,溴电极碳毡的润湿性也在逐渐改善,但是由于膜太薄,正极向负极的膜透酸现象造成负极Pt/C催化剂电化学活性面积下降明显,这是电池能量效率降低的主要原因。
4 结论
(1)在氢溴电池负极碳纸扩散层上建立Pt/C憎水催化层,有助于膜透酸的氢气吹扫排出,提高Pt/C催化剂的电化学活性比表面积;在正极碳毡上浸渍导电炭黑BP2000,提高溴电极的电化学活性比表面积,这是氢溴电池可在200 mA·cm-2电流密度下,持续稳定运行的关键。
(2)提高电解液中氢溴酸浓度,可减小充电过程的正极浓差极化,氢溴电池充电性能提高;同时,提高电解液中氢溴酸浓度,有利于提高溴的溶解性,降低放电过程中溴电极的浓差极化,氢溴电池放电性能提高;向氢溴酸中添加单质溴,也有利于降低放电过程正极的浓差极化。
(3)降低充电过程中氢出压力,有利于负极氢气的产生、逸出,提高电池充电性能,但正负极压差增大,膜透酸问题会严重;放电过程,合适的氢出压力是维持氢气在碳纸憎水催化层的单层吸附,有利于质子的传导;循环过程,充放电均维持氢出压力在40.0 kPa,可避免压力频繁波动对膜电极造成的损坏,同时阻止膜透酸现象的发生。
(4)降低质子交换膜厚度,将降低氢溴电池的内阻电压降,但是当膜厚度降低到一定程度,充电过程中膜透酸问题会很严重,使负极Pt/C催化剂电化学活性比表面积下降,电池充电性能降低;膜厚度对放电过程的影响与电流密度有关,低电流密度区,膜透酸使负极电化学活性比表面下降居主导地位,这是薄膜放电性能较低的主要原因;而在高电流密度区,膜内阻电压降居主导地位,薄膜内阻低,电压降较小,薄膜放电性能较高。
(5)采用20.0 μm质子交换膜,电解液中氢溴酸浓度和溴浓度分别为3和5 mol·L-1,氢出压力40.0 kPa,在200 mA·cm-2电流密度恒流充放电,前五次循环,电池的能量效率和电压效率达到85.3%,库伦效率达到100%。
(1) Panwar,N.L.;Kaushik,S.C.;Kothari,S.Renewable Sustainable Energy Rev.2011,15(3),1513.doi:10.1016/j. rser.2010.11.037
(2) Zeng,Y.K.;Zhou,X.L.;An,L.;Wei,L.;Zhao,T.S.J.Power Sources 2016,324,738.doi:10.1016/j.jpowsour.2016.05.138
(3) Zeng,Y.K.;Zhao,T.S.;An,L.;Zhou,X.L.;Wei,L.J.Power Sources 2015,300,438.doi:10.1016/j.jpowsour.2015.09.100
(4)Wei,L.;Zhao,T.S.;Zhao,G.;An,L.;Zeng,L.Appl.Energy 2016,176,74.doi:10.1016/j.apenergy.2016.05.048
(5) Roznyatovskaya,N.;Noack,J.;Fühl,M.;Pinkwart,K.;Tübke, J.Electrochim.Acta 2016,211,926.doi:10.1016/j. electacta.2016.06.073
(6) Zhang,L.Q.;Lai,Q.Z.;Zhang,J.L.;Zhang,H.M. ChemSusChem 2012,5(5),867.doi:10.1002/cssc.201100530
(7) Yang,H.S.;Park,J.H.;Ra,H.W.;Jin,C.S.;Yang,J.H.J. Power Sources 2016,325,446.doi:10.1016/j. jpowsour.2016.06.038
(8) Zhao,P.;Zhang,H.M.;Zhou,H.T.;Yi,B.L.Electrochim.Acta 2005,51(6),1091.doi:10.1016/j.electacta.2005.06.008
(9) Zhou,H.T.;Zhang,H.M.;Zhao,P.;Yi,B.L.Electrochim.Acta 2006,51(28),6304.doi:10.1016/j.electacta.2006.03.106
(10) Wei,X.L.;Li,L.Y.;Luo,Q.T.;Nie,Z.M.;Wang,W.;Li,B.; Xia,G.G.;Miller,E.;Chambers,J.;Yang,Z.G.J.Power Sources 2012,218,39.doi:10.1016/j.jpowsour.2012.06.073
(11) Li,B.;Li,L.Y.;Wang,W.;Nie,Z.M.;Chen,B.W.;Wei,X.L.; Luo,Q.T.;Yang,Z.G.;Sprenkle,V.J.Power Sources 2013, 229,1.doi:10.1016/j.jpowsour.2012.11.119
(12) http://www.tau.ac.il/institutes/ifcbc/pdf/_EnStorage% 20presentation%20%20Public%206-07.pdf(accessed June, 2007).
(13) Lin,G.;Chong,P.Y.;Yarlagadda,V.;Nguyen,T.V.;Wycisk,R. J.;Pintauro,P.N.;Bates,M.;Mukerjee,S.;Tucker,M.C.; Weber,A.Z.J.Electrochem.Soc.2016,163(1),A5049. doi:10.1149/2.0071601jes
(14) Cho,K.T.;Tucker,M.C.;Ding,M.;Ridgway,P.;Battaglia,V. S.;Srinivasan,V.;Weber,A.Z.ChemPlusChem 2015,80(2), 402.doi:10.1002/cplu.201402043
(15) Wang,C.H.;Li,X.F.;Xi,X.L.;Zhou,W.;Lai,Q.Z.;Zhang, H.M.Nano Energy 2016,21,217.doi:10.1016/j. nanoen.2016.01.015
(16) Zhang,L.Q.;Zhang,H.M.;Lai,Q.Z.;Li,X.F.;Cheng,Y.H. J.Power Sources 2013,227,41.doi:10.1016/j. jpowsour.2012.11.033
(17) Höhne,K.;Starbeck,G.Hydrogen/Bromine Cell.U.S.Pat. Appl.4520081,1985.
(18) Braff,W.A.;Bazant,M.Z.;Buie,C.R.Nat.Commun.2013,4, 2346.doi:10.1038/ncomms3346
(19) Xu,W.;Scott,K.Int.J.Hydrog.Energy 2010,35(21),12029. doi:10.1016/j.ijhydene.2010.08.055
(20) Medina,P.;Santarelli,M.Int.J.Hydrog.Energy 2010,35(11), 5173.doi:10.1016/j.ijhydene.2010.02.130
(21) Ehteshami,S.M.M.;Vignesh,S.;Rasheed,R.K.A.;Chan,S. H.Appl.Energy 2016,170,388.doi:10.1016/j. apenergy.2016.03.001
(22) Mikkola,M.S.;Rockward,T.;Uribe,F.A.;Pivovar,B.S.Fuel Cells 2007,7(2),153.doi:10.1002/fuce.200600206
(23) Hongsirikarn,K.;Goodwin,J.G.,Jr.;Greenway,S.;Creager,S. J.Power Sources 2010,195(21),7213.doi:10.1016/j. jpowsour.2010.05.005
(24) Jie,X.;Shao,Z.G.;Yi,B.L.Electrochem.Commun.2010,12 (5),700.doi:10.1016/j.elecom.2010.03.010
(25) Park,J.W.;Wycisk,R.;Pintauro,P.N.J.Membr.Sci.2015, 490,103.doi:10.1016/j.memsci.2015.04.044
(26) Peled,E.;Blum,A.;Goor,M.Encyclopedia of Electrochemical Power Sources,1st ed.;Elservier:Amsterdam,2009;pp 182-191.doi:10.1016/B978-044452745-5.00860-1
(27) Costa,R.F.D.;Ferreira,J.Z.;Deslouis,C.J.Membr.Sci.2003, 215(1-2),115.doi:10.1016/S0376-7388(02)00607-5
(28) Saito,M.;Ikesaka,S.;Kuwano,J.;Qiao,J.;Tsuzuki,S.; Hayamizu,K.;Okada,T.Solid State Ionics 2007,178(7-10), 539.doi:10.1016/j.ssi.2007.01.001
(29) Tötzke,C.;Gaiselmann,G.;Osenberg,M.;Arlt,T.;Markötter, H.;Hilger,A.;Kupsch,A.;Müller,B.R.;Schmidt,V.;Lehnert, W.;Manke,I.J.Power Sources 2016,324,625.doi:10.1016/j. jpowsour.2016.05.118
(30) Cho,K.T.;Ridgway,P.;Weber,A.Z.;Haussener,S.;Battaglia, V.;Srinivasan,V.J.Electrochem.Soc.2012,159(11),A1806. doi:10.1149/2.018211jes
(31) Huskinson,B.;Aziz,M.J.Energy Sci.Technol.2013,5(1),1. doi:10.3968/j.est.1923847920130501.854
(32) Livshits,V.;Ulus,A.;Peled,E.Electrochem.Commun.2006,8 (8),1358.doi:10.1016/j.elecom.2006.06.021
(33) Tucker,M.C.;Cho,K.T.;Spingler,F.B.;Weber,A.Z.;Lin,G. Y.J.Power Sources 2015,284,212.doi:10.1016/j. jpowsour.2015.03.010
Hydrogen Bromine Battery Structure Optimization and the Operation Condition Effects on Battery Performance
SHI Ji-Cheng1XU Hong-Feng1,*LU Lu1GAO Jun2
(1Liaoning Province Key Laboratory of New Energy Battery,College of Environmental and Chemical Engineering,Dalian Jiaotong University,Dalian 116028,Liaoning Province,P.R.China;2Heilongjiang Daqing Refining&Chemical Company, Daqing 163411,Heilongjiang Province,P.R.China)
This paper studies how particular factors affect hydrogen bromine batteries,including the cell structure,the hydrobromic acid and bromine concentrations,the hydrogen pressure and the proton exchange membrane thickness.After the Pt/C hydrophobic catalyst layer was loaded onto the carbon paper,the hydrogen bromine battery worked at 200 mA·cm-2current density and the battery Coulombic efficiency was 100%.The bromine electrode electrochemical reaction was controlled by the concentration polarization.The battery performance improved when the hydrobromic acid concentration increased.The bromine solubility also increased at the higher hydrobromic acid concentration and the battery discharge performance improved.When the hydrobromic acid concentration was increased from 0.5 mol·L-1to 1 mol·L-1,the energy efficiency and the voltage efficiency increased by 27.9%at the current density of 200 mA·cm-2.In the charge process,asthe hydrogen pressure was reduced,the battery charging performance improved,but severe membrane acid permeability was observed.In the discharge process,the optimal hydrogen pressure was able to maintain the monolayer hydrogen adsorption on the hydrophobic catalyst layer on the carbon paper.The energy efficiency was 80.2%at 40.0 kPa hydrogen pressure in the charge and discharge processes.In the charge process,the membrane thickness was closely related to the membrane resistance polarization and the membrane acid permeability.After the membrane thickness was reduced from 50.0 to 15.0 μm,acid permeability through the membrane was more severe.This reduced the electrochemical active surface area and a reduction in the battery performance was observed.In the discharge process,the membrane acid permeability was the leading factor at the lower current density;the battery with the 50.0 μm Nafion membrane had a higher discharge performance.As the current density was>200 mA·cm-2,the membrane polarization resistance was the dominated factor;the battery with the 15.0 μm Nafion membrane had a higher discharge performance.With the 20.0 μm proton exchange membrane,the energy efficiency and voltage efficiency of the hydrogen bromine battery were 85.3%and the Coulombic efficiency was 100%at the current density of 200 mA·cm-2with five cycles.
Hydrogen bromine battery;Membrane electrode;Proton exchange membrane;Membrane acid permeability; Battery efficiency
O646
10.3866/PKU.WHXB201609195
Received:July 20,2016;Revised:September 19,2016;Published online:September 19,2016.
*Corresponding author.Email:hfxu@fuelcell.com.cn;Tel:+86-411-84106713.
The project was supported by the National Natural Science Foundation of China(21376034,21406024)and National High-Tech Research and Development Program,China(863)(2012AA052002).
国家自然科学基金(21376034,21406024)和国家高技术研究发展计划(863)(2012AA052002)资助项目
