立方体纳米氧化亚铜反应动力学的理论及实验研究
2016-12-29汤焕丰黄在银陈栎莹
汤焕丰 黄在银,2,3,* 肖 明 梁 敏 陈栎莹
(1广西民族大学化学化工学院,南宁530006;2广西民族大学,广西林产化学与工程重点实验室,南宁530006;3广西高校食品安全与药物分析化学重点实验室,南宁530006)
立方体纳米氧化亚铜反应动力学的理论及实验研究
汤焕丰1黄在银1,2,3,*肖 明1梁 敏1陈栎莹1
(1广西民族大学化学化工学院,南宁530006;2广西民族大学,广西林产化学与工程重点实验室,南宁530006;3广西高校食品安全与药物分析化学重点实验室,南宁530006)
为了探究纳米多相反应过程的动力学行为,本文通过液相还原法可控合成了粒度为55 nm的立方体氧化亚铜(Cu2O)。基于纳米与块体Cu2O的区别,采用原位微量热技术获取Cu2O体系与HNO3反应过程的热动力学精细信息,结合热动力学原理及动力学过渡态理论计算得到Cu2O反应动力学参数,并建立立方体动力学模型讨论并佐证动力学实验结果。结果表明,纳米Cu2O的反应速率常数大于块体,而表观活化能、指前因子、活化焓、活化熵和活化Gibbs自由能均小于块体;随着温度的升高,纳米Cu2O的反应速率常数和活化Gibbs自由能均增大。动力学模型表明影响反应动力学参数的主要因素为:偏摩尔表面焓影响表观活化能,偏摩尔表面熵影响指前因子,偏摩尔表面Gibbs自由能影响反应速率常数。本文为纳米材料多相反应动力学参数的获取和分析应用提供了一种普适的理论模型和实验方法。
原位微量热技术;反应动力学;动力学模型;纳米材料;立方体Cu2O
Key Words:In-situ microcalorimetry;Reaction kinetics;Kinetic model;Nanomaterial; Cubic cuprous oxide
1 引言
纳米材料由于自身独特的表面结构,表现出有异于块体材料的表面物理化学效应1,2。动力学性质是纳米材料的固有属性,影响多相反应速率、活化能和反应机理等过程,现已成为纳米材料在吸附3、溶解4、催化5、传感6、电化学7、生物学8等实际应用中不可或缺的一部分。
近年来,大批的化学家把工作重点转移到纳米动力学领域9,10,但纳米动力学性质强烈依赖于材料的形貌与粒度11,如何准确测量纳米反应动力学参数并探索其演变规律,是纳米动力学发展亟待解决的科学问题。目前,Chen等12利用不同形貌Cu2O催化分解高氯酸铵,采用模型拟合差示扫描量热(DSC)法获取其动力学参数,发现形貌是影响催化动力学重要因素,{110}晶面刻蚀的Cu2O展现出更低的活化能和最佳的催化活性。Chaudhary等13建立等温解吸动力学模型,研究一系列粒度MgH2反应的动力学行为,发现动力学参数与粒度有很强的相关性,粒度越小,反应动力学越快且远远快于块体。薛永强等14-16由动力学模型结合实验结果验证纳米反应动力学参数与粒度存在显著比例关系:随着粒度减小,表观活化能与指前因子减小,速率常数则增大。上述研究的对象大多是微米级甚至毫米级的固体颗粒,动力学方程是经验或半经验的动力学模型,或模型局限于无内孔球形颗粒。因此,寻求一种有效方法获取化学反应过程热动力学信息并建立合适的模型,对于纳米反应动力学研究至关重要。
现代原位微量热技术17,18是一种能实时在线监测体系反应过程的热动力学变化并获取动力学参数的实验方法,具有高精度、高灵敏度,快速准确地获取热力学和动力学精细信息的独特优势,应用于纳米材料生长、反应、吸附、溶解等过程热动力学研究具有普适性和科学性。因此,本文以立方体纳米Cu2O为研究体系,采用原位微量热技术结合热动力学原理及动力学过渡态理论计算获得Cu2O与硝酸反应过程的动力学参数,并建立立方体动力学模型关联讨论了纳米/块体Cu2O反应动力学规律。
2 实验部分
2.1 试剂与仪器
CuSO4·5H2O(AR,≥99.0%),NaOH(AR,≥96.0%)购于国药集团化学试剂有限公司;柠檬酸三钠(AR,≥99.0%),抗坏血酸(AR,≥99.7%),HNO3(GR,65%-68%)均购于广东西陇化工股份有限公司;KCl(GR,99.99%),块体Cu2O(AR,≥99.0%)购于阿拉丁试剂有限公司;纳米Cu2O为实验室自主合成。
微量电子天平(XS3DU,瑞士梅特勒-托利多国际股份有限公司);X射线衍射仪(XRD,Ultima IV,日本理学株式会社,测试条件:Cu靶,Kα射线源,λ=0.15406 nm,扫描角度范围为20°-80°,扫描速率为5(°)·min-1);显微拉曼光谱仪(Raman,InVia,英国雷尼绍公司;测试激发波长为532 nm);场发射扫描电子显微镜(FE-SEM,SUPRA 55 Sapphire,德国卡尔蔡司公司);透射电子显微镜(TEM,JEM-2100,日本电子株式会社);微量热仪(RD 496-CK 2000,绵阳中物热分析仪器有限公司);粒度分布直方图由Nano Measurer软件对扫描电镜图统计所得。
实验前利用焦耳效应标定微量热仪,测得其在298.15 K下的量热常数为(65.91±0.02)µV·mW-1。为了进一步验证仪器的准确性,在298.15 K下测定了特纯KCl在去离子水中以摩尔比为nKCl:nH2O=1:1110的溶解焓为(17.582±0.034)kJ·mol-1,这与报道值((17.536±0.009)kJ·mol-1)19非常接近,表明量热系统准确可靠。
2.2 立方体纳米Cu2O的制备
量取200 mL去离子水和0.5 mL、0.6 mol·L-1柠檬酸三钠于250 mL的烧杯中,在30°C水浴池以恒定速率搅拌20 min;快速注入0.5 mL、1.2 mol·L-1CuSO4溶液;反应5 min后,滴加0.5 mL、4.8 mol·L-1NaOH溶液;继续反应5 min,滴加0.5 mL、1.2 mol·L-1抗坏血酸,接着反应30 min后得到橙红色沉淀;静置后,分别用去离子水和无水乙醇离心洗涤3次,通足够的N2并封存于无水乙醇中。实验前在60°C真空干燥箱干燥6 h后使用。
2.3 Cu2O微量热实验
微量电子天平准确称取1.500 mg纳米/块体Cu2O于15 mL样品池,移液枪移取1.0 mL、2.0 mol·L-1的HNO3溶液于小玻璃管中;将小玻璃管嵌入样品池中并移至微量热系统,设定仪器参数,分别恒温至298.15、308.15和318.15 K;待基线平稳后捅破小玻璃管,使Cu2O和HNO3混合发生反应,得到反应过程的原位热谱曲线。经计算可获得纳米/块体Cu2O的动力学参数。
2.4 纳米Cu2O反应动力学参数的实验获取
纳米/块体Cu2O与HNO3溶液反应的化学方程式为:
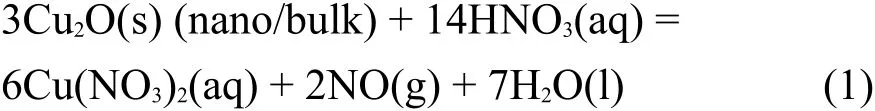
在298.15、308.15和318.15 K温度下,由RD 496-CK 2000型微量热仪分别实时记录纳米/块体Cu2O与HNO3溶液反应过程热电势信息,通过对文献20报道的等温等压下不可逆化学反应的热动力学方程进行最小二乘法回归,即可求出反应的速率常数。

其中,H∞为整个反应过程的焓变,Hi为反应时间t时的瞬时焓变;dHi/dt为热焓变化率,k为反应速率常数(单位为s-1),n为反应级数。
由温度和速率常数的数据对式(3)进行最小二乘法回归,可求出反应的表观活化能(Ea)和指前因子(A);同样,由式(4)和(5)可分别求得活化Gibbs自由能,活化焓和活化熵。
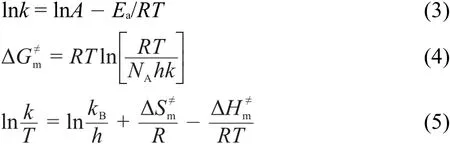
式中,T为反应温度,NA是阿伏伽德罗常数,h是普朗克常数,kB是波尔兹曼常数,R是摩尔气体常数。
3 结果与讨论
3.1 Cu2O的表征
图1(a)是所制备Cu2O的SEM图谱,该Cu2O形貌单元为立方体,形貌规则、分布均匀。由图1(b)的粒度分布直方图和图1(c)的TEM图谱可知,立方体Cu2O的平均粒度为(55.0±6.6)nm。图1(c1)的选区电子衍射图显示立方体纳米Cu2O属于(020)、(110)、(220)和(310)晶面,但图1(c2)的晶格间距d为0.30 nm,说明该立方体Cu2O主要暴露晶面为(110)晶面。图1(e)的块体Cu2O形貌不规则且粒度在10µm以上。
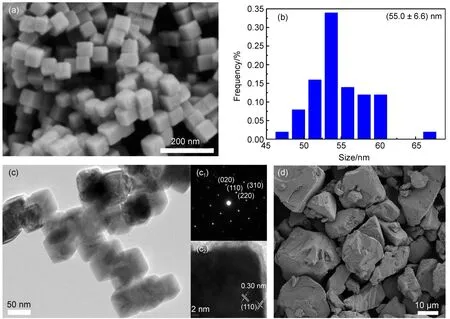
图1 纳米Cu2O的(a)SEM图,(b)粒度分布图,(c)TEM图谱,(c1)选区电子衍射图谱,(c2)高分辨透射电镜图;(d)块体Cu2O的SEM图Fig.1 (a)Scanning electron microscopy(SEM)image,(b)particle size distribution histogram,(c)transmission electron microscopy(TEM)image,(c1)selected area electron diffraction(SAED)pattern, (c2)high-resolution TEM image of nano-Cu2O;(d)SEM image of bulk Cu2O
图2(a)的XRD图谱表明纳米和块体Cu2O的衍射峰均与氧化亚铜面心立方晶系Cu2O(JPCDS卡片No.05-0667)峰型相对应。图中各衍射峰强度较强且未出现其他杂质峰,表明它们结晶度良好,晶体较纯。其中,块体Cu2O的(111)峰强远高于纳米Cu2O。图2(b)显示产物的拉曼特征峰符合Cu2O文献报道21,22且没有发现CuO的特征峰23,表明晶体较纯,这与XRD表征结果一致。此外,在218 cm-1处块体Cu2O峰强较纳米Cu2O的尖锐。
3.2 立方体纳米Cu2O的反应动力学模型
3.2.1 活化焓、活化Gibbs自由能和活化熵
根据薛永强等24-26报道的偏摩尔焓理论,有
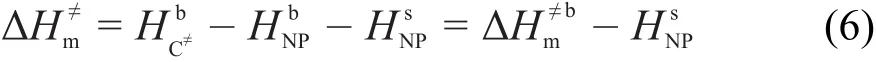

图2 纳米和块体Cu2O的(a)XRD图谱和(b)拉曼图谱Fig.2 (a)X-ray diffraction(XRD)patterns and (b)Raman spectra of nano-Cu2O and bulk Cu2O
不同于无内孔球形颗粒,立方体纳米颗粒的偏摩尔表面焓理论模型为:

式中,M、ρ、l和Hs分别为立方体纳米颗粒的摩尔质量、密度、棱长和比表面焓。
结合式(6)和式(7),可得立方体纳米颗粒的活化焓为:
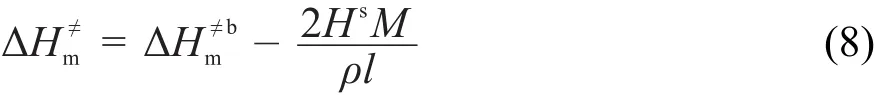
同理,立方体纳米颗粒的偏摩尔表面Gibbs自由能和活化Gibbs自由能分别为:

式中,σ为表面张力,ΔrG≠bm为块体活化Gibbs自由能。
如果温度对纳米颗粒体积的影响可以忽略,根据热力学基本方程ΔS=-(∂ΔG/∂T)p和式(10),则有:

由式(11)可得偏摩尔表面熵为:

3.2.2 表观活化能、指前因子和反应速率常数
假设纳米反应体系符合过渡态理论,那么根据过渡态理论,表观活化能可表示为:

结合式(8),上式可改写为:
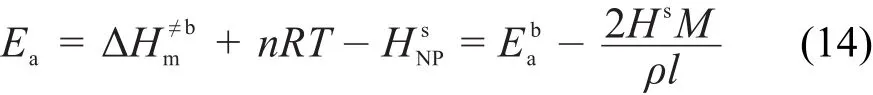
从式(14)可看出,纳米反应的表观活化能与粒度和比表面焓有关,且表观活化能主要由偏摩尔表面焓决定。粒度越小,偏摩尔表面焓越大,表观活化能越小。
在特定温度下,指前因子与exp(ΔSm≠/R)成比例关系,结合式(11)得:

式中,C1是与温度有关的常数。
从式(15)可知,指前因子与反应物粒度和偏摩尔表面熵有关,指前因子主要由偏摩尔表面熵决定。当纳米颗粒的粒径大于10 nm时,σ可近似为常数;对于普通的纯固体物质,。所以,粒度越小,偏摩尔表面熵越大,指前因子越小。
假设纳米反应动力学体系符合Arrhenius公式lnk=lnA-Ea/RT,将式(13)和式(15)代入得:

式中,C2是与温度有关的常数。
将式(9)代入式(16),得:

由式(16)及(17)可知,反应速率常数k与反应物的粒度和偏摩尔表面Gibbs自由能有关,反应速率常数主要由偏摩尔表面Gibbs自由能决定。粒度越小,偏摩尔表面Gibbs越大,反应速率常数越大。
3.3 立方体纳米Cu2O反应动力学参数
3.3.1 反应速率常数
由微量热仪测得的热动力学数据对式(2)进行线性回归,可获得不同温度下Cu2O体系与HNO3反应的速率常数,平均三次实验的数据见表1。
如表1所示,同一温度下,纳米Cu2O的反应速率常数明显大于块体Cu2O。纳米材料与块体材料的本质区别在于表面相的高比表面效应。当物质超细化至纳米尺度后,表面原子数目急剧增加,这些原子存在悬空键而极其活泼,因此增大了反应速率,速率常数k增大。由动力学模型分析,偏摩尔表面Gibbs自由能是反应速率常数主要决定因素。55 nm的Cu2O粒度远远小于对应的块体,故其偏摩尔表面Gibbs自由能大,速率常数大于块体Cu2O。

表1 不同温度下的纳米和块体Cu2O(s)与HNO3(aq)反应的速率常数Table 1 Rate constants of nano-Cu2O and bulk Cu2O(s)in HNO3(aq)at different temperatures
随着温度升高,纳米和块体Cu2O的反应速率常数均增大。因为温度升高,表面活化原子数增多,反应速率增大,速率常数k增大。
3.3.2 表观活化能与指前因子
根据式(3)的Arrhenius方程,对速率常数的自然对数(lnk)与温度的倒数(1/T)数据进行线性拟合(图3),由斜率和截距可分别求得Cu2O反应体系的表观活化能Ea和指前因子A,数据见表2。
由表2可知,纳米Cu2O反应的表观活化能与指前因子均比块体材料小,这与式(14)表观活化能和式(15)指前因子的动力学模型一致。由动力学模型可知,表观活化能的影响主要归因于偏摩尔表面焓。对于块体反应物,比表面焓很小,与活化能相比可忽略不计;而对于纳米反应物,比表面焓很大,从而导致表观活化能明显降低。因此,纳米Cu2O粒度小,偏摩尔表面焓大,故反应的表观活化能小于块体。指前因子的影响主要归因于偏摩尔表面熵。纳米颗粒越细,摩尔活化熵越小,而偏摩尔表面熵越大,则指前因子越大。
3.3.3 活化Gibbs自由能、活化焓和活化熵
由已知的速率常数和式(4)可得到不同温度立方体Cu2O反应的活化Gibbs自由能;由式(5)将lnk/T对温度的倒数(T-1)进行线性回归,可获得立方体Cu2O反应的活化焓和活化熵,具体计算数据见表3。

图3 速率常数的自然对数(lnk)与温度的倒数(1/T)的关系曲线Fig.3 Relationships between the natural logarithm of rate constant(lnk)and the reciprocal of temperature(1/T)

表2 纳米和块体Cu2O(s)与HNO3(aq)反应的活化能(Ea)和指前因子的自然对数(lnA)Table 2 Apparent activation energy(Ea)and natural logarithm of pre-exponential factor(lnA)of nano-Cu2O(s)and bulk Cu2O(s)in HNO3(aq)
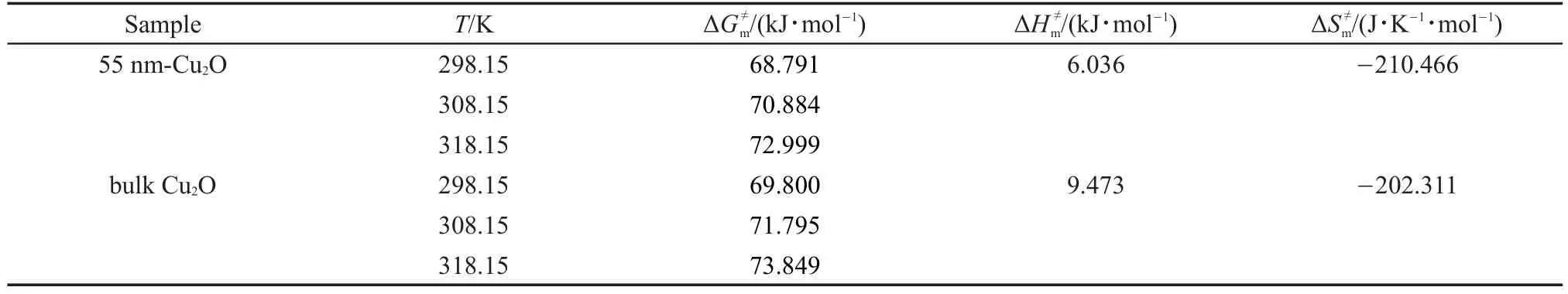
表3 纳米和块体Cu2O(s)与HNO3(aq)反应的活化焓(ΔHm≠)、活化熵(ΔSm≠)及活化Gibbs自由能(ΔGm≠)Table 3 Activation enthalpy(ΔHm≠),activation entropy(ΔSm≠),and activation Gibbs free energy(ΔGm≠)of nano-Cu2O(s)and bulk Cu2O(s)in HNO3(aq)
如表3所示,纳米Cu2O反应的活化焓、活化熵及活化Gibbs自由能均比块体的小,这与式(8)、(10)和(11)的动力学模型规律一致。因为纳米粒子特殊的高比表面效应,使得势能高于相应块体,根据过渡态理论,到达同一过渡态时纳米体系所需克服的能垒比块体小,因此粒度越小,物质被活化所需能量越小,亦即活化焓、活化熵及活化Gibbs自由能越小。此外,活化Gibbs自由能随着温度的升高而增大。
4 结论
通过原位微量热技术获取了纳米/块体氧化亚铜与硝酸溶液反应过程热动力学信息,结合热动力学原理及过渡态理论计算得到反应动力学参数,建立了立方体模型讨论并论证动力学实验结果,可得出如下结论:(1)纳米Cu2O的反应速率常数大于块体,而表观活化能、指前因子、活化焓、活化熵和活化Gibbs自由能均小于块体;(2)随着温度升高,纳米Cu2O的反应速率常数和活化Gibbs自由能均增大;(3)动力学模型表明反应动力学参数的影响因素为:偏摩尔表面焓影响表观活化能,偏摩尔表面熵影响指前因子,偏摩尔表面Gibbs自由能影响反应速率常数。本文对比分析了纳米与块体材料的动力学参数差异,可为下一步不同粒度的纳米反应动力学研究提供思路与方法。
(1) Tian,N.;Zhou,Z.Y.;Sun,S.G.;Ding,Y.;Wang,Z.L.Science 2007,316(5825),732.doi:10.1126/science.1140484
(2) Sun,S.G.;Chen,S.L.Electrocatalysis;Chemical Industry Press:Beijing,2013;pp 12-20.[孙世刚,陈胜利.电催化.北京:化学工业出版社,2013:12-20.]
(3) Xue,D.X.;Belmabkhout,Y.;Shekhah,O.;Jiang,H.;Adil,K.; Cairns,A.J.;Eddaoudi,M.J.Am.Chem.Soc.2015,137(15), 5034.doi:10.1021/ja5131403
(4) Gao,J.Y.Anal.Chem.2012,84(24),10671.doi:10.1021/ ac302297a
(5) Bai,S.;Jiang,J.;Zhang,Q.;Xiong,Y.Chem.Soc.Rev.2015,44 (10),2893.doi:10.1021/acs.analchem.5b01518
(6) Wagner,C.E.;Macedo,L.J.;Opdahl,A.Anal.Chem.2015,87 (15),7825.doi:10.1021/ja512224g
(7) Mao,X.;Tian,W.;Wu,J.;Rutledge,G.C.;Hatton,T.A.J.Am. Chem.Soc.2015,137(3),1348.doi:10.1021/ja512224g
(8) Hariadi,R.F.;Yurke,B.;Winfree,E.Chem.Sci.2015,6(4), 2252.doi:10.1039/C3SC53331J
(9) Ning,H.B.;Li,Z.R.;Li,X.Y.Acta Phys.-Chim.Sin.2016,32 (1),131.[甯红波,李泽荣,李象远.物理化学学报,2016,32 (1),131.]doi:10.3866/PKU.WHXB201512151
(10) Hashemi,H.;Babaee,S.;Mohammadi,A.H.;Naidoo,P.; Ramjugernath,D.J.Chem.Thermodyn.2015,82,47. doi:10.1016/j.jct.2014.10.017
(11) Li,X.X.;Huang,Z.Y.;Zhong,L.Y.;Wang,T.H.;Tan,X.C. Chin.Sci.Bull.2014,59(25),2490.[李星星,黄在银,钟莲云,王腾辉,谭学才.科学通报,2014,59(25),2490.]doi:10.1360/ N972014-00332
(12) Luo,X.L.;Wang,M.J.;Yun,L.;Yang,J.;Chen,Y.S.J.Phys. Chem.Solids 2016,90,1.doi:10.1016/j.jpcs.2015.11.005
(13) Chaudhary,A.L.;Sheppard,D.A.;Paskevicius,M.;Pistidda, C.;Dornheim,M.;Buckley,C.E.Acta Mater.2015,95,244. doi:10.1016/j.actamat.2015.05.046
(14) Xue,Y.Q.;Du,J.P.;Wang,P.D.;Wang,Z.Z.Acta Phys.-Chim.Sin.2005,21(7),758.[薛永强,杜建平,王沛东,王志忠.物理化学学报,2005,21(7),758.]doi:10.3866/PKU. WHXB20050712
(15) Xue,Y.Q.;Xia,X.Y.;Cui,Z.X.;Shi,J.Q.J.Comput.Theor. Nanosci.2014,11(9),1927.doi:10.1166/jctn.2014.3589
(16) Wang,S.T.;Wen,Y.Z.;Cui,Z.X.;Xue,Y.Q.J.Nanopart.Res. 2016,18(15),1.doi:10.1007/s11051-016-3324-2
(17) Fan,G.C.;Ma,Z.;Huang,Z.Y.J.Therm.Anal.Calorim.2013, 116(1),485.doi:10.1007/s10973-013-3515-3
(18) Liu,Z.J.;Fan,G.C.;Huang,Y.L.;Qin,X.X.;Huang,Z.Y.;Tan,X.C.;Zhong,L.Y.;Liu,S.G.;Liao,Y.J.Sci.Sin.Chim. 2015,45(8),855.[刘作娇,范高超,黄叶玲,覃小幸,黄在银,谭学才,钟莲云,刘绍刚,廖艳娟.中国科学:化学,2015,45 (8),855.]doi:10.1360/N032014-00304
(19) Hu,R.Z.;Zhao,F.Q.;Gao,H.X.;Song,J.R.Fundamentals and Applications of Calorimetry;Science Press:Beijing,2011; pp 1-10.[胡荣祖,赵凤起,高红旭,宋纪蓉.量热学基础与应用.北京:科学出版社,2011:1-10.]
(20) Gao,S.L.;Chen,S.P.;Hu,R.Z.;Li,H.Y.;Shi,Q.Z.Chin.J. Inorg.Chem.2002,18(4),362.[高胜利,陈三平,胡荣祖,李焕勇,史启祯.无机化学学报,2002,18(4),362.]
(21) Pan,L.;Zou,J.J.;Zhang,T.R.;Wang,S.B.;Wang,L.;Zhang, X.W.J.Phys.Chem.C 2013,118(30),16335.doi:10.1021/ jp408056k
(22) Li,C.;Li,Y.B.;Delaunay,J.J.ACS Appl.Mater.Interfaces 2013,6(1),480.doi:10.1021/am404527q
(23) Wu,L.L.;Tsui,L.K.;Swami,N.;Zangari,G.J.Phys.Chem.C 2010,114(26),11551.doi:10.1021/jp103437y
(24) Xue,Y.Q.;Wang,X.F.;Cui,Z.X.Prog.React.Kinet.Mech. 2011,36(4),329.doi:10.3184/146867811X13103063934186
(25) Fu,Q.S.;Cui,Z.X.;Xue,Y.Q.Eur.Phys.J.Plus 2015,130 (10),212.doi:10.1140/epjp/i2015-15212-4
(26) Fu,Q.S.;Xue,Y.Q.;Cui,Z.X.;Wang,M.F.J.Nanomater. 2014,2014,132.doi:10.1155/2014/856489
An Investigation into the Reaction Kinetics of Cubic Nano-Cu2O in Theory and Experiment
TANG Huan-Feng1HUANG Zai-Yin1,2,3,*XIAO Ming1LIANG Min1CHEN Li-Ying1
(1College of Chemistry and Chemical Engineering,Guangxi University for Nationalities,Nanning 530006,P.R.China;2Key Laboratory of Forest Chemistry and Engineering,Guangxi University for Nationalities,Nanning 530006,P.R.China;3Guangxi Colleges and Universities Key Laboratory of Food Safety and Pharmaceutical Analytical Chemistry,Nanning 530006,P.R.China)
To investigate the kinetic behaviors of nanoparticle heterogeneous reactions,we introduced a liquidphase reduction method to control the synthesis of cubic cuprous oxide with a particle size of 55 nm.Based on the differences between nano-Cu2O and bulk Cu2O,in-situ microcalorimetry was used to acquire fine thermodynamic information of Cu2O systems in HNO3.The reaction kinetic parameters of Cu2O were calculated by a combination of thermodynamic principles and kinetic transition state theory,whose results are discussed and verified with the kinetic models of a cube that has been built.The results demonstrate that unlike the higher reaction rate constant than bulk Cu2O,nano-Cu2O shows lower kinetic parameters,including apparent activation energy,pre-exponential factor,activation enthalpy,activation entropy and activation Gibbs free energy.Both the reaction rate constant and activation Gibbs free energy increase with increasing temperature.The kinetic models show that the main factors affecting the reaction kinetic parameters are as follows:(i)the partial molar surface enthalpy affects the apparent activation energy;(ii)the partial molar surface entropy affects the preexponential factor;and(iii)the partial molar surface Gibbs free energy affects the reaction rate constant.We also provide a universal theoretical model and experimental method for gaining and analyzing kinetic parameters of nanomaterial heterogeneous reactions.
O643
10.3866/PKU.WHXB201609133
Received:August 10,2016;Revised:September 12,2016;Published online:September 13,2016.
*Corresponding author.Email:huangzaiyin@163.com;Tel:+86-13014986096.
The project was supported by the National Natural Science Foundation of China(21273050,21573048).
国家自然科学基金(21273050,21573048)资助项目
