Notch信号通路在相关疾病中的研究进展
2016-12-25,
,
(南华大学公共卫生学院,湖南 衡阳 421001)
·文献综述·
Notch信号通路在相关疾病中的研究进展
唐凯玲,龙鼎新*
(南华大学公共卫生学院,湖南 衡阳 421001)
Notch信号通路在进化上高度保守的一条转导系统,调控细胞的发育、增殖和分化等。Notch信号通路参与多种疾病过程,如肿瘤发生,神经退行性疾病,遗传性疾病等,调控神经系统和免疫系统等生理功能。本文进一步阐述Notch信号通路在肿瘤,阿尔茨海默症,动脉粥样硬化等疾病中的作用。
Notch信号通路; 肿瘤; 神经系统; 免疫系统; 心血管系统; 遗传疾病
Notch信号已经发现近一个世纪,最早是在果蝇研究中发现的一种基因,其功能的异常可导致翅膀锯齿状缺口。Notch信号通路在进化上高度保守,广泛存在于无脊椎动物和脊椎动物中。近年来,Notch成为发育学、细胞生物学、免疫学、血液学、肿瘤学等多个领域的研究热点之一,Notch信号参与许多疾病的发生与发展过程。本文就Notch信号转导途径在相关疾病中的研究进展作一回顾。
1 Notch的结构特点和功能
在哺乳动物中Notch家族主要有4种受体Notch1~4和5种配体(Dll-1,Dll-3,Dll-4,Jagged-1和Jagged-2)均属于单次跨膜蛋白。Notch信号的活化主要通过配体对受体激活后,经过两次裂解,释放胞内段NICD,转运到核内与DNA连接蛋白结合并使之活化,激活 Hes家族、Myc和p21等靶基因的转录,进而发挥一系列生物学效应。
Notch分子分为胞内和胞外段。Notch胞外区由10~36个表皮生长因子(EGF)样重复序列(参与配体间相互作用),3个富含半胱氨酸Lin-12-Notch重复序列(LNR)组成和1个含异二聚体结构域(HD),此区域调控Notch胞内与胞外相互作用。Notch胞内段包括一个RAM结构域, 6~7锚蛋白(ANK)样重复序列,两个核定位序列(NLS),一个脯氨酸-谷氨酸-丝氨酸-苏氨酸富集区(PEST)序列和转录激活区(TAD)[1]。新合成的Notch需经高尔基体通过Furin样转化酶酶剪切(S1),形成一个胞外区和一个含跨膜区和胞内区片段,这两个片段结合在一起形成非共价异源二聚体。运输至细胞表面前,Notch经过进一步糖基化修饰,形成成熟Notch(图1)。
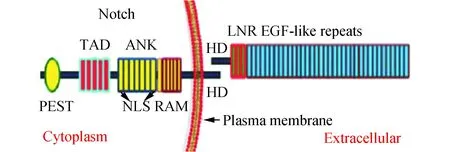
图1 Notch结构示意图
经典Notch激活途径,是通过细胞与细胞间的相互作用,受体与配体(Delta或Jagged)结合,Notch再经过两步水解,激活Notch信号通路。第一步水解是在配体和受体结合后,由金属蛋白酶肿瘤坏死因子α-转化酶(TACE),如ADAM17,在胞外区酶解Notch受体,第二步水解是在跨膜区中近胞膜内位点,经γ-分泌酶/早老素(presenilin-1)水解,释放Notch胞内段NICD。
经过两次水解,释放Notch活化形式NICD转运至细胞核内,通过RAM区和ankyrin重复序列与DNA结合蛋白CSL(RBP-J,CBF-1,Su(H),LAG-1)相互作用,调控下游转录因子表达水平[2]。在核内NICD与RBP-J结合并吸引MAML-1,转录辅助因子形成转录活化因子,激活Notch下游靶基因, HES和HERP活化,编码核碱螺旋-环螺-旋(bHLH)蛋白,继续调控下游基因的表达,发挥生物学功能[3]。Notch信号通路参与细胞发育,增殖,分化,凋亡和粘附等,还调控多种肿瘤发生,神经退行性疾病,免疫系统,心血管系统功能调控以及遗传性疾病等生理病理过程。
2 Notch信号通路与肿瘤
近年来研究发现,Notch信号通路失调与多种肿瘤的发生、发展密切相关,在很多肿瘤中发现Notch信号通路异常活化,表达量升高。最早发现Notch信号通路与肿瘤的联系是在人类T细胞性急性淋巴母细胞白血病(T cell acute lymphoblastic leukemia,T-ALL)基因突变或染色体异位研究中证实的。在T-ALL中发现t(7;9)(q34;q34.3)染色体异位,这个位于9号染色体的突变发现与果蝇Notch1基因同源,在超过50%的T-ALL中存在Notch1突变,主要集中在编码HD和PEST结构域,导致NIC1降解减少,聚集过多致Notch1处于异常活化。乳腺癌的研究中,通过建立小鼠乳腺癌模型,发现鼠乳腺肿瘤病毒插入Notch4基因位点,使得Notch4异常表达导致激活Notch信号通路,诱导肿瘤形成。研究还发现在人乳腺癌细胞系中Notch1表达水平比正常人高,而Myc作为Notch1的作用靶基因,其表达量增加,诱导小鼠肿瘤发生[4]。Notch1 ICD过度表达,还可能通过抑制细胞凋亡促进乳腺癌的发生。乳腺癌病人中还发现在高表达Notch1和Jagged1比低表达的预后更差[5]。神经胶质瘤中,Notch1和其配体Dll-1,Jagged1表达量都存在不同程度的升高。在敲低Notch1或者Dll-1的神经胶质瘤模型小鼠中,显示存活时间比对照组显著延长[6]。越来越多研究发现,Notch信号通路与多种信号通路存在相互作用,如Wnt,AKT/PI3K,NF-κB等信号通路,与肿瘤的形成发展联系密切。
虽然在很多Notch信号通路与肿瘤的研究中发现它主要发挥促癌作用,但是由于Notch信号通路的多样复杂性,其在不同起源的肿瘤或者同一肿瘤的不同阶段,可能发挥着不同的作用,如在皮肤癌,宫颈癌,甲状腺癌等中为抑癌作用[7]。
3 Notch信号通路与神经系统疾病
Notch信号通路参与神经系统发育。Notch信号通路调控神经干/祖细胞的增殖分化,活化Notch信号通路促进神经干细胞增殖,而阻断通路神经干细胞分化增多[8]。Notch信号通路对不同神经细胞发育存在双向选择,Notch信号通路通过抑制神经元细胞,而星形胶质细胞增多[9]。在神经元胶质细胞中,Notch信号通路可促进向星形胶质细胞分化而抑制寡突胶质细胞的分化[10]。Notch信号通路还参与神经再生过程。研究发现Notch信号通路还与轴突和树突生长密切相关,星形胶质细胞可以通过Jagged1介导Notch途径负性调控神经生长[11]。
越来越多的研究表明,Notch信号通路的异常与多种中枢神经系统疾病发生有关[12]。在阿尔茨海默症(Alzheimer’s disease,AD)中,患者大脑中Notch1水平比正常人显著升高。与阿尔茨海默症(AD)密切相关的早老素(PS),证明也参与Notch信号通路调控,是γ-分泌酶家族成员,能特异性切割β淀粉样前体蛋白(APP),最终形成β-淀粉样蛋白(Aβ),即老年斑(SP)主要成分,是AD主要病理变化之一[13]。同时研究表明在AD中, tau有着异常堆积,伴随着Notch-1高表达,提示tau与Notch-1存在联系,与AD的神经病变有关。由于早老素/γ-分泌酶功能发生紊乱,导致Notch信号通路的异常调节,造成神经退行性病变,可能与AD发生有关。同时Notch信号通路也参与小胶质细胞的活化调控,而在AD中发现存在小胶质细胞异常反应,释放的神经炎症因子也是AD的重要发病机制。研究表明阻断Notch信号通路,可改变小胶质细胞极化,可观察到神经元丢失减少现象[14]。
研究发现在脑缺血损伤中,Notch信号是上调的。脑缺血后,Notch诱导损伤后的神经再生。使用γ-分泌酶抑制物(γGSI)和Notch功能缺失模型,已经证实Notch信号通路可诱导小神经胶质细胞免疫反应,而小胶质细胞免疫反应激活,释放神经炎症因子,对神经元造成进一步损伤[15]。同样,在另一个研究中表明Notch1直接参与胶质细胞形成,在梗死周围区域有助于细胞侵袭。但是在低氧缺血中,Notch激活是一个关键过程,促进神经干细胞增殖。在低氧条件下,通过配体过表达,Notch信号通路激活。在正常生理条件下神经干细胞在SGZ和SVZ中是静息状态,但是在发生损伤之后,Notch被激活,神经干细胞增殖。这种再生潜力,是随年龄增长而降低。在使用具有神经毒性的红藻氨酸作用1周,Notch依赖的神经干细胞出现增殖,主要以星形胶质细胞为主。在大脑低氧缺血损伤时外源性Jagged1的应用可促进神经发生潜力在发生瘢痕损伤中,对神经再生和神经元更新是有利影响。近年来还有研究发现通过异氟烷预处理可诱导Notch信号,介导神经保护作用在局灶性缺血中。所以Notch信号通路在脑缺血性损伤中的作用是保护还是抑制,研究结果存在争议。
4 Notch信号通路与免疫系统疾病
Notch信号通路不仅介导神经系统的发育,还参与造血祖细胞,淋巴细胞增殖,发育以及免疫反应过程[16]。在Notch1缺陷突变和RBP-JK(CBF1)缺陷突变小鼠中,造血转录因子SCL,Lmo2,GATA-1,GATA-2,和Runx1表达量减少。此外,NICD-RBP-jk复合物介导GATA-2基因启动和调控GATA-2表达[17]。还有,Jagged1表达减少将直接影响GATA-2表达和在AGM 中的造血功能[18]。过表达NICD或Jagged1将激活Notch信号通路,增强HSCs更新能力,维持未分化细胞状态[19]。但是也有研究证明Notch信号通路并非是HSC自我更新所必须的,在Notch1或RBP-JK基因敲除小鼠中,除了T淋巴细胞出现缺陷,其他造血细胞发育正常。同时在Notch1/Jagged1条件敲除小鼠中,也并没有发现HSCs更新能力和分化情况的异常[20]。
Notch1和RBP-jk基因敲除小鼠,胸腺中T细胞早期发育停滞,产生异常B细胞。在小鼠中移植过表达NICD骨髓细胞,出现非依赖胸腺的未成熟T细胞和B细胞发育阻滞[21]。说明Notch信号通路对T/B细胞的分化具有调控作用[22]。过表达NICD,激活Notch信号通路,增加CD8SP细胞比例,降低CD4SP细胞数[23]。但也有研究显示,过表达NICD,对这两种细胞比例没有影响,但可促进DP细胞向CD4SP和CD5SP细胞发育。在Notch1和RBP-jk基因敲除小鼠中,CD4和CD8SP细胞正常,未出现异常[24]。需要更进一步的研究探索这种差异。
5 Notch信号通路与心血管系统疾病
近十年来,很多研究发现Notch信号通路在心血管发育中有着重要作用,并且与许多心血管疾病的发生和发展有联系。当老鼠胚胎发生Notch1或Notch1和Notch4突变,Notch信号减弱,出现动脉缺陷和胚胎死亡[25]。同样在人出生后和成年时期,Notch1,2和4以及其配体Dll1,4和Jagged-1,-2在血管内皮细胞的表达调节血管生成。研究发现VEGF(血管内皮生长因子)与Notch信号存在相互调控关系,在VEGF存在时,Notch 信号限制管腔的扩大和血管萌芽从而抑制血管新生,而抑制Notch 信号可诱发内皮细胞增生[26]。除了调节血管生成外,Notch信号在维持内皮细胞完整性中起着重要作用,如炎症和缺血时,抑制内皮细胞凋亡。在体外实验中,TNF-α作用于内皮细胞,会导致Notch信号减弱和凋亡。在心力衰竭病人中,Notch失调可能导致人脐静脉内皮细胞(HUVEC)凋亡,这些患者血清中TNF-α越高,疾病越严重[26]。在缺血情况下,VEGF-A调控内皮细胞增殖,侵袭和凋亡。当用γ-secretase 抑制剂阻断Notch通路,内皮细胞在无血清培养条件中,VEGF-A无抑制凋亡作用,提示Notch信号活化对VEGF-A发挥生物学功能有着重要作用[27]。
Notch信号通路由于在内皮细胞中发挥重要生物学功能作用,其在动脉粥样硬化(AS)形成起始阶段有重要影响,激活的巨噬细胞加剧粥样斑块的炎症反应和斑块的不稳定性。大量实验表明,炎症因子激活巨噬细胞中的Notch途径,诱导一氧化氮合酶(iNOS)、PTX3和Id1基因表达,加剧AS病变[28]。在载脂蛋白E缺陷的AS小鼠模型中,以DAPT阻断Notch信号激活,发现减少斑块的形成,抑制AS 病变中巨噬细胞的活性[29]。类似发现,在低密度脂蛋白受体缺陷小鼠中使用DII4拮抗剂阻断Dll4-Notch信号,动脉粥样硬化减弱,减少斑块钙化,改善胰岛素抵抗,降低的脂肪堆积的作用。血管平滑肌细胞(VSMC)增殖,迁移,基质分泌和凋亡也有助于动脉粥样硬化形成,体外实验中,激活Notch1,3 信号,促使VSMC细胞增殖,抑制其凋亡[29]。Notch信号通路还参与心脏的发育,在一些遗传性疾病,如 Alagille综合征,主动脉瓣狭窄,和左室流出道缺陷中存在Notch突变[30]。
6 Notch信号通路与遗传性疾病
常染色体显性遗传性脑动脉病(cerebral autosomal dominant arteriopathy with subcortical infarcts and leukoence Phalopathy,CADASIL),主要临床表现为反复TIA发作,血管性痴呆,缺血性脑卒中等。CADASIL主要致病基因为Notch3,其中大部分变异发生在胞外域EGF样重复序列中,影响到EGF-R中保守半胱氨酸,主要是引起血管内皮平滑肌细胞Notch3构象改变,导致Notch信号通路发生异常[18,31]。在Alzheimer 氏病有一定的家族性,研究发现也与基因突变有关联,其中与早老素(presenilin-1、2)基因遗传突变密切相关[32]。PS同时也参与Notch信号通路调控作用。
7 展 望
Notch信号通路在进化上高度保守,广泛存在于无脊椎动物和脊椎动物中。随着近年来的研究,对Notch信号通路了解越来越深入。Notch信号通路不仅与细胞增殖,与细胞命运决定中起关键作用,而它在其他领域的作用不断被发现。Notch信号通路参与多种生理病理过程,其中一些分子的突变与缺失与很多种疾病的发生发展有关。Notch信号通路还与其他信号通路相互调节,共同发挥作用,是多条信号通路的交汇点之一,Notch信号通路更加多样性复杂性,其与疾病发生的某些分子机制还不太明确,有待进一步探讨。但是,Notch信号通路在多种疾病中的重要作用,使其成为新的药物作用靶点。随着研究的深入,进一步阐明Notch信号通路在疾病中的分子机制,Notch作为新的药物靶点具有广阔的应用前景。
[1] ZhouZD,Kumari U,Xiao ZC,et al.Notch as a molecular switch in neural stem cells[J].IUBMB Life,2010,62(8):618-623.
[2] Iso T,Kedes L,Hamamori Y.HES and HERP families:multiple effectors of the Notch signaling pathway[J].J Cell Physiol,2003,194(3):237-255.
[3] Stylianou S,Clarke RB,Brennan K.Aberrant activation of notch signaling in human breast cancer[J].Cancer Res,2006,66(3):1517-1525.
[4] Klinakis A,Szabolcs M,Politi K,et al.Myc is a Notch1 transcriptional target and a requisite for Notch1-induced mammary tumorigenesis in mice[J].PNAS,2006,103(24):9262-9267.
[5] Chen L,Zhang W,Yan W,et al.The putative tumor suppressor miR-524-5p directly targets jagged-1 and hes-1 in glioma[J].Carcinogenesis,2012,33(11):2276-2282.
[6] Reedijk M,Pinnaduwage D,Dickson BC,et al.JAG1 expression is associated with a basal phenotype and recurrence in lymph node-negative breast cancer[J].Breast Cancer Res Tr,2008,111(3):439-448.
[7] 高方,张琪,郑敏化.转录因子RBP-J介导的信号通路抑制神经干细胞向神经祖细胞的分化[J].医学争鸣,2010,1(2):46.
[8] Sibbe M,Haussler U,Dieni S,et al.Experimental epilepsy affects Notch1 signalling and the stem cell pool in the dentate gyrus[J].Euro J Neuro,2012,36(12):3643-3652.
[9] Arumugam TV,Cheng YL,Choi Y,et al.Evidence that gamma-secretase-mediated Notch signaling induces neuronal cell death via the nuclear factor-kappaB-Bcl-2-interacting mediator of cell death pathway in ischemic stroke[J].Mol Pharma,2011,80(1):23-31.
[10] 程连臣,王昊,徐川,等.Notch1对局灶性脑缺血再灌注损伤后神经细胞凋亡的影响[J].中国生化药物杂志,2015,35(2):59-62.
[11] Nagarsheth MH,Viehman A,Lippa SM,et al.Notch-1 immunoexpression is increased in Alzheimer’s and Pick’s disease[J].J Neuro Sci,2006,244(1-2):111-116.
[12] Chavez-Gutierrez L,Bammens L,Benilova I,et al.The mechanism of gamma-Secretase dysfunction in familial Alzheimer disease[J].EMBO J,2012,31(10):2261-2274.
[13] Moehlmann T,Winkler E,Xia X,et al.Presenilin-1 mutations of leucine 166 equally affect the generation of the Notch and APP intracellular domains independent of their effect on Abeta 42 production[J].PNAS,2002,99(12):8025-8030.
[14] Alberi L,Chi Z,Kadam SD,et al.Neonatal stroke in mice causes long-term changes in neuronal Notch-2 expression that may contribute to prolonged injury[J].Stroke,2010,41(10):64-71.
[15] 冯小兵,李月敏,李杨.Notch信号通路与胸腺T细胞分化发育[J].肿瘤基础与临床,2015,28(1):87-90.
[16] 汪晓纯,金丽华.Notch信号途径中的Su(H)和E(spl)基因对果蝇天然免疫的影响[J].生物化学与生物物理进展,2014,41(5):456-461.
[17] 董丽,孔令蕊,王恬.Notch信号通路对免疫细胞的调节作用[J].中国生物化学与分子生物学报,2013,29(12):1106-1112.
[18] Wagner JE,Gluckman E.Umbilical cord blood transplantation:the first 20 years[J].Semin Hematol,2010,47(1):3-12.
[19] Fryer CJ,White JB,Jones KA.Mastermind recruits CycC:CDK8 to phosphorylate the Notch ICD and coordinate activation with turnover[J].Mol Cell,2004,16(4):509-520.
[20] Zakrzewski JL,Kochman AA,Lu SX,et al.Adoptive transfer of T-cell precursors enhances T-cell reconstitution after allogeneic hematopoietic stem cell transplantation[J].Nat Med,2006,12(9):1039-1047.
[21] Roderick JE,Gonzalez-Perez G,Kuksin CA,et al.Therapeutic targeting of NOTCH signaling ameliorates immune-mediated bone marrow failure of aplastic anemia[J].The J Exp Med,2013,210(7):1311-1329.
[22] Wong GT,Manfra D,Poulet FM,et al.Chronic treatment with the gamma-secretase inhibitor LY-411,575 inhibits beta-amyloid peptide production and alters lymphopoiesis and intestinal cell differentiation[J].J Biol Chem,2004,279(13):12876-12882.
[23] Ohishi K,Varnum-Finney B,Bernstein ID.Delta-1 enhances marrow and thymus repopulating ability of human CD34+CD38-cord blood cells[J].J Clin Invest,2002,110(8):1165-1174.
[24] Arboleda-Velasquez,Manent J,Lee JH.Hypomorphic Notch 3 alleles link Notch signaling to ischemic cerebral small-vessel disease[J].PNAS,2011,108(21):128-135.
[25] Pompa JL,Epstein JA.Coordinating tissue interactions:Notch signaling in cardiac development and disease[J].Dev Cell,2012,22(2):244-254.
[26] Rizzo P,Miele L,Ferrari R.The Notch pathway:a crossroad between the life and death of the endothelium[J].Eur Heart J,2013,34(32):2504-2509.
[27] Quillard T,Charreau B.Impact of notch signaling on inflammatory responses in cardiovascular disorders[J].Inter J Mol Sci,2013,14(4):6863-6888.
[28] Delbosc S,Glorian M,Le Port AS,et al.The benefit of docosahexanoic acid on the migration of vascular smooth muscle cells is partially dependent on Notch regulation of MMP-2/-9[J].Am J Pathol,2008,172(5):1430-1440.
[29] Rentschler S,Yen AH,Lu J,et al.Myocardial Notch signaling reprograms cardiomyocytes to a conduction-like phenotype[J].Circulation,2012,126(9):1058-1066.
[30] Urbanek K,Cabral-da-Silva MC,Ide-Iwata N,et al.Inhibition of notch1-dependent cardiomyogenesis leads to a dilated myopathy in the neonatal heart[J].Circ Res,2010,107(3):429-441.
[31] 李艳艳.CADASIL的MRI特征及NOTCH3基因的研究[J].中国实用神经疾病杂志,2015,18(14):72-73.
[32] Selkoe DJ,Wolfe MS.Presenilin:running with scissors in the membrane[J].Cell,2007,131(2):215-221.
10.15972/j.cnki.43-1509/r.2016.02.027
2015-11-30;
2016-02-18
国家自然科学基金(81172712);南华大学博士启动基金(2010XQD19).
*通讯作者,E-mail:dxlong99@163.com
Q7
A
蒋湘莲)
