超高效液相色谱-串联质谱法同时测定中药制剂中松香酸、11-羰基-β-乙酰乳香酸及苏丹红Ⅰ~Ⅳ的含量
2016-12-23刘成雁王志嘉任雪冬吴冬冬尤海丹
王 璐,刘成雁,王志嘉,任雪冬,吴冬冬,尤海丹,熊 爽
(辽宁省分析科学研究院 辽宁省标准化体系建设工程技术研究中心 辽宁省分析测试技术
超高效液相色谱-串联质谱法同时测定中药制剂中松香酸、11-羰基-β-乙酰乳香酸及苏丹红Ⅰ~Ⅳ的含量
王 璐,刘成雁*,王志嘉,任雪冬,吴冬冬,尤海丹,熊 爽
(辽宁省分析科学研究院 辽宁省标准化体系建设工程技术研究中心 辽宁省分析测试技术
建立了快速检测中药制剂中松香酸、11-羰基-β-乙酰乳香酸、苏丹红Ⅰ~Ⅳ的超高效液相色谱-串联质谱方法。样品以甲醇为提取溶剂,经Zorbax SB-C18色谱柱分离,以乙腈-0.1%甲酸水溶液为流动相梯度洗脱,流速为0.3 mL/min;采用电喷雾离子源(ESI),正离子多反应监测(MRM)扫描方式检测;基质匹配标准曲线法定量。结果表明,6种化合物分别在3.0~100 μg/L(苏丹红Ⅰ,Ⅱ)及30~1 000 μg/L(松香酸、11-羰基-β-乙酰乳香酸及苏丹红Ⅲ,Ⅳ)范围内线性关系良好,相关系数均大于0.99,方法检出限为0.7~8.6 μg·kg-1,定量下限为2.2~25.1 μg·kg-1。低、中、高3个加标水平下各化合物的平均回收率为76.5%~94.9%,相对标准偏差(RSD)为2.3%~9.9%。采用酸化提取液的方法解决了苏丹红Ⅲ和Ⅳ的光学异构现象带来的计算误差。通过对目标化合物碎片离子的研究以及质谱裂解规律的总结,为其定性鉴别和定量分析提供了参考。该方法操作简便、准确、快速、灵敏,适合掺假中药制剂中松香酸及苏丹红含量的检测。
超高效液相色谱-串联质谱法;松香酸;11-羰基-β-乙酰乳香酸;苏丹红Ⅰ~Ⅳ;中药制剂
乳香、没药、血竭具有调气活血、舒筋活络、消肿散结等功效,适用于各种跌打损伤[1]。乳香与没药均为树脂类药材,乳香中的主要特征成分为11-羰基-β-乙酰乳香酸,目前主要依靠进口,来源有限,价格较高。经市场调查,常有用松脂或松香掺假的乳香、没药销售[2-3]。松香的主要成分为松香酸,属萜类化合物,有小毒,中医临床多为外用,少内服。因此药品中添加松香不仅降低药效,还具有一定的安全风险。劣质血竭药材常用苏丹红染色,以改善外观,提高售价。苏丹红Ⅰ~Ⅳ原型及其代谢产物均有一定的潜在致癌作用,我国已禁止其作为色素添加剂在食品中使用。由此可见,伪劣中药严重影响患者健康甚至危及生命,必须加强中药掺假的打击力度。
近年来对松香酸和乳香酸的检测,主要有高效液相色谱法(HPLC)[4-5]、薄层色谱法(TLC)等[6-7],但其灵敏度低,选择性和特异性较差。针对苏丹红的检测方法主要有HPLC[8]、液相色谱-串联质谱法(HPLC-MS/MS)[9-14]和气相色谱-质谱法(GC-MS)[15]等,但其测定的样品多为辣椒制品、调味品、熟食、蛋禽类等食品,鲜见测定中药中非法添加苏丹红染色剂的报道[16-17],而关于同时测定中药制剂中松香酸、11-羰基-β-乙酰乳香酸及苏丹红的方法尚未见报道。
本研究首次建立了同时快速测定中药制剂中松香酸、11-羰基-β-乙酰乳香酸及苏丹红Ⅰ ~ Ⅳ的UPLC-MS/MS法。由于苏丹红为偶氮化合物,在光照条件下,苏丹红Ⅲ和Ⅳ产生两个顺反异构体,易造成测定结果不准确[18]。实验采用酸化提取液的方法解决了苏丹红光学异构现象带来的计算误差。并首次推断松香酸及11-羰基-β-乙酰乳香酸的质谱裂解方式,通过对化合物特征碎片离子的研究,为阳性样品的定性分析提供了有利参考。该法前处理简单,分析速度快,灵敏度高,重现性好,为评价中药质量,监测中药掺假问题提供了有效的质量控制手段。
1 实验部分
1.1 仪器与试剂
Agilent 1200 UPLC/6410 B MS/MS 液相色谱-串联四极杆质谱联用仪(安捷伦科技有限公司);KQ3200DB型超声清洗器(江苏昆山超声仪器有限公司);乙腈、甲醇(色谱纯,美国Fisher Scientific公司);甲酸(HPLC级,美国Tedia公司);实验用水为Milli-Q纯水系统(Millipole公司)制备的超纯水;对照品:松香酸、乳香酸、苏丹红Ⅰ~Ⅳ购自中国药品生物制品检定所。
1.2 标准溶液的配制
由表2可以看出,10种有机防晒剂均有刺激,特别是PBSA和BP3呈现强刺激性;MBC、OCR、HMS的IS值相对略低,刺激性稍微低一些;EHMC、EHDP、BEMT、BMDM的IS值较低,刺激性相对更低。有机防晒剂或多或少都会带来眼部刺激,刺激感的强弱除了与防晒剂种类有关外,还同用量有关,特别是SPF值高的防晒产品。因此产品开发人员在设计产品配方时,除了考虑SPF、PA对防晒产品的贡献外,还应充分考虑各种防晒剂的特点,尽量选取刺激性相对小,相对温和的防晒剂进行搭配使用。
标准储备液:准确称取上述标准品各5.0 mg,用甲醇溶解并定容至50 mL棕色容量瓶中,配成 1.0 mg/mL的标准储备液,于-20 ℃冰箱中保存。
标准工作曲线:实验过程中用5%的酸化甲醇稀释上述标准储备液,分别配成质量浓度为3~100 μg/L(苏丹红Ⅰ,Ⅱ),30~1 000 μg/L(松香酸、乳香酸、苏丹红Ⅲ,Ⅳ)的混合标准工作液,现用现配。
基质匹配混合标准溶液:取不含目标化合物的阴性中药样品,按“1.3”样品前处理后作为标准溶液的稀释液,配制成不同质量浓度的混合标准溶液。
1.3 样品处理
准确称取0.2 g(或0.2 mL)样品于10 mL容量瓶中,加入适量甲醇,超声处理30 min,放冷,加入0.5 mL 5%甲酸溶液及适量甲醇至刻度,摇匀,过0.20 μm微孔滤膜,上机测定。
1.4 实验条件
1.4.1 色谱条件 色谱柱:Zorbax SB-C18色谱柱(2.1 mm×150 mm,3.5 μm);流动相:A为0.1%甲酸水溶液,B为乙腈;梯度洗脱程序:0~3 min,15% A;3~4 min,15%~5% A;4~10 min,5% A;10~11 min,5%~15% A;11~12 min,15% A;流速为0.3 mL/min;柱温 30 ℃;进样量10 μL。
1.4.2 质谱条件 离子源为电喷雾(ESI)离子源,正离子电离模式;干燥气(N2)温度350 ℃,干燥气流量 9.0 L/min;雾化气(N2)压力295.4 kPa;电喷雾电压4 000 V;扫描方式为多反应监测(MRM)模式,其他质谱参数见表1。
表1 6种化合物的质谱条件参数
Table 1 UPLC-MS/MS parameters of 6 compounds

CompoundtR(min)Parention(m/z)Productions(m/z)Fragmentor(Ⅴ)Collisionenergy(Ⅴ)Abieticacid(松香酸)4730321232∗,25719010,10Boswellicacid(乳香酸)6351311731∗,407118060,50SudanⅠ(苏丹红Ⅰ)332491932∗,15628020,25SudanⅡ(苏丹红Ⅱ)5427721560∗,12118512,20SudanⅢ(苏丹红Ⅲ)7835321962∗,15619022,20SudanⅣ(苏丹红Ⅳ)1063812912∗,22428020,20
* quantitative ion

图1 6种化合物的总离子流图Fig.1 MRM chromatogram of six compounds1.Sudan Ⅰ,2.abietic acid,3.Sudan Ⅱ,4.boswellic acid,5.Sudan Ⅲ,6.Sudan Ⅳ
2 结果与讨论
2.1 液相色谱条件的优化
考察了有机相溶剂(甲醇和乙腈)与水及不同种类的挥发性缓冲液作为流动相时对待测物的分离效果和离子化程度的影响。通过比较发现,有机相为乙腈时分离效果明显优于甲醇,且能显著缩短分析时间。实验对比了乙腈-0.1%甲酸水和乙腈-5 mmol/L乙酸铵对待测物灵敏度的影响。结果显示,在ESI(+)模式下流动相中加入0.1%甲酸,可提高目标化合物的离子化效率和灵敏度,因此采用乙腈-0.1%甲酸水作为流动相进行梯度洗脱。按“1.4.1”色谱条件,6种化合物在12 min内获得较好的分离效果,结果见图1。
2.2 质谱条件的优化及裂解规律的研究
分别配制浓度为500 μg/L的标准溶液,在正负模式下选择适当的电离方式。乳香酸和松香酸在正负模式下均可带电,而苏丹红为偶氮类化合物,容易带正电荷,因此选择ESI(+)作为离子化模式。分别找出这6种化合物的[M+H]+准分子离子峰,并对干燥气体、雾化器压力、干燥气流量等参数进行优化,然后对母离子进行碰撞诱导解离,选择2个信噪比较高的特征子离子分别作为定量、定性离子对。在ESI(+)-MS/MS 条件下,松香酸主要发生羟基、羧基和开环断裂,形成碎片离子m/z285,257,149 和123,其中m/z123的丰度最高;乳香酸主要脱掉甲酸、乙酸分子及开环断裂,形成碎片离子m/z173,407。苏丹红主要是羟基、偶氮基和C—N键断裂形成子离子,由于它们属于偶氮化物,结构相似,故在偶氮基断裂时产生相同的碎片离子峰m/z156。6种化合物具体的断裂方式如图2所示。
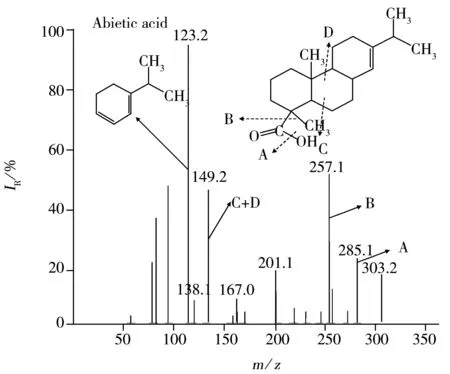


Fig.2 MS spectra and fragmentation pathways of 6 compounds
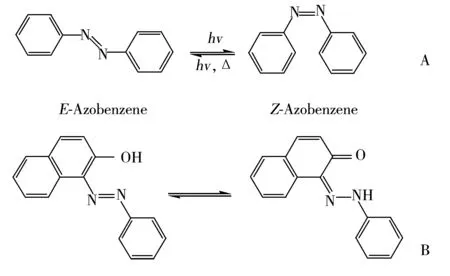
图3 偶氮化合物E-Z顺反互变异构(A)和质子互变异构(B)Fig.3 Azobenzene and its E-Z isomerization(A), azo-hydrazone prototropic tautomerism(B)
2.3 苏丹红的光学异构现象及稳定性考察
实验发现苏丹红Ⅲ、Ⅳ在不同的保留时间(3.5 min,7.8 min)、(4.7 min,10.6 min)出现双峰,而苏丹红Ⅰ、Ⅱ为单峰。这是由于苏丹红分子结构中含有氮-氮双键,在光照条件下会发生E-Z顺反互变异构现象(见图3A),使苏丹红Ⅲ、Ⅳ有两个顺反异构体,色谱分离时有双峰现象。而苏丹红Ⅰ、Ⅱ主要发生质子化互变异构(见图3B),所以只产生单个色谱峰[18-19]。由于顺反异构体的存在会对苏丹红含量测定带来10%~30%的定量误差[18]。为解决此问题,文献[19-20]提出避光放置24,12 h后进行测定,刘正才等[21]提出碱化定容液后进行测定。
本研究发现,酸性、碱性溶液均可催化E-Z构象互变转化加快,使第一峰消失,但在酸性条件下的检测灵敏度高于碱性条件,且在碱性溶液中松香酸和乳香酸的出峰完全变形。因此,最终选择在酸性条件下解决苏丹红Ⅲ、Ⅳ的光学异构现象。实验考察了不同含量的甲酸(0.5%,1%,2%,5%和10%)对异构化的影响,结果显示,随着酸度的增加,第一个色谱峰逐渐减小,第二个色谱峰不断增加,当甲酸含量超过5%时,第一个色谱峰基本消失。
进一步考察了各化合物在5%酸化甲醇溶液中的稳定性。取同一浓度的标准品混合溶液(50 μg/L),平行3份,分别放置0,0.5,1,2,4,8,10,12 h后上机测定。结果表明,放置超过8 h后,苏丹红Ⅲ和Ⅳ的第二色谱峰面积减小,逐渐出现双峰现象,而在8 h内6种化合物的稳定性良好。
2.4 体系的基质效应
基质效应(ME%)=(基质匹配标准溶液曲线的斜率/标准溶液工作曲线的斜率-1)×100%。由公式可知,ME>0,产生基质增强效应;ME<0,产生基质抑制效应;ME=0,则无基质效应。采用空白基质溶液和溶剂分别配制相同浓度的标准溶液,对6种化合物进行基质效应的评价。结果表明:6种化合物均存在不同程度的基质抑制效应(-1.5% ~-36%)。实验最终采用基质加标法定量以补偿基质效应的影响。
表2 6种化合物的基质效应评价
Table 2 Evaluation of matrix effects of 6 compounds
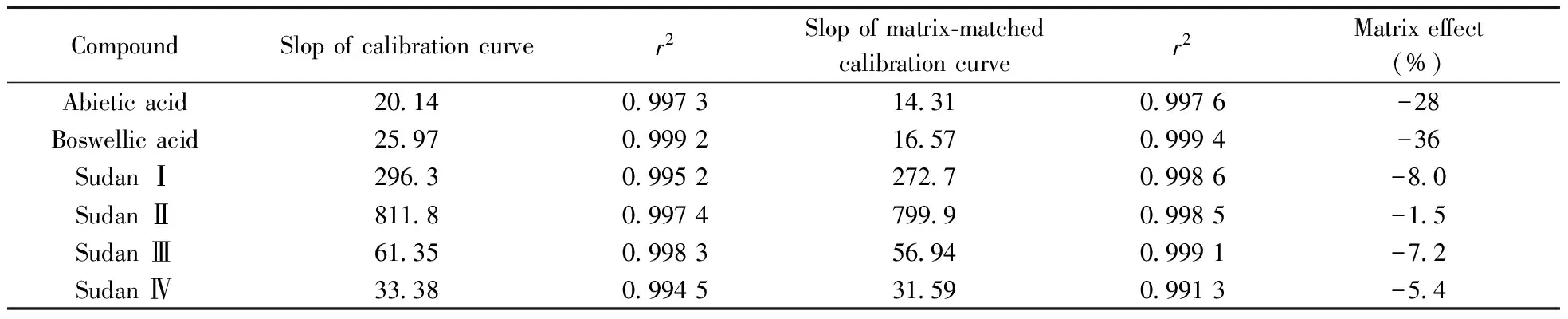
CompoundSlopofcalibrationcurver2Slopofmatrix⁃matchedcalibrationcurver2Matrixeffect(%)Abieticacid201409973143109976-28Boswellicacid259709992165709994-36SudanⅠ296309952272709986-80SudanⅡ811809974799909985-15SudanⅢ613509983569409991-72SudanⅣ333809945315909913-54
2.5 线性范围、检出限与定量下限
采用空白基质分别配制质量浓度为30~1 000 μg/L(松香酸、乳香酸、苏丹红Ⅲ,Ⅳ)及质量浓度为3.0~100 μg/L(苏丹红Ⅰ,Ⅱ)的混合标准溶液,以各组分的峰面积(Y) 对其质量浓度(X,μg/L)绘制标准曲线。结果显示,各化合物在相应的质量浓度范围内具有良好的线性关系,相关系数(r2)均大于0.99(见表2)。样品基质中分别以3倍信噪比(S/N≥3)及10倍信噪比(S/N≥10)进行计算,得到方法的检出限(LOD)为0.7~8.6 μg·kg-1,定量下限(LOQ)为2.2~25.1 μg·kg-1(见表3)。
2.6 回收率与相对标准偏差
取6份空白的中药样品进行加标回收实验,分别对其添加低、中、高3个浓度水平的标准溶液,每个水平做6个平行,结果见表3。6种化合物的平均回收率为76.5%~94.9%,相对标准偏差(RSD)均不大9.9%,方法显示了较好的准确度和精密度。
表3 空白基质中6种化合物的加标回收率、相对标准偏差、检出限及定量下限(n=6)
Table 3 Recoveries,RSDs,LODs and LOQs of 6 compounds in spiked blank sample(n=6)
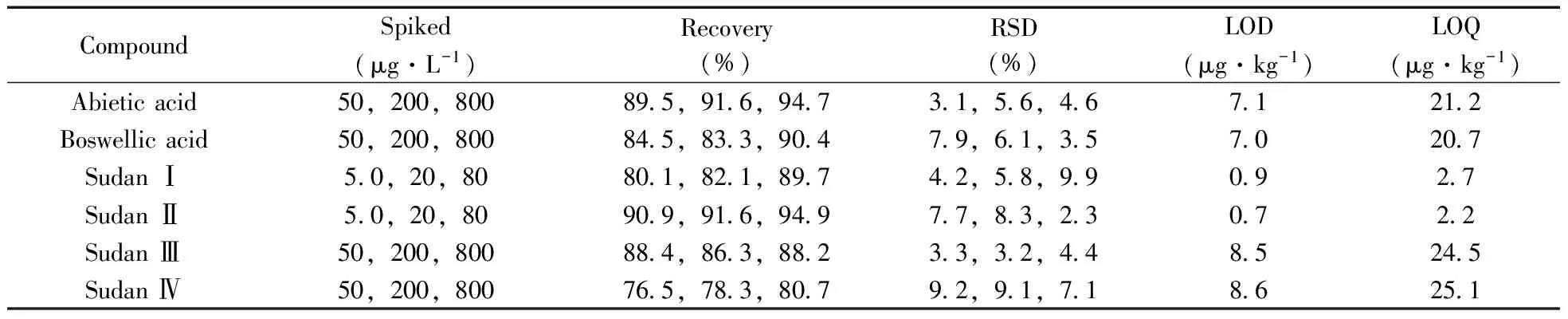
CompoundSpiked(μg·L-1)Recovery(%)RSD(%)LOD(μg·kg-1)LOQ(μg·kg-1)Abieticacid50,200,800895,916,94731,56,4671212Boswellicacid50,200,800845,833,90479,61,3570207SudanⅠ50,20,80801,821,89742,58,990927SudanⅡ50,20,80909,916,94977,83,230722SudanⅢ50,200,800884,863,88233,32,4485245SudanⅣ50,200,800765,783,80792,91,7186251
2.7 实际样品的测定
应用本方法对市售的15批根痛平胶囊、骨筋丸胶囊、活血接骨胶囊进行测定,均检出乳香酸的特征成分11-羰基-β-乙酰乳香酸,其中2批检测出松香酸,苏丹红染料未检出。结果表明,存在用松香冒充乳香投料的问题,应引起重视。
3 结 论
本文建立了检测中药制剂中松香酸、11-羰基-β-乙酰乳香酸、苏丹红Ⅰ~Ⅳ含量的超高效液相色谱-串联质谱法。方法灵敏度高、操作简便,具有很好的实际应用价值,为中药打假提供了有效手段,同时还能辅助高效液相色谱法来确证阳性样品。
[1] Lang R,Wang X P,Yang M.J.Tradit.Chin.OrthopedicsTraumatol.(朗然,王晓平,杨朦.中医正骨),2006,18(11):49-50.
[2] Xiao C,Rao W W,Zhong M C.J.Chin.Med.Mater.(肖聪,饶伟文,钟名诚.中药材),2012,35(18):1237-1241.
[3] Yu J,Cao M J,Xue X F,Chen X.AnhuiMed.Pharm.J.(余俊,曹美婧,薛霞飞,陈星.安徽医药),2014,18(7):1241-1243.
[4] Wang R Z,Zhang Y R,He Y,Dai Z,Lu J,Ma S C.Chin.Tradit.PatentMed.(王瑞忠,张玉荣,何轶,戴忠,鲁静,马双成.中成药),2014,36(11):2326-2329.
[5] Zhang Y S,Min C Y.J.NorthwestPharm.(张亚双,闵春艳.西北药学杂志),2013,28(2):133-136.
[6] Zhong M C,Rao W W,Peng F Y.ChinaPharm.(钟名诚,饶伟文,彭飞燕.中国药师),2013,16(12):1791-1794.[7] Sun L,Liu Y,Feng Y,Jin H Y.Chin.Pharm.Affairs(孙磊,刘燕,逢瑜,金红宇.中国药事),2013,27(7):722-724.
[8] Su R H,Ruan G H,Zeng L Z,Chen Z Y,Du F Y.J.Instrum.Anal.(苏日辉,阮贵华,曾令镇,陈正毅,杜甫佑.分析测试学报),2015,34(5):546-551.
[9] Pardo O,Yusà V,León N,Pastor A.Talanta,2009,78(3):178-186.
[10] Li J,Ding X M,Liu D D,Gao F,Chen Y,Zhang Y B,Liu H M.J.Chromatogr.B,2013,942:46-52.
[11] Chen N,Liu K F,Zhang Y P.J.Instrum.Anal.( 陈娜,刘坤峰,张裕平.分析测试学报),2014,33(8):956-962.[12] Yu L H,Yang Y Y,Chen J H,Li G X,Mu D H,Cai D C.J.Instrum.Anal.(喻凌寒,杨运云,陈江韩,李光宪,牟德海,蔡大川.分析测试学报),2005,24(4):28-31.
[13] Ning X J,Wang D L,Yu C H,Lu Z Y,Zhang Y Q.J.Chin.Mass.Spectrom.Soc.(宁啸骏,王丁林,虞成华,陆志芸,张燕琴.质谱学报),2009,30(1):41-46.
[14] Rebane R,Leito I,Yurchenko S,Herodes K.J.Chromatogr.A,2010,1217:2747-2757.
[15] Wu H Q,Huang X L,Huang F,Lin X S,Deng X,Cai D C.J.Instrum.Anal.(吴惠勤,黄晓兰,黄芳,林晓珊,邓欣,蔡大川.分析测试学报),2005,24(3):1-5.
[16] Yu A H.Clin.Res.(余爱红.临床研究),2002,1:249-250.
[17] Zhao J H.Tradit.Chin.Med.Res.(赵江红.中医研究),2011,24(8):17-19.
[18] Mölder K,Künnapas A,Herodes K,Leito I.J.Chromatogr.A,2007,1160:227-234.
[19] Zacharis C K,Kika F S,Tzanavaras P D,Rigas P,Kyranas E R.Talanta,2011,84:480-486.
[20] Zhu H,Huang K Y,Fu J F,Hu Y,Huang X N,Chen X H,Zou B B,Jin M C.Chin.J.Chromatogr.(朱浩,黄坤玉,付建飞,胡岳,黄娴妮,陈晓红,邹宝波,金米聪.色谱),2014,32(3):224-229.
[21] Liu Z C,Yang F,Yin T K,Qiang J.J.Instrum.Anal.(刘正才,杨方,尹太坤,钱疆.分析测试学报),2005,34(2):171-176.
Simultaneous Determination of Abietic Acid,Acetyl-11-keto-β-boswellic Acid and Sudan Ⅰ-Ⅳ in Traditional Chinese Medicine by Ultra Performance Liquid Chromatography-Tandem Mass Spectrometry
WANG Lu,LIU Cheng-yan*,WANG Zhi-jia,REN Xue-dong,WU Dong-dong,YOU Hai-dan,XIONG Shuang
(Liaoning Key Laboratory of Analysis and Testing Techniques,Liaoning Research Center of Engineering and Technology of Standardization Construction,Liaoning Academy of Analytical Science,Shenyang 110015,China)
An ultra performance liquid chromatography-tandem mass spectrometric(UPLC-MS/MS) method was established for the simultaneous determination of abietic acid,acetyl-11-keto-β-boswellic acid and Sudan Ⅰ-Ⅳ in traditional Chinese medicine.The sample was extracted with methanol,and then separated on a Zorbax SB-C18(3.5 μm,2.1 mm×150 mm) chromatographic column using a mixture of acetonitrile and 0.1% formic as mobile phase by gradient elution at a flow rate of 0.3 mL/min.The electrospray was operated in the positive mode under the multiple reaction monitoring(MRM) mode,and the quantitation was carried out by the matrix standard curve.As a result,the calibration curves for Sudan Ⅰ/Ⅱ were linear in the range of 3.0-100 μg/L,and for the others were linear in the range of 30-1 000 μg/L.The correlation coefficients for all the compounds were greater than 0.99.The limits of detection(LOD) ranged from 0.7 μg·kg-1to 8.6 μg·kg-1,and the limits of quantitation(LOQ) ranged from 2.2 μg·kg-1to 25.1 μg·kg-1.The average recoveries of six compounds at three spiked levels were in the range of 76.5%-94.9% with relative standard deviations(RSD) of 2.3%-9.9%.It was demonstrated that the first peak would not appear if the sample was kept in methanol-5% formic acid solution which could be avoided 10% errors in quantitative analysis for Sudan Ⅲ and Sudan Ⅳ.Moreover,the mass spectrometric behaviour and the ion fragmentation patterns of six compounds could provide beneficial references for the qualitative identification and quantitative analysis.This method is simple,rapid and accurate,and is suitable for the rapid determination of abietic acid,acetyl-11-keto-β-boswellic acid and Sudan Ⅰ-Ⅳ in traditional Chinese medicine.
ultra performance liquid chromatography-tandem mass spectrometry(UPLC-MS/MS);abietic acid;acetyl-11-keto-β-boswellic acid;Sudan Ⅰ-Ⅳ;traditional Chinese medicine
2015-11-03;
2015-11-10
国家自然科学基金项目(21307051);辽宁省自然科学基金项目(2013020152)
10.3969/j.issn.1004-4957.2016.05.005
O657.63;TQ460.72
A
1004-4957(2016)05-0526-06
*通讯作者:刘成雁,博士,研究员,研究方向:危险化学品的快速分析方法和应急处理,Tel:024-24823748,E-mail:chengyanliuln@163.com
