增强MRI鉴别诊断良恶性胰腺神经内分泌肿瘤的临床价值
2016-12-22刘秀香刘剑羽程钢德杰
刘秀香 刘剑羽 程钢 德杰
·论著·
增强MRI鉴别诊断良恶性胰腺神经内分泌肿瘤的临床价值
刘秀香 刘剑羽 程钢 德杰
目的 探讨MRI鉴别诊断良、恶性胰腺神经内分泌肿瘤(PNETs)的临床价值。方法 回顾性分析经病理证实的13例PNETs患者的MRI表现,包括G1~G3级肿瘤的体积、边界、信号及周围脏器受累情况,并计算MRI诊断PNETs的敏感性、特异性及准确性。结果 13例患者共计18个肿瘤,良性(G1级)12个,恶性(G2~G3级)6个。66.7%(8/12)G1级肿瘤最长径≤2cm,100%(6/6)G2~G3级肿瘤最长径>2cm;100%(12/12)G1级肿瘤边界清晰,50%(2/4)G2级肿瘤边界不清晰,100%(2/2)G3级肿瘤边界不清晰;83.3%(10/12)G1级肿瘤内部信号均匀,100%(6/6)G2~G3级肿瘤内部信号不均匀;100%(2/2)G3级肿瘤有脏器受侵、腹膜后淋巴结肿大。MRI鉴别诊断良、恶性PNETs的敏感性、特异性和准确性分别为83.3%、85.7%、84.6%。结论MRI鉴别诊断良、恶性PNETs有较高的敏感性、特异性和准确性,但鉴别诊断部分G1级和G2级肿瘤存在困难。肿瘤体积大小不能独立作为鉴别肿瘤良性和恶性的可靠指标。
胰腺; 神经内分泌肿瘤; 磁共振成像; 诊断,鉴别
胰腺神经内分泌肿瘤(pancreatic neuroendocrine tumors, PNETs)是一组异质性肿瘤,具有不同程度的恶性潜能,发病率为1/10万~4/10万,占胰腺原发性肿瘤的1%~2%[1-5],术前准确定性评价肿瘤的良恶性对指导临床治疗具有重要的价值。已有研究侧重于探讨PNETs的多层螺旋CT(multislice spiral computed tomography, MSCT)表现及不同级别神经内分泌肿瘤的MSCT特征[6-7],但鲜有利用MRI评价肿瘤良恶性的报道。本研究回顾性分析13例PNETs患者的MRI表现,以术后病理结果为金标准,评价MRI在PNETs术前定性诊断中的临床价值。
资料与方法
一、 病例资料
回顾性查询北京大学第三医院PACS系统(centricity GE)2007年7月至2012年7月间的胰腺MRI(平扫+增强)检查数据,共计635例患者有完整胰腺MR资料及手术资料。经病理证实为PNETs患者13例,其中男性6例,女性7例,年龄24~73岁,中位年龄55岁。临床症状表现为上腹痛4例,劳累或饥饿后头晕3例,体检偶然发现6例。
二、MRI检查方法
采用3.0T磁共振机(Discover 750,GE,US)和Magnetom (Trio Tim, Siemens, Germany)。MR750采用8通道表面线圈,T2WI采用快速恢复快速自旋回波序列(FRFSE)[重复时间(TR) 8 000 ms,回波时间(TE) 94 ms]和脂肪抑制自旋回波序列(TR 8 571 ms,TE 90 ms)扫描;采用LAVA-Flex T1WI做增强序列,TR 3.78 ms,TE 1.68 ms,T1WI脂肪抑制技术采用水脂分离法(LAVA-Flex, TR 3.78 ms,TE 1.68 ms),层厚6 mm,间隔1 mm,视野(FOV)360 mm×360 mm,激励次数2.0。Siemens Trio Tim采用8通道相控阵线圈,T2WI采用BLADE技术并在呼吸门控下获取脂肪抑制图像(TR 2 300 ms,TE 100 ms);采用3D VIBE T1WI做增强序列(TR 3.31 ms,TE 1.17 ms),T1WI脂肪抑制技术使用脂肪饱和法,层厚2 mm,间隔0.4 mm,FOV 350 mm×306 mm,带宽500 Hz,矩阵256×205,激励次数1.0。造影剂使用磁显葡胺(Gadolinium DTPA,Gd-DTPA北京北陆公司)0.2 ml/kg体重,注射速度2 ml/s,分别于注射开始后20、40、70 s时刻采集图像,分别获得胰腺动脉期、实质期和门脉期图像。
三、图像评价方法及分析
由2名具有丰富胰腺疾病影像诊断经验的放射科医师共同在PACS系统上分析13例患者的胰腺MRI图像,若有分歧通过协商达成一致。分析肿瘤MRI征象:(1)肿瘤最长径:在动脉期测量肿瘤最长径,分为最长径>2 cm和最长径≤2 cm两组,对多发病灶者,阅片前对肿瘤进行标记,便于核实结果;(2)肿瘤信号:在T2WI压脂序列上评价肿瘤内部信号,包括实性、囊性及囊实性;(3)肿瘤边界:包括清晰、不清晰(呈浸润性生长);(4)周围脏器和淋巴结受侵或转移:周围脏器包括胃、十二指肠、肾、脾、肝;(5)肿瘤强化方式:包括均匀明显强化、不均匀强化、环形强化和延迟强化。以正常胰腺组织信号作为对照,平扫与正常胰腺组织信号相同为等信号,依次将肿瘤信号分为低信号、等信号和高信号。
2010年WHO关于PNETs病理分级[8]:G1级相当于高分化神经内分泌瘤,良性;G2级相当于高分化神经内分泌癌,恶性;G3级相当于低分化神经内分泌癌,恶性。
MRI诊断G2和G3级PNETs的依据包括肿瘤边界不清、浸润生长、周围脏器受侵或邻近脏器转移、淋巴结肿大;G1级PNETs的诊断依据包括肿瘤边界清晰、信号均匀、均匀明显强化、无周围脏器转移及无淋巴结肿大。
四、统计学处理
以病理结果为金标准,计算MRI定性评价PNETs的敏感性、特异性、准确性。
结 果
一、PNETs的病理分析
13例PNETs患者共计18个肿瘤,其中1例患者有2个肿瘤,1例患者有5个肿瘤,其余均为1个肿瘤;肿瘤位于钩突部7个、头部4个、体部1个、尾部3个和体尾部3个。18个肿瘤中,高分化神经内分泌瘤(G1级)12个,高分化神经内分泌癌(G2级)4个,低分化神经内分泌癌(G3级)2个。1例为Von Hippel-Lindau综合征,有2个病灶,均为高分化神经内分泌瘤G1级。
二、MRI评价PNETs情况
13例患者行MRI增强检查,共检出18个肿瘤,其中良性肿瘤12个,恶性肿瘤6个(表1)。在MRI图像上,G1级(图1)肿瘤边界均清晰,83.3%(10/12)内部信号均匀,66.7%(8/12)肿瘤最长径≤2 cm;G2级(图2)肿瘤内部信号不均匀,可见片状低信影,增强后低信号区未见强化,实性部分呈明显强化,当肿瘤体积较大时,肿瘤边界不清晰,呈浸润性生长;G3级(图3)肿瘤边界均不清晰,呈浸润性生长,内部信号不均,可见囊变、坏死区,邻近脏器受侵,肝门区淋巴结肿大。100%(6/6)的G2~G3级肿瘤最长径>2 cm(表1)。MRI增强序列正确定性诊断11例PNETs,其中5例神经内分泌癌(G2~G3级),6例高分化神经内分泌瘤(G1级)。MRI增强序列定性诊断PNETs的敏感性为83.3%,特异性85.7%,准确性84.6%。

表1 MRI增强序列显示的肿瘤
注:a同一患者;b同一患者
讨 论
神经内分泌肿瘤在组织学上分为G1~G3级别,其中G1级相当于新版分类系统中的高分化神经内分泌瘤或旧版分类系统中的神经内分泌瘤,表现为良性生物学行为;G2及G3级分别相当于新版分类系统中的高分化神经内分泌癌、低分化神经内分泌癌或旧版分类系统中的神经内分泌癌、混合型腺神经内分泌癌,表现为恶性生物学行为[8-11]。良性PNETs常局限在胰腺内生长,无血管壁的侵犯,最长径常<2 cm,有丝分裂≤2,Ki-67阳性指数/10高倍镜视野≤2%;恶性PNETs分为低级别恶性和高度恶性两种。低级别恶性的肿瘤细胞呈中-高度分化,伴有局部脉管或神经等显著浸润,肿瘤最长径常>2 cm,细胞核中度异型性,核分裂象和肿瘤细胞增殖指数增加;高度恶性神经内分泌肿瘤亦称小细胞癌,肿瘤可以任意大,细胞呈实性团巢样结构伴细胞巢中心坏死,细胞核明显异型性,核分裂象明显增加,脉管浸润显著,常伴肝脏或腹腔外转移[10,12-13]。
PNETs的体积大小与生物学行为具有一定相关性[10,13-15],良性肿瘤长径通常≤2 cm,而恶性肿瘤长径常>2 cm。Rha等[11]、Oberg等[12]及郑杰[10]报道,肿瘤长径<2 cm时,接近100%为良性;长径在2~3 cm时,90%可能为良性;高度恶性肿瘤直径可以任意大。本研究中66.7%的G1级肿瘤最长径≤2 cm,G2~G3级肿瘤最长径均>2 cm,和上述研究结论基本一致。
良性PNETs边界清晰、信号通常均匀,而恶性PNETs的边界通常不清,浸润性生长,侵犯邻近组织,内部密度或信号不均,常见囊变坏死和散在结节状、壳样钙化[16-17],囊变坏死和出血表明肿瘤具有恶性潜能或生物学行为未定[17-18],但也有研究认为囊变表明肿瘤生存时间较长,一般超过10年,提示肿瘤为良性或无功能性[19]。本研究中有8(8/18)个肿瘤发生囊变坏死,6个肿瘤为G2~G3级,可见恶性肿瘤囊变坏死概率大。钙化对判定肿瘤生物学
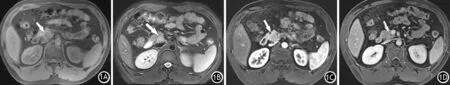
图1 男性,24岁,间断头晕1年。T1压脂序列(1A)和T2压脂序列(1B)可见肿瘤(↑)呈长T1稍长T2信号,内部信号均匀,增强扫描动脉期(1C)肿瘤呈轻度强化,门脉期(1D)肿瘤强化程度和正常胰腺组织相同。病理证实为高分化内分泌瘤G1级

图2 女性,61岁,间断上腹痛10年,加重1个月。T1压脂序列(2A)和T2压脂序列(2B)肿瘤(↑)呈稍长T1稍长T2信号,T2压脂序列(2B)可见肿瘤内部更低信号,增强动脉期(2C)肿瘤呈明显环形强化,门脉期(2D)呈延迟强化。病理证实为高分化内分泌癌G2级

图3 男性,45岁,腹痛3 d。平扫T2压脂序列(3A)肿瘤呈稍长T2信号(↑),肝脏可见转移灶,呈长T2信号,增强动脉期肿瘤不均匀强化,胆总管与肿瘤分界不清,胆总管受侵(3B↑),胆囊受侵(3C),十二指肠受侵(3C↑),肝门区淋巴结转移(3D↑)。病理证实为低分化内分泌癌G3级
行为亦有重要价值,Rha等[11]报道,20%的神经内分泌肿瘤有钙化,并且钙化更多见于恶性神经内分泌肿瘤。本研究中1例肿瘤CT检查显示有不规则结节状钙化,但MRI图像上钙化结节显示欠佳(未提供该图片),可见MRI检查存在局限性。G3级肿瘤边界均不清晰,信号不均,然而G2级肿瘤边界可以清晰,G1级部分肿瘤内部信号也可不均匀,G1级和G2级肿瘤部分影像表现类似,如果没有浸润生长和转移灶,MRI增强序列对鉴别G1级和G2级肿瘤存在困难。
本研究增强MRI定性诊断PNETs的敏感性、特异性、准确性分别为83.3%、85.7%和84.6%。Fletcher等[18]和Birchard等[19]曾分别报道为87%和85.1%。MRI软组织分辨率高,呈现肿瘤信息更多、更丰富、更准确,定性评价肿瘤的准确性较高,为临床提供更多有价值的信息。本研究中1例G1级肿瘤,最长径1.3 cm,在CT上未发现病灶,然而在MRI上能清晰显示该病灶(未提供该图片)。另有1例肿瘤体积较大,最长径3.8 cm,位于胰腺尾部,信号不均匀,MRI误诊断为恶性神经内分泌肿瘤,分析原因可能与2位医师仅仅考虑到肿瘤体积较大,忽略了恶性肿瘤其他特征。因此仅依据体积大小不能准确定性肿瘤,体积仅仅代表肿瘤发展过程中的一个特定时间点的表现,不能改变多数肿瘤的生物学行为本质[11]。此外还有1例MRI误诊为良性肿瘤,病理证实为G2级,肿瘤最长径2.6 cm,边界清晰,信号不均匀,无转移及淋巴结肿大,分析原因可能与肿瘤细胞分化程度较好、细胞核异型性小有关,因此在信号、强化方式上和G1级肿瘤类似。
总之,MRI鉴别诊断PNETs具有较高的敏感性、特异性和准确性,对临床怀疑PNETs而CT结果呈假阴性时,MRI检查可以作为补充,提高病变检出率;在定性评价肿瘤上,体积不能作为独立参考因素;MRI鉴别诊断部分G1级和G2级肿瘤存在困难。本研究患者例数较少,尤其是G2级和G3级肿瘤,因此需收集更多该级别病例,进一步分析总结PNETs良恶性的影像征象。
[1] Hruban RH, Pitman MB, Klimstra DS. Tumors of the pancreas[M]∥Silverberg SG, Sobin LH, eds. AFIP atlas of tumor pathology. 4th ed. Washington, DC: American Registry of Pathology, 2007.
[2] Ehehalt F, Saeger HD, Schmdt CM, et al. Neuroendocrine tumors of the pancreas[J]. Oncologist, 2009,14(5):456-467.DOI:10.1634/theoncologist.2008-0259.
[3] 中华医学会外科学分会胰腺外科学组.胰腺神经内分泌肿瘤治疗指南(2014版)[J].中华消化外科杂志,2014,13(12):919-922.DOI:10.3760/cma.j.issn.1673-9752.2014.12.001.
[4] 吴峻立,苗毅.胰腺神经内分泌肿瘤的手术治疗[J].中华消化外科杂志,2014,13(10):763-767.DOI:10.3760/cma.j.issn.1673-9752.2014.10.004.
[5] 楼文晖.胰腺神经内分泌肿瘤初治治疗策略[J].中华消化外科杂志,2014,13(10):760-762.DOI:10.3760/cma.j.issn.1673-9752.2014.10.003.
[6] 章婷婷,余永强,钱银锋,等.胰腺神经内分泌肿瘤MSCT表现及良恶性鉴别[J].临床放射学杂志,2014,33(5):722-726.DOI:10.13437/j.cnki.jcr.2014.05.020.
[7] 史玉振,王中秋,卢光明,等.胰腺神经内分泌肿瘤的影像学表现与临床病理对照分析[J].临床放射学杂志,2011,30(11):1618-1623.DOI:10.13437/j.cnki.jcr.2011.11.046.
[8] Solicia E, Kloeppel G, Sobin LH. World health organization: International histological classification of tumours[M]. Berlin: Springer, 2000.
[9] 李增山,李青. 2010年版消化系统肿瘤WHO分类解读[J].中华病理学杂志, 2011,5(40):351-354.DOI:10.3760/cma.j.issn.0529-5807.2011.05.019.
[10] 郑杰. 规范胃肠道和胰腺神经内分泌肿瘤的病理诊断[J].中华病理学杂志, 2010, 39(12):793-795.DOI:10.3760/cma.j.issn.0529-5807.2010.12.001.
[11] Rha SE, Jung SE, Lee KH, et al. CT and MR imaging findings of endocrine tumor of the pancreas according to WHO classification[J]. Eur J Radiol, 2007, 62(3):371-377.DOI:10.1016/j.ejrad.2007.02.036.
[12] Oberg K, Eriksson B. Endocrine tumors of the pancreas[J]. Best Pract Res Clin Gastroenterol, 2005, 19(5):753-81. DOI:10.1016/j.bpg.2005.06.002.
[13] Noone TC, Hosey J,Firat Z, et al. Imaging and localization of islet-cell tumors of the pancreas on CT and MRI[J]. Best Pract Res Clin Endocrinol Mrtab, 2005, 19(2):195-211. DOI:10.1016/j.bpg.2005.06.002.
[14] Power N, Resnek RH. Imaging pancreatic islet cell tumours[J]. Imaging, 2002, 14(2):147-159. DOI: 10.1259/img.14.2.140147.
[15] Lewis RB, Lattin GE Jr, Paal E. Pancreatic endocrine tumors: radiologic-clinicopathologic correlation[J]. Radiographics, 2010, 30(6):1445-1464. DOI: 10.1148/rg.306105523.
[16] Rockall AG, Reznek RH. Imaging of neuroendocrine tumours (CT/MR/US) [J]. Best Pract Res Clin Endocrinol Metab, 2007, 21(1):43-68.DOI:10.1016/j.beem.2007.01.003.
[17] Ahrendt SA, Komorowski RA, Demeure MJ, et al. Cystic pancreatic neuroendocrine tumors: is preoperative diagnosis possible[J]? J Gastrointest Surg, 2002, 6(1): 66-74. DOI:10.1016/S1091-255X(01)00020-8.
[18] Fletcher JG, Wiersema MJ, Farrell MA, et al. Pancreatic malignancy: value of arterial, pancreatic, and hepatic phase imaging with multi-detector row CT[J]. Radiology, 2003, 229(1):81-90. DOI: 10.1148/radiol.2291020582.
[19] Birchard KR, Semelka RC, Hyslop WB, et al. Suspected pancreatic cancer: evaluation by dynamic gadolinium-enhanced 3D gradient-echo MRI[J]. AJR Am J Roentgenol, 2005, 185(3):700-703. DOI: 10.2214/ajr.185.3.01850700.
(本文编辑:屠振兴)
Clinical significance of enhanced MRI in differentiating benign and malignant pancreatic neuroendocrine tumors
LiuXiuxiang,LiuJianyu,ChengGang,DeJie.
DepartmentofRadiology,BeijingGeriatricHospital,Beijing100095,China
LiuJianyu,Email:juliu5791@sina.com
Objective To determine the clinical value of contrast enhanced MRI in differentiating benign and malignant pancreatic endocrine tumors (PNETs). Methods MRI findings on 13 cases who were pathologically diagnosed as PNETs were retrospectively analyzed, including the tumor volume, border, MRI signal and adjacent organ involvement of Grade 1~3 tumors, and the sensitivity, specificity and accuracy of MRI for diagnosing PNETs were calculated. Results A total of 18 tumors were detected, including 12 benign (Grade 1) and 6 malignant (Grade 2~3) tumors. Eight Grade 1 tumors′(66.7%) maximal diameters were ≤2 cm, while 100%(6/6) Grade 2~3 tumors′ maximal diameters were ≥2 cm. All of Grade 1 tumors (100%) had clear boundary, while 50%(2/4) Grade 2 and 100%(2/2) Grade 3 tumors had unclear boundary. Ten Grade 1 tumors (83.3%) had intratumoral homogeneous signal, while 100%(6/6) Grade 2~3 tumors had heterogeneous intratumoral signal. Two Grade 3 tumors (100%) had organ infiltration and retroperitoneal lymph node metastasis. The sensitivity, specificity and accuracy of MRI for differentiating benign and malignant PNETs were 83.3%, 85.7% and 84.6%, respectively. Conclusions MRI had higher sensitivity, specificity and accuracy in differentiating benign and malignant PNETs, but it was still difficult to differentiate Grade 1 from Grade 2 tumors by MRI. Tumors size could not be considered to be a reliable indicator for differentiating benign and malignant PNETs.
Pancreas; Neuroendocrine tumor; Magnetic resonance imaging; Diagnosis, differential
10.3760/cma.j.issn.1674-1935.2016.06.005
100095 北京,北京老年医院放射科(刘秀香、程钢、德杰);北京大学第三医院放射科(刘剑羽)
刘剑羽,Email: jyliu5791@sina.com
2016-06-16)
