DcR3在胰腺癌组织中的表达及其临床意义
2016-12-22张文熠林伟余乐杰
张文熠 林伟 余乐杰
DcR3在胰腺癌组织中的表达及其临床意义
张文熠 林伟 余乐杰
诱捕受体(decoy receptor,DcR)是新近发现的肿瘤坏死因子受体(tumour necrosis factor receptor,TNFR)超家族成员。已有研究表明,DcR3基因能够通过多种途径阻断T细胞、自然杀伤细胞(natural killer cell,NK)诱导肿瘤细胞凋亡,从而促进恶性肿瘤的免疫逃逸,在肺癌、乳腺癌、肝癌、胃癌等多种恶性肿瘤的发生与发展中扮演重要角色[1]。DcR家族有DcR1、DcR2、DcR3三个成员,目前关于胰腺癌涉及DcR的研究主要集中在DcR1、DcR2,而对DcR3的研究相对较少[2]。随着DcR3单克隆抗体技术以及小干扰RNA(small interfering RNA,siRNA)技术的发展,DcR3在恶性肿瘤的基因诊断及靶向治疗方面的应用价值越来越大[3]。本研究检测胰腺癌组织DCR的表达,探讨其对胰腺癌诊断、治疗及预后判断的意义。
一、资料与方法
1.研究对象:选取温州医科大学附属第一医院病理科2010年至2012年收集的资料完整的40例胰腺癌组织、20例匹配的胰腺癌旁组织、20例正常胰腺组织。癌旁组织是指距离病灶<3 cm的胰腺组织,正常胰腺组织来源于本院外科手术的患者,均经病理学检查证实为正常胰腺组织。术前接受过放化疗治疗的患者、临床随访资料不完整的患者以及标本未经病理学证实的患者均排除在外。出院后每3个月复查1次全腹部及胸部CT,检测肿瘤标志物,随访3年。
2.免疫组化检查:采用链霉亲和素-过氧化物酶法检测胰腺组织DcR3蛋白表达。DcR3单克隆抗体购自ABCAM公司,工作浓度1∶50;免疫组化SP法试剂盒购自北京赛驰生物科技公司,按说明书操作。以PBS替代一抗作为阴性对照。由病理科医师盲法读片。胞质内出现黄色、棕黄色、褐色颗粒为阳性表达,并根据着色强度及阳性细胞数评分:无色为0分,黄色为1分,棕黄色为2分,褐色为3分;阳性细胞数占总细胞数<5%为0分、5%~<25%为1分、25%~<50%为2分、50%~<75%为3分、>75%为4分。两分相乘>4分为阳性。

二、结果
1.临床资料:胰腺癌组织40例,其中男性22例、女性18例,年龄39~72岁,平均(58±10)岁;根据WHO2000年制定的肿瘤分期标准,高分化8例、中分化9例、低分化23例;依据AJCCTNM分期标准,Ⅰ期4例、Ⅱ期10例、Ⅲ期26例。癌旁组织20例,其中男性11例、女性9例,年龄42~70岁,平均(56±10)岁。正常胰腺组织20例,其中男性10例、女性10例,年龄44~68岁,平均(58±9)岁。3组间差异无统计学意义(P>0.05)。
2.胰腺组织DcR3蛋白表达:胰腺癌、癌旁组织、正常胰腺组织DcR3蛋白阳性表达率分别为77.5%(31/40)、35.0%(7/20)、5.0%(1/20),胰腺癌组织显著高于癌旁组织及正常胰腺组织,差异有统计学意义(χ2=32.400,P<0.001,图1)。
3.胰腺癌组织DcR3蛋白表达与肿瘤临床病理参数的相关性:胰腺癌组织DcR3蛋白表达与肿瘤TNM分期、分化程度及淋巴结转移均有显著的相关性(P值均<0.05,表1)。
4.胰腺癌组织DcR3蛋白表达与患者预后的关系:40例胰腺癌患者随访9~34个月,失访3例,随访率92.5%。到截止日期仅1例DcR3蛋白阴性表达患者存活。DcR3蛋白阴性表达的胰腺癌患者中位生存时间为24.8个月,显著高于DcR3蛋白阳性表达胰腺癌患者的17.8个月(图2),差异有统计学意义(χ2=4.889,P=0.029)。
讨论 目前的研究表明,肿瘤的发生是由于细胞增殖与凋亡的平衡过程受到破坏所致。DcR3是重要的凋亡抑制蛋白之一,由300个氨基酸组成,因缺乏跨膜结构,属于分泌性蛋白,能够在血清中检出。DcR3与TNFR具有高度同源性,能够通过与Fas等介导细胞凋亡的蛋白分子配体相结合,阻断后者介导的细胞凋亡过程[4];另外,DcR3还参与T细胞的免疫凋节,导致机体免疫功能紊乱,促进肿瘤细胞的免疫逃逸[6]。已有研究表明,DcR3过表达与多种恶性肿瘤的发生密切相关。苏传丽[7]检测肝癌、肝硬化、急性感染患者的DcR3水平,证实肝癌患者DcR3阳性率明显高于其他良性肝病患者,能够鉴别肿瘤与炎症性疾病。周健等[8]报道,与良性肿瘤患者及健康人群比较,胰腺癌患者血清DcR3水平显著升高,而肿瘤切除后血清DcR3水平明显下降。本研究结果也显示,胰腺癌组织DcR3蛋白阳性表达率显著高于癌旁胰腺组织及正常胰腺组织。DcR3在胰腺癌发病中的机制可能为:(1)DcR3能够与Fas竞争结合Fas配体(FasL),形成性质稳定的DcR3-Fc-FasL复合物,从而抑制FasL有效发挥介导细胞凋亡的作用[9]。(2)DcR3能够与单纯疱疹病毒侵入介质(herpesvirusentrymediator,HVEM)的受体(LIGHT)相结合,阻断LIGHT与淋巴毒素β受体及单纯疱疹病毒侵入介质相结合介导的细胞凋亡机制[10]。(3)DcR3基因表达能够影响LIGHT与肿瘤坏死因子样配体1A(TL1A)介导的T细胞激活机制[11],使CD80等多种T淋巴细胞协同刺激信号分子的水平明显降低,从而降低机体的细胞免疫功能。(4)DcR3能够上调IL-4的表达,从而抑制CD4+T淋巴细胞活性,导致Th1/Th2的失衡[12]。
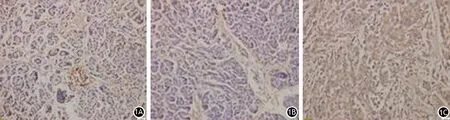
图1 癌旁组织(1A)、正常胰腺组织(1B)、胰腺癌组织(1C)DcR3蛋白表达(SP ×20)
表1 胰腺癌组织DcR3蛋白表达与肿瘤临床病理参数的相关性

临床病理参数阳性例数(%)阴性例数(%)χ2值P值年龄(岁)0.0180.893 ≥5518(58.1)5(55.6) <5513(41.9)4(44.4)性别0.5230.47 男18(58.1)4(44.4) 女13(41.9)5(55.6)肿瘤直径(cm)0.0430.845 ≥416(51.6)5(55.6) <415(48.4)4(44.4)TNM分期5.1190.024 Ⅰ+Ⅱ8(25.8)6(66.7) Ⅲ23(74.2)3(33.3)分化程度5.9140.015 高+中10(32.3)7(77.8) 低21(67.7)2(22.2)淋巴结转移4.2690.039 是12(38.7)7(77.8) 否19(61.3)2(22.2)

图2 生存函数图
Dias-Santos等[13]研究报道,胰腺癌DcR3表达与肿瘤组织分化程度显著呈负相关,与淋巴结转移呈正相关。本研究结果显示,DcR3阳性表达与胰腺癌TNM分期、分化程度及淋巴结转移、生存时间等密切相关,这现象可能与DcR3与TL1A能够促进血管新生所致[14]。已有研究表明,DcR3基因表达能够影响肝癌患者的肿瘤血管密度[15],推测除了抑制肿瘤细胞凋亡,DcR3可能还通过影响肿瘤组织的血供和营养状态,从而影响肿瘤组织的生长和侵袭能力。但其具体机制还有待以后进一步研究。
[1] 谢优,史振鸿,熊货杰,等.微小RNA-152靶向DcR3对HepG2细胞相关信号通路的作用[J].实用医技杂志,2015,22(9):915-918.
[2] 杨健,张旭,张立峰,等.DcR3、CA19-9联合检测在胰腺癌诊断中的临床价值[J].世界华人消化杂志,2015,23(22):3629-3633.
[3] 刘祖宏,倪仰鹏,黄绮国,等.结肠癌中DcR3和livin表达与预后的关系[J].广东医学,2013,34(7):1055-1057.DOI:10.3969/j.issn.1001-9448.2013.07.026.
[4]WangW,ZhangM,SunW,etal.Reductionofdecoyreceptor3enhancesTRAIL-mediatedapoptosisinpancreaticcancer[J].PLosOne,2013,8(10):e74272.DOI: 10.1371/journal.pone.0074272.
[5]FukudaK,MiuraY,MaedaT,etal.Decoyreceptor3regulatestheexpressionofvariousgenesinrheumatoidarthritissynovialfibroblasts[J].IntJMolMed,2013,32(4):910-916.DOI: 10.3892/ijmm.2013.1461.
[6] 肖波. 主胰管绕道征——胰腺神经内分泌肿瘤的一个重要MRI征象[J]. 磁共振成像, 2015, 6(3): 194-198.
[7] 苏传丽.小干扰RNA靶向抑制DcR3基因对肝癌细胞凋亡和迁移的影响[J].世界华人消化杂志,2013,21(27): 2772-2779.
[8] 周健,宋世铎,朱东明,等.诱骗受体3在胰腺癌组织中的表达及意义[J].肿瘤防治研究,2013,40(12):1143-1146.DOI:10.3971/j.issn.1000-8578.2013.12.008.
[9] 苗兰英,刘满华,李舒.胃癌组织中Survivin和DcR3基因的表达及临床意义[J].中国老年学杂志,2013,33(17):4126-4128.DOI:10.3969/j.issn.1005-9202.2013.17.011.
[10] 黄黎月,庄国洪,丘劲华,等.DcR3重组蛋白对糖尿病大鼠心肌组织凋亡相关分子的表达及细胞凋亡的作用[J].中国免疫学杂志,2015,31(4):472-476.DOI:10.3969/j.issn.1000-484X.2015.04.008.
[11] 赵志强.胰腺癌根治术胰肠吻合方式研究[J].现代仪器与医疗,2014,20(1):13-16.DOI:10.11876/mimt201401004.
[12]WaddellN,PajicM,PatchAM,etal.Wholegenomesredefinethemutationallandscapeofpancreaticcancer[J].Nature, 2015, 518(7540): 495-501.DOI: 10.1038/nature14169.
[13]Dias-SantosD,FerroneCR,LillemoeKD,etal. 332.TheCharlson-agecomorbidityindex(CACI)predictsearlymortalityfollowingsurgeryforpancreaticcancer[J].EurJSurgOncol, 2014, 40(11):S130-S131.
[14]SonJ,LyssiotisCA,YingH,etal.GlutaminesupportspancreaticcancergrowththroughaKRAS-regulatedmetabolicpathway[J].Nature, 2013, 496(7443): 101-105.DOI: 10.1038/nature12040.
[15]OettleH,NeuhausP,HochhausA,etal.Adjuvantchemotherapywithgemcitabineandlong-termoutcomesamongpatientswithresectedpancreaticcancer:theCONKO-001randomizedtrial[J].Jama, 2013, 310(14): 1473-1481.DOI: 10.1001/jama.2013.279201.
(本文编辑:屠振兴)
10.3760/cma.j.issn.1674-1935.2016.06.013
325000 浙江温州,温州医科大学附属第一医院放化疗科(张文熠、林伟),胃肠外科(余乐杰)
张文熠,Email: zesir_mark@163.com
2016-03-14)
