黄鳝载脂蛋白A1的基因结构及表达谱分析
2016-12-20阚延泽孙文秀
阚延泽,江 翱,孙文秀,李 伟
( 长江大学 湿地生态与农业利用教育部工程研究中心,湖北 荆州 434025 )
黄鳝载脂蛋白A1的基因结构及表达谱分析
阚延泽,江 翱,孙文秀,李 伟
( 长江大学 湿地生态与农业利用教育部工程研究中心,湖北 荆州 434025 )
根据克隆的黄鳝载脂蛋白A1基因的部分序列,进行5′RACE扩增和内含子的克隆并采用荧光定量PCR分析该基因的表达谱。结果表明,该基因cDNA全长1207 bp,5′UTR区域长32 bp,编码1个262 aa的多肽;在长1391 bp的gDNA上,只发现了1个长184 bp的内含子。荧光定量PCR对该基因在不同组织和病原细菌嗜水气单胞菌感染后的表达情况分析表明,该基因转录本在肝脏中表达量最高,在胃、肾脏、小肠、脑、皮肤和血液中表达量中等,而在心脏、脾脏和肌肉中表达量很低;病原细菌感染会显著影响该基因在小肠、肝脏和脾脏中的表达水平。以上结果显示黄鳝的载脂蛋白Apo-A1基因可能参与了鱼体的天然免疫反应。
黄鳝; 载脂蛋白; 基因结构; 表达
载脂蛋白Apo-A1 是血浆高密度脂蛋白的主要成分,在机体逆向胆固醇运输和脂质代谢中具有重要作用[1]。人的载脂蛋白Apo-A1由肝脏和小肠合成,它不仅可以作为重要辅助因子激活卵磷脂胆固醇酰基转移酶的活性参与胆固醇的酯化反应,而且还可以促进细胞内胆固醇的清除,从而降低动脉粥样硬化发病的危险[2]。除此以外,载脂蛋白Apo-A1也是一个非常重要的天然免疫分子,它为许多免疫复合物的组装提供了平台[3];并且具有抗病毒、抗细菌内毒素等多样化的功能[4]。其在免疫系统中的作用吸引了鱼类分子育种学家的重视。目前已有相当数量的鱼类载脂蛋白Apo-A1基因被克隆,其中包括大西洋鲑(Salmosalar)[5]、虹鳟(Oncorhynchusmykiss)[6]、斑马鱼(Daniorerio)[7]、金头鲷(Sparusaurata)[8]、鳗鲡(Anguillajaponica)[9]、草鱼(Ctenopharyngodonidells)[10]、赤点石斑鱼(Epinephelusakaara)[11]、斜带石斑鱼(E.coioides)12]、美洲条纹狼鲈(Moronesaxatilis)[13]、朝鲜(Hemibarbusmylodon)[14]和香鱼(Plecoglossusaltivelis)[15]等。同哺乳动物相类似,重组的鱼类载脂蛋白Apo-A1蛋白具有明显的体外抗细菌活性,且其基因表达水平往往受到外源病原的调节作用,说明它们可能参与了鱼类的天然免疫反应[6,11-12]。相关资料显示,鱼类载脂蛋白Apo-A1基因的研究注重其在免疫系统中的作用,却对其在脂质代谢过程中的功能关注较少[11]。邱庆崇等[16]通过同源克隆的方法克隆了黄鳝(Monopterusalbus)载脂蛋白Apo-A1基因的cDNA片段,指出该基因可能是黄鳝脂质代谢的一个重要生化指标。但对于该基因的结构及其在免疫反应中的应答未进行深入研究。笔者立足于该cDNA片段基础上,通过进行5′- RACE扩增获得其5′-UTR序列,并克隆其内含子结构;采用荧光定量PCR技术对不同组织和病原细菌感染后该基因的表达谱进行分析。这将为进一步明确黄鳝载脂蛋白Apo-A1基因在鱼体天然免疫系统中的作用提供参考资料。
1 材料与方法
1.1 试验用鱼及病原菌感染
体质量约60~70 g的黄鳝100尾,购于荆州太湖市场。先于室温条件下水箱中暂养7 d后,提取总RNA 并进行病原菌感染试验。取适量心脏、肝脏、脾脏、胃、肾脏、血细胞、皮肤、肠、肌肉和脑组织,在液氮中速冻后-80 ℃保存备用。细菌感染试验按文献[17]的方法进行。挑取病原细菌嗜水气单胞菌(Aeromonashydrohilia)单克隆在液体LB 培养基中 28 ℃培养到对数生长期后,离心收集,用灭菌生理盐水(0.9%)将菌液稀释约至2.2×107cfu/mL。随机取50 尾黄鳝用间氨基苯甲酸乙酯甲磺酸盐处理麻醉后进行腹腔注射。每尾鱼注射20 μL细菌。对照鱼注射生理盐水。分别在感染后3、6、12、24、48、72 h 随机选3尾个体,取其小肠、肝脏和脾脏3 种组织液氮速冻后用于总RNA的提取。
1.2 引物设计、cDNA合成 和5′-RACE扩增
根据黄鳝载脂蛋白Apo-A1的基因片段,设计基因特异性引物Apo-5GSP(5′-GTATGAGGATCAGCTTGCAGGGGAGC-3′)用于5′-RACE的扩增。肝脏总RNA 提取按照Trizol 试剂说明书进行。cDNA 合成按照PrimeScript RT regent 试剂盒说明书进行。
5′-RACE按照Smart RACE cDNA 扩增试剂盒说明书进行。Touchdown 扩增反应程序:94 ℃预变性3 min;94 ℃变性1 min,70 ℃退火45 s,72 ℃延伸2 min,5 个循环;94 ℃预变性1 min,65 ℃退火50 s,72 ℃延伸1 min,30 个循环;延伸10 min。PCR 产物回收、纯化后,连接至pEASY-T1 载体,克隆至T1感受态细胞,挑取阳性克隆进行序列测定。
1.3 DNA的提取及内含子的克隆
根据上述1.2获得的cDNA全长,设计一对基因特异性引物Apo-F (5′-ATGGCTCCCCTGCAAGCTGATC-3′) 和Apo-R(5′-TCAGTTTGGGGTGAAGGTAG-3′) 用于基因组DNA上该基因包含全部ORF区域的扩增,以便获得其所有内含子序列。DNA提取按照天根公司DNA提取试剂盒说明书进行。
1.4 黄鳝载脂蛋白Apo-A1基因的表达谱分析
采用荧光定量 PCR 技术,检测载脂蛋白Apo-A1基因组织表达特异性和病原菌感染对该基因表达的影响。以不添加模板的反应作为空白对照,以β-actin 的表达作为内参。设计了引物rt-F (5′-CTGAGCGTGTGGAGCAACTG-3′)和rt-R (5′-TCTGCTACCTTCACCCCA-3′) 用于该基因的表达分析。荧光定量PCR 在Bio-Rad 公司CFX96系统上进行。20 μL 反应体系中包含1 μL 模板,10 μL SYBR Premix ExTaq,0.4 μL 引物,7.8 μL ddH2O。反应程序:95 ℃ 预变性30 s;95 ℃变性30 s,54 ℃退火25 s,72 ℃ 延伸1 min,40 个循环。
每个处理重复3次,数据处理采用SPSS 20.0软件包中的单因素方差分析进行,基因表达值用平均值±标准差表示,并进行多重比较检验。当P<0.05为差异显著,当P<0.01时差异极显著。
2 结果与分析
2.1 黄鳝载脂蛋白Apo-A1的序列分析
用Apo-5GSP引物进行的5′RACE扩增获得了长度为112 bp的片段,将该片段和已知基因片段进行重叠后得到了长度为1207 bp的cDNA。其中5′UTR长32 bp,编码区长度为792 bp,编码262个氨基酸。用扩增全长ORF的引物对Apo-F/R扩增获得了一个长为184 bp的内含子,经过和全长cDNA序列进行拼接获得了其基因组结构(图1)。

图1 黄鳝载脂蛋白Apo-A1基因的基因结构及编码氨基酸序列
2.2 黄鳝载脂蛋白Apo-A1基因的组织表达分析
通过Real time RT-PCR方法检测载脂蛋白Apo-A1转录本在不同组织的表达情况,结果显示,在所检测的10种组织中,载脂蛋白Apo-A1的表达量存在明显差异;其中在肝脏表达最高,在心脏、脾脏、肌肉表达很低,而在胃、小肠、肾、脑、皮肤和血液中表达量中等。
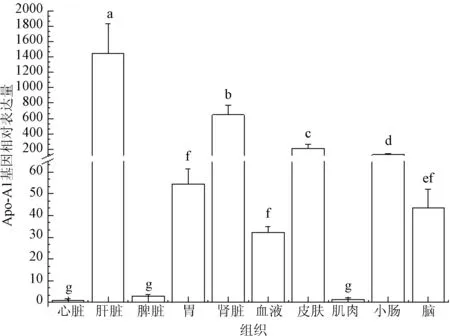
图2 黄鳝载脂蛋白Apo-A1基因的相对表达量
2.3 病原菌感染对黄鳝载脂蛋白Apo-A1基因表达的影响
病原菌嗜水气单胞菌的感染会显著影响肝脏、脾脏和小肠中载脂蛋白Apo-A1基因的表达水平。受病原菌嗜水气单胞菌感染的影响,小肠里载脂蛋白Apo-A1基因的表达量在感染初期即急剧下降;在感染后的72 h内呈反复波动趋势(图3a)。而脾脏中载脂蛋白Apo-A1基因的表达量在感染后3~24 h呈逐步增加的趋势,随后表达量逐渐降低(图3b)。肝脏中的载脂蛋白Apo-A1基因的表达量也呈现波动趋势,在感染3~6 h表达量逐渐降低,在感染后24 h呈剧烈上升达到最大值,随后又逐渐降低,直至感染后72 h降至正常水平(图3c)。
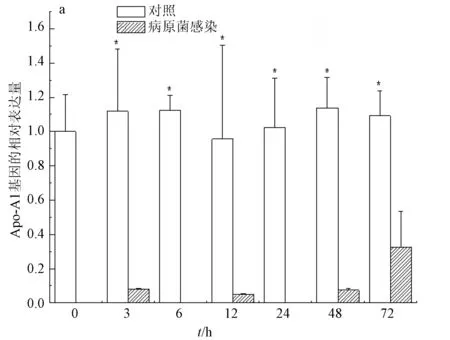
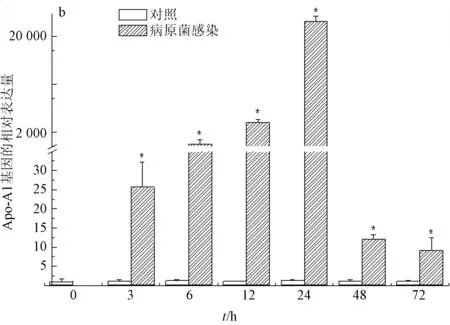
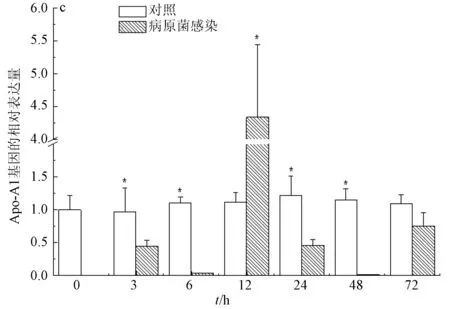
图3 病原菌感染后载脂蛋白Apo-A1 基因的相对表达量a: 小肠; b: 脾脏; c: 肝脏.
3 讨 论
载脂蛋白Apo-A1是血浆高密度脂蛋白的主要成分,在机体脂质代谢和抗动脉粥样硬化中具有重要作用。除此之外,它们还与生物体的抗氧化、抗炎、抗细菌和病毒等过程密切相关[11]。鱼类等低等脊椎动物也具有和哺乳动物相类似的天然免疫系统和获得性免疫系统以应对外界病原物的入侵。只是,鱼类的获得性免疫系统相对不完善,更加依赖于天然免疫分子作为第一道防线[18]。鱼类的载脂蛋白Apo-A1基因作为鱼类的重要免疫相关候选基因,其分离和功能的鉴定对于鱼类健康养殖具有重要的意义。
研究发现,黄鳝的载脂蛋白Apo-A1基因转录本在本研究所检测到的10种健康组织里均有不同程度的表达。这个研究结果和赤点石斑鱼[11]、斜带石斑鱼[12]、虹鳟[6]和沟鲇(Ietaluruspunetaus)[19]的载脂蛋白Apo-A1基因组织分布结果相类似。有些鱼类载脂蛋白Apo-A1基因的分布具有一定局限性,如草鱼的小肠中未检测到载脂蛋白Apo-A1基因的表达[10],而大西洋鲑[5]的载脂蛋白Apo-A1基因的表达仅限于肝脏、肌肉和小肠中等。鱼类载脂蛋白Apo-A1基因分布特异性结果提示鱼类的肝脏和小肠仍与高等哺乳动物一样是载脂蛋白Apo-A1基因的主要合成部位[15]。
哺乳动物上的大量试验表明,载脂蛋白Apo-A1是炎症发生过程中急性反应期的负反馈因子[20]。有些鱼类的载脂蛋白Apo-A1的研究结果似乎与哺乳动物的有些不同。如对于虹鳟的研究发现,病原细菌的感染并未显著影响载脂蛋白Apo-A1在肝脏和血清里的表达水平[6]。对于赤点石斑鱼的研究也发现,除脾脏外,受病原菌感染的其他组织里载脂蛋白Apo-A1基因的表达水平并无显著的差异[11]。然而,也有相当多的研究支持在哺乳动物上的研究结论。如斜带石斑鱼[12]、沟鲇[19]、大西洋鳕(Gadusmorhua)[21]的研究发现病原细菌、病毒及其类似物对鱼体的载脂蛋白Apo-A1基因表达具有显著的影响。笔者的研究也发现,病原菌嗜水气单胞菌感染会显著影响黄鳝肝脏、小肠和脾脏内载脂蛋白Apo-A1基因的表达水平。这充分说明,在低等脊椎动物鱼类上载脂蛋白Apo-A1基因可能是一个非常重要的天然免疫分子,其在免疫系统中的具体作用值得进一步深入研究。
[1] Chung H, Randolph A, Reardon I,et al. The covalent structure of apolipoprotein AI from canine high density lipoproteins [J]. J Biol Chem, 1982,257(6):2961-2967.
[2] 马百坤,郭利利,方蓉,等.人载脂蛋白A-I基因的克隆表达及功能[J].中国生物化学与分子生物学报, 2005,21(2):273-277.
[3] Shiflett A M, Bishop J R, Pahwa A, et al. Human high density lipoproteins are platforms for the assembly of multi-component innate immune complexes [J].J Biol Chem,2005,280(38):32578-32585.
[4] 廖雪玲,吴满平.载脂蛋白A-I 与机体非特异性免疫系统防御功能[J].中国临床药学杂志, 2005,14(3):193-196.
[5] Powell R,Higgins D G,Wolff J,et al.The salmon gene encoding apolipoprotein AI:cDNA sequence, tissue expression and evolution [J]. Gene,1991,104(2):155-161.
[6] Villarroel F,Bastías A,Casado A,et al.Apolipoprotein AI, an antimicrobial protein inOncorhynchusmykiss: evaluation of its expression in primary defence barriers and plasma levels in sick and healthy fish [J]. Fish and Shellfish Immunol, 2007,23(1):197-209.
[7] Babin P J,Thisse C,Durliat M,et al. Both apolipoprotein E and AI genes are present in a nonmammalian vertebrate and are highly expressed during embryonic development [J]. Proc Natl Acad Sci,1997,94(16):8622-8627.
[8] Llewellyn L, Ramsurn V P,Wigham T,et al.Cloning, characterization and expression of the apolipoprotein A-I gene in the sea bream (Sparusaurata) [J]. Biochim Biophys Acta Gene Struct Expr, 1998,1442(2/3):399-404.
[9] Kondo H, Kawazoe I,Nakaya M, et al. The novel sequences of major plasma apolipoproteins in the eelAnguillajaponica[J]. Biochim Biophys Acta Mol Cell Biol Lipids, 2001,1531(1/2):132-142.
[10] Concha M I, Molina S A, Oyarzún C, et al. Local expression of apolipoprotein A-I gene and a possible role for HDL in primary defence in the carp skin [J]. Fish and Shellfish Immunol, 2003,14(3):259-273.
[11] Qu M, Huang X, Zhang X, et al. Cloning and expression analysis of apolipoprotein A-I (ApoA-I) in the Hong Kong grouper (Epinephelusakaara) [J]. Aquaculture,2014(432):85-96.
[12] Wei J, Gao P, Zhang P. Isolation and function analysis of apolipoprotein A-I gene response to virus infection in grouper [J].Fish and Shellfish Immunol, 2015,43(2):396-404.
[13] Johnston L D,Brown G,Gauthier D,et al. Apolipoprotein A-I from striped bass (Moronesaxatilis) demonstrates antibacterial activity in vitro [J]. Comp Biochem Physiol B, 2008,151(2):167-175.
[14] Kim K Y,Cho Y S,Bang I C,et al.Isolation and characterization of the apolipoprotein multigene family inHemibarbusmylodon(Teleostei: Cypriniformes)[J].Comp Biochem Physiol B, 2009,152(1):38-46.
[15] Chen J, Shi Y,Hu H, et al. Apolipoprotein A-I, a hyperosmotic adaptation-related protein in ayu (Plecoglossusaltivelis) [J]. Comp Biochem Physiol A,2009,152(2):196-201.
[16] 邱庆崇,耿小雪,刘成都,等.黄鳝载脂蛋白 apoAI 基因的克隆及序列分析[J].湖北农业科学,2011,50(21):4500-4502.
[17] Li W,Sun W X,Hu J F,et al.Molecular characterization,polymorphism and expression analysis of swamp eel major histocompatibility complex class IIB gene,after infection byAeromonashydrophilia[J].The Journal of Animal & Plant Sciences, 2014, 24(2):481-491.
[18] Plouffe D A,Hanington P C,Walsh J G,et al.Comparison of select innate immune mechanisms of fish and mammals [J]. Xenotransplantation,2005,12(4):266-277.
[19] Pridgeon J W,Klesius P H.Apolipoprotein A1 in channel catfish: transcriptional analysis, antimicrobial activity, and efficacy as plasmid DNA immunostimulant againstAeromonashydrophilainfection [J]. Fish and Shellfish Immunol, 201,35(4):1129-1137.
[20] Wang M, Briggs M R. HDL: the metabolism, function, and therapeutic importance [J]. Chem Rev, 2004,104(1):119-137.
[21] Caipang C M A,Hynes N,Puangkaew J,et al.Intraperitoneal vaccination of Atlantic cod,Gadusmorhuawith heat-killedListonellaanguillarumenhances serum antibacterial activity and expression of immune response genes[J].Fish and Shellfish Immun,2008,24(3):314-322.
GeneStructureandExpressionofApo-A1GenefromSwampEel
KAN Yanze, JIANG Ao, SUN Wenxiu, LI Wei
( Engineering Research Center of Ecology and Agricultural Use of Wetland,Ministry of Education,Yangtze University, Jingzhou 434025,China )
In this paper, full-length cDNA and genomic structure of Apo-A1 gene were identified based on the cDNA fragment that we previously reported. Tissue distribution and immune response of the Apo-A1 gene to bacterial challenge were investigated. Results showed that the full-length cDNA was 1207 bp in length including a 32 bp-long 5′ untranslated region (UTR) encoding a 262 amino acids. In the 1391 bp-long genomic DNA,just one intron was identified. Real-time quantitative PCR demonstrated that Apo-A1 transcripts were ubiquitously expressed in ten tissues, with distinctly different expression level. Significant changes were observed in intestine, liver and spleen after the fish was challenged with pathogenic bacteriumAeromonashydrophilia. The findings suggeste that Apo-A1 may involve in the immune system of this fish.
swamp eel; Apo-A1, gene structrue; expression
10.16378/j.cnki.1003-1111.2016.06.016
S966.4
A
1003-1111(2016)06-0697-05
2016-01-26;
2016-04-18.
湖北省教育厅基金资助项目(Q20131206).
阚延泽(1993—),男, 硕士研究生;研究方向:生化与分子生物学. E-mail: 378053841@qq.com.通讯作者:李伟(1976—),男, 副教授;鱼类分子生物学. E-mail: wetli@yangtzeu.edu.cn.
