植物生长物质和水解乳蛋白对蓖麻再生体系建立的影响
2016-12-20杜雪玲余如刚宋运贤张慧君
杜雪玲,余如刚,宋运贤,张慧君
(淮北师范大学 生命科学学院,安徽省资源植物学重点实验室,安徽 淮北 235000)
植物生长物质和水解乳蛋白对蓖麻再生体系建立的影响
杜雪玲,余如刚,宋运贤,张慧君
(淮北师范大学 生命科学学院,安徽省资源植物学重点实验室,安徽 淮北 235000)
为筛选蓖麻再生体系建立的最佳配方,本研究以云杂N-2蓖麻种子为供试材料,对蓖麻种子消毒后,取胚轴分别接种在MS(Murashige and Skoog)为基本培养基上,并附加不同浓度的IAA(0.1 mg/L、0.3 mg/L和0.5 mg/L)、6-BA(0.5 mg/L、0.7 mg/L和0.9 mg/L)及不同浓度水解乳蛋白(0 mg/L、250 mg/L、500 mg/L和750 mg/ L),进行愈伤组织培养和分化培养.结果表明:在IAA浓度为0.3 mg/L、6-BA浓度为0.7 mg/L时蓖麻愈伤组织诱导率最高为80%;在IAA和6-BA浓度最适,水解乳蛋白的浓度为500 mg/L时,愈伤组织生长状况最佳,呈淡黄色,褐化程度低;诱导芽增殖的最适培养基为MS+0.5 mg/L 6-BA+0.02 mg/L NAA,芽的增殖系数达6.15.
蓖麻;植物生长物质;水解乳蛋白;愈伤组织;芽增殖
0 引言
蓖麻耐酸碱性强,有机物质含量丰富,排水效果好且培养方便,最重要的一点是蓖麻油可生产柴油,因此蓖麻成为许多研究的热点.目前国内外关于蓖麻方面的一些研究已取得一定的进展,例如严兴初等[1]对蓖麻作为能源开发的现状与前景进行研究.文献[2-3]对蓖麻组织培养进行研究,张利明等[4]对蓖麻组织培养和植株再生进行研究.此外还有文献[5-6]对蓖麻的用途与栽培技术及我国蓖麻良种选育研究现状及发展策略进行研究等.另外,文献[7-9]分别研究植物生长物质、水解乳蛋白对小麦花粉愈伤组织和芋芽继代培养的影响,而植物生长物质和水解乳蛋白对蓖麻愈伤组织的影响还未见报道.本实验是以云杂N-2蓖麻种子为试材,研究不同浓度的植物生长物质(生长素IAA、细胞分裂素6-BA)及不同浓度的水解乳蛋白对蓖麻愈伤组织诱导率及生长情况的影响,旨在为获得大量高品质的蓖麻愈伤组织,获得再生植株及对蓖麻品种遗传改良奠定基础.
1 实验材料与方法
1.1 实验材料
蓖麻种子:云杂N-2.
1.2 启动培养(无菌体系的建立)
1.2.1 蓖麻种子的筛选
选取籽粒饱满,无病虫害感染、无机械损伤、大小相近的蓖麻种子.
1.2.2 蓖麻种子的消毒
将蓖麻种子流水下冲洗30 min,然后用75%的酒精消毒30 s,用无菌水冲洗2~3次,再用0.1%升汞浸泡消毒8~10 min[10],最后用无菌水冲洗3~4次.用升汞消毒时一定要把握好浸泡时间,以免时间过短达不到消毒的效果,时间过长会杀死蓖麻种子,影响蓖麻愈伤组织的诱导率.种子消毒后用干燥的无菌吸水纸吸干,放入无菌操作台上的灭菌培养皿中待用.
1.2.3 预培养
分别将脱毒处理后的不去皮蓖麻种子、去皮蓖麻种子以及经解剖得到的完整幼胚分别接种于MS+ 0.1 mg/L 6-BA培养基上,每种材料接种20瓶,每瓶4个,预培养一周并观察其生长状况,统计污染率,通过比较得出最佳外植体.
1.2.4 愈伤组织的诱导及丛生芽的分化
取预培养一周的胚轴接种到添加不同浓度的6-BA和IAA(见表1)及不同浓度的水解乳蛋白(见表2)的MS培养基中,琼脂6 g/L,蔗糖为30 g/L,pH为5.8,每个处理接种8瓶,每瓶接种3个.遮光培养,室温25±2℃、相对湿度70%~80%.接种2~4周后分别统计蓖麻愈伤组织的诱导率,并观察记录各组愈伤组织的生长情况.将含有芽体的愈伤组织接种到添加不同浓度植物生长物质6-BA(0.1 mg/L、0.3 mg/L、0.5 mg/L、0.7 mg/L)和NAA 0.02 mg/L的培养基中培养,12 h光照培养30 d后统计芽的增殖情况.
蓖麻愈伤组织诱导率=形成愈伤组织的材料数/总的接种材料数×100%
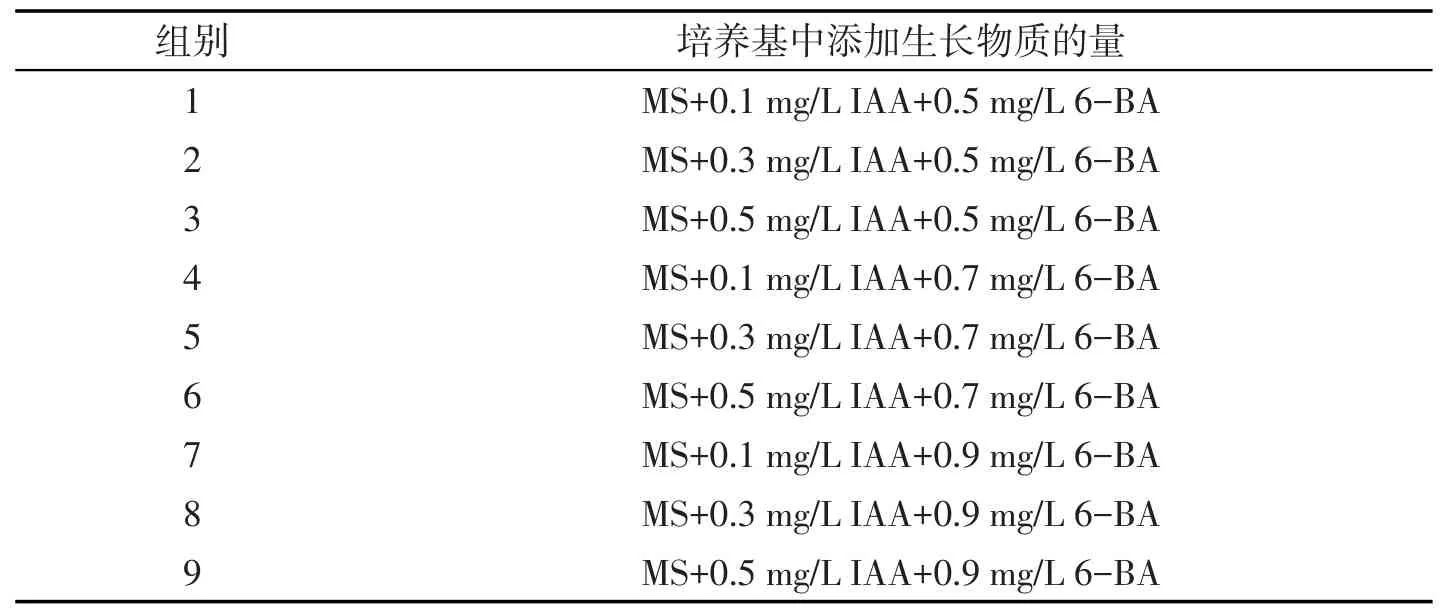
表1 IAA和6-BA对蓖麻愈伤组织诱导的配方

表2 水解乳蛋白对蓖麻愈伤组织诱导的配方
2 结果与分析
2.1 愈伤组织培养中植物生长物质双因子浓度试验的结果与分析
2.1.1 不同外植体下的污染率
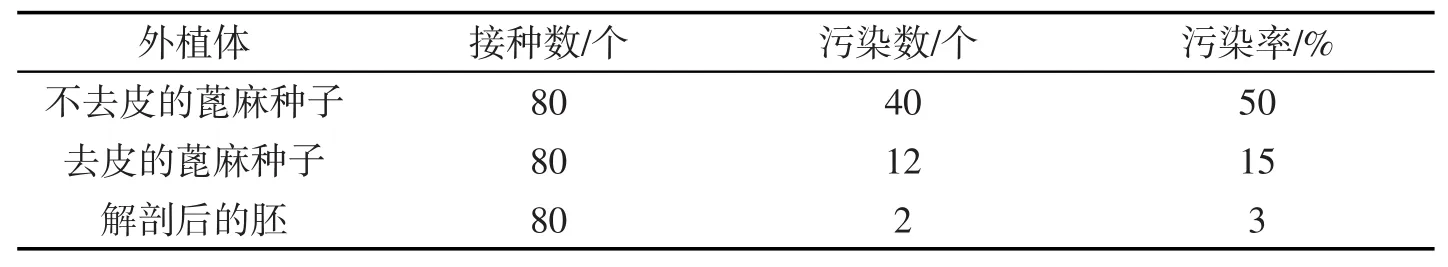
表3 不同外植体的污染率统计
由表3可知,完整的云杂N-2号蓖麻种子有外阜,若不去皮,脱毒效果最差,污染率最高;将种子脱去外壳,相同脱毒方法下,污染率明显降低,发芽率升高;将种子纵向剖开,取其胚作为外植体污染率极低,并可快速得到幼苗或愈伤组织,大大缩短培养周期.

图1 去皮种子接种一周后(A);整胚接种一周后(B)
不去皮的种子其污染率最高,生长最缓慢,主要原因是长期进化过程中,有些品种的蓖麻种子形成外阜,及其坚硬的外壳都对种子的杀菌消毒有阻隔作用,若去皮,污染率大大降低,但生长仍缓慢;解剖后的胚在接种两天后开始明显生长膨胀,污染率极低(见图1).
2.1.2 不同浓度的6-BA和IAA对蓖麻愈伤组织诱导率的影响
根据结果统计,在6-BA浓度分别为0.5 mg/L、0.7 mg/L和0.9 mg/L,IAA浓度不同时蓖麻愈伤组织诱导率如图2所示.
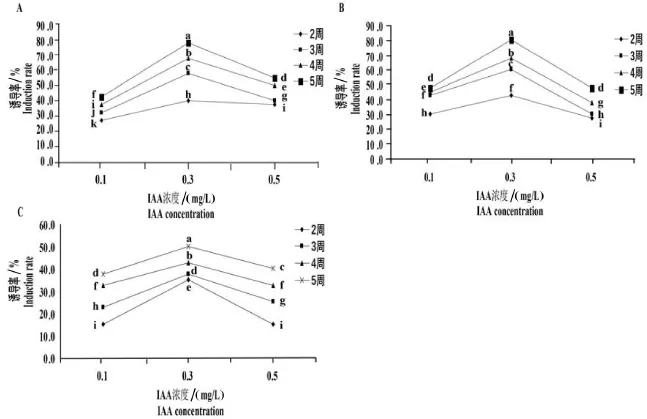
图2 IAA对蓖麻愈伤组织诱导率的影响A.6-BA浓度为0.5 mg/L;B.6-BA浓度为0.7 mg/L;C.6-BA浓度为0.9 mg/L
由图2可知,在6-BA浓度分别为0.5 mg/L、0.7 mg/L、0.9 mg/L时,相同的培养时间愈伤组织诱导率随着IAA的浓度增加先增加后降低.不同的培养时间观察并计算得到的愈伤组织诱导率随IAA的浓度增加的变化趋势相同,均在IAA浓度为0.3 mg/L时,愈伤组织诱导率较高,且在6-BA浓度为0.7 mg/L最高,为80%,其余8组蓖麻愈伤组织的诱导率均低于80%,其中蓖麻愈伤组织诱导率最低的一组是7组,为37.5%.最终得出蓖麻愈伤组织诱导较适植物生长物质浓度为IAA浓度0.3 mg/L,6-BA浓度0.7 mg/L.
2.1.3 不同浓度的植物生长物质对蓖麻愈伤组织生长状况的影响
培养4周后观察并记录不同浓度IAA和6-BA培养基上愈伤组织生长情况如表4和图3.

表4 培养4周后IAA和6-BA对愈伤组织的颜色、质地、生长情况的描述

图3 IAA和6-BA对蓖麻愈伤组织生长的影响
由表4和图3对比得出:在添加IAA为0.3 mg/L、6-BA为0.7 mg/L的MS培养基上(5组)的蓖麻愈伤组织相对于其他8组蓖麻愈伤组织的生长情况较好(如图3),其呈淡黄色,质地较其他组疏松,生长迅速,表面呈大的颗粒状,且体积最大,其他几组的蓖麻愈伤组织呈淡黄色中带有淡绿色,质地坚硬,生长较缓慢,长势较差.
2.1.4 愈伤组织培养中水解乳蛋白单因子浓度试验结果与分析
在基本培养基MS附加IAA 0.3 mg/L和6-BA 0.7 mg/L的培养基中,加入不同浓度的水解乳蛋白,4周后观察愈伤组织的生长情况如表4.由表5可知,水解乳蛋白在0~500 mg/L(不包含500 mg/L)浓度范围抑制愈伤组织的生长,使蓖麻愈伤组织发生褐化,而500~750 mg/L(包含500 mg/L)的浓度范围内则促进愈伤组织的生长,且有效的抑制蓖麻愈伤组织的褐化程度.其中,水解乳蛋白浓度在500 mg/L时愈伤组织生长最好.

表5 培养4周后水解乳蛋白对蓖麻愈伤组织颜色、质地及生长情况的描述
2.2 不同植物生长物质浓度配比对芽增殖的影响

表6 6-BA对蓖麻芽增殖的影响
由表6可知,不同浓度6-BA和NAA的组合均能够促进芽的增殖,当6-BA浓度为0.1 mg/L时,芽增殖率较低,芽较细长且发黄;随着6-BA浓度的升高,不定芽增殖系数也逐渐增高,当6-BA浓度为0.5 mg/L时,芽的增殖系数达到最高位6.15,且此时芽体粗壮;当6-BA浓度高于0.5 mg/L时芽增殖系数又开始降低.因此,诱导芽增殖的6-BA浓度为0.5 mg/L(见图4).

图4 愈伤组织分化培养(A);芽的增殖生长(B)
3 讨论
3.1 外植体的选择
蓖麻组织培养中外植体的选择一直是研究的难点也是研究的热点.本研究初期将种子先进行脱毒处理,然后分两组培养,其中一组在无菌条件下剥去种皮.结果表明去皮接种明显优于带皮接种,因为去除种皮使得种子吸收营养物质和水分变得更加容易,同时减少胚芽胀破种皮的时间,进而促使种子较早萌发.
3.2 试材选择对蓖麻愈伤组织颜色、生长的影响
蓖麻愈伤组织培养过程中,常选用幼胚作为外植体[2],其极易被诱导产生愈伤组织,但幼胚是由胚根、下胚轴、上胚轴、胚芽、子叶这几部分组成[13],而在丁兰[2]、张慧英等[3]对蓖麻愈伤组织培养中均以胚轴、胚根、胚芽顶、子叶为试材,其中上胚轴和胚芽顶速度最快,胚根和子叶次之.本研究中选用胚进行预培养一周后选取上胚轴,在研究植物生长物质和水解乳蛋白对蓖麻愈伤组织生长影响的实验中,上胚轴出愈时间较为适合;对不同试材选择,出愈时间过短可能造成最终现象不明显,而出愈时间过长可能造成MS培养基成分的大量浪费.并且选择不同的试材,出愈时愈伤组织的颜色不同.选用子叶、胚芽顶和下胚轴,其诱导产生的愈伤组织为绿色或淡绿色,胚根诱导的愈伤组织大部分为淡黄色,少数为淡绿色.而本研究中上胚轴的愈伤组织为黄色或淡黄色,且形成的愈伤组织较子叶长势好.在实验浓度范围内,随着细胞分裂素和生长素浓度比例的增高,愈伤组织长势较好.
3.3 不同植物生长物质对蓖麻愈伤组织诱导及芽分化的影响
本课题研究不同植物生长物质对蓖麻再生的影响,不仅可以进行蓖麻快速繁殖和保存资源,而且为蓖麻遗传转化奠定基础.我国关于蓖麻愈伤组织培养和植株再生的培养报道相对较少,在本研究结果中,当6-BA浓度为0.5 mg/L时,芽的增殖系数达到最高位,与丁兰等[2]研究中得出6-BA浓度为0.4 mg/L时适合芽增殖的结果不符,而与张利明等[4]研究结果相同.另外,本研究中再生苗的生根结果不太理想,在后期将进一步研究.
[1]严兴初,王力军.蓖麻作为能源开发的现状与前景[J].安徽农业科学,2007,35(34):11165,11167.
[2]丁兰,王涛,景宏伟,等.蓖麻的组织培养[J].西北师范大学学报(自然科学版),2010,46(1):79-83.
[3]张慧英,韦家川.蓖麻组织培养技术探究[J].广西农业生物科学,2001,20(3):233-234.
[4]张利明,侯玲玲,李文彬,等.蓖麻组织培养和植株再生的研究[J].中国油料作物学报,2009,31(2):253-255.
[5]王兆木.蓖麻的用途与栽培技术[J].新疆农业科学,2000,12(5):223-225.
[6]曾祥艳,王东雪,马锦林.我国蓖麻良种选育研究现状及发展策略[J].广西热带农业,2010(6):27-29.
[7]杜希华,孙秀玲,郝岗平,等.不同外植体和激素对银杏愈伤组织的诱导和生长的影响[J].山东师范大学学报,2008,23(1):129-133.
[8]胡琳,许为刚,赵向科.三种氨基酸及水解乳蛋白对小麦花粉愈伤组织发生能力的影响[J].山西农业科学,1989(6):25-26.
[9]汤青林,牛义,王志敏,等.芋芽继代培养中激素、水解乳蛋白、碳源的调节研究[J].西南农业学报,2006,19(5):928-930.
[10]陈超,王桂兰,田立民,等.长寿花胚性愈伤组织的诱导及胚状体再生[J].园艺学报,2004,31(2):249-252.
[11]王震星,杨恩芹,刘贵仁,等.金丝小枣花药离体培养再生植株研究[J].河北果树,1996(3):9-10.
[12]丁运华,吴天灵,陈兆贵.马铃薯茎尖分生组织试管苗再生体系的建立[J].惠州学院学报,2006,26(6):51-55.
[13]田萍萍,刘延岭,崔翠菊,等.大叶藻胚的结构和种子萌发过程的研究[J].海洋科学进展,2012,30(3):402-407.
Effects of Plant Growth Substances and Hydrolyzed Milk Protein on Establishment of Castor Regeneration System
DU Xueling,YU Rugang,SONG Yunxian,ZHANG Huijun
(School of Life Science,Huaibei Normal University,Anhui Key Laboratory of Plant Resources and Biology,235000,Huaibei,Anhui,China)
To screen the best formula of the castor callus regeneration system,the seeds of castor(N-2)were used as explants for in vitro regeneration.After surface sterilization of seed,the hypocotyl explants were cul⁃tured on Murashige and Skoog(MS)basal medium,supplemented with IAA(0.1,0.3 and 0.5 mg/L),6-BA(0.5,0.7 and 0.9 mg/L)and hydrolyzed milk protein(250,500 and 750 mg/L)for induction,culture and dif⁃ferentiation of callus.As a result,the formula of MS+IAA 0.3 mg/L+6-BA 0.7 mg/L was the highest in cal⁃lus induction rate(80%)of castor.Based on this result,In hydrolyzed milk protein(500 mg/L),the growth of calli were the best,which were shown pale yellow and soft,and lower browning degree.In addition,the best formula of propagation was MS+6-BA 0.5 mg/L+IAA 0.02 mg/L,and the multiplication coefficient was 6.15.
castor;plant growth substance;hydrolyzed milk protein;callus;buds propagation
S 565.6
A
2095-0691(2016)04-0069-06
2016-07-10
2014安徽省资源植物学重点实验室项目
杜雪玲(1976- ),女,河南扶沟人,副教授,研究方向:植物细胞工程.
