切除单侧眼柄对不同体质量养殖斑节对虾卵巢发育及产卵的影响
2016-12-19杨其彬邱丽华黄建华周发林温为庚
杨其彬,邱丽华,黄建华,周发林,温为庚
( 中国水产科学研究院 南海水产研究所,农业部南海渔业资源开发利用重点实验室,广东 广州 510300 )
切除单侧眼柄对不同体质量养殖斑节对虾卵巢发育及产卵的影响
杨其彬,邱丽华,黄建华,周发林,温为庚
( 中国水产科学研究院 南海水产研究所,农业部南海渔业资源开发利用重点实验室,广东 广州 510300 )
在盐度31、水温28~29 ℃下,进行了4次卵巢诱导试验,研究了切除单侧眼柄对体质量56.4~105.4 g的养殖斑节对虾卵巢发育和产卵的影响及卵巢发育、产卵与体质量之间的关系。结果显示,切除单侧眼柄诱导养殖斑节对虾卵巢发育成熟,成功率(y)与雌虾体质量(x)显著相关(P<0.05),雌虾体质量越小,诱导成功率越低,回归方程为:y=133.92lnx-535.63(r2=0.9297)。养殖斑节对虾眼柄手术后,最快10 d产卵,部分雌虾能重复产卵。产卵量(y)与雌虾体质量(x)显著正相关(P<0.05),雌虾体质量越小,产卵量越小,回归方程为:y=122.22lnx-472.2(r2=0.9738)。雌虾累积死亡率、卵子直径和卵子孵化率与雌虾体质量无显著相关性(P>0.05)。建议用体质量80 g以上的养殖斑节对虾雌虾作为亲虾。
斑节对虾;卵巢;成熟;产卵;养殖
斑节对虾(Penaeusmonodon)最大体长可达350 mm,体质量达500 g,是对虾属中个体最大的养殖对虾。斑节对虾活力强、食性杂,广泛分布于非洲南部和东部海岸、印度、巴基斯坦、马来西亚、泰国、日本和中国等沿海,中国的浙江、福建、台湾、广东、广西和海南沿海有分布[1]。
传统的斑节对虾亲虾均源于自然海区,但亲虾资源日渐枯竭,不能满足斑节对虾养殖业的需求。有研究发现,野生斑节对虾亲虾携带病毒的比例极高,如泰国野生斑节对虾样品携带白斑综合症病毒的比例高达89.8%[2],这就增加了养殖斑节对虾失败的几率。近年斑节对虾有逐渐被经过选育的“生长快、无特定病原”的凡纳滨对虾(Litopenaeusvannamei)改良品系所取代的趋势[3],养殖面积显著减少。因此,开展斑节对虾良种培育,获得生长快、无特定病原的斑节对虾新品系,是斑节对虾养殖业持续、稳定发展的需要。而这首先要研究养殖斑节对虾性成熟和卵巢诱导成熟及产卵的规律。已有的研究表明,养殖的斑节对虾性成熟和繁殖十分困难,亲虾的成熟率、产卵量和孵化率都很低,难以满足规模化苗种生产需求[4-6],也是斑节对虾全人工繁殖技术的关键。黄建华等[7]跟踪研究了养殖斑节对虾的性成熟,认为养殖斑节对虾雌虾性成熟与体质量显著相关。这与养殖墨吉明对虾(Fenneropenaeusmerguiensis)[8]和凡纳滨对虾[9]的性成熟与其个体大小密切相关一致。但目前尚无有关养殖斑节对虾卵巢诱导成熟及产卵与体质量关系的试验支持这一观点。
在前人研究基础上,笔者推测,养殖斑节对虾卵巢诱导发育成熟及产卵可能与体质量密切相关。本研究设计了4批次试验,切除不同体质量(56.4~105.4 g)的养殖斑节对虾雌虾的单侧眼柄,诱导其卵巢快速发育成熟并产卵,跟踪分析养殖斑节对虾卵巢诱导成熟及产卵与体质量之间的关系,为斑节对虾全人工繁殖提供参考。
1 材料与方法
1.1 材料
1.1.1 试验条件
于2013和2014年春季和秋季在南海水产研究所三亚基地先后进行了4次诱导卵巢成熟试验,每次持续30 d。试验池为室内水泥池,面积1 m2的80口,20 m2的4口,深度1.3 m。试验用水为80 cm厚的细沙层过滤、沉淀24 h的自然海水,盐度31,温度28~29oC,pH 8.3,再经250目筛绢袋过滤。饵料为市场购买的鱿鱼、蟹肉、贝肉和活沙蚕。
1.1.2 试验虾的准备及管理
斑节对虾为试验基地培育的虾苗(全长1.2 cm),投放到三亚林旺养殖示范基地的石斑鱼(Epinephelus)养殖池塘(面积0.5~0.8 hm2)中混养。虾苗密度为15尾/m2, 鱼种(全长5.0 cm)密度0.5 尾/m2。早晚各投喂一次杂鱼磨成的鱼浆。在15口塘养殖266 d后,挑选附肢完整、弹跳力强、色泽鲜亮、带有精荚的不同体质量的雌虾60尾,最小56.4 g,最大105.4 g。10 g为一个梯度范围,4次诱导卵巢成熟试验雌虾体质量分布范围见表1。同时挑选雄虾30尾,运回试验基地,分别投放到室内2口20 m2的水池中,加入深度50 cm海水,暂养5 d,每日8:00和19:00过量投喂饵料。每日18:00用虹吸法清除残饵及粪便,换水50%。
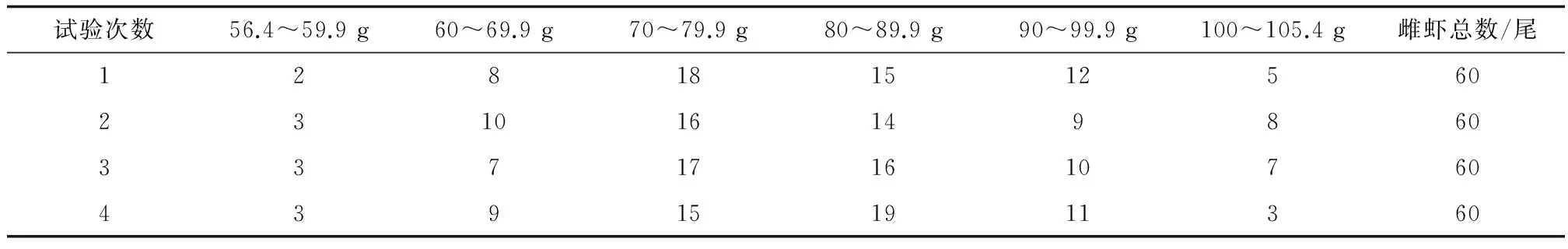
表1 各次试验中雌虾的体质量范围及数量
1.2 方法
根据文献[10]的方法剪除单边眼柄。剪眼柄虾放在同一个20 m2水池(催熟池),同时投放30尾雄虾,雌雄比例2∶1,最终养殖密度4.5 尾/m2。催熟水池用黑布遮光,光照度10 lx。每日8:00、19:00、21:00过量投喂饵料。清除残饵及换水和准备阶段相同。
卵巢的发育分期参照文献[11-12],外观观察参照文献[13]描述的方法进行。剪眼柄5 d后,每日19:00—20:00用潜水手电筒照射雌虾腹部,仔细检查卵巢发育情况。若卵巢达到Ⅲ期或以上即可移至产卵池(1 m2),加入试验用水至1 m深。雌虾产卵后,记录其体质量并移至另一个催熟池(20 m2)中,以区别于卵巢不发育的雌虾,同时观察卵巢再发育效果。未产卵的雌虾移回催熟池或者让其在产卵池继续待产。
每日9:00左右,将已产卵的池水充分搅动,让卵子尽可能分布均匀,从池四个角和中间的浅、深各处取样100 mL,在显微镜下计数卵子数量,测量卵子直径,计算样品平均值(n)。卵子在产卵池中留2 d,孵化成无节幼体后,按照前述方法估算无节幼体数量。
每日记录不同体质量雌虾的死亡数、产卵雌虾数、卵巢达到Ⅲ期(及以上)雌虾数(不含卵巢重复发育的雌虾)、产卵量、无节幼体数量和卵子直径。计算下列指标:
总产卵数量/104粒·池-1=S×n1
无节幼体数/104尾·池-1=S×n2
孵化率/%=n3/n4×100%
累积死亡率/%=n5/n6×100%
诱导成功率/%=n7/n6×100%
式中,S为产卵池面积(m2),n1为卵子样品平均值(104粒/m2),n2为无节幼体样品平均值(104尾/m2),n3为无节幼体估计数,n4为卵子估计数,n5为死亡雌虾数,n6为剪眼柄雌虾数,n7为卵巢Ⅲ期(及以上)雌虾数。
1.3 数据处理
各次试验中,将不同体质量雌虾的诱导成功率、产卵量和无节幼体数量逐个在Microsoft Excel 2010上作散点图,进行回归分析,得出回归方程及其显著性。以表1作为体质量范围,计算同一体质量范围该次试验孵化率、卵子直径、死亡率结果数值和最终4次试验结果的平均值,在Microsoft Excel 2010上作散点图,对最终结果进行回归分析,得出其回归方程及显著性。
2 结 果
2.1 诱导后斑节对虾卵巢的发育
在试验中,不同体质量的斑节对虾雌虾被剪除单侧眼柄后,在适宜条件(暗光、高蛋白饵料等)下,卵巢发育较快,6 d就能观察到清晰的卵巢。不同体质量雌虾卵巢发育到Ⅲ期(及以上)的尾数占手术雌虾总数的比例(诱导成功率)不同,体质量56.4~59.9 g的雌虾平均诱导成功率为8.2%;60~69.9 g诱导成功率为8.4%;70~79.9 g诱导成功率为48.3%;80~89.9 g诱导成功率为67.4%;90~99.9 g诱导成功率为73.6%;100~105.4 g诱导成功率为81.6%。养殖斑节对虾卵巢诱导成功率与其体质量呈显著的正相关(P<0.05):体质量越小,卵巢诱导成功率越低。诱导成功率与体质量成对数关系:y=133.92lnx-535.63(r2=0.9297)(图1)。
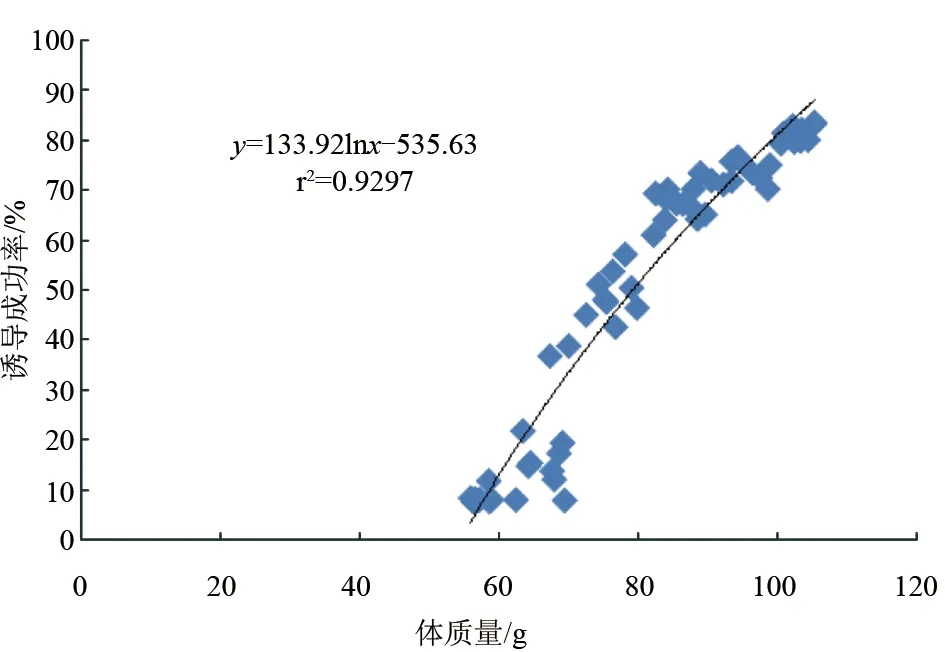
图1 不同体质量养殖斑节对虾的诱导成功率
2.2 诱导后斑节对虾产卵
养殖斑节对虾雌虾通过人工诱导(剪除单侧眼柄)发育成熟加快,最快10 d就产卵。体质量56.4~59.9 g雌虾产卵1.5×105粒,60~69.9 g雌虾产卵2.17×105粒(1.95×105~2.43×105粒),70~79.9 g雌虾产卵4.38×105粒(3.61×105~5.16×105粒),80~89.9 g雌虾产卵7.22×105粒(6.22×105~8.03×105粒),90~99.9 g雌虾产卵7.75×105粒(6.54×105~8.95×105粒),100~105.4 g以上产卵量为8.73×105粒(7.80×105~9.66×105粒)。雌虾产卵量与其体质量呈显著正相关(P<0.05),体质量越大,产卵越多。产卵量与体质量成对数关系:y=122.22lnx-472.2(r2=0.9738)(图2)。
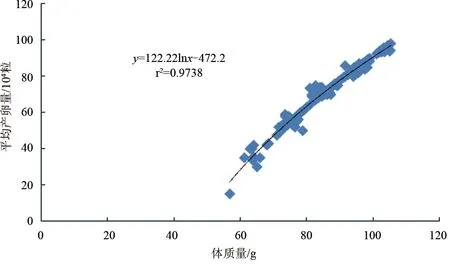
图2 不同体质量养殖斑节对虾平均单次产卵量
斑节对虾卵约28 h孵出无节幼体,平均单次无节幼体产量与雌虾体质量密切相关(P<0.05)。56.4~59.9 g雌虾平均一次产无节幼体6.0×104尾,60~69.9 g产无节幼体1.25×105尾,70~79.9 g产无节幼体2.80×105尾,80~89.9 g产无节幼体5.17×105尾,90~99.9 g产无节幼体5.50×105尾,100~105.4 g产无节幼体6.81×105尾。无节幼体产量与雌虾体质量成对数关系:y=95.964lnx-374.51(r2=0.9475)(图3)。整个试验过程中,卵子孵化率最高82.2%,最低40.0%。各体质量梯度范围(由低到高)平均孵化率依次是:10%、57.6%、63.7%、71.6%、70.7%、75.6%。卵子孵化率与雌虾体质量的线性或对数关系均不显著(P>0.05)(图4)。斑节对虾卵直径为268.7~312.1 μm,各体质量梯度范围(由低到高)卵直径平均值依次为:287.3 μm、291.0 μm、291.1 μm、293.7 μm、290.3 μm、291.6 μm,与雌虾体质量无显著线性或对数关系(P>0.05)(图5)。
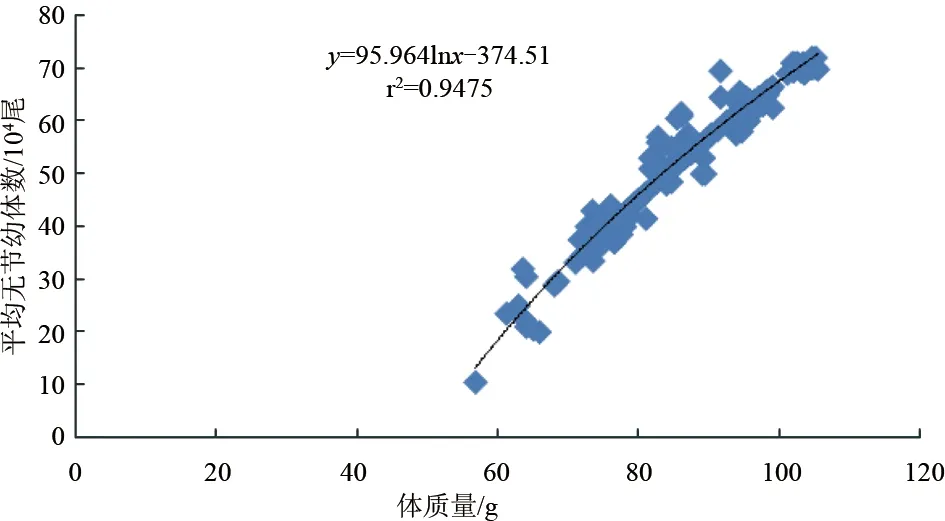
图3 不同体质量养殖斑节对虾平均单次无节幼体产量
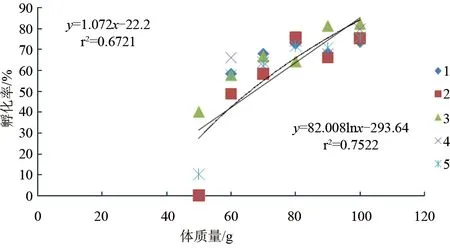
图4 不同体质量养殖斑节对虾卵子孵化率注:系列1、2、3和4是该次试验结果平均值;系列5是4次试验结果的总平均值。为简洁,只画出“5”的趋势线.下同.
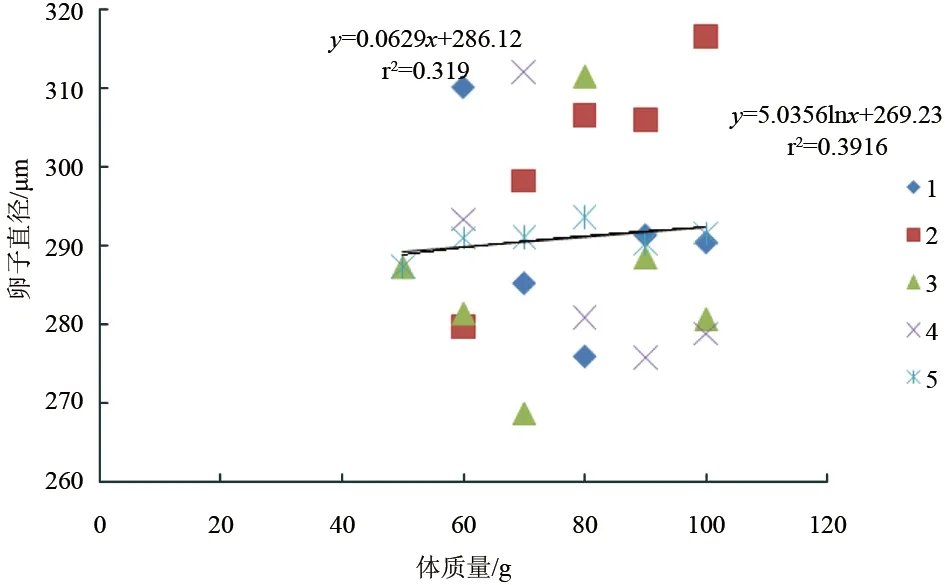
图5 不同体质量养殖斑节对虾卵子直径
2.3 斑节对虾的诱导死亡率
剪除单侧眼柄能诱导养殖斑节对虾卵巢快速发育,也会导致对虾死亡,最高死亡率为50%,平均值13.8%~23.0%。各体质量梯度范围(由低至高)死亡率平均值依次是18.8%、17.6%、13.8%、16.8%、16.5%和23.0%,与雌虾体质量无显著线性或对数关系(P>0.05)(图6)。

图6 不同体质量养殖斑节对虾雌虾眼柄手术后的死亡率
3 讨 论
3.1 关于诱导成功率
本试验跟踪观察到,养殖斑节对虾的诱导成功率与其体质量显著相关(P<0.05),体质量越小诱导成功率越低。体质量80 g以上的雌虾诱导成功率67.4%以上,与野生虾的60%~90%相当[10],而体质量80 g(不含80 g)以下的雌虾诱导成功率为48.3%以下。黄建华等[7]的跟踪研究显示,养殖斑节对虾雌虾性成熟的最小体质量为75.0 g,只有性成熟后的养殖斑节对虾雌虾才容易诱导成熟产卵,体质量80 g以上的雌虾诱导成功率较高。本试验结果与Chotipuntu等[14]的结果“养殖斑节对虾第一次卵巢成熟平均体质量为(78 ± 4) g (n=2)”一致。对其他对虾如墨吉明对虾[8]和凡纳滨对虾[9]的研究也发现,性成熟与体质量密切相关。另外,卵巢诱导成熟还有其他条件配合。Hoang等[8,10]认为,暗光有利于卵巢成熟;Xu等[15]认为,优质饵料(如鱼肉、维生素C和鱼油)在水生动物繁殖中起重要作用。该试验采用了暗光和鲜活饵料,可能这是导致少数体质量较小的雌虾被诱导发育成熟的原因。试验虾的养殖日龄对卵巢诱导效果的影响,有待以后深入研究。
3.2 关于产卵量
本试验跟踪观察到,剪除单侧眼柄后,养殖斑节对虾的产卵量与体质量显著相关(P<0.05):体质量80 g以上的雌虾平均单次产卵7.22×105粒,最高9.66×105粒;体质量70 g以下雌虾平均单次产卵4.38×105粒,最低1.5×105粒。高于Arnold等[16]的研究结果“第八代养殖斑节对虾平均每次产卵量4.13×105粒”。Peixoto等[17]认为,卵巢成熟度显著影响产卵量。同一成熟度的卵巢,性腺指数相似,雌虾体质量越大,其卵巢就越大,所含的卵子越多,产卵量越大,与Menasevta等[18]的研究结果一致。所以,笔者建议用体质量80 g以上的养殖斑节对虾雌虾作为亲虾。
3.3 关于雌虾死亡率
本试验中,剪除单侧眼柄导致试验雌虾累积死亡率为13.8%~23.0%,略高于Emerenciano等[19]的研究结果(6%~12%),雌虾死亡率与其体质量无显著关系(P>0.05)。剪除眼柄是破坏性手术,损伤试验虾,甚至死亡。用夹烫法剪除眼柄效果最好,试验虾存活率几乎达到100%[10]。本试验中,养殖斑节对虾雌虾的死亡可能是剪眼柄手术所致,与体质量无显著关系。目前,已有学者研究了降低卵巢诱导发育中虾死亡率的新方法,如Meeratana等[18]用注射血青素诱导罗氏沼虾(Macrobrachiumrosenbergii)卵巢成熟,Vaca等[20]用血青素诱导凡纳滨对虾卵巢成熟,温为庚等[13,21]用血青素诱导斑节对虾卵巢成熟。此方法虽然能降低虾类的死亡率,但操作复杂,还有待深入研究。
3.4 关于孵化率
本试验中,卵子孵化率为40.0%~82.2%,与雌虾体质量无显著关系(P>0.05)。影响卵子孵化率的因素很多[22],但Arnold等[23]认为,精荚质量、精子数量和质量显著影响孵化率,而Coman等[24]认为,卵子的质量显著影响孵化率;Ramesh[25]认为,天然饵料能改善卵子质量;Meunpol等[26]则认为,饵料是影响雄虾繁殖性能的重要因子。养殖斑节对虾生存环境局限在池塘中,不同体质量的对虾摄食的饵料主要是人工投喂的饵料,差异不显著,对精子和卵子质量影响不显著,对孵化率影响不显著。
经过多年选育,斑节对虾对饵料的利用率有所提高[27],繁殖力有改善[28],但繁殖效率依然较低。如何提高斑节对虾的繁殖效率和培育无特定病原斑节对虾亲虾,有待深入研究。
[1] 刘瑞玉,钟振如. 南海对虾类[M]. 北京:农业出版社,1986:106-108.
[2] 杨丽诗,黄建华,孙苗苗,等. 3种来源的野生斑节对虾携带病毒情况调查[J]. 上海海洋大学学报,2011, 20(4):546-552.
[3] Wyban J. Domestication of Pacific white shrimp revolutionizes aquaculture [J]. G Aqua Ad, 2007(4):42-44.
[4] Coman G J, Crocos P J, Amold S J, et al. Growth, survival and reproductive performance of domesticated Australian stock of the giant tiger shrimp,Penaeusmonodon, reared in tanks and raceways [J]. J W Aqua So, 2005, 36(4):464-479.
[5] Coman G J, Amold S J, Peixoto S, et al. Reproductive performance of reciprocally crossed wild-caught and tank rearedPenaeusmonodonbroodstock [J]. Aquaculture, 2006, 252(2/4):372-384.
[6] Coman G J, Amold S J, Callaghal T R, et al. Effect of two maturation diet combination on reproductive performance of domesticatedPenaeusmonodon[J]. Aquaculture, 2007, 263(1/4):75-83.
[7] 黄建华,杨其彬,马之明,等. 池塘养殖斑节对虾的生长、发育与性成熟[J]. 水产学报,2013,37(3):397-406.
[8] Hoang T, Lee S Y, Keenan C P,et al. Maturation and spawning performance of pond-rearedPenaeusmerguiensisin different combinations of temperature, light intensity and photoperiod [J]. Aqua Res, 2002, 33(15):1243-1252.
[9] Ceballos-Vazquez B P, Rosas C, Racotta I S. Sperm quality in relation to age and weight of white shrimpLitopenaeusvannamei[J]. Aqua, 2003,228(1/4):141-151.
[10] 陈明耀,冯玉爱,梁华芳,等. 斑节对虾亲虾卵巢催熟若干问题的探讨[J]. 湛江水产学院学报,1992, 12(1):1-6.
[11] 黄建华,马之明,周发林,等. 南海北部野生斑节对虾卵巢解剖结构及组织学的研究[J]. 南方水产,2005,1(3):49-53.
[12] 黄建华,周发林,马之明,等. 南海北部斑节对虾卵巢发育的形态及组织学观察[J]. 热带海洋学报, 2006,25(3):47-52.
[13] 温为庚,黄建华,杨其彬,等. 血清素在斑节对虾催熟过程中的作用[J]. 南方水产,2009,5(1):59-63.
[14] Chotipuntu P, Wuthisuthimethayee S, Direkbusrakom S,et al.Reproductive aspects of SPFPenaeusmonodongrown in closed culture captivity[J]. Ag Tech Bios, 2013,10(3):227-236.
[15] Xu J Y, Wang T T, Wang Y F, et al. Effect of combined fish meal, soyabean meal ratio, vitamin-C, and fish oil supplementations in diet on the growth and reproduction of red shrimp, crayfish,Procambarusclarkii(Crustacea Decapoda)[J]. Aquaculture Research, 2010,41(9):252-259.
[16] Arnold S J,Coman G J, Emerenciano M. Constraints on seedstock production in eighth generation domesticatedPenaeusmonodonbroodstock[J].Aqua, 2013(410/411):95-100.
[17] Peixoto S, Coman G J, Arnold S J, et al. Histological examination of final oocyte maturation and atresia in wild and domesticatedPenaeusmonodon(Fabricius) broodstock[J]. Aqua Res, 2005, 36(7):666-673.
[18] Meeratana P, Withyachamnarnkul B, Damrongphol P,et al. Serotonin induces ovarian maturation in giant freshwater prawn broodstock,Macrobrachiumrosenbergiide Man[J]. Aqua, 2006,160 (1/2):315-325.
[19] Emerenciano M, Cuzon G, Mascaro M,et al. Reproductive performance, biochemical composition and fatty acid profile of wild-caught and 2nd generation domesticatedFarfantepenaeusduorarum(Burkenroad,1939) broodstock [J]. Aqua, 2012(344/349):194-204.
[20] Vaca A A, Alfaro J. Ovarian maturation and spawning in the white shrimp,Penaeusvannamei, by serotonin injection [J]. Aqua, 2000,182 (3/4):373-385.
[21] Wongprasert K, Asuvapongpatana S, Poltana P, et al. Serotonin stimulates ovarian maturation and spawning in the black tiger shrimp,Penaeusmonodon[J].Aqua, 2006, 261(3):1447-1454.
[22] Wouter R, Lavens P, Nieto J,et al. Penaeid shrimp broodstock nutrition: an update review on research and development[J]. Aqua, 2001,202(1/2):1-21.
[23] Arnold S J,Coman G J, Burridge C, et al. A novel approach to evaluate the relationship between measures of male fertility and egg fertilization inPenaeusmonodon[J]. Aqua, 2012(338/341):181-189.
[24] Coman G J, Arnold, S J, Callaghan T R, et al.Effect of two maturation diet combinations on reproductive performance of domesticatedPenaeusmonodon[J]. Aqua, 2007, 263(1):75-83.
[25] Ramesh B K. Improved maturation of wild and pond-reared black tiger shrimpPenaeusmonodon(Fabricius) using different combinations of live and wet feeds[J]. Asia Jour Ex, 2013,27(2):37-42.
[26] Meunpol O, Meejing P,Piyatiratitivorakul S. Maturation diet based on fatty acid content for malePenaeusmonodon(Fabricius) broodstock[J]. Aquac Res,2005,36(12):1216-1225.
[27] Glencross B, Tabrett S, Irvin S, et al. An analysis of the effect of diet and genotype on protein and energy utilization by the black tiger shrimp,Penaeusmonodon—why do genetically selected shrimp grow faster? [J]. Aqua Nut, 2013, 19(2):128-138.
[28] Coman, G J, Arnold, S J, Wood, A T, et al. Evaluation of egg and nauplii production parameters of a single stock of domesticatedPenaeusmonodon(giant tiger shrimp) across generations[J]. Aqua, 2013(400/401):125-128.
EffectsofUnilateralEyestalkAblationonOvaryDevelopmentandSpawningofCulturedTigerShrimpPenaeusmonodonwithDifferentBodyWeight
YANG Qibin, QIU Lihua, HUANG Jianhua, ZHOU Falin, WEN Weigeng
( Key Laboratory of South China Sea Fishery Resources Exploitation and Utilization, Ministry of Agriculture, South China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Guangzhou 510300, China )
The effects of unilateral eyestalk ablation on ovary development and spawning were studied in cultured tiger shrimpPenaeusmonodonwith body weight from 56.4 g to 105.4 g in 4 trials to evaluate the relationship between ovary development and spawning and body weight of cultured tiger shrimp. The results showed that ovary maturation of cultured tiger shrimp was induced by unilateral eyestalk ablation, with maturation success rate (%), significantly related to the body weight of female logarithmically (P<0.05):y=133.92lnx-535.63(r2=0.9297). The smaller female was, the lower maturation success rate was. The tiger shrimp females with eyestalk ablated spawned as early as the 10th day after ablation, some females spawning repeatedly. The fecundity was found to be significantly positively related to the body weight of female logarithmically (P<0.05):y=122.22lnx-472.2(r2=0.9738), the smaller the female was, the less egg production was. The accumulative mortality of female, egg diameter and hatching rate were not significantly related to the body weight of female. The cultured tiger shrimp females with body weight of ≥80.0 g is recommended for broodstock.
Penaeusmonodon; ovary; maturation; spawning; culture
10.16378/j.cnki.1003-1111.2016.05.010
S968.22
A
1003-1111(2016)05-0516-06
2016-01-06;
2016-04-05.
海南省重点科技计划项目(ZDXM2014057);海南省社会发展项目(SF201439).
杨其彬(1972—),男,助理研究员;研究方向:对虾遗传育种. E-mail:yangqibin1208@163.com. 通信作者:温为庚(1963—),男,副研究员;研究方向:对虾基础生物学.E-mail: wenweigeng@163.com.
