饲料中添加浒苔对仿刺参幼参生长、消化酶活性和免疫力的影响
2016-12-19郭中帅王正丽
杨 宁,郭中帅,王正丽
( 青岛农业大学 海洋科学与工程学院,山东 青岛 266109 )
饲料中添加浒苔对仿刺参幼参生长、消化酶活性和免疫力的影响
杨 宁,郭中帅,王正丽
( 青岛农业大学 海洋科学与工程学院,山东 青岛 266109 )
在水温17~18 ℃和盐度30条件下,将初始体质量为(4.09±0.26) g的仿刺参饲养在15个循环水玻璃缸(容积100 L)中,投喂在基础饲料中添加0%、3%、6%、9%和12%浒苔的饲料,于投喂后第7、14、28 d和42 d分别检测仿刺参的生长指标、消化酶(蛋白酶、淀粉酶、纤维素酶和褐藻酸酶)和体腔液免疫酶(溶菌酶、酸性磷酸酶、碱性磷酸酶和超氧化物歧化酶)的活性。试验结果表明,投喂试验饲料后第14、28 d和42 d:(1)饲料中添加6%和9%浒苔组仿刺参的特定生长率显著增加(P<0.05),在不同取样时间其他添加组仿刺参的的特定生长率与对照组差异不显著(P>0.05);(2)饲料中浒苔添加量为6%和9%试验组仿刺参的4种消化酶比活力显著高于对照组(P<0.05),其中6%组仿刺参的消化酶比活力最高;(3)饲料中浒苔添加量为6%时,仿刺参溶菌酶活力显著高于对照组及其他试验组(P<0.05);饲料中浒苔添加量为6%和9%时,仿刺参碱性磷酸酶活力和超氧化物歧化酶活力显著高于对照组及其他试验组(P<0.05);添加浒苔可以显著提高酸性磷酸酶活力,至第42 d,试验组酸性磷酸酶活力高于对照组(P<0.05),且浒苔添加量为6%时活力最高。在本试验条件下,饲料中添加浒苔可以提高仿刺参的特定生长率、消化酶活力及免疫力,浒苔的最适添加量为6%~9%。
仿刺参;饲料;浒苔;生长;消化酶;免疫力
仿刺参(Apostichopusjaponicus)具有较高的营养和药用价值,目前已成为我国北方地区重要的海水养殖对象[1-2]。随着仿刺参养殖业的发展,人工配合饲料的开发越来越引起人们的重视。大型海藻是生产仿刺参人工配合饲料的主要原料之一,因此,随着仿刺参养殖业的发展,马尾藻(Sargassum)、鼠尾藻(S.thunbergii)等大型海藻的需求量不断增加,其自然资源逐渐供不应求。因此寻求合适的替代原料成为仿刺参饲料研究中亟待解决的关键问题之一[3-4]。
浒苔(Enteromorphaprolifera)含有丰富的蛋白质、脂肪酸、氨基酸及矿物质等多种营养物质,是一种重要的经济海藻,目前已作为新的饲料资源受到广泛关注[5-7]。有效开发利用浒苔资源,将其转化为有开发价值的经济藻类具有重要意义。
浒苔作仿刺参饲料的可行性已有研究[8-12],然而未给出适宜的添加量。本试验以青岛地区加工后的浒苔为原料,部分替代仿刺参饲料中的鼠尾藻,研究其对仿刺参生长、消化酶活力及免疫力的影响,确定浒苔在仿刺参饲料中的适宜添加量,为浒苔在仿刺参饲料中的合理开发和利用提供参考。
1 材料与方法
1.1 材料
试验用浒苔采自青岛附近海域,洗净沥干烘干、粉碎成粉状,其粗蛋白含量约11.2%,粗纤维含量约6.7%,粗脂肪含量约1.5%,钙1.55%,总氨基酸含量9.58%,必需氨基酸种类齐全,占总氨基酸的43%,呈味氨基酸占总量的56%以上[13]。
试验用仿刺参来自日照某养殖场,体质量为(4.09±0.26) g,在室内暂养7 d后,随机分配到室内海水循环系统中的15个玻璃缸(容积100 L)中。
试验用基础饲料以俄罗斯白鱼粉为主要蛋白源,鱼油、豆油和大豆卵磷脂为主要脂肪源,总蛋白含量约为19.6%,脂肪含量约为4.7%。试验设计5种等氮等能的饲料,浒苔添加量分别为0%、3%、6%、9%和12%,其组成和营养成分见表1。原料经粉碎后过150目筛,按比例逐级混匀,最后按1∶5与海泥混合。

表1 试验饲料组成 %
1.2 试验设计与饲养管理
试验共设置5个处理,每个处理设3个重复,每缸放30个仿刺参。试验用海水符合中华人民共和国渔业水质标准(GB 11607—89),水温17~18 ℃,pH 8.2±0.2,盐度30。养殖试验持续50 d,初始投饲量为仿刺参体质量的5%,根据仿刺参摄食情况饱食投喂,每日早晚各投喂1次,每日上午定时吸污,每3 d更换一次海水,换水量约50%。
1.3 样品采集与测定
试验开始后分别在第7、14、28 d和42 d测定各组仿刺参的生长,取样测定消化酶活力及免疫酶活力。取样前仿刺参饥饿24 h,每个试验组随机选取5头仿刺参进行体质量测定及粗酶液制备。
1.3.1 体质量测定
用捞网沥净仿刺参水分,在干滤纸上放置30 s后快速称量。为减少操作误差,测定过程中由同一固定人员完成。计算特定生长率:
特定生长率/%·d-1=(lnmt-lnm0)/t×100%
式中,mt为仿刺参终末平均体质量(g),m0为仿刺参初始平均体质量(g),t为试验时间(d)。
1.3.2 免疫酶
仿刺参取出后,于腹部切口,用1 mL无菌注射器收集体腔液,3000 r/min离心5 min(4 ℃),取上清液于4 ℃保存备用,24 h内测定完毕。
溶菌酶、酸性磷酸酶、碱性磷酸酶和超氧化物歧化酶的活性均使用南京建成生物科技有限公司生产的试剂盒进行测定。
溶菌酶活性用溶菌酶含量来表示(μg/mL);酸性磷酸酶活性单位定义为:100 mL体腔液在37 ℃每克蛋白30 min 产生1 mg酚为1 个酶活性单位(U);碱性磷酸酶活性单位定义为:100 mL体腔液在37 ℃与基质作用15 min产生1 mg酚为1 个活力单位(U);超氧化物歧化酶活性单位定义为:每毫升反应液中超氧化物歧化酶抑制率达到50%时所对应的超氧化物歧化酶量为一个超氧化物歧化酶活力单位(U)。
1.3.3 消化酶
剖开仿刺参腹部,取出消化道,剔除肠系膜上的脂肪组织,用预冷的磷酸盐缓冲液(pH 7.5)冲洗干净,-20 ℃保存备用。取10条肠,按肠质量的10倍加入预冷的磷酸盐缓冲液,0 ℃匀浆。将匀浆液于4 ℃,10 000 r/min,离心30 min,所得上清液即为粗酶液, 4 ℃保存备用,24 h内测定完毕。
蛋白酶活力采用酪蛋白为底物的福林—酚法测定,40 ℃,每分钟水解酪蛋白产生1 μg酪氨酸定义为一个酶活力单位(U)。
淀粉酶活力采用以可溶性淀粉为底物的3,5-二硝基水杨酸显色法测定,40 ℃,每分钟催化淀粉产生1 mg麦芽糖定义为一个酶活力单位(U)。
纤维素酶活力采用以羧甲基纤维素钠为底物的3,5-二硝基水杨酸显色法测定,40 ℃,每分钟催化纤维素产生1 mg葡萄糖定义为一个酶活力单位(U)。
褐藻酸酶活力采用以褐藻酸钠为底物的3,5-二硝基水杨酸显色法测定,40 ℃,每分钟催化褐藻酸酶产生1 mg葡萄糖定义为一个酶活力单位(U)。
1.4 数据分析
所有数据使用SPSS 18.0进行单因素方差分析,并进行Duncan多重比较,P<0.05为差异显著。
2 结 果
2.1 浒苔添加量对仿刺参生长的影响
经过6周的养殖试验,各饲料组仿刺参在不同时间的特定生长率见图1。结果显示,除投喂试验饲料7 d外,饲料中添加浒苔均显著影响仿刺参的特定生长率(P<0.05)。第14 d时,浒苔添加量为6%组仿刺参的特定生长率显著高于其他各组(P<0.05)。随着养殖时间的增加,第28 d和42 d时,浒苔添加量为6%和9%组仿刺参的特定生长率均显著高于其他各组(P<0.05),其他组间差异不显著(P>0.05),其中浒苔添加量为6%组的特定生长率显著高于9%组(P<0.05)。
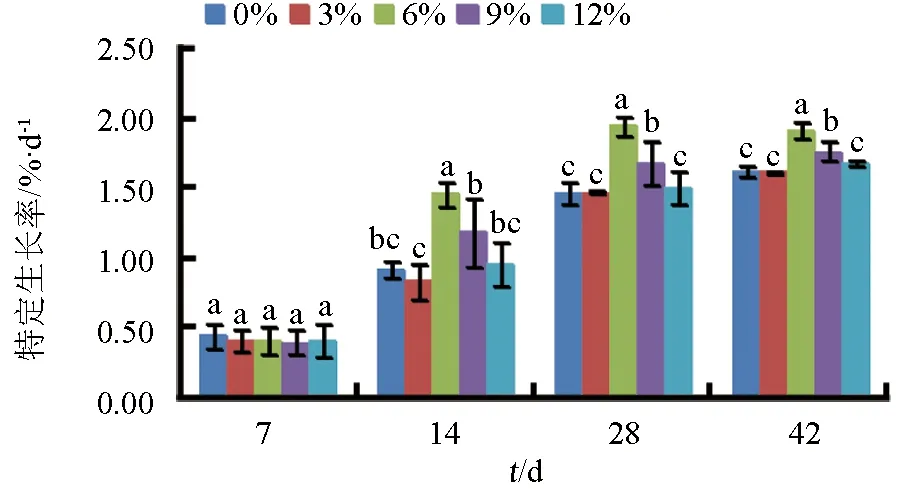
图1 浒苔添加量对仿刺参特定生长率的影响
2.2 浒苔添加量对仿刺参消化道消化酶活力的影响
2.2.1 浒苔添加量对仿刺参淀粉酶比活力的影响
随着养殖时间的增加(第14、28、42 d),饲料中浒苔添加量对淀粉酶比活力影响显著(P<0.05)(图2),其中6%添加组淀粉酶比活力最高,9%添加组次之,在第28 d和42 d时均显著高于对照组(P<0.05); 其他添加组与对照组间差异不显著(P>0.05)。

图2 浒苔添加量对仿刺参消化道淀粉酶比活力的影响
2.2.2 浒苔添加量对仿刺参蛋白酶比活力的影响
随着养殖时间的增加(第14、28、42 d),饲料中浒苔添加量显著影响仿刺参消化道蛋白酶比活力(P<0.05)(图3);6%和9%添加组的仿刺参蛋白酶比活力显著高于其他各组(P<0.05),添加量为6%组仿刺参的蛋白酶比活力最高。

图3 浒苔添加量对仿刺参蛋白酶比活力的影响
2.2.3 浒苔添加量对仿刺参纤维素酶比活力的影响
第14 d,添加6%浒苔组仿刺参消化道纤维素酶比活力显著高于其他添加组(P<0.05)(图4);第28 d和42 d,浒苔6%和9%添加组仿刺参的纤维素酶比活力显著高于其他各组(P<0.05),浒苔添加量为6%组仿刺参的蛋白酶比活力最高。

图4 浒苔添加量对仿刺参纤维素酶比活力的影响
2.2.4 浒苔添加量对仿刺参褐藻酸酶比活力的影响
第14、28、42 d,饲料中添加6%、9%和12%的浒苔,显著增加仿刺参褐藻酸酶比活力(P<0.05),添加量为6%组仿刺参的褐藻酸酶比活力最高(P>0.05)(图5)。

图5 浒苔添加量对仿刺参褐藻酸酶比活力的影响
2.3 浒苔添加量对仿刺参免疫酶活力的影响
2.3.1 浒苔添加量对仿刺参溶菌酶活力的影响
在第14、28、42 d,浒苔添加量这6%组仿刺参溶菌酶活力显著高于对照组及其他组(P<0.05)(图6),第14 d活力最强;添加浒苔9%组在第14 d显著高于对照组(P<0.05),至第42 d与其他各组及对照组差异不显著(P>0.05)。
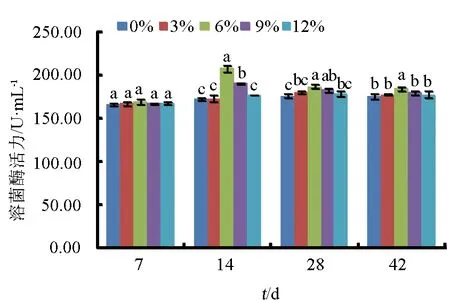
图6 浒苔添加量对仿刺参体腔液溶菌酶活力的影响
2.3.2 浒苔添加量对仿刺参酸性磷酸酶活力的影响
在第14 d,饲料中添加6%和9%浒苔组仿刺参酸性磷酸酶活力显著增加(P<0.05)(图7);在第28 d和42 d,对照组的酸性磷酸酶活力显著低于添加6%、9%和12%浒苔组(P<0.05)。
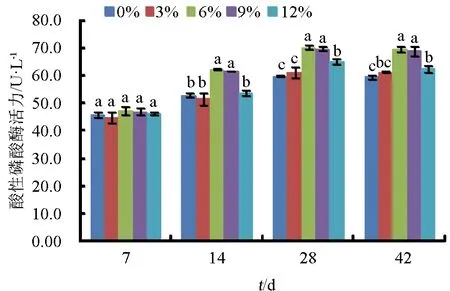
图7 浒苔添加量对仿刺参体腔液酸性磷酸酶活力的影响
2.3.3 浒苔添加量对仿刺参碱性磷酸酶活力的影响
在第14、28、42 d,添加6%和9%组仿刺参碱性磷酸酶活力均显著高于对照组和其他添加组(P<0.05)(图8)。

图8 浒苔添加量对仿刺参体腔液碱性磷酸酶活力的影响
2.3.4 浒苔添加量对仿刺参超氧化物歧化酶活力的影响
在第14 d和第28 d时, 饲料中添加6%、9%和12%浒苔组仿刺参体腔液超氧化物歧化酶活力显著增加(P<0.05, 图9),其中添加6%组超氧化物歧化酶活力最高,第42 d时,添加12%浒苔组的超氧化物歧化酶活力与对照组差异不显著(P<0.05)。

图9 浒苔添加量对仿刺参体腔液超氧化物歧化酶活力的影响
3 讨 论
3.1 浒苔对仿刺参生长的影响
浒苔是高蛋白、高膳食纤维、低脂肪、低能量,富含矿物质和维生素的天然理想营养食品原料[17],作为饲料加工原料,已广泛受到关注。现有研究表明,适量添加浒苔能提高蛋鸡的产蛋率、产蛋性能,降低蛋黄中胆固醇含量[18-22];提高肉鸡平均日增加质量及免疫力等[23-24];亦有显著增进猪、兔、奶牛生长的作用[25-27]。浒苔作为饲料原料,可以提高大菱鲆(Scophthalmusmaximus)、大黄鱼(Pseudosciaenacrocea)、黄斑蓝子鱼(Siganusoramin)的特定生长率[28-31]。而现有研究显示,浒苔含有大量的营养成分,可以替代或部分替代鼠尾藻等作为仿刺参的饲料原料[8-11]。朱建新等[12]用蛋白酶处理浒苔后能够显著提高仿刺参的生长率,认为用适当的方法加工后浒苔可以作为仿刺参的良好饲料。而本试验以浒苔部分替代鼠尾藻作仿刺参的饵料,不会降低仿刺参的特定生长率,这与之前的研究结果一致,因此浒苔可以作为仿刺参的良好饲料源,且浒苔添加量为6%~9%时,可以显著提高仿刺参的特定生长率。
3.2 浒苔对仿刺参消化道消化酶活力的影响
消化酶活性的高低直接影响动物对营养物质的吸收,与水产动物的生长和发育紧密相关[32-33]。常用消化酶的种类和活力来判断动物的摄食活力、食物来源以及动物对这种食物的适应性等[34-35]。蛋白酶、淀粉酶、纤维素酶、褐藻酸酶等是仿刺参的主要消化酶[36]。不同发育阶段和季节仿刺参消化酶活力不同[37-38],不同食物来源和不同营养物质也可影响消化酶的分泌。仿刺参的生长速率越快,其肠道消化酶的活性越高[39]。浒苔中富含多种生物活性物质,氨基酸组成合理,具有独特的芳香气味,可作为水产动物的诱食剂[17]。本研究测定了仿刺参重要的消化酶——蛋白酶、淀粉酶、纤维素酶和褐藻酸酶,显示添加6%~9%浒苔量可以显著提高各消化酶的比活力,其他添加组与对照组相比无显著差异,这一结果与特定生长率结果一致。
3.3 浒苔对仿刺参体腔液免疫酶活力的影响
浒苔无毒无害,含有丰富的蛋白质、多糖及其复合物,有关浒苔及其提取物对脊椎动物及无脊椎动物动物免疫力的影响已有研究,结果显示,浒苔及其提取物可以增强机体的免疫力和抗氧化功能[40-42]。
非特异性免疫在仿刺参免疫防御中具有重要的作用,而各种免疫酶类是非特异性免疫的重要组成部分。溶菌酶、超氧化物歧化酶、酸性磷酸酶和碱性磷酸酶是近年来评价仿刺参机体免疫力的常用指标[43-44]。现有研究表明,这些酶类在识别异物、增强吞噬细胞的吞噬能力、消除异物、促进新陈代谢、提高免疫力和抗氧化能力等方面起重要作用[43-45]。本试验中,添加6%和9%浒苔时,仿刺参各免疫酶活力显著提高,免疫力增强;而其他浒苔添加组各免疫酶活力与对照组差异不显著,即对免疫能力无明显的促进作用,这与唐薇等[46]的研究结果一致。唐薇等[46]在饲料中添加30%浒苔粉后,仿刺参的免疫能力无显著提高,成活率与对照组相比并无提高。由此,笔者认为,浒苔的适宜添加量为6%~9%。
[1] 廖玉麟.我国的海参[J].生物学通报,2001,35(9):1-3.
[2] 袁秀堂,杨红生,周毅,等.盐度对刺参(Apostichopusjaponicus)呼吸和排泄的影响[J].海洋与湖沼,2006,37(4):348-354.
[3] 袁成玉.海参饲料研究的现状与发展方向[J].水产科学,2005,24(12):54-56.
[4] 唐黎,王吉桥,程骏驰,等.海参饲料使用和发展方向[J].饲料工业,2007, 28(22):22-23.
[5] 徐大伦,黄晓春,杨文鸽,等. 浒苔营养成分分析[J].浙江海洋学院学报,2003, 22(4):318-320.
[6] 孙文,张国琛,李秀辰,等.浒苔资源利用的研究进展及应用前景[J].水产科学,2011,30(9):588-590.
[7] 罗佳捷,肖淑华,张彬,等. 浒苔的研究进展及其在动物生产中的应用[J].资源开发,2014(2):31-34.
[8] 廖梅杰,郝志凯,尚德荣,等. 浒苔营养成分分析与投喂刺参试验[J]. 渔业现代化,2011,38(4):32-36.
[9] 郭娜,董双林,刘慧. 几种饲料原料对刺参幼参生长和体成分的影响[J].渔业科学进展,2011,32(1):122-128.
[10] 刘天红,吴志宏,王颖,等.浒苔作为仿刺参幼参植物饲料源的可行性研究[J].水产科学,2013,32(10):597-600.
[11] 李晓,王颖,吴志宏,等.浒苔对刺参幼参影响的初步研究[J].中国水产科学,2013,20(5):1092-1099.
[12] 朱建新,曲克明,李健,等.不同处理方法对浒苔饲喂稚幼刺参效果的影响[J].渔业科学进展,2009,30(5):108-112.
[13] 林英庭,朱风华,徐坤,等. 青岛海域浒苔营养成分分析与评价[J].饲料工业,2009,30(3):46-49.
[14] 潘鲁青,王克行.中国对虾幼体消化酶活力的实验研究[J].水产学报,1997,21(1):26-31.
[15] 史峰.生物化学实验[M].杭州:浙江大学出版社,2002:11-113.
[16] 赵亚华.生物化学实验技术教程[M].广州:华南理工大学出版社,2000:144-159.
[17] 林文庭.浅谈浒苔的开发与利用[J].中国食物与营养,2007(9):23-25.
[18] 王述柏,贾玉辉,王利华,等.浒苔添加水平对蛋鸡产蛋性能、蛋品质、免疫功能及粪便微生物区系的影响[J].动物营养学报,2013,25(6):1346-1352.
[19] 赵军,林英庭,孙建凤,等.饲粮中不同水平浒苔对蛋鸡蛋黄品质、抗氧化能力和血清生化指标的影响[J].动物营养学报,2011,23(3):452-458.
[20] 张威,苏秀榕,邓亮亮,等.浒苔和江蓠对仙居鸡产蛋性能的影响[J].畜牧与兽医,2009,41(7):46-48.
[21] 苏秀榕,张威,李妍妍,等.浒苔和江蓠增强仙居鸡抗性的研究[J].家畜生态学报,2010,31(3):27-29.
[22] 位孟聪,王卫,战新强,等.青岛海域野生浒苔对蛋鸡生产性能影响的试验研究[J].中国畜牧杂志,2013,49(16):58-60.
[23] 孙建凤,赵军,祁茹,等.日粮中浒苔添加水平对肉鸡免疫功能和血清生化指标的影响[J].动物营养学报,2010,22(3):682-688.
[24] 王述柏,史雪萍,周传凤,等.浒苔添加水平对肉鸡生产性能、胴体品质及小肠消化酶活性的影响[J].动物营养学报,2013,25(6):1332-1337.
[25] 林英庭,宋春阳,薛强,等.浒苔对猪生长性能的影响及养分消化率的测定[J].饲料研究,2009(3):47-49.
[26] 孙国强,胡昌军,李国兴,等.浒苔粉对奶牛产奶性能及粪便微生物菌群的影响[J].畜牧与兽医,2010,42(6):54-56.
[27] 周蔚,徐小明,嵇珍,等.浒苔用作肉兔饲料的研究[J].江苏农业科学,2001(6):68-69.
[28] 周胜强,游翠红,王树启,等.饲料中添加浒苔对黄斑蓝子鱼生长性能与生理生化指标的影响[J].中国水产科学,2013,20(6):1257-1265.
[29] 梁萌青,姚健,常青,等.以绿藻浒苔作为大菱鲆诱食剂的制备方法:中国,200810249651.9[P]2009-06-17.
[30] Asino H, Ai Q H, Mai K S. Evaluation ofEnteromorphaproliferaas a feed component in large yellow croaker (Pseudosciaenacrocea, Richardson, 1846) diets[J]. Aqu Res, 2011,42(4):525-533.
[31] Yousif O M, Osman M F, Anawhi A R, et al. Growth response and carcass composition of rabbitfishSiganuscanaliculatus(Park) fed diet supplemented with dried seaweed,Enteromorphasp[J]. Emir J Agric Sci, 2004(16):18-26.
[32] 聂琴,杨凡,万龙飞,等.饲料中添加酵母对刺参肠道消化酶活性和超导微生物的影响[J].中国饲料,2014(17):42-44.
[33] 倪小英,张永普,贾守菊,等.pH和温度对小荚蛏淀粉酶和纤维素酶活性的影响[J].海洋湖沼通报,2009,31(1):151-154.
[34] Harris R P, Samain J F, Martin-Jézéquel V, et al. Effects of algal diet enzyme activity inCalanushelgolandicus[J]. Mar Biol, 1986(90):353-361.
[35] Hirche H. Spatial distribution of digestive enzyme activities ofCalanusfinmarchicusandC.hyperboreusin Farm/Greenland sea[J]. J Plankton Research, 1989, 11(3):431-443.
[36] 王羽,孙永欣,汪婷婷,等.海参消化酶的研究进展[J].中国饲料,2008(13):38-41.
[37] 唐黎,王吉桥,许重,等.不同发育期的幼体和不同规格刺参消化道中4种消化酶的活性[J].水产科学,2007,26(5):275-277.
[38] 王吉桥,唐黎,许重,等.仿刺参消化道的组织学及其4种消化酶活力的周年变化[J].水产科学,2007,26(9):481-484.
[39] 张洪彩,朱江艳,陈政强,等.不同规格刺参消化酶活性差异性研究[J].泉州师范学院学报,2014,32(2):27-30.
[40] 王怀禹.海藻在畜禽养殖业中的应用[J]. 养殖与饲料,2009(4):23-25.
[41] 徐大伦,黄晓春,欧昌荣,等.浒苔多糖对非特异性免疫功能的体外实验研究[J].食品科学,2005,26(10):233-235.
[42] 徐大伦,黄晓春,欧昌荣,等.浒苔多糖对华贵栉孔扇贝血淋巴中SOD酶和溶菌酶活性的影响[J].水产科学,2006,25(2):72-74.
[43] 孙永欣,王吉桥,汪婷婷,等.海参防御机制的研究进展[J].水产科学,2007,26(6):358-361.
[44] 常杰,牛化欣,张文兵.刺参免疫系统及其免疫增强剂评价指标的研究进展[J].中国饲料,2011(6):8-12.
[45] Zhang R Q, Chen Q X, Zheng W Z, et al. Inhibition kinetics of green crab (Scyllaserrata) alkaline phosphatase activity by dithiothreitol or 2-mercaptoethanol[J]. Int J Biochem Cell Biol, 2000,32(8):865-872.
[46] 唐薇,王庆吉,张蕾,等.不同藻粉对刺参组织免疫性能和体壁成分的影响[J].资源开发与市场,2014,30(8):905-908.
EffectsofDietaryGreenLaverEnteromorphaproliferaonGrowth,ActivityofDigestiveEnzymesandImmunityinSeaCucumberApostichopusjaponicus
YANG Ning, GUO Zhongshuai, WANG Zhengli
( College of Marine Science and Engineering, Qingdao Agricultural University, Qingdao 266109, China )
A 6-week feeding experiment was conducted to evaluate the effects of dietary green laverEnteromophaproliferaon growth, activities of digestive enzymes and immunity in sea cucumberApostichopusjaponicuswith initial body weight of (4.09±0.26) g. The sea cucumber juveniles were reared in 15 tanks of each 100 L in volume with recycling water and fed the diets containing 0%, 3%, 6%, 9% and 12% of green laver powder at water temperature of 17—18 ℃ and a salinity of 30. The specific growth rate, and activities of digestive enzymes including protease, amylase, cellulase, and alginase and immune enzymes including lysozyme, acid phosphatase, alkaline phosphatase and superoxide dismutase were analyzed 7, 14, 28 and 42 days after the sea cucumber were fed different diets. The results showed that there were significantly increase in specific growth rate in the sea cucumber fed the diets supplemented with 6% and 9% green laver on the days 14, 28 and 42 (P<0.05), without significant differences among other groups compared with control group (P>0.05). Compared with the control group, there were significantly higher activities of the digestive enzymes in the sea cucumber fed the diets containing 6% and 9% of green laver (P<0.05), the maximum in the sea cucumber fed the diets containing 6% of green laver (P<0.05). The sea cucumber fed the diet supplemented with 6% of green laver had significantly higher activities of lysozyme, acid phosphatase and superoxide dismutase than the juveniles in other groups (P<0.05). It is concluded that dietary green laver leads to significant increase in specific growth, activities of digestive enzymes and immunity of sea cucumber, with the optimal supplementation of 6%—9% under the present experimental conditions.
Apostichopusjaponicus; diet;Enteromorphaprolifera; growth; digestive enzyme; immunity
10.16378/j.cnki.1003-1111.2016.05.007
S968.9
A
1003-1111(2016)05-0498-06
2015-05-08;
2016-04-29.
青岛市关键技术攻关计划项目(12-6-1-7-hy).
杨宁(1977—),女,讲师;研究方向:水产动物免疫学.E-mail:yangning04@163.com.通讯作者:王正丽(1977—),女,教授,硕士生导师;研究方向:水产动物营养与饲料.E-mail: zhengliwang2004@163.com.
