基因多态性与药品不良反应的相关性Δ
2016-12-19孙雪林徐巧玲北京医院药学部国家老年医学研究中心药物临床风险与个体化应用评价北京市重点实验室北京00730解放军第305医院药局北京0007
孙雪林,胡 欣,徐巧玲(.北京医院药学部/国家老年医学研究中心/药物临床风险与个体化应用评价北京市重点实验室,北京 00730;2.解放军第305医院药局,北京 0007)
·精准医疗·
基因多态性与药品不良反应的相关性Δ
孙雪林1*,胡欣1,徐巧玲2#(1.北京医院药学部/国家老年医学研究中心/药物临床风险与个体化应用评价北京市重点实验室,北京100730;2.解放军第305医院药局,北京100017)
目的:为临床精准用药、预防和减少药品不良反应(ADR)的发生提供参考。方法:收集近年来国内外有关药物基因组学与ADR的研究文献,对基因多态性与ADR的相关性进行归纳和总结。结果与结论:目前已发现多种ADR相关基因。人类白细胞抗原基因多态性与双氯芬酸、阿莫西林克拉维酸钾等药物致肝损伤,卡马西平、阿巴卡韦等药物致皮肤过敏反应有关;肝脏药物转运体1B1基因多态性与他汀类药物致肌病有关;N-乙酰基转移酶2基因多态性与异烟肼致肝损伤有关;一氧化氮合酶1调酶基因、心脏钠离子通道5A基因和钾离子通道E1基因多态性与药物致QT间期延长有关等。基因多态性研究可为预防ADR提供新的参考依据,临床可在药物治疗前对患者进行基因型检测,以降低ADR的发生率。
药品不良反应;药物基因组学;基因多态性;精准用药
药品不良反应(Adverse drug reaction,ADR)增加了患者在用药过程中非疾病因素导致的发病率和病死率,轻者影响药物治疗、延长病程、增加患者经济负担,重者则对患者生命安全造成威胁,目前已成为全球高度关注的公共卫生问题[1-2]。2015年全国药品ADR监测网络共收到ADR/不良事件报告表139.8万份,较2014年增长5.3%,新的和严重ADR/不良事件报告数量占同期报告总数的28.2%[3]。ADR可影响机体肝脏、心脏、皮肤和肌肉等多个器官和组织,有的药品甚至还可引发更广泛的过敏反应。严重的ADR主要表现为肝脏毒性和心脏毒性。其中,药物引起的肝脏毒性表现为肝细胞损伤和胆管细胞膜损伤所致的胆汁淤积,约10%肝毒性ADR可进展为肝衰竭,对患者生命安全造成严重威胁[4];而药物引起的心脏毒性则主要表现为心脏复极延迟,心电图检测示QT间期延长,引起室颤,最终导致患者死亡[5]。
药物基因组学(Pharmacogenomics,PGx)是研究基因多态性如何影响药物治疗的反应性和治疗过程中遗传变异与ADR风险的关联性的一门学科。PGx可确定药物的作用和遗传因素间的相关性,并以此来减少ADR的发生。例如,服用伯氨喹导致的溶血反应是由于患者缺乏葡萄糖-6-磷酸脱氢酶(G6PD)[6],而卡马西平引起的中毒性表皮坏死溶解症(TEN)和Steven-Johnson综合征(SJS)则与人类白细胞抗原(Human leukocyte antigen,HLA)-B*1502等位基因密切相关[7]。
本文通过收集近年来国内外有关PGx与ADR的研究文献,对基因多态性与ADR的相关性进行了归纳和总结,为提高药物治疗效果、减少患者开支、预防严重ADR/不良事件的发生提供借鉴,为临床精准用药提供参考。
1 HLA与药物性肝损伤、过敏反应和皮疹
HLA是人类白细胞抗原的简称,编码基因是人类主要组织相容性复合体,与人类免疫系统的功能密切相关。HLA基因位于第6号染色体短臂6p21.3区域,长度为3.6×106bp。根据其在染色体上的排列可分为3个区域:Ⅰ类基因区包括HLA-A、HLA-B和HLA-C;Ⅱ类基因区包含HLA-DR、HLADP和HLA-DQ;Ⅲ类基因区位于上述2个基因区之间,为补体系统,包括C2和C4。HLA基因多态性与药物性肝损伤、SJS和TEN等相关,可作为某些ADR的风险预测因子。
1.1HLA与药物性肝损伤
目前临床应用的许多药物均会引起药物性肝损伤,发生概率约为1/10 000[8],发生机制可能与药物对肝脏细胞的直接毒性有关,包括氧化应激和细胞损伤等,给肝细胞带来直接伤害[9]。日本首先报道了血清Ⅱ型HLA-DR2与药物性肝损伤的关系。在发生黄疸的患者中,DR2血清分型的检出率达58.3%;在药物性肝损伤引发黄疸的患者中,DR2单倍体的频率为0.236,与对照组比较差异有统计学意义(P<0.004 2)[10]。此外,血清Ⅰ型HLA-A11与三环类抗抑郁药和双氯芬酸相关,其引发肝炎的概率分别为50%和75%;血清Ⅱ型HLA-DR6与氯丙嗪相关,在氯丙嗪所致肝炎患者中HLA-DR6的检出率高达80%[11]。
目前,研究HLA与药物性肝损伤的相关性主要是利用患者的基因分型。第一个被发现HLA基因分型与药物性肝损伤相关的药物是阿莫西林克拉维酸钾。这种损伤和经典的免疫反应不同,其与HLA-DR B1*1501编码的血清HLA-DR2蛋白有关[12]。相关性最强的是抗菌药物氟氯西林与Ⅰ型HLA-B* 5701基因,同时该基因也与阿巴卡韦引起的过敏反应高度相关[13-14]。HLA与ADR的相关性见表1。
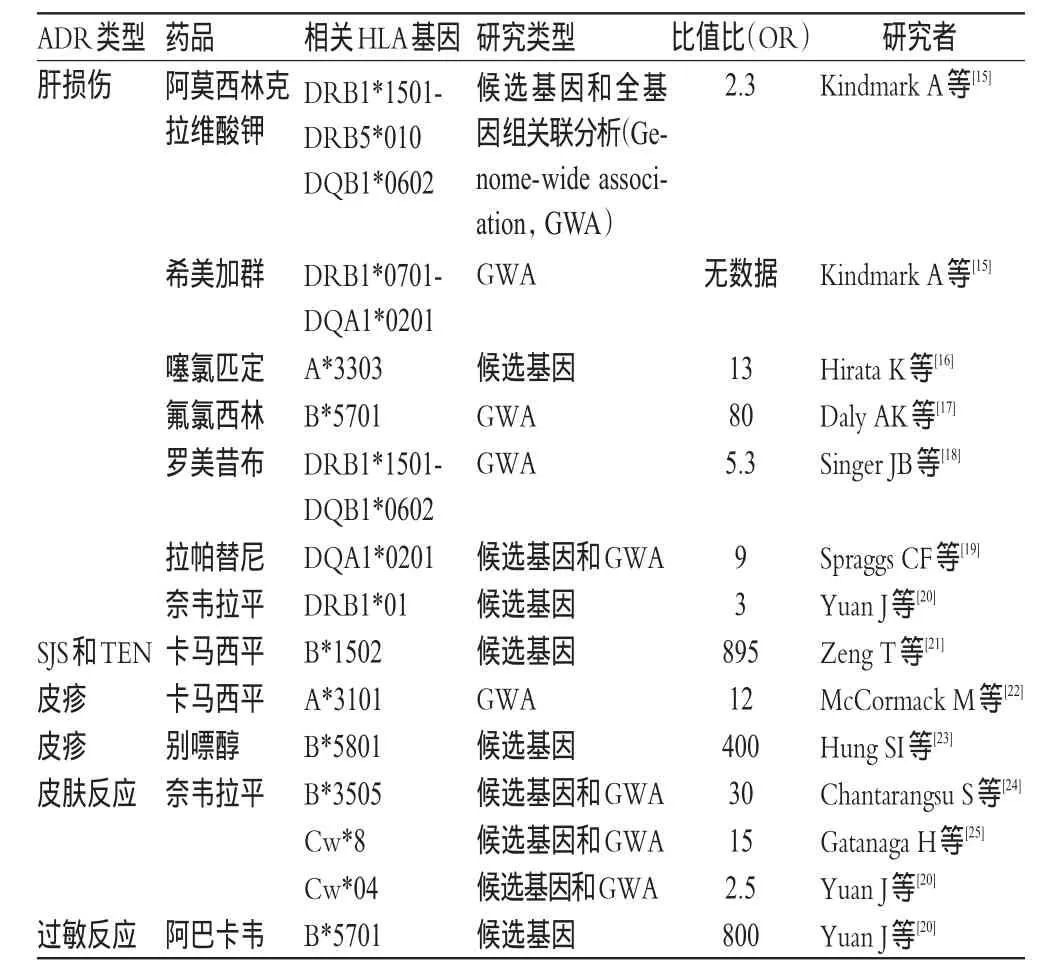
表1 HLA与ADR的相关性Tab 1 Correlation between HLAandADR
1.2HLA与皮肤过敏反应
ADR引起的皮肤过敏反应可分为速发型和迟发型反应。速发型反应主要由免疫球蛋白(Ig)E介导,涉及的遗传因素尚不明确。迟发型过敏反应的皮肤表现个体差异较大,停药后皮肤症状可立即改善。该类过敏反应还可涉及其他组织和器官,表现为发热和嗜酸性粒细胞增多,甚至可引发严重的皮疹(包括SJS和TEN)。相关研究表明,T细胞与药物引起的迟发型皮肤过敏反应有关[26]。由HLA基因编码的人类白细胞抗原提呈抗原给T细胞,故其基因多态性可能与迟发型过敏反应相关。
1.2.1卡马西平与皮肤过敏卡马西平致ADR的相关基因多态性首次在台湾人群中被报道,该药引发的SJS和HLA-B* 1502高度相关[27]。HLA-B*1502位点的突变在我国汉族及泰国、马来西亚、印度尼西亚、菲律宾和印度南部等种族人群中普遍存在,建议以上人群在服用卡马西平之前检测HLA-B* 1502基因位点是否存在变异,以减少皮肤过敏反应的发生[7];由于HLA-B*1502基因在其他人群中突变频率较低,暂不推荐其他人群检测。
1.2.2阿巴卡韦与皮肤过敏抗人类免疫缺陷病毒(Human immunodef iciency virus,HIV)药阿巴卡韦引起的ADR主要表现为皮疹、呼吸道和胃肠道症状,其症状一般较轻,且停药后即可缓解,但若再次服药则会引发严重症状,有些甚至是致命的。HLA-B*5701和阿巴卡韦致过敏反应的相关性在19个国家1 956例患者的双盲、随机、对照试验中得到证实,HLA-B* 5701在试验人群中有5.6%的携带率,94%的患者服用阿巴卡韦发生过敏反应的风险较低;但在发生过敏反应的患者中,47.9%的患者携带HLA-B*5701[28]。表明HLA-B*5701可能与阿巴卡韦致过敏反应有关,该基因型的检测可能有助于降低阿巴卡韦致过敏反应的发生率,因此建议在服用阿巴卡韦前应对患者进行HLA基因型检测。
1.2.3致皮肤过敏的其他ADR别嘌呤醇引起的SJS、TEN或其他轻度的皮肤过敏反应和HLA-B*5801基因位点相关,该位点首先在我国台湾人群中被发现,且在我国汉族人群中的关联性也较强[23,29]。在别嘌醇所致的皮疹患者中,有95%的患者携带HLA-B*5801,而未发生皮疹的患者中携带该基因的比例仅为12%[OR=127.6,95%置信区间(CI)(40.8,398.6)][29],表明HLA-B*5801可能与别嘌醇致皮肤过敏有关,建议在服用该药前进行HLA-B*5801多态性位点检测。在欧洲人群中同样发现了该位点与ADR的相关性[30]。抗HIV病毒药奈韦拉平常见的ADR也是皮肤反应,严重程度因人而异。在萨丁和日本人群中,奈韦拉平致皮疹与HLA Cw*8相关[25,31];在泰国人群中,与HLA-B*3505相关[32];在欧洲、亚洲和非裔美国人群中,与HLACw*04相关[20]。
2 引起ADR的其他基因多态性
除HLA基因多态性与ADR相关外,还有一些其他遗传因素与ADR有关,包括影响药物体内代谢过程、先天免疫系统和心脏离子通道的相关基因及其多态性。
2.1药物体内代谢相关基因及其多态性
目前已发现肝脏药物转运体1B1基因(SLCO1B1)多态性和他汀类药物所致肌病、N-乙酰基转移酶2基因(NAT2)多态性和异烟肼所致药物性肝损伤有关,其他与ADR相关的基因还包括三磷酸腺苷结合盒转运体(ABC)和糖基转移酶(UGT)等基因,详见表2。
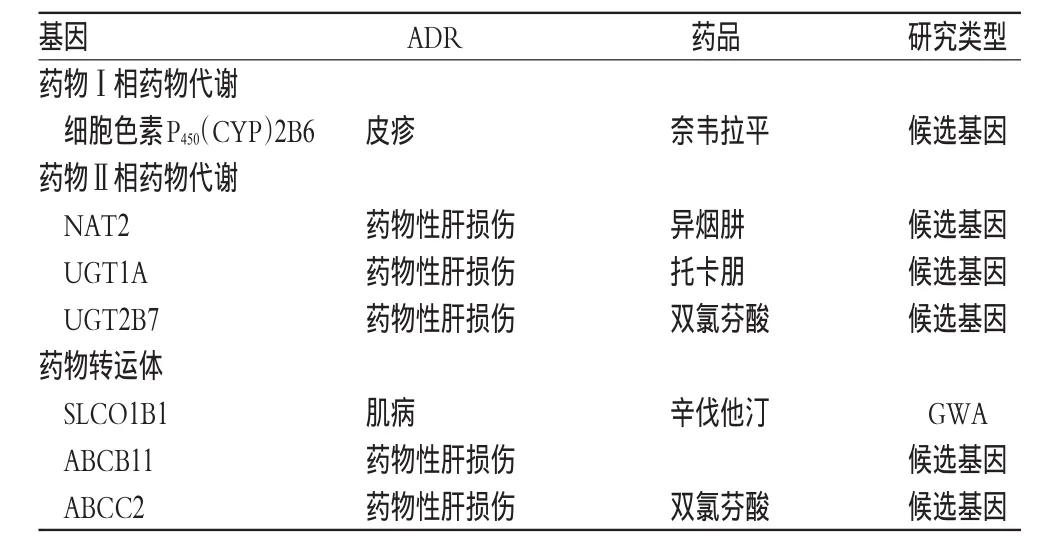
表2 药物体内代谢相关基因及其多态性与ADRTab 2 Drug metabolism-related gene and its polymorphisms andADR
他汀类药物是目前最有效的调脂药,主要ADR为肌肉毒性,通常表现为无症状的血清肌酸激酶水平升高,严重的可引发横纹肌溶解症,甚至导致死亡[33]。有文献报道,辛伐他汀引起的肌肉酸痛等ADR与SLCO1B1基因多态性有关,SLCO1B1在肝脏细胞中编码转运蛋白[34],后者将外周血中的药物转运到肝脏细胞中进行代谢。SLCO1B1*5/*15基因突变可延长药-时曲线下面积(AUC),使转运蛋白合成受损,导致他汀类药物代谢受阻,血药浓度升高,ADR发生率增加。但SCLO1B1*5/*15基因多态性在预测不同种类他汀类药物的ADR时有较大差异,影响最大的为辛伐他汀,其次为匹伐他汀和阿托伐他汀[35]。
CYP2B6是代谢奈韦拉平的酶类,516G>T的突变可降低该酶催化奈韦拉平及其代谢物的能力,增加皮疹发生的风险[20]。NAT2基因编码N-乙酰基转移酶2,在异烟肼代谢过程中发挥着重要的作用。异烟肼经过代谢后生成乙酰肼,可进一步被CYP或NAT2代谢为毒性更低的二乙酰基肼。若NAT2酶活性正常,异烟肼可被代谢为二乙酰基肼,发生ADR的概率将大大降低;若NAT2等位基因发生纯合突变,其酶活性将明显降低,则异烟肼无法被代谢,发生药物性肝损伤等ADR的概率将明显增加[36]。
此外,与药物性肝损伤相关的还有UGT基因多态性。UGT1A6基因与托卡朋引起的转氨酶升高相关[37];UGT2B7基因多态性位点与双氯芬酸引起的肝毒性有关[38]。ABC家族除了转运药物之外还负责胆汁的转运,因此ABCB4(编码MDR3蛋白,磷脂输出泵)和ABCB11(编码BSEP蛋白,胆盐输出泵)基因突变后会导致胆汁淤积[39]。ABCC2(编码MRP2蛋白,多药耐药相关蛋白)在胆汁分泌葡糖醛酸结合物中具有重要作用,ABCC2(24C>T)基因多态性与肝毒性的发生密切相关:24C>T突变可导致MRP2蛋白合成减少,葡糖醛酸易在细胞内堆积,发生双氯芬酸酰基葡糖醛酸反应从而引发肝毒性[38,40]。
2.2先天免疫系统相关基因及其多态性
基因筛查发现,免疫系统某些细胞因子的多态性可影响患者的先天免疫系统,并可预测药物性肝损伤的发生。例如,在服用双氯芬酸所致肝损伤的患者中发现,白细胞介素(IL)-10基因-627位点和IL-4基因-590位点存在突变,可引起IL-10的低转录和IL-4的高转录,有助于T细胞介导的疾病易感基因相关的抗体反应[41]。
2.3心脏离子通道相关基因及其多态性
心脏毒性是药品撤市最常见的原因[42]。非药物引起的QT间期延长主要与患者心脏离子通道相关基因的突变有关。目前已确认与之有关的基因包括:一氧化氮合酶1调节酶基因(NOS1AP)、心脏钠离子通道(SCN)5A基因和钾离子通道(KCN)J2基因[43-44]。
对药物致QT间期延长的患者进行离子通道基因测序,结果显示,在32例患者中,有4例患者存在突变,其中有2例是KCNE1 253G>A(D85N,rs1805128)发生突变[45]。对307例药物致QT间期延长的患者进行基因型分析,也证实了D85N和KCNE1基因多态性与药物心脏毒性相关[46]。NOS1AP(rs10494366)突变与维拉帕米引起的QT间期延长有关,且在前瞻性研究(n=7 000)中得到证实:各患者服用维拉帕米后,GG基因型[QT间期为25.4 ms,95%CI(5.9,44.9)]与TT基因型[QT间期为19.8 ms,95%CI(1.9,37.7)]患者比较,其QT间期明显延长[47]。最近英国学者又发现,NOS1AP的另外一个单核苷酸多态性位点(rs10800397)与药物引起的QT间期延长有关[OR=3.3,99.95%CI(1.0,10.8)][48]。
3 结语
目前,我国ADR监测主要依靠医疗机构、药品经营企业、药品生产企业以及个人上报的数据,最后以ADR信息通报的形式向社会发布,起到警示、宣传和促进合理用药的作用,但要精准或个体化地预防ADR的发生,就必须在用药前对高危人群进行相关的基因型检测,若患者带有某ADR相关位点的突变基因,建议降低药物剂量或直接换用其他药物。
虽然现有基因多态性可解释部分ADR发生的原因,但与大多数ADR之间的对应关系还有待于进一步研究,特别是对我国人群的深入研究。人体对药物反应的差异受多种因素的影响,除了基因多态性外,还包括其健康状况、饮食、性别、年龄等因素;临床上常见的联合用药也使ADR的发生机制更为复杂,给预防和判断增加了难度。因此,如何将PGx知识转化为临床应用,是目前临床面临的一个重大课题。此外,从分子水平深入研究导致ADR(尤其是严重ADR)发生的确切原因,利用基因差异筛选技术,对特定人群推荐或开发“量身定做”的新药,提高药物疗效、降低用药风险,也是未来医药发展的方向。
[1]Daly AK.Pharmacogenomics of adverse drug reactions[J]. Genome Med,2013,5(1):5.
[2]Bienfait KL,Shaw PM,Murthy G,et al.Mobilizing pharmacogenomic analyses during clinical trials in drug development[J].Pharmacogenomics,2013,14(10):1 227.
[3]国家食品药品监督管理总局.国家药品不良反应监测年度报告:2015年[S].2016-07-13.
[4]Assis DN,Navarro VJ.Human drug hepatotoxicity:a contemporaryclinicalperspective[J].ExpertOpinDrug Metab Toxicol,2009,5(5):463.
[5]Service JA,Waring WS.QT Prolongation and delayed atrioventricular conduction caused by acute ingestion of trazodone[J].Clin Toxicol:Phila,2008,46(1):71.
[6]Beutler E.The hemolytic effect of primaquine and related compounds:a review[J].Blood,1959,14(2):103.
[7]Chen Z,Liew D,Kwan P.Effects of a HLA-B*15:02 screening policy on antiepileptic drug use and severe skin reactions[J].Neurology,2014,83(22):2 077.
[8]Mengoli M,Parmeggiani D,Mengoli MC,et al.Drug-induced hepatotoxicity:clinical and biochemical features of 26 patients and a review of the literature[J].Recenti Prog Med,2011,102(6):253.
[9]Leung L,Kalgutkar AS,Obach RS.Metabolic activation in drug-induced liver injury[J].Drug Metab Rev,2012,44(1):18.
[10]Otsuka S,Yamamoto M,Kasuya S,et al.HLA antigens in patients with unexplained hepatitis following halothane anesthesia[J].Acta Anaesthesiol Scand,1985,29(5):497.
[11]Berson A,Fréneaux E,Larrey D,et al.Possible role of HLA in hepatotoxicity:an exploratory study in 71 patients with drug-induced idiosyncratic hepatitis[J].J Hepatol,1994,20(3):336.
[12]Hautekeete ML,Horsmans Y,van Waeyenberge C,et al. HLA association of amoxicillin-clavulanate-induced hepatitis[J].Gastroenterology,1999,117(5):1 181.
[13]Mallal S,Nolan D,Witt C,et al.Association between presence of HLA-B*5701,HLA-DR7,and HLA-DQ3 and hypersensitivity to HIV-1 reverse-transcriptase inhibitor abacavir[J].Lancet,2002,359(9 308):727.
[14]Hetherington S,Hughes AR,Mosteller M,et al.Genetic variations in HLA-B region and hypersensitivity reactions to abacavir[J].Lancet,2002,359(9 312):1 121.
[15]Kindmark A,Jawaid A,Harbron CG,et al.Genome-wide pharmacogenetic investigation of a hepatic adverse event without clinical signs of immunopathology suggests an underlying immune pathogenesis[J].Pharmacogenomics J,2008,8(3):186.
[16]Hirata K,Takagi H,Yamamoto M,et al.Ticlopidine-induced hepatotoxicity is associated with specific human leukocyte antigen genomic subtypes in Japanese patients:a preliminary case-control study[J].Pharmacogenomics J,2008,8(1):29.
[17]Daly AK,Donaldson PT,Bhatnagar P,et al.HLA-B*5701 genotype is a major determinant of drug-induced liver injury due to flucloxacillin[J].Nat Genet,2009,41(7):816.
[18]Singer JB,Lewitzky S,Leroy E,et al.A genome-wide study identifies HLA alleles associated with lumiracoxibrelated liver injury[J].Nat Genet,2010,42(8):711.
[19]Spraggs CF,Budde LR,Briley LP,et al.HLA-DQA1*02∶01 is a major risk factor for lapatinib-induced hepatotoxicity in women with advanced breast cancer[J].J Clin Oncol,2011,29(6):667.
[20]Yuan J,Guo S,Hall D,et al.Toxicogenomics of nevirapine-associated cutaneous and hepatic adverse events among populations of African,Asian,and European descent[J].Aids,2011,25(10):1 271.
[21]Zeng T,Long YS,Min FL,et al.Association of HLA-B* 1 502 allele with lamotrigine-induced Stevens-Johnson syndrome and toxic epidermal necrolysis in Han Chinese subjects:a meta-analysis[J].Int J Dermatol,2015,54(4):488.
[22]McCormack M,Alfirevic A,Bourgeois S,et al.HLA-A* 3101 and carbamazepine-induced hypersensitivity reactions in Europeans[J].N Engl J Med,2011,364(12):1 134.
[23]Hung SI,Chung WH,Liou LB,et al.HLA-B*5801 allele as a genetic marker for severe cutaneous adverse reactions caused by allopurinol[J].Proc Natl Acad Sci USA,2005,102(11):4 134.
[24]Chantarangsu S,Mushiroda T,Mahasirimongkol S,et al. Genome-wide association study identifies variations in 6p21.3 associated with nevirapine-induced rash[J].Clin Infect Dis,2011,53(4):341.
[25]Gatanaga H,Yazaki H,Tanuma J,et al.HLA-Cw8 primarily associated with hypersensitivity to nevirapine[J].Aids,2007,21(2):264.
[26]Svensson CK,Cowen EW,Gaspari AA.Cutaneous drug reactions[J].Pharmacol Rev,2001,53(3):357.
[27]Chung WH,Hung SI,Hong HS,et al.Medical genetics:a marker for Stevens-Johnson syndrome[J].Nature,2004,428(6 982):486.
[28]Mallal S,Phillips E,Carosi G,et al.HLA-B*5701 screening for hypersensitivity to abacavir[J].N Engl J Med,2008,358(6):568.
[29]Cheng L,Xiong Y,Qin CZ,et al.HLA-B*58∶01 is strongly associated with allopurinol-induced severe cutaneous adverse reactions in Han Chinese patients:a multicentre retrospective case-control clinical study[J].Br J Dermatol,2015,173(2):555.
[30]Lonjou C,Borot N,Sekula P,et al.A European study of HLA-B in Stevens-Johnson syndrome and toxic epidermal necrolysis related to five high-risk drugs[J].Pharmacogenet Genomics,2008,18(2):99.
[31]Littera R,Carcassi C,Masala A,et al.HLA-dependent hypersensitivity to nevirapine in Sardinian HIV patients[J]. Aids,2006,20(12):1 621.
[32]Chantarangsu S,Mushiroda T,Mahasirimongkol S,et al. HLA-B*3505 allele is a strong predictor for nevirapine-induced skin adverse drug reactions in HIV-infected Thai patients[J].Pharmacogenet Genomics,2009,19(2):139.
[33]Dalakas MC.Toxic and drug-induced myopathies[J].J Neurol Neurosurg Psychiatry,2009,80(8):832.
[34]Search Collaboraive Group,Link E,Parish S,et al.SLCO1B1 variants and statin-induced myopathy:a genomewide study[J].N Engl J Med,2008,359(8):789.
[35]Niemi M.Transporter pharmacogenetics and statin toxicity [J].Clin Pharmacol Ther,2010,87(1):130.
[36]Metushi IG,Cai P,Zhu X,et al.A fresh look at the mechanism of isoniazid-induced hepatotoxicity[J].Clin Pharmacol Ther,2011,89(6):911.
[37]Acuña G,Foernzler D,Leong D,et al.Pharmacogenetic analysis of adverse drug effect reveals genetic variant for susceptibility to liver toxicity[J].Pharmacogenomics J,2002,2(5):327.
[38]Daly AK,Aithal GP,Leathart JB,et al.Genetic susceptibility to diclofenac-induced hepatotoxicity:contribution of UGT2B7,CYP2C8,and ABCC2 genotypes[J].Gastroenterology,2007,132(1):272.
[39]Noe J,Kullak-Ublick GA,Jochum W,et al.Impaired expression and function of the bile salt export pump due to three novel ABCB11 mutations in intrahepatic cholestasis [J].J Hepatol,2005,43(3):536.
[40]Choi JH,Ahn BM,Yi J,et al.MRP2 haplotypes confer differential susceptibility to toxic liver injury[J].Pharmacogenet Genomics,2007,17(6):403.
[41]Aithal GP,Ramsay L,DalyAK,et al.Hepatic adducts,circulating antibodies,and cytokine polymorphisms in patients with diclofenac hepatotoxicity[J].Hepatology,2004,39(5):1 430.
[42]Kannankeril P,Roden DM,Darbar D.Drug-induced long QT syndrome[J].Pharmacol Rev,2010,62(4):760.
[43]Arking DE,Pfeufer A,Post W,et al.A common genetic variant in the NOS1 regulator NOS1AP modulates cardiac repolarization[J].Nat Genet,2006,38(6):644.
[44]Newton-Cheh C,Eijgelsheim M,Rice KM,et al.Common variants at ten loci influence QT interval duration in the QTGEN Study[J].Nat Genet,2009,41(4):399.
[45]Nishio Y,Makiyama T,Itoh H,et al.D85N,a KCNE1 polymorphism,is a disease-causing gene variant in long QT syndrome[J].J Am Coll Cardiol,2009,54(9):812.
[46]Kääb S,Crawford DC,Sinner MF,et al.A large candidate gene survey identifies the KCNE1 D85N polymorphism as a possible modulator of drug-induced torsades de pointes[J].Circ Cardiovasc Genet,2012,5(1):91.
[47]van Noord C,Aarnoudse AJ,Eijgelsheim M,et al.Calcium channel blockers,NOS1AP,and heart-rate-corrected QT prolongation[J].Pharmacogenet Genomics,2009,19(4):260.
[48]Jamshidi Y,Nolte IM,Dalageorgou C,et al.Common variation in the NOS1AP gene is associated with drug-induced QT prolongation and ventricular arrhythmia[J].J Am Coll Cardiol,2012,60(9):841.
(编辑:张元媛)
Relationship between Genetic Polymorphisms andAdverse Drug Reaction
SUN Xuelin1,HU Xin1,XU Qiaoling2(1.Dept.of Pharmacy,Beijing Hospital/National Center of Gerontology/ Beijing Key Laboratory for Assessment of Clinical Drugs Risk and Individual Application,Beijing 100730,China;2.Dept.of Pharmacy No.305 Hospital of PLA,Beijing 100730,China)
OBJECTIVE:To provide reference for precision medication in the clinic,preventing and reducing the occurrence of adverse drug reaction(ADR).METHODS:Foreign and domestic literatures about pharmacogenomics and ADR were collected to summarize the relationship of genetic polymorphisms with ADR.RESULTS&CONCLUSIONS:At present,many ADR-related genes are identified.The polymorphisms of human leukocyte antigen genes are associated with liver injury induced by diclofenac,amoxicillin clavulanate potassium and other drugs,and allergic reaction induced by carbamazepine,abacavir and other drugs.The polymorphisms of liver drug transporter 1B1 genes are associated with myopathy induced by statins.The polymorphisms of N-acetylase 2 genes are associated with liver injury induced by isoniazid.The polymorphisms of NOS1AP,SCN5A and KCNE1 genes are associated with drug-induced QT prolongation.Gene polymorphism study can provide a new reference for the prevention of ADR. Gene detection can be conducted before drug treatment to reduce the incidence of ADR.
Adverse drug reaction;Pharmacogenomics;Gene polymorphisms;Precise medication
R969.3
A
1001-0408(2016)32-4469-04
10.6039/j.issn.1001-0408.2016.32.02
卫生计生委保健局保健重点科研项目(No.W2016ZD01)
*主管药师,博士。研究方向:临床药学。电话:010-85133632。E-mail:sunxuelin4543@bjhmoh.cn
主任药师,博士。研究方向:医院药学。电话:010-66799176。E-mail:xuqiaoling305@163.com
(2016-07-23
2016-09-05)
