巧用单电子配对法突破共价键学习的瓶颈
2016-12-16江苏省新海高级中学222000
江苏省新海高级中学(222000)
杨 剑●
巧用单电子配对法突破共价键学习的瓶颈
江苏省新海高级中学(222000)
杨 剑●
电子式书写是教学重点,共价键数目是教学难点.单电子配对法可有效解决共价键数目,有效突破共价键学习的瓶颈.
单电子;电子式;共价键
现行中学教材对共价键知识的学习,主要停留在能用电子式表示共价分子的结构,进而写出共价分子的结构式.笔者在教学中发现:采用先电子式后结构式的教学方法,学生对典型分子(H2、HCl、H2O、NH3、CH4)的教学效果较好,但对CO2、HClO、H2O2、N2H4、CxHy等电子式的书写掌握较差,甚至对原子晶体(金刚石、晶体硅、碳化硅)及分子晶体(C60、 C70)中共价键目无从下手.笔者采用单电子配对法计算共价键数目,让学生顺利突破共价键学习的瓶颈.
一、单电子配对法的理论基础
经典共价键理论认为原子间通过共用电子对形成共价键,现代价键理论认为自旋相反的成单电子可以形成稳定的化学键.共价层电子对互斥理论的基础是分子或离子的几何构型主要决定于与中心原子相关的电子对之间的排斥作用.可见,共价键的形成离不开单电子配对.
二、单电子配对法在书写共价分子电子式中的具体做法
1.写出原子的电子式
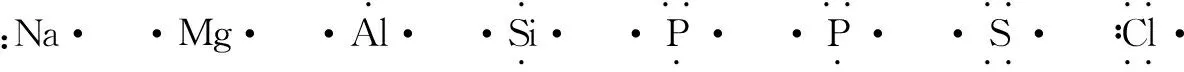
2.计算共用电子对数目
价键理论中,成键的两个原子的轨道发生重叠,一对电子位于两个原子之间.例如氯元素的原子在化学反应中易获得一个电子,而氢元素的原子也容易获得一个电子形成稳定结构,这两种元素的原子相互作用的结果是双方各以最外层一个电子组成一个电子对,为两原子共用,在两个原子核外的空间运动,从而使双方都达到稳定结构,这种电子对叫做共用电子对.共用电子对数目为各元素原子单电子数目和的一半,如HCl共用电子对数目为(1+1)/2=1;H2O共用电子对数目为(1+1+2)/2=2;N2H4共用电子对数目为(3+3+4)/2=5;CxHy共用电子对数目(4x+y)/2.
3.据对称性原则书写结构式
4.将结构式改成对应的共用电子对
如HClO结构式为H-O-Cl,共用电子对为H∶O∶Cl;H2O2结构式为H-O-O-H,共用电子对为H∶O∶O∶H.
5.据各元素原子最外层电子数补全电子式
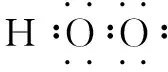
三、用单电子配对法计算原子晶体中共价键数目
金刚石、晶体硅、二氧化硅、碳化硅等原子晶体由于为空间网状结构,在计算它们共价键时难度较大,采用单电子配对法可有效解决此类问题.如金刚石晶体中每个碳原子与相邻的4个碳原子以共价键结合,形成空间网状结构,1mol金刚石中共价键数目则不易得出,采用单电子配对法算出1mol碳单电子数为4mol,共用电子对为2mol,共价键为2mol;1mol晶体硅中共价键数目为4/2=2mol;1mol二氧化硅中共价键数目为(4+2+2)/2=2mol;1mol碳化硅中共价键数目为(4+4)/2=4mol.
四、用单电子配对法计算分子晶体(C60、C70)中共双键数目
C60是一种由60个碳原子构成的分子(物质一般不由原子构成),形似足球,又名足球烯.每个碳原子单电子为4,60个碳原子有240个单电子,可形成120个共价键,由C60分子结构模型可以看出,每个碳原子与另三个碳原子成键,周围有2个碳碳单键,1个碳碳双键,所以C60分子中含单键数为120×1/2=60,碳碳双键为(120-60)/2=30;同理,不难算出C70中共价键为(4×70)/2=140,单键数为70,双键数为35.
用单电子配对法可有效解决共价物质中共价键数目,前提是11~17号元素原子电子式按上下左右四个方向分别写一个电子,多余电子成对,每个方向不超过两个电子的方式书写,且各原子单电子均成共价键.若有原子单电子未全部成键或为多原子共用则不能用单电子配对法,如SO3、SO2、NO2、NO、O3、苯等共价键数目则无法求出.
G632
B
1008-0333(2016)22-0069-01
