重组杆状病毒表达Sf-caspase-1双链RNA对昆虫细胞凋亡的影响
2016-12-16欧艳梅许晓东
欧艳梅,许晓东
(西北农林科技大学 生命科学学院,陕西 杨凌 712100)
重组杆状病毒表达Sf-caspase-1双链RNA对昆虫细胞凋亡的影响
欧艳梅,许晓东
(西北农林科技大学 生命科学学院,陕西 杨凌 712100)
【目的】 构建包含Sf-caspase-1反向重复序列的重组杆状病毒vAcMNPV-dsCasp,并在草地贪夜蛾(Sf9)细胞中表达Sf-caspase-1双链RNA,用以抑制Sf9细胞的凋亡,为未来优化杆状病毒表达系统提供试验依据。【方法】 将Sf-caspase-1反向重复序列构建到pBac5上,与AcMNPV Bacmid共转染Sf9细胞产生重组杆状病毒,用RT-PCR和PI活细胞染色方法,分别检测Sf-caspase-1 mRNA含量及Sf9细胞的凋亡情况。【结果】 PCR和双酶切检测结果表明,成功构建了重组质粒pBac5-dsCasp,并得到重组杆状病毒vAcMNPV-dsCasp。PI染色结果表明,相比野生型病毒vAcMNPV,重组杆状病毒vAcMNPV-dsCasp能够抑制Sf9细胞的凋亡。RT-PCR结果表明,vAcMNPV-dsCasp感染的Sf9细胞中Sf-caspase-1 mRNA含量明显下降。【结论】 在重组杆状病毒上表达Sf-caspase-1双链RNA确实能够沉默Sf-caspase-1,从而抑制细胞凋亡。
vAcMNPV;RNAi;dsRNA;Sf-caspase-1;细胞凋亡;杆状病毒表达系统
RNA干扰(RNAi)是生物体内一种进化上保守的可抵御转基因或外来病毒侵犯的防御机制。其原理是,将与靶基因mRNA具有同源互补序列的双链RNA(dsRNA) 导入细胞,能特异性地降解靶基因的mRNA,从而产生相应的功能表型缺失[1-3]。RNAi现象由Fire等[3]在线虫中发现后,被广泛应用于沉默目的基因,以研究相关基因的功能。
目前,RNAi技术已成功应用于线虫、果蝇、真菌及哺乳动物等生物基因功能的研究[4-6]。而杆状病毒是特异感染节肢动物的DNA病毒,主要包括核型多角体病毒属(NPV)和颗粒体病毒属(GV),苜蓿银纹夜蛾多核型多角体病毒(AcMNPV)是杆状病毒的模式种。自从1983年Smith等[7]首次将杆状病毒运用于表达系统以来,针对杆状病毒表达载体系统的改造研究一直进展缓慢,其中延长感染细胞存活期以提高目的蛋白表达量是优化杆状病毒表达系统的一种重要方式,而宿主细胞的存活时间与细胞凋亡有着密切的关系。细胞凋亡是细胞的一种程序性死亡过程[8-9],它的主要作用是清除机体内不正常或不需要的细胞,凋亡过程中细胞会发生一系列的形态变化,如DNA断裂、染色体聚集、产生膜泡等[8,10]。细胞凋亡的信号通路主要有2个:膜受体通路和caspase(cysteinyl aspartate specific proteinase) 激活的生物化学途径,其中细胞调控caspase活性对细胞凋亡非常重要[11]。
利用RNAi技术延长感染细胞存活期的研究较多。2007年,台湾的一个研究组用RNA干扰载体在草地贪夜蛾(Spodopterafrugiperda,Sf9)细胞中表达Sf-caspase-1 dsRNA,成功沉默了细胞中的Sf-caspase-1,从而延长了细胞的生存时间,并筛选出了抑制Sf9细胞凋亡的细胞系[12]。2008年,Li等[13]研究发现,删除AcMNPV ac68,可将幼虫半数致死时间延长16 h。2009年,Shen等[14]发现,敲除家蚕核型多角体病毒(BombyxmoriNuclear Polyhydrosis Virus,BmNPV)中同源基因Orf74,可将其幼虫存活时间延长14.7 h。2013年,Wu等[15]用RNA干扰沉默了细胞周期蛋白D,发现目的蛋白表达量提高了2倍。但目前尚未见在重组杆状病毒载体上表达dsRNA来抑制细胞凋亡的报道。本研究运用RNAi技术,构建包含Sf-caspase-1 dsRNA的重组杆状病毒vAcMNPV-dsCasp,并在Sf9细胞中成功表达Sf-caspase-1 dsRNA,沉默Sf9细胞中的Sf-caspase-1,从而抑制Sf9细胞的凋亡,以期为杆状病毒表达系统的优化提供基础。
1 材料与方法
1.1 菌株、质粒和细胞
大肠杆菌Top10细胞、pTriEx、Sf9细胞皆由西北农林科技大学生命科学学院分子病毒学实验室所保存;载体pBac5购自Novagen公司;AcMNPV Bacmid来源于University of Reading, Prof. Ian Jones实验室,其与外源蛋白的重组效率为100%[16]。
1.2 主要试剂
反转录试剂盒购自ABM生物公司;实时定量PCR试剂盒购自TaKaRa公司;Taq酶、PCR产物纯化试剂盒、质粒DNA小量抽提试剂盒、UNIQ-10柱式病毒基因组抽提试剂盒均购自上海生工生物工程有限公司;柱式DNAback试剂盒购自北京天恩泽基因科技有限公司;限制性内切酶XhoⅠ、BamHⅠ、EcoRⅠ、NcoⅠ和其同尾酶BspHⅠ及T4 DNA连接酶均购自Fermentas公司;DL5000 DNA Marker和DL2000 DNA Marker购自Vazyme公司;酵母浸粉和蛋白胨均购自北京奥博星生物技术有限公司;FuGENE®HD转染试剂、碘化丙啶(Propidium Iodide,PI)购自Roche公司;胎牛血清和昆虫细胞培养基购自Thermo Scientific HyClone公司。
1.3 引物设计与合成
参照NCBI中草地贪夜蛾 caspase-1 mRNA序列(序列号1814278),用Primer Premier 5和VectorNTI软件设计特异性扩增引物(表1)。引物均由上海生工生物工程有限公司合成。
1.4Sf-caspase-1 dsRNA重组质粒pBac5-dsCasp的构建
1.4.1 Sf-forward-caspase-1和Sf-reverse-caspase-1片段的扩增 以Sf9细胞基因组为模板,分别扩增Sf-forward-caspase-1及Sf-reverse-caspase-1片段。反应体系为:Sf9 细胞100 ng,5 mmol/L MgCl22.5 μL,10×TaqBuffer 2.5 μL,25 mmol/L dNTP 0.5 μL,10 μmol/L上游引物Sf-caspase-F 1 μL,10 μmol/L下游引物Sf-forward-caspaseR-EcoRⅠ或Sf-reverse-caspaseR-EcoRⅠ 1 μL,Taq酶 0.25 μL,ddH2O补足25 μL;反应条件为:95 ℃预变性4 min;95 ℃ 30 s, 58 ℃ 30 s,72 ℃ 1 min,35个循环;最后72 ℃ 10 min。PCR产物用1%琼脂糖凝胶电泳检测,再用PCR产物纯化试剂盒纯化后于-20 ℃保存。

表 1 本试验中 PCR和RT-PCR所用引物
1.4.2 重组质粒pBac5-dsCasp的构建 用NcoⅠ和EcoRⅠ双酶切载体pBac5,然后切胶回收。用EcoRⅠ和NcoⅠ同尾酶BspHⅠ对Sf-forward-caspase-1 PCR产物进行双酶切,然后用PCR产物纯化试剂盒回收。将Sf-forward-caspase-1 PCR酶切产物和酶切后的载体pBac5用T4 DNA连接酶于22 ℃连接1 h,然后转化大肠杆菌Top10感受态细胞,涂布于含50 μg/mL氨苄青霉素的培养基上,过夜培养,挑单菌落进行PCR鉴定;然后将阳性菌落接种至含50 μg/mL氨苄青霉素的LB液体培养基中,37 ℃、250 r/min过夜摇菌,用质粒DNA小量抽提试剂盒提取质粒;用BamHⅠ和EcoRⅠ进行双酶切鉴定,鉴定成功的重组质粒为pBac5-dsCasp-forward,再用EcoRⅠ和XhoⅠ双酶切该质粒,胶回收后待用。Sf-reverse-caspase-1 PCR产物用限制性内切酶EcoRⅠ和XhoⅠ双酶切,然后按构建重组质粒pBac5-dsCasp-forward的步骤,把Sf-reverse-caspase-1 PCR产物连接到pBac5-dsCasp-forward载体上,XhoⅠ和EcoRⅠ双酶切鉴定筛选阳性克隆,命名为pBac5-dsCasp。
1.5 重组杆状病毒的构建
用pBac5和pBac5-dsCasp分别与线性化的AcMNPV Bacmid共转染Sf9细胞,转染过程如下:先向1.5 mL离心管中加入100 μL无菌水,然后加入3 μL线性化的AcMNPV Bacmid,再分别加入5 μL的pBac5和pBac5-dsCasp,充分混匀,最后加入5 μL转染试剂,轻轻混匀,静置15~30 min。将Sf9细胞铺入6孔板中,静置15 min使细胞贴壁,然后将上述混合好的溶液逐滴加入到细胞培养皿中,混匀,28 ℃培养5 d后分别收集重组病毒vAcMNPV和vAcMNPV-dsCasp(即上清液)。取收集的病毒上清100 μL再次感染Sf9细胞,28 ℃培养3 d后收集病毒,4 ℃保存备用。
1.6 重组病毒滴度的Q-PCR测定
取重组病毒vAcMNPV和vAcMNPV-dsCasp各100 μL,按UNIQ-10柱式病毒基因组抽提试剂盒操作手册提取重组病毒vAcMNPV和vAcMNPV-dsCasp基因组。取10 μL pTriEx质粒稀释到100 μL,测定OD260,得到质粒浓度;并将pTriEx质粒梯度稀释为10-1、10-2、10-3、10-4、10-5、10-6、10-7。用1629FO和1629RO为引物进行Q-PCR,反应体系如下:各稀释梯度的质粒或病毒DNA 2 μL,2×SYBR Premix ExTaqⅡ 12.5 μL,1629FO(10 μmol/L) 1 μL,1629RO(10 μmol/L) 1 μL,超纯水 8.5 μL。采用两步法PCR,第1步,95 ℃预变性30 s;第2步, 95 ℃ 5 s,60 ℃ 30 s,40个循环;60 ℃ 5 s,每个循环增加0.5 ℃直到95 ℃。PCR结束后,用CFX96定量分析软件分析数据。
1.7Sf9细胞凋亡的PI活细胞染色法检测
根据1.6中得到的病毒滴度,用重组病毒vAcMNPV和vAcMNPV-dsCasp平行感染Sf9细胞,感染复数(Multiplicity of infection,MOI)分别为5,20,50和100,并设无病毒感染的Sf9细胞作为阴性对照。5 d后收集细胞到1.5 mL离心管中,600g离心1 min,PBS(pH 7.4)清洗,加100 μL PBS悬浮后,分别加入1 μL PI(100 μg/mL)至各个样品中,15 min后用流式细胞仪检测细胞凋亡情况。
1.8Sf9细胞中Sf-caspase-1 mRNA含量的RT-PCR检测
重组病毒vAcMNPV和vAcMNPV-dsCasp再次平行感染Sf9细胞4 d,用无病毒感染的Sf9细胞作为阴性对照。根据康为世纪生物公司的TRIzol总RNA提取操作手册提取总RNA。以RNA为模板,反转录得到cDNA,反应体系如下:RNA 1 μL,5×reaction Mix 2 μL,RNase Free ddH2O 7 μL;反应程序为:25 ℃ 10 min,42 ℃ 60 min,70 ℃ 5 min。将cDNA稀释20倍,作为PCR模板,Sf-casp1mRNA-forward 和Sf-casp1mRNA-reverse、Sf-casp1dsRNA-forward和Sf-casp1dsRNA-reverse、ActinF和ActinR分别为引物进行RT-PCR,1%琼脂糖凝胶电泳检测并用Image-Pro Plus 6.0分析光密度,比较重组病毒vAcMNPV和vAcMNPV-dsCasp感染Sf9细胞中caspase mRNA、caspase dsRNA和Actin mRNA的含量。
2 结果与分析
2.1 重组质粒pBac5-dsCasp的构建
构建的重组质粒pBac5-dsCasp-forward用BamHⅠ和EcoRⅠ双酶切鉴定,得到的900 bp DNA片段与预期(图1A)一致,说明重组质粒pBac5-dsCasp-forward 构建成功。重组质粒pBac5-dsCasp用XhoⅠ和EcoRⅠ进行双酶切鉴定,得到长800 bp的片段,其大小也与预期相吻合(图1B),说明重组质粒pBac5-dsCasp构建成功。

图 1 pBac5-dsCasp-forward(A)及pBac5-dsCasp(B)的双酶切鉴定
2.2Sf9细胞凋亡情况检测
pBac5-dsCasp重组质粒包含Sf-caspase-1 800 bp反向重复序列Sf-forward-caspase-1及Sf-reverse-caspase-1和100 bp间隔区域。该质粒与AcMNPV Bacmid共转染Sf9细胞后,产生重组杆状病毒vAcMNPV-dsCasp(图2)。其在Sf9细胞中表达Sf-caspase-1 dsRNA,可以沉默Sf9细胞中Sf-caspase-1的表达。

图 2 重组杆状病毒vAcMNPV-dsCasp的构建图谱和Sf-caspase-1 dsRNA的内源性表达
PI为一种核酸染料,不能透过完整的细胞膜,可用于凋亡中晚期和死细胞的染色。PI染色后,用流式细胞仪检测,峰值越偏右,说明被PI染色的细胞越多,即死细胞和凋亡细胞越多。如图3所示,PI染色后,相比vAcMNPV病毒感染的Sf9细胞,重组病毒vAcMNPV-dsCasp感染Sf9细胞的峰值整体向左移动。以Sf9细胞为参考设门,门内细胞几何平均值即荧光强度平均值见表2。由表2可知,vAcMNPV-dsCasp感染Sf9细胞的荧光强度平均值比vAcMNPV病毒感染Sf9细胞降低20%,说明重组病毒vAcMNPV-dsCasp感染Sf9细胞后,抑制了Sf9细胞的凋亡。

图 3 基于PI染色的Sf9细胞凋亡流式细胞仪检测
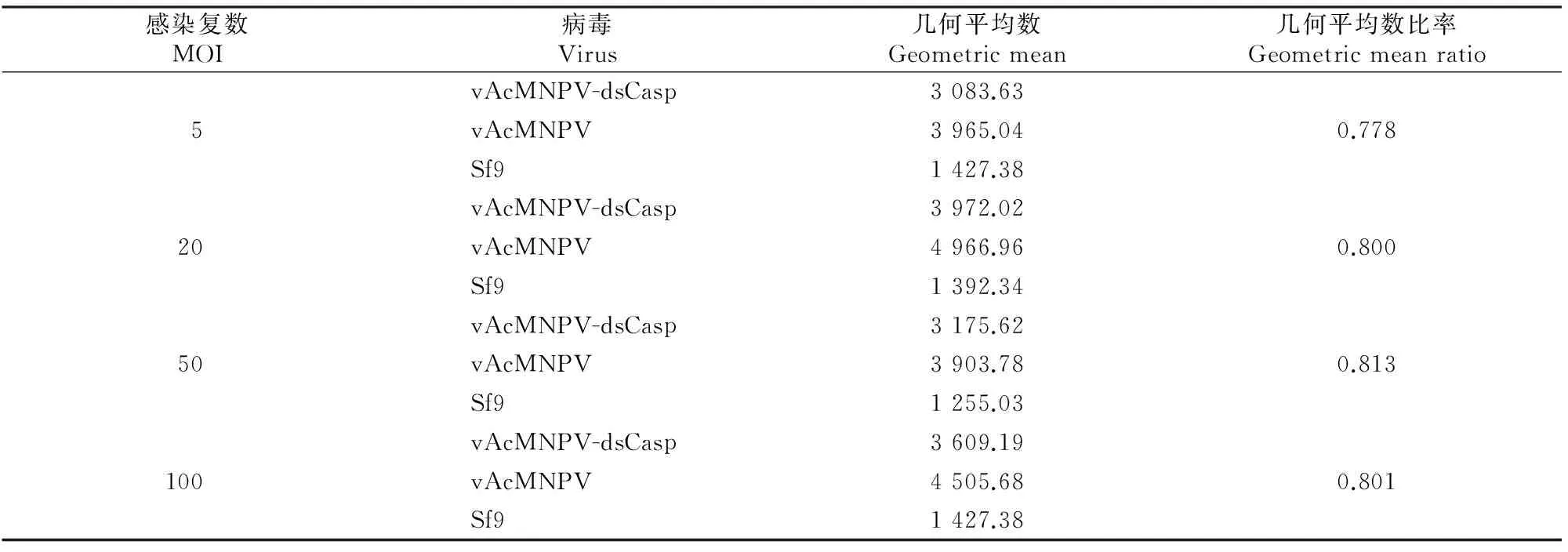
表 2 Sf9细胞凋亡的流式细胞仪检测结果
2.3Sf9细胞中的Sf-caspase-1 mRNA 含量
用RT-PCR检测Sf-caspase1 RNA含量,以确定重组病毒vAcMNPV-dsCasp能否沉默Sf- caspase-1,结果见图4和表3。由图4和表3可知,相对于感染vAcMNPV的Sf9细胞,vAcMNPV-dsCasp感染Sf9细胞的光密度值降幅为51.8%,表明感染vAcMNPV-dsCasp的Sf9细胞表达Sf-caspase1 dsRNA后降低了Sf-caspase-1 RNA含量,说明重组型病毒vAcMNPV-dsCasp表达的Sf-caspase-1 dsRNA确实降低了Sf-caspase-1的含量,这与PI染色检测细胞凋亡的结果相符。
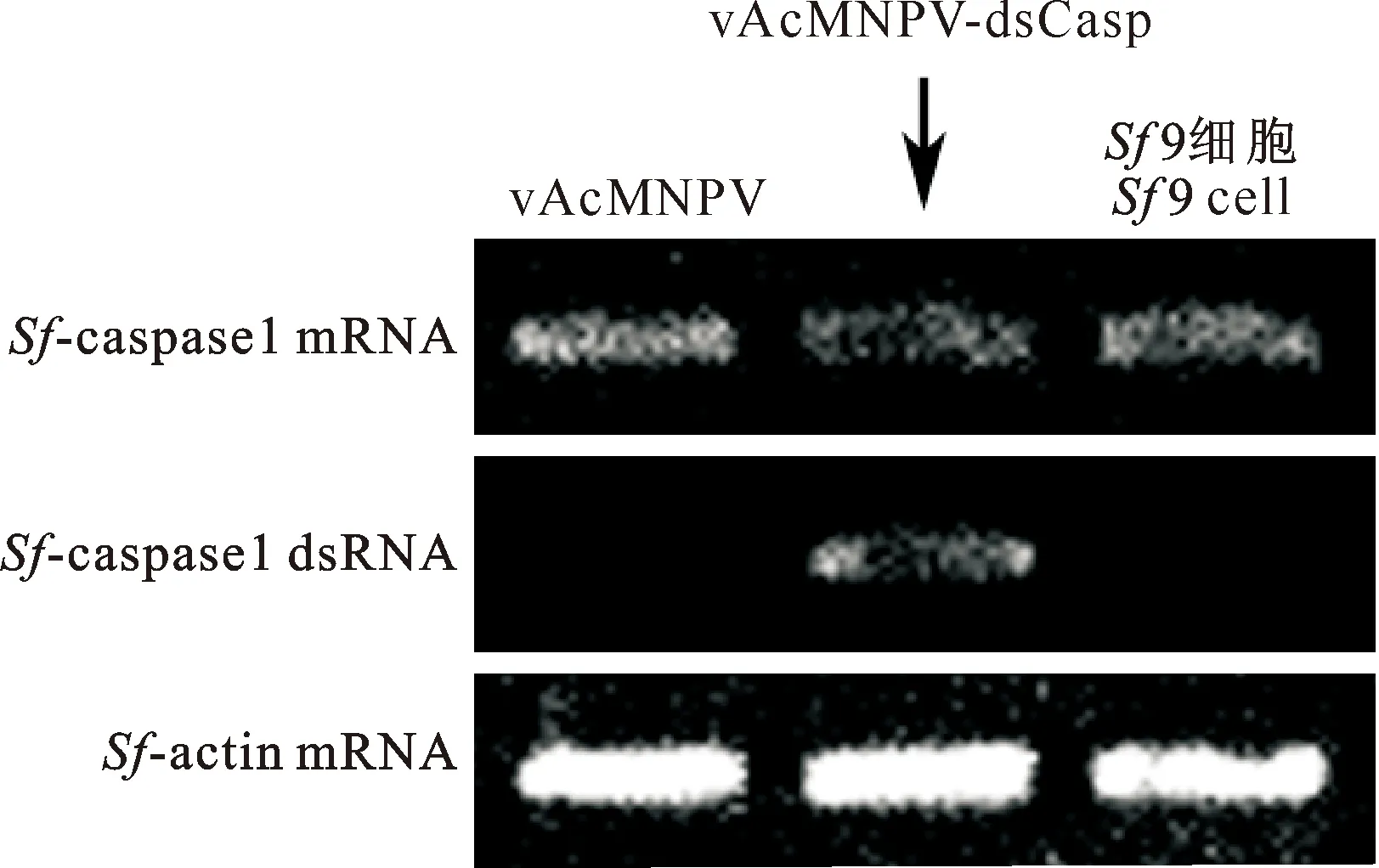
图 4 vAcMNPV-dsCasp感染Sf9细胞后Sf-caspase-1 mRNA含量
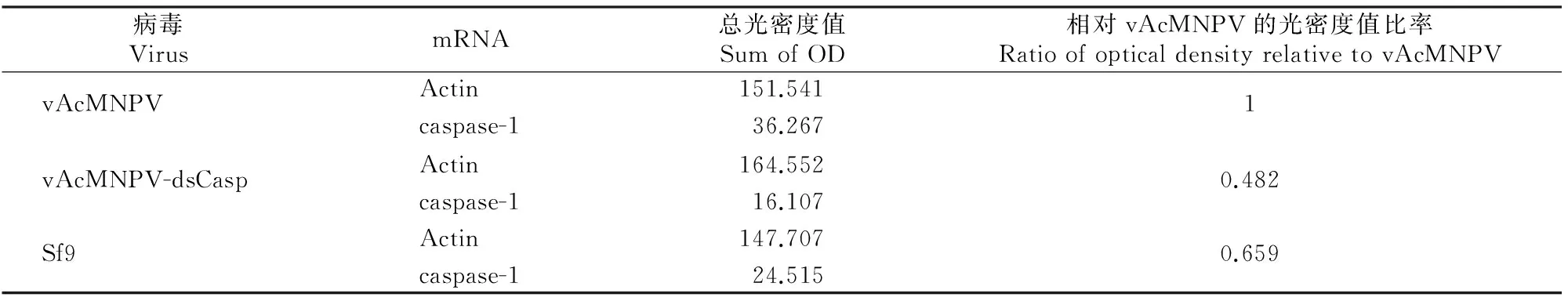
表 3 Sf-caspase-1 mRNA的光密度值
3 讨 论
有研究表明,体外导入双链RNA到粉纹夜蛾(Trichoplusini)、草地贪夜蛾(Spodopterafrugiperda)细胞中能够沉默目的蛋白[17-19]。但是,目前主要通过体外直接导入双链RNA或用RNAi表达质粒直接表达双链RNA,筛选出相应的细胞系,还未见直接在重组杆状病毒上表达双链RNA抑制蛋白表达的相关研究。
1983年,Smith等[7]成功将杆状病毒作为外源蛋白表达载体,表达外源蛋白。人们运用各种方法改造杆状病毒-昆虫表达系统以提高外源蛋白表达的产量。其中,Lin等[12]在Sf9细胞中用RNA干扰表达载体表达了Sf-caspase-1的双链RNA以沉默Sf-caspase-1,同时筛选出了细胞系。但是,将Sf-caspase-1反向重复序列构建在昆虫染色体上可能会导致昆虫细胞失去凋亡通路,进而导致细胞系的退化。因此,若能在重组杆状病毒上表达Sf-caspase-1双链RNA,则在病毒感染细胞的同时,还可抑制细胞凋亡,即重组杆状病毒能够延长Sf9细胞的存活时间,且不会导致Sf9细胞系的退化。
本研究将表达Sf-caspase-1双链RNA的重组质粒直接重组到vAcMNPV病毒上,这个重组杆状病毒能够抑制宿主细胞Sf9细胞的凋亡,从而延长了Sf9细胞的存活时间,而杆状病毒表达系统是瞬时表达系统,延长Sf9细胞的存活时间可大大提高外源蛋白的表达量,因此,本研究构建的重组杆状病毒对于杆状病毒表达系统的优化有重要的意义。
4 结 论
本研究将Sf-caspase-1 dsRNA的反向互补序列成功重组到杆状病毒vAcMNPV上,使重组杆状病毒vAcMNPV-dsCasp在Sf9细胞中表达Sf-caspase-1 dsRNA,进而起到沉默Sf-caspase-1的作用,以抑制Sf9细胞的凋亡。检测结果表明,重组杆状病毒vAcMNPV-dsCasp感染细胞后会使细胞中Sf-caspase-1 mRNA的含量下降,从而成功抑制细胞凋亡。这为未来优化杆状病毒-昆虫细胞表达系统提供了重要的基础。
[1] Hamilton A J,Baulcombe D C.A species of small antisense RNA in posttranscriptional gene silencing in plants [J].Science,1999,286(5441):950-952.
[2] Hammond S M,Bernstein E,Beach D,et al.An RNA-directed nuclease mediates post-transcriptional gene silencing inDrosophilacells [J].Nature,2000,404(6775):293-296.
[3] Fire A,Xu S Q,Montgomery M K,et al.Potent and specific genetic interference by double-stranded RNA inCaenorhabditiselegans[J].Nature,1998,391(6669):806-811.
[4] Chuang C F,Meyerowitz E M.Specific and heritable genetic interference by double-stranded RNA inArabidopsisthaliana[J].Proceedings of the National Academy of Sciences,2000,97(9):4985-4990.
[5] Lee Y S,Carthew R W. Making a better RNAi vector forDrosophila:use of intron spacers [J].Methods,2003,30(4):322-329.
[6] Sui G,Soohoo C,Affar E B,et al.A DNA vector-based RNAi technology to suppress gene expression in mammalian cells [J].Proceedings of the National Academy of Sciences,2002,99(8):5515-5520.
[7] Smith G E,Summers M D,Fraser M J.Production of human beta interferon in insect cells infected with a baculovirus expression vector [J].Molecular and Cellular Biology,1983,3(12):2156-2165.
[8] Schafer Z T,Kornbluth S.The apoptosome:physiological,developmental,and pathological modes of regulation [J].Developmental Cell,2006,10(5):549-561.
[9] Zoog S J,Schiller J J,Wetter J A,et al.Baculovirus apoptotic suppressor P49 is a substrate inhibitor of initiator caspases resistant to P35invivo[J].EMBO,2002,21:5130-5140.
[10] Ferri K F,Kroemer G.Organelle-specific initiation of cell death pathways [J].Nature Cell Biology,2001,3(11):E255-E263.
[11] Green D R.Apoptotic pathways:the roads to ruin [J].Cell,1998,94(6):695-698.
[12] Lin C C,Hsu J T A,Huang K L,et al.Sf-Caspase-1-repressed stable cells:resistance to apoptosis and augmentation of recombinant protein production [J].Biotechnology and Applied Biochemistry,2007,48(1):11-19.
[13] Li G,Wang J,Deng R,et al.Characterization of AcMNPV with a deletion of ac68 gene [J].Virus Genes,2008,37(1):119-127.
[14] Shen H,Chen K,Yao Q,et al.Characterization ofBombyxmorinucleopolyhedrovirusorf74,a novel gene involved in virulence of virus [J].Virus Genes,2009,38(3):487-494.
[15] Wu H C,Hebert C G,Hung C W,et al.Tuning cell cycle of insect cells for enhanced protein production [J].Journal of Biotechnology,2013,168(1):55-61.
[16] Zhao Y,Chapman D A G,Jones I M.Improving baculovirus recombination [J].Nucleic Acids Research,2003,31(2):e6.
[17] Hajos J P,Vermunt A M W,Zuidema D,et al.Dissecting insect development:baculovirus-mediated gene silencing in insects [J].Insect Molecular Biology,1999,8(4):539-544.
[18] Isobe R,Kojima K,Matsuyama T,et al.Use of RNAi technology to confer enhanced resistance to BmNPV on transgenic silkworms [J].Archives of Virology,2004,149(10):1931-1940.
[19] Valdes V J,Sampieri A,Sepulveda J,et al.Using double-stra-nded RNA to preventinvitroandinvivoviral infections by recombinant baculovirus [J].Journal of Biological Chemistry,2003,278(21):19317-19324.
Influence of insect cell apoptosis by expression ofSf-caspase-1 double-stranded RNA in recombinant baculovirus
OU Yanmei,XU Xiaodong
(CollegeofLifeSciences,NorthwestA&FUniversity,Yangling,Shaanxi712100,China)
【Objective】 This study constructed recombinant baculovirus containing inverted repeat sequence ofSf-caspase-1.The recombinant baculovirus expressedSf-caspase-1 double-stranded RNA and inhibited apoptosis ofSpodopterafrugiperda(Sf9) cell.【Method】 Inverted repeat sequence ofSf-caspase-1 was inserted into pBac5 before being co-transfected with AcMNPV Bacmid into Sf9 cells to produce recombinant baculovirus.RT-PCR and PI vital cell staining were used to detect the content ofSf-caspase-1 mRNA and apoptosis of Sf9,respectively.【Result】 PCR and restriction enzyme digestion showed that pBac5-dsCasp vector was built successfully.The recombinant virus vAcMNPV-dsCasp was obtained by recombination between Bacmid and pBac5-dsCasp.Comparing with the cell infected by vAcMNPV,RT-PCR and PI vital cell staining indicated that vAcMNPV-dsCasp inhibited cell apoptosis and the content ofSf-caspase1 mRNA declined.【Conclusion】 Expression ofSf-caspase-1 double-strained RNA in recombinant baculvirus silencedSf-caspase-1,and inhibited cell apoptosis.
vAcMNPV;RNAi;dsRNA;Sf-caspase-1;cell apoptosis;baculovirus expression system
时间:2016-10-09 10:08
10.13207/j.cnki.jnwafu.2016.11.027
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20161009.1008.054.html
2015-05-29
陕西省自然科学基金项目(2011JM3002)
欧艳梅(1988-),女,湖南宁远人,在读硕士,主要从事杆状病毒表达系统优化研究。 E-mail:ouyanmei19881223@163.com
许晓东(1967-),男,黑龙江甘南人,副教授,硕士生导师,主要从事分子病毒学研究。E-mail:xuxd@nwsuaf.edu.cn
Q786
A
1671-9387(2016)11-0187-06
