PM2.5刺激非小细胞肺癌A549细胞凋亡基因的表达
2016-12-16杨彪李新鸣祁荣陈冬梅肖纯凌
杨彪,李新鸣,祁荣,陈冬梅,肖纯凌
(1.辽宁中医药大学中西医结合基础学科,沈阳 110032;2.沈阳医学院环境污染与微生态重点实验室,沈阳 110034;3.沈阳医学院科学实验中心,沈阳 110034)
PM2.5刺激非小细胞肺癌A549细胞凋亡基因的表达
杨彪1,李新鸣2,祁荣3,陈冬梅2,肖纯凌2
(1.辽宁中医药大学中西医结合基础学科,沈阳 110032;2.沈阳医学院环境污染与微生态重点实验室,沈阳 110034;3.沈阳医学院科学实验中心,沈阳 110034)
目的观察PM2.5暴露对非小细胞肺癌A549细胞的影响,进而了解其对细胞的毒性作用机制。方法利用细胞活力检测法确定PM2.5暴露的浓度;用透射电镜观察暴露后细胞的形态特征;通过转录组测序及实时定量RT⁃PCR,对损伤发生机制进行预测。结果通过细胞活力检测确定PM2.5暴露处理的终浓度为50 μg/cm2。形态学检测表明,暴露处理后,细胞核内染色质凝聚,边集于核膜。凋亡相关基因IL1A、IL1B、CXCL3、CXCL2、PTGS2、IRAK2的表达上调,TP53和TNFRSF1A的表达下调。结论通过刺激细胞凋亡基因表达水平的变化,PM2.5暴露诱导了非小细胞肺癌A549细胞的凋亡。
空气污染细颗粒物;A549细胞;细胞活力;凋亡;转录组测序;差异基因
网络出版地址
空气污染物是由多种资源消耗途径产生的不同类型的异质混合物,这些污染物进入呼吸系统可能产生潜在的毒性作用[1⁃2]。流行病学调查和基础实验研究已经证实,空气污染会导致呼吸系统疾病及肺功能损伤。研究[3]显示,PM2.5浓度每降低3.9 μg/mL将减少7 978人入院治疗,并能够节约近3.33亿美元。因此,空气污染水平下降能够给公共健康带来非常积极的影响。本研究完成了主要空气污染物PM2.5样品的收集,明确了PM2.5暴露可刺激A549细胞凋亡发生,并通过转录组测序阐述了空气污染后细胞损伤的机制。
1 材料与方法
1.1PM2.5样品的收集[4⁃5]
通过高流量(1.13 m3/min)样品颗粒采集器,即Hi⁃Vol PM2.5采样头(美国Tisch Environmental Inc公司)将空气动力学直径<2.5 μm的PM2.5颗粒收集至硝化棉滤膜(美国GE公司)。超声震荡收集PM2.5颗粒物,用PBS缓冲液溶解至储备浓度(5 mg/mL),保存于-80℃备用。使用时进行超声震荡处理。
1.2细胞培养及PM2.5暴露
用含10%小牛血清(四季青血清,浙江天杭生物科技股份有限公司)、100 U/mL青霉素、100 μg/mL链霉素的RPMI⁃1640完全培养基,在37°C、5%CO2的条件下,培养非小细胞肺癌A549细胞株(江苏凯基生物技术股份有限公司)。将细胞接种于96孔板,当细胞密度达85%时,用浓度梯度为0、50、100、200、400 μg/cm2的PM2.5溶液处理实验组细胞,对照组加入等量的RPMI⁃1640不完全培养基处理,培养72 h。
1.3细胞活力检测
实验组细胞加入终浓度为0、50、100、200、400 μg/cm2的PM2.5溶液,对照组加入等量的RPMI⁃1640不完全培养基处理,培养72 h,更换不完全培养基。按照CellTiter 96 AQueous One Solution Cell Proliferation Assay试剂盒(美国Promega公司)说明书进行细胞活力检测。
1.4细胞形态学观察
用50 μg/cm2的PM2.5处理实验组细胞,对照组则加入等量的PBS,培养72 h后,收集细胞。固定、脱水、包埋、切片,透射电子显微镜(H⁃7650,日本日立公司)下进行形态观察并拍照。
1.5基因测序
1.5.1RNA提取和质量控制:采用TRIZOL Reagent试剂盒(美国Thermo Fisher Scientific公司)提取细胞total RNA,经电泳质检合格后,用RNeasy micro kit和RNase⁃Free DNase Set(德国QIAGEN公司)纯化total RNA。经NanoDrop ND⁃2000分光光度计(美国Thermo Fisher Scientific公司)及Agilent Bioanalyzer 2100进行质检,质检合格的RNA置于-80°C待用。
1.5.2凋亡相关基因测序:转录组高通量测序由上海伯豪生物技术有限公司完成。按照实验操作说明对纯化后的total RNA进行mRNA的分离或rRNA去除、片段化、第一链cDNA合成、第二链cDNA合成、末端修复、3’末端加A、连接接头、富集等,完成测序样本文库构建。按照cBot User Guide所示相应流程,在Illummina HiSeq 2500测序仪配套的cBot上完成Cluster生成和第一向测序引物杂交。按照HiSeq 2500 User Guide准备测序试剂,将携有cluster的flow cell上机(HiSeq 2500,美国Illumina公司)。选用paired⁃end程序,进行双端测序。测序过程由Illumina公司提供的data collection software控制,并进行实时数据分析。
1.5.3通路分析:通过来源于KEGG(Kyoto Ency⁃clopedia of Genes and Genomes)pathways(http:// www.genome.jp/kegg/)的基因地图,分析差异表达的损伤基因的作用通路。
1.6实时定量real⁃time PCR
使用ABI Prism 7500(美国Applied Biosystems公司)和SYBR Select Master Mix(美国Thermo Fish⁃er Scientific公司)完成实时定量PCR(qRT⁃PCR),检测候选基因的表达变化。反应体系20 μL。初始激活反应条件:50°C 2 min,95°C 2 min;40个循环的条件为95°C 15 s,60°C 1 min。GAPDH作为内参基因。相关基因的表达结果通过2-ΔΔCt计算。引物序列见表1。
1.7蛋白相互作用网络构建
应用STRING数据库(http://string⁃db.org)建立蛋白相互作用网络图[6],从多种资源整合并衡量信息,包括寻找相邻的保守性、基因的融合作用、共表达、系统的联合发生、大规模的实验以及基因相关文献。对分值高于0.7者进行下一步的分析,并完成网络的建立。

表1 实时定量PCR引物序列Tab.1 Sequences of real⁃time PCR primers
1.8统计学分析
采用GraphPad PRISM 5.0软件完成统计学分析。采用非配对双侧t检验比较细胞活力检测实验和qRT⁃PCR结果。所有实验内容至少重复3次。P<0.05为差异有统计学意义。
2 结果
2.1A549细胞增殖检测结果
如图1所示,随着PM2.5暴露浓度的增加,细胞增殖抑制率升高,与对照组比较,差异有统计学意义(P<0.01)。暴露终浓度为50 μg/cm2时,细胞增殖抑制明显,后续研究选择在该暴露浓度下进行。
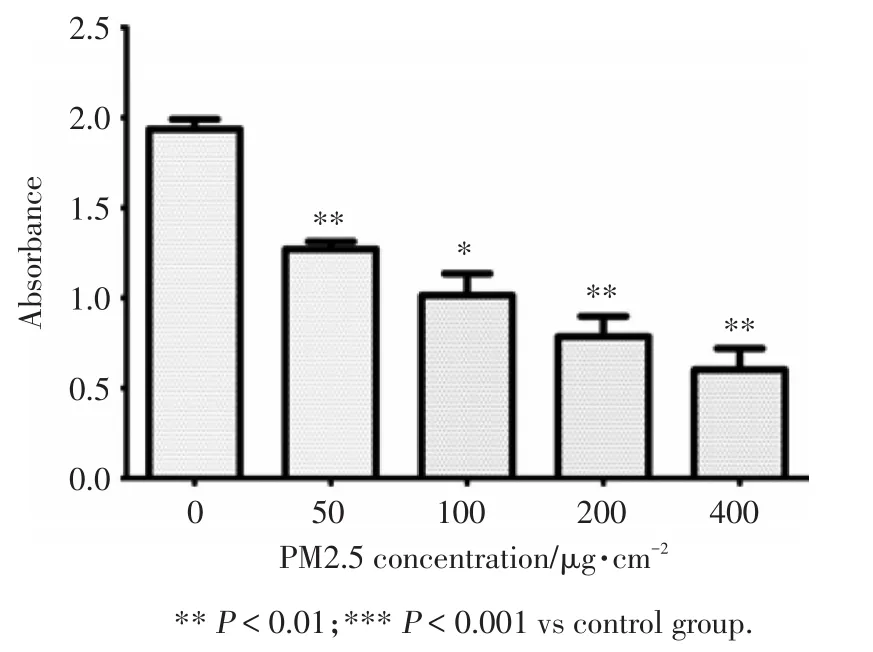
图1 不同浓度PM2.5暴露下的细胞活力Fig.1 The cell viability assay under different concentrations PM2.5 exposure
2.2A549细胞超微结构的变化
透射电子显微镜观察发现,对照组细胞绒毛清晰,细胞膜、核膜均完整,染色质均匀(图2A);实验组暴露72 h后可见细胞核内染色质凝聚,边集于核膜,呈现凋亡相关变化(图2B)。

图2 透射电子显微镜观察细胞形态特征Fig.2 The morphological characteristics of cells observed with transmission electron microscope
2.3凋亡相关基因分析结果
经琼脂糖凝胶电泳和Agilent Bioanalyzer 2100分析,实验组和对照组RNA完整性良好。凋亡相关基因测序后,应用KEGG的基因地图分析寻找凋亡通路中差异表达的基因。结果显示,PM2.5暴露诱导表达变化的参与凋亡通路的基因主要是IL1A、IRAK2、TP53和TNFRSF1A(表2),TNFRSF1A表达量下调(图3),提示PM2.5暴露处理后主要通过IL1A激活凋亡相关信号通路,刺激细胞发生凋亡反应。另外,由TNF信号通路的差异蛋白表达发现,TNFRSF1A的表达下调,同样说明TNF信号通路较少参与暴露细胞的凋亡损伤;IL1A等炎性因子的表达上调,说明PM2.5暴露能促使细胞分泌更多的炎性因子,调节细胞活力,从而适应微环境的变化。
2.4qRT⁃PCR检测结果
为了验证细胞损伤相关基因表达水平的变化,本研究选择了转录组基因测序的8个差异表达基因进行qRT⁃PCR。结果显示,IL1A、IL1B、CXCL3、CX⁃CL2、PTGS2、IRAK2基因表达上调,TP53和TN⁃FRSF1A基因表达下调。qRT⁃PCR比较结果与测序结果趋势相同(表2)。
2.5基因网络分析结果
通过转录组测序结果找到凋亡通路差异表达的基因,利用STRING数据库建立蛋白相互作用网络图。结果显示,CXCL2和CXCL3,IRAK2、IL1A和IL1B,PTGS2和TP53彼此间的作用明显(图4)。
3 讨论
环境细颗粒物能够诱导呼吸道上皮细胞产生过多的氧自由基,对受侵袭细胞产生毒性作用,使一部分细胞无法适应周围新的生存环境,发生多种途径死亡[7⁃8]。研究[5,9,11]结果显示,PM2.5暴露能刺激大鼠呼吸系统病变,导致其促炎和抗炎因子失衡,发生炎性损伤。本研究针对PM2.5暴露下凋亡相关基因的表达变化情况进行广泛的数据分析,以了解相关疾病的分子机制。
本研究通过透射电子显微镜观察发现,PM2.5暴露使细胞产生凋亡的形态学变化。通过对暴露细胞进行转录组基因测序发现,PM2.5暴露主要是诱导了凋亡相关基因表达水平的变化,并通过qRT⁃PCR进一步验证了上述结果。本研究还发现PM2.5暴露使细胞内凋亡相关基因表达水平发生变化,发现IL1A,IL1B,TP53,CXCL3,CXCL2,PTGS2,TN⁃FRSF1和IRAK2参与了PM2.5诱导的细胞凋亡信号通路。其中,IL1A,IL1B,CXCL2和CXCL3的表达显著上调。

图3 差异表达基因的凋亡通路和肿瘤坏死信号通路分析Fig.3 The apoptosis and TNF signaling pathway analysis on differentially expressed genes
凋亡和坏死的发生在某种程度上受到局部炎性反应的影响,与此同时,炎性反应又能够激发更加快速的凋亡和坏死[10⁃13]。研究[12]证实,急性损伤刺激能够诱导细胞表达炎性因子,促使细胞发生凋亡;同时,环境压力也可以诱导细胞发生自噬,低水平的自噬能使细胞活力旺盛,利于生长,而超出细胞承受能力的自噬则可杀伤细胞。

表2 PM2.5暴露处理后凋亡相关基因的差异表达Tab.2 Differentially expressed genes in apoptosis after confrontation with PM2.5 exposure

图4 PM2.5暴露凋亡通路基因的互作图Fig.4 An interactive network view with apoptosis of PM2.5 ex⁃posure
研究表明,空气污染颗粒物能破坏人类赖以生存的自然环境,损害人体健康。分析空气污染颗粒物对细胞的作用特点,探究组织中相关转录因子的表达变化,有助于阐明PM2.5的毒性作用机制,将在分子水平上为相关疾病的治疗提供更直接、更有价值的依据。
[1]BURNETT RT,POPE CA 3rd,EZZATI M,et al.An integrated risk function for estimating the global burden of disease attributable to ambient fine particulatematter exposure[J].Environ Health Per⁃spect,2014,122(4):397-403.DOI:10.1289/ehp.1307049.
[2]LAING S,WANG G,BRIAZOVA T,et al.Airborne particulate mat⁃ter selectively activates endoplasmic reticulum stress response in the lung and liver tissue[J].Am J Physiol Cell Physiol,2010,299(4):C736-749.DOI:10.1152/ajpcell.00529.2009.
[3]SHAH AS,LANGRISH JP,NAIR H,et al.Global association of air pollution and heart failure:a systematic review and meta⁃analysis[J].Lancet,2013,382(9897):1039-1048.DOI:10.1016/S0140⁃6736(13)60898⁃3.
[4]MA M,LI S,JIN H,et al.Characteristics and oxidative stress on rats and traffic policemen of ambient fine particulate matter from Shenyang[J].Sci Total Environ,2015,526:110-115.DOI:10.1016/ j.scitotenv.2015.04.075.
[5]XIAO C,LI S,ZHOU W,et al.The effect of air pollutants on the mi⁃croecology of the respiratory tract of rats[J].Environ Toxicol Phar⁃macol,2013,36(2):588-594.DOI:10.1016/j.etap.2013.04.012.
[6]SZKLARCZYK D,FRANCESCHINI A,KUHN M,et al.The STRING database in 2011:functional interaction networks of pro⁃teins,globally integrated and scored[J].Nucleic Acids Res,2011,39(Database issue):D561-568.DOI:10.1093/nar/gkq973.
[7]DENG X,ZHANG F,WANG L,et al.Airborne fine particulate mat⁃ter induces multiple cell death pathways in human lung epithelial cells[J].Apoptosis,2014,19(7):1099-1112.DOI:10.1007/ s10495⁃014⁃0980⁃5.
[8]DENG X,ZHANG F,RUI W,et al.PM2.5⁃induced oxidative stress triggers autophagy in human lung epithelial A549 cells[J].Toxicol In Vitro,2013,27(6):1762-1770.DOI:10.1016/j.tiv.2013.05.004.
[9]肖纯凌,李舒音,尚德志,等.PM2.5大气污染物致大鼠呼吸系统病理学变化[J].中国公共卫生,2011,27(12):1579-1581.DOI:10.11847/zgggws2011⁃27⁃12⁃33.
[10]王雪梅,尚德浩.姜黄素对成骨细胞凋亡的影响[J].中国医科大学学报,2015,44(12):1094-1097.DOI:10.12007/j.issn.0258⁃4646.2015.12.010.
[11]张霞,关洪全.斑蝥酸钠诱导RTP801表达促进结肠癌细胞HCT116凋亡[J].中国医科大学学报,2016,45(3):222-226. DOI:10.12007/j.issn.0258⁃4646.2016.03.008.
[12]WAND G,ZHAO J,JIANG R,et al.Rat lung response to ozone and fine particulate matter(PM2.5)exposures[J].Environ Toxi⁃col,2015,30(3):343-356.DOI:10.1002/tox.21912.
[13]BOOTH LA,TAVALLAI S,HAMED HA,et al.The role of cell sig⁃nalling in the crosstalk between autophagy and apoptosis[J].Cell Signal,2013,26(3):549-555.DOI:10.1016/j.cellsig.11.028.
(编辑王又冬)
PM2.5 Induces Apoptosis in A549 Cells by Stimulating Apoptosis⁃related Gene Expression
YANG Biao1,LI Xinming2,QI Rong3,CHEN Dongmei2,XIAO Chunling2
(1.Basic Discipline of Chinese and Western Integrative,Liaoning University of Traditional Chinese Medicine,Shenyang 110032,China;2.Key Lab of Environmental Pollution and Microecology,Shenyang Medical College,Shenyang 110034,China;3.Science Experiment Center,Shenyang Medical College,Shenyang 110032,Chi⁃na)
ObjectiveTo observe the effects of PM2.5 exposure on A549 cells,and explore the mechanism of toxicity.MethodThe concentra⁃tions of PM2.5 exposure were determined utilizing cell viability assay.The morphological characteristics of exposed cell were observed with trans⁃mission electron microscope.Using big date from RNA⁃Seq and qRT⁃PCR,the mechanism was explored.ResultsThe final concentration of PM2.5 exposure was 50 μg/cm2;morphological detection showed that chromatin condensation after exposure which was also found on the boundary of nuclear membrane.KEGG pathway analysis and interaction network were finished,and 8 kinds of apoptosis⁃related genes were found to be in⁃volved in the process of damage.ConclusionPM2.5 induces apoptosis in A549 cells by stimulating the changes of apoptosis⁃related genes ex⁃pressions.
PM2.5;A549 cell;cell viability;apoptosis;RNA⁃Seq;differential genes
X51;R329.24
A
0258-4646(2016)12-1110-05
10.12007/j.issn.0258⁃4646.2016.12.012
沈阳市重点实验室建设专项(No F14⁃181⁃1⁃00);沈阳市科学技术计划(F13⁃221⁃9⁃36);沈阳市公益类科技项目
杨彪(1984-),男,博士研究生.
肖纯凌,E-mail:xiaochunling@symc.edu.cn
2015-12-28
网络出版时间:
