Kr1基因在小麦×玉米远缘杂交中的表达及甲基化变异
2016-12-15赵维萍阮在浩
蔡 华,赵维萍,葛 奇,阮在浩
(滁州学院生物与食品工程学院,安徽滁州 239000)
Kr1基因在小麦×玉米远缘杂交中的表达及甲基化变异
蔡 华,赵维萍,葛 奇,阮在浩
(滁州学院生物与食品工程学院,安徽滁州 239000)
Kr1基因是小麦远缘杂交不亲和主效基因,为了解其表达及调控机制,本研究系统比较了小麦自花授粉和小麦×玉米远缘杂交两个过程中 Kr1基因的表达差异,同时分析了这两个过程中 Kr1基因部分序列的DNA甲基化状态。结果表明, Kr1基因在小麦自花授粉过程中始终处于低量表达或不表达状态,而在小麦×玉米远缘杂交过程中的表达呈动态变化,具体表现为授粉前低量表达,授粉后迅速大量表达,24 h后又恢复为低量表达,高峰表达时期在外源花粉授入后0.5~2 h左右。DNA甲基化分析显示,小麦自花授粉前后 Kr1基因一直处于较高水平的甲基化状态,分别为58%和62%;而在授以玉米花粉后, Kr1基因迅速去甲基化,在0.5 h内降到12%,在其后的1、2、24 h内一直维持在10%~12%的低甲基化水平,表明DNA甲基化修饰参与了 Kr1基因在小麦×玉米远缘杂交中的表达调控。
小麦; Kr1基因;远缘杂交;DNA甲基化
小麦(TriticumestivumL.)近缘属种中蕴藏着大量优异基因,通过远缘杂交将其转移到小麦中,这对丰富小麦遗传基础、选育优良新品种具有重要意义[1]。然而,小麦远缘杂交面临的首要问题是突破来自不同基因组双亲的杂交不亲和(Cross-incompatibility,CI)障碍。细胞遗传学研究表明,位于5B染色体上的 Kr1 基因是小麦远缘杂交不亲和主效基因[2-5]。Alagu等用中国春5B单体( kr1kr1,2n=41)× Mara( Kr1Kr1,2n=42)构建的重组自交系群体(Recombinant Inbred Lines,RIL)进行cDNA-AFLP分析,获得一条长751 bp 的 Kr1基因差异表达cDNA片段[6]。我们以此序列为模板,在中国春中同源克隆了一条DNA序列,该序列与NCBI网站上已公布的小麦自交不亲和(Self-incompatibility,SI)S位点受体激酶基因相同区域的同源性达87%[7],但迄今 Kr1基因完整的分子结构仍不清楚。研究发现,小麦远缘杂交的不亲和性在不同杂交系统中表现各异,例如用亲缘关系较近的黑麦或球茎大麦的花粉给小麦授粉时,极难获得杂种胚,而用亲缘关系较远的玉米或鸭茅状摩擦禾的花粉给小麦授粉时,杂种胚的获得率可达30%以上[8-10],这种不亲和性的差异与植物远缘杂交的正常机制不符。在小麦×玉米远缘杂交中还发现,相同基因型小麦与不同基因型玉米杂交时,杂种胚的获得率差异显著,且受低温、暗培养、不同2,4-D处理等外界环境因素影响显著[11-16]。目前小麦远缘杂交不亲和性的分子机制尚不清楚。
研究表明,远缘杂交过程中会出现大量DNA胞嘧啶甲基化变异[17-19],它关闭或启动某些基因的转录表达[20-21]。如在水稻[22-23]、玉米[24]等远缘杂交的研究中发现,杂交后代DNA 甲基化变异与基因表达调控密切相关。Liu 等[25-26]发现小麦远缘杂交和异源多倍体化过程中会诱发稳定遗传的胞嘧啶甲基化变异,变异的序列包括低拷贝编码和非编码序列。张 勇等[27]在小麦-黑麦易位系中发现,外源种质可以诱发小麦基因组发生广泛的DNA甲基化变异。Shaded等[28]比较了一粒小麦×山羊草远缘杂交过程中全基因组的甲基化变异,发现8.7%的CpG 甲基化位点发生了变异,与亲本相比,有4.4%的甲基化变异是在异源多倍体中发生的。针对上述问题,本研究在前期已克隆小麦 Kr1基因部分片段的基础上,以小麦×玉米远缘杂交为试验对象,研究授粉前后不同时间段小麦柱头 Kr1基因的表达差异;采用亚硫酸氢盐修饰后测序法(Bisulfite Sequencing,BS),分析外源花粉导入引发小麦 Kr1基因发生DNA 甲基化的变异特性,解析DNA甲基化作用于小麦远缘杂交产生表观遗传变异的分子机制,以期为揭示小麦远缘杂交不亲和机制、促进小麦遗传改良和种质创新提供理论依据。
1 材料与方法
1.1 材 料
试验所用材料种植于滁州学院试验田。试验所用的普通小麦种质为中国春,玉米品种为凤糯1号。小麦于适播期种植于试验田。为使小麦与玉米的花期相遇,自1月2日起,每隔7 d播种30粒玉米于塑料小盆钵营养土中,置于15 ℃生长箱使幼苗越冬,期间给予每天12 h光照,共播种8批。玉米幼苗于3月上旬移栽至小麦试验田,用于远缘杂交授粉。
1.2 方 法
1.2.1 基因组DNA提取
小麦开花前2~3 d进行人工去雄,套袋隔离。1~2 d后收集供试的新鲜玉米花粉和新鲜小麦花粉,分别给去雄的麦穗逐花授粉,授粉后仍套袋隔离,并标记自花授粉和小麦×玉米远缘杂交授粉的麦穗。分别采集开花前、自花授粉和远缘杂交授粉后0.5、1、2、24 h的麦穗,剥取小花内的子房用于提取基因组DNA。基因组DNA提取参照TransGen公司(北京)的试剂盒EasyPure Plant Genomic DNA Kit说明书进行。
1.2.2 总RNA提取及cDNA第一链合成
参照宝生物工程(大连)有限公司的TaKaRa试剂盒RNAiso Plus说明书分别提取开花前、自花授粉和小麦×玉米远缘授粉后0.5、1、2、24 h的小麦子房总RNA。参照TaKaRa试剂盒PrimeScript 1st Strand cDNA Synthesis Kit说明书反转录cDNA第一链。
1.2.3 Kr1基因表达的RT-PCR分析
根据已公布的小麦 Kr1基因cDNA序列(Genbank登录号:167554889),利用Primer 5.0软件设计多对outer和inner引物,在中国春cDNA中进行5′和3′延伸,最后获得1条长1 273 bp的cDNA片段,再以此序列为模板,设计特异引物KR1-F1:5′-GCTGTGGTTCTTCTTCC GCTAC-3′和KR1-R1:5′-CCAAGGTCCTGA TTTCCA-3′ (由上海英俊生物科技有限公司合成),利用MG96G-PCR仪进行RT-PCR分析。
为使不同处理的小麦子房试验样品标准一致,以小麦微管蛋白Tubulin基因( Genbank登录号:DQ435662.1)作为内参,内参引物序列为F1:5′-TGCAAATCTTCGTCAAAACCC-3′和R1:5′-GGGAATGGGTAGACAAGACACT-3′。以反转录产物单链cDNA为模板进行PCR扩增。首先根据内参引物的PCR结果调整各样品的cDNA模板浓度,使所扩增Tubulin基因的电泳条带亮度一致,进一步确定所需单链cDNA的模板量。 Kr1基因特异引物的半定量PCR反应体系总体积为10 μL,各成分如下:Trans 2×EasyTaq○RPCR SuperMix 5 μL、1 μmol·L-1上下游引物各0.5 μL、cDNA模板1 μL,加灭菌超纯水至10 μL。PCR反应程序如下:94 ℃ 预变性3 min;94 ℃变性45 s,56 ℃退火45 s,72 ℃延伸1.5 min,35次循环;72 ℃延伸10 min。
1.2.4 Kr1基因的甲基化反应及其测序
采用亚硫酸氢盐修饰后测序法分析小麦远缘杂交前后 Kr1基因的甲基化反应。基因组DNA的亚硫酸氢盐转换处理(包括纯化和脱磺基反应)、处理后DNA的回收、脱磺基、中和、纯化等过程均按上海生工UNIQ-10 Column Methy DNA Purification Kit0试剂盒说明,参照汪艳杰等[29]的方法进行。
根据本实验室前期获得的 Kr1基因DNA序列[7],应用Primer 5.0软件设计特异引物扩增经亚硫酸氢盐转换后的 Kr1基因DNA序列,分析甲基化变异。用于设计引物的序列经过methyl primer express software v1.0软件转换,其中C转换为T,但CpG的C因甲基化修饰保持不变,仍为C,通过分析经亚硫酸氢盐转换处理后的 Kr1基因PCR产物测序结果,判断CpG是否发生甲基化,每次测序均挑选10个克隆,CpG发生甲基化比例=甲基化的CpG数目/(甲基化的CpG数目+非甲基化的CpG数目)×100%。用于甲基化分析的引物序列为KR1-F2:5′-AAGATA AGTATTTTGGGA-3′和KR1-R2:5′-CTCC ACGCTTCACCCTT-3′。
经亚硫酸氢盐转换处理后的 Kr1基因的PCR扩增反应总体系为50 μL,各成分如下:处理纯化的DNA模板3 μL、引物KR1-F2和KR1-R2各1 μL、dNTPs 1 μL、10×PCR Buffer(with Mg2+)5 μL、5 U·μL-1Taq酶0.8 μL、灭菌超纯水 38.2 μL。PCR反应程序如下:98 ℃预变性4 min;20个循环,94 ℃变性45 s,66 ℃退火45 s,72 ℃延伸1 min;20循环,94 ℃变性45 s,56 ℃退火45 s,72 ℃延伸1 min;72 ℃延伸8 min。3%凝胶电泳观察结果,并使用胶回收纯化试剂盒回收纯化PCR产物。PCR扩增产物交由南京金斯瑞公司纯化、TA克隆后测序。
1.2.5 序列分析
应用DNAMAN软件的Alignment对测序结果进行同源性比对,并在NCBI网站(http://blast.ncbi.nlm.nih.gov/)上进行BLAST分析。应用序列处理在线工具包(http://www.bio-soft.net/sms/index.html)寻找被测序列的最大开放阅读框ORF等。
2 结果与分析
2.1 基因组DNA和总RNA
普通小麦中国春各个处理样品的基因组DNA和总RNA凝胶电泳检测见图1。从图1可见,各处理的基因组DNA和总RNA浓度基本一致,纯度较好,可以作为后序PCR反应的扩增模板。
2.2 Kr1基因在小麦×玉米远缘杂交中的表达分析
以Tubulin内参调平后的cDNA为模板,以KR1-F1和KR1-R1为特异引物,对小麦自花授粉和小麦×玉米远缘杂交前后不同时间段的小麦子房进行RT-PCR扩增,PCR产物经电泳检测如图2,挑出有产物的条带纯化后测序。序列分析表明,该cDNA片段与模板序列同源率达98.34%,表明扩增产物为目的基因片段。图2同时显示,小麦 Kr1基因的表达在自花授粉和远缘杂交过程中截然不同。自花授粉时,开花前 Kr1基因低量表达,自花授粉后 Kr1基因基本失活,表明自花授粉在一定程度上抑制了柱头中 Kr1基因的表达,这与小麦属于严格自花闭花授粉植物的自交亲和特性相符;远缘杂交过程中, Kr1基因的表达呈现剧烈变化,在小麦柱头接受到玉米花粉0.5 h内迅速大量表达,并一直维持到授粉后2 h左右才逐渐降低,24 h后 Kr1基因的表达量接近开花前的较低水平,表明远缘杂交过程促进了小麦柱头中 Kr1基因的表达。综合以上试验结果,初步推断 Kr1基因在小麦自花授粉系统中处于低量表达至不表达状态,而在小麦×玉米远缘杂交系统中的表达特性为:授粉前低量表达→授粉后表达迅速上升→随后表达量逐渐降低→一段时间后又恢复为低量表达,高峰表达时期在玉米花粉授入后0.5~2 h左右。
A图为基因组DNA; B图为总RNA; M:Marker;1:开花前的子房; 2:自花授粉0.5 h后的子房; 3:授玉米花粉0.5 h后的子房; 4:授玉米花粉1 h后的子房; 5:授玉米花粉2 h后的子房; 6:授玉米花粉24 h后的子房。
A figure is genomic DNA ;B figure is total RNA;M:Marker;1:Ovary before flowering;2:Ovary after self-pollination 0.5 h;3:Ovary after granting maize pollen 0.5 h;4:Ovary after granting maize pollen 1 h;5:Ovary after granting maize pollen 2 h;6:Ovary after granting maize pollen 24 h.
图1 小麦基因组DNA和总RNA
Fig.1 Genomic DNA and total RNA of wheat

M:Marker;1:开花前的子房; 2:自花授粉0.5 h后的子房; 3:授玉米花粉0.5 h后的子房; 4:授玉米花粉1 h后的子房; 5:授玉米花粉2 h后的子房; 6:授玉米花粉24 h后的子房。
M:Marker;1:Ovary before flowering;2:Ovary after self-pollination 0.5 h;3:Ovary after granting maize pollen 0.5 h;4:Ovary after granting maize pollen 1 h;5:Ovary after granting maize pollen 2 h;6:Ovary after granting maize pollen 24 h.
图2 Kr1基因在小麦×玉米中的表达
Fig.2 Kr1 gene expression in wheat×maize
2.3 Kr1基因的DNA 甲基化分析
亚硫酸氢盐转换处理过的基因组DNA经特异引物KR1-F2和KR1-R2扩增,PCR产物长212 bp(图3)。回收测序分析结果表明,与模板 Kr1基因cDNA序列(Genbank登录号:167554889)相比,CG的胞嘧啶C不变,非CG的胞嘧啶C全部转换为T(图4),说明亚硫酸氢盐对小麦 Kr1基因的DNA序列转换充分。从各处理的 Kr1基因甲基化状态,以及由此统计分析得到各个样品的甲基化水平和变化特点(图5和表1)可以看出,在小麦自花授粉系统中,开花前和自花授粉0.5 h后的子房中 Kr1基因一直处于较高的甲基化水平状态,CpG发生甲基化的比例分别为58%和62%。高水平的甲基化会显著抑制 Kr1基因的表达,这也较好地解释了 Kr1基因在小麦开花前的低量表达和自花授粉0.5 h后不表达的现象。

a:开花前的子房; b:自花授粉0:5 h后的子房; c:授玉米花粉0.5 h后的子房; d:授玉米花粉1 h后的子房; e:授玉米花粉2 h 后的子房; f:授玉米花粉24 h后的子房。
a:Ovary before flowering;b:Ovary after self-pollination 0.5 h;c:Ovary after granting maize pollen 0.5 h;d:Ovary after granting maize pollen 1 h;e:Ovary after granting maize pollen 2 h;f:Ovary after granting maize pollen 24 h.
图3 Kr1基因经亚硫酸氢盐转换后的基因组DNA-PCR
Fig.3 Kr1 gene after sulfite conversion genomic DNA-PCR
在小麦×玉米远缘杂交系统中, Kr1基因甲基化水平在杂交前后发生了极明显的变化。授粉前小麦子房中 Kr1基因的高水平甲基化状态在受到玉米花粉刺激后迅速降低(图5),在授粉后0.5 h很短的时间内, Kr1基因甲基化水平由58%快速降到12%,其后的1、2、24 h内一直维持在10%到12%的低甲基化水平,说明小麦×玉米远缘杂交引起 Kr1基因明显去甲基化变异。

引物序列用下画线标出,每一个CpG 位点都用加框显示。
The primer sequence is marked with a line, and each CpG locus is displayed in a box.
图4 小麦 Kr1基因DNA 序列(上链)和亚硫酸氢盐转换后的DNA 序列(下链)
Fig.4 DNA sequence of wheat Kr1 gene(up-chain) and DNA sequence after sulfite conversion(down-chain)
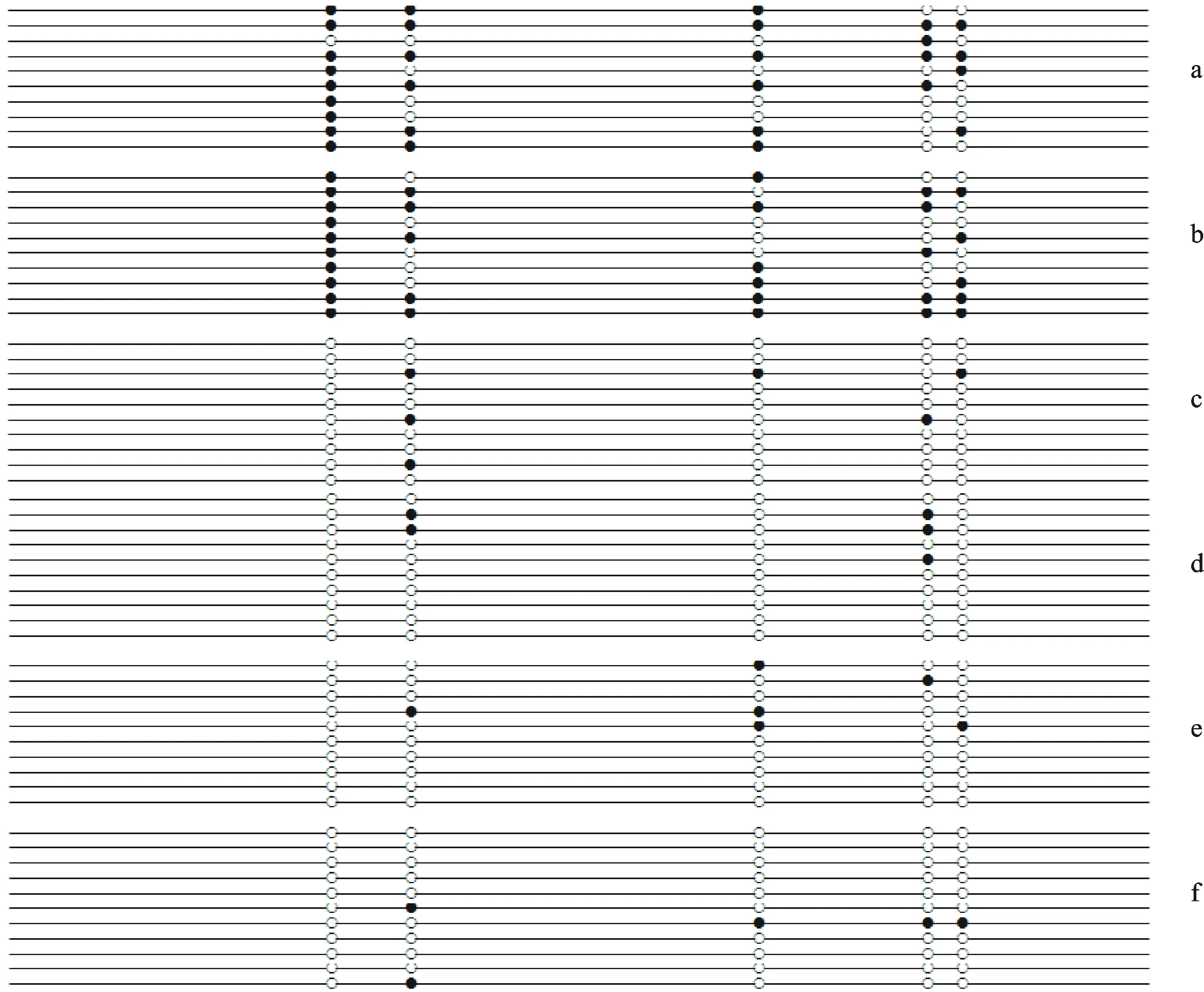
a:开花前的子房; b:自花授粉0.5 h后的子房; c:授玉米花粉0.5 h后的子房; d:授玉米花粉1 h后的子房; e:授玉米花粉2 h后的子房; f:授玉米花粉24 h后的子房;○和●分别代表没有甲基化的和甲基化的CpG。
a:Ovary before flowering;b:Ovary after self-pollination 0.5 h;c:Ovary after granting maize pollen 0.5 h;d:Ovary after granting maize pollen 1 h;e:Ovary after granting maize pollen 2 h;f:Ovary after granting maize pollen 24 h;○and ● represent no methylation and methylation of CpG,respectively.
图5 小麦 Kr1基因的甲基化状态
Fig.5 Methylation status of Kr1 gene in wheat
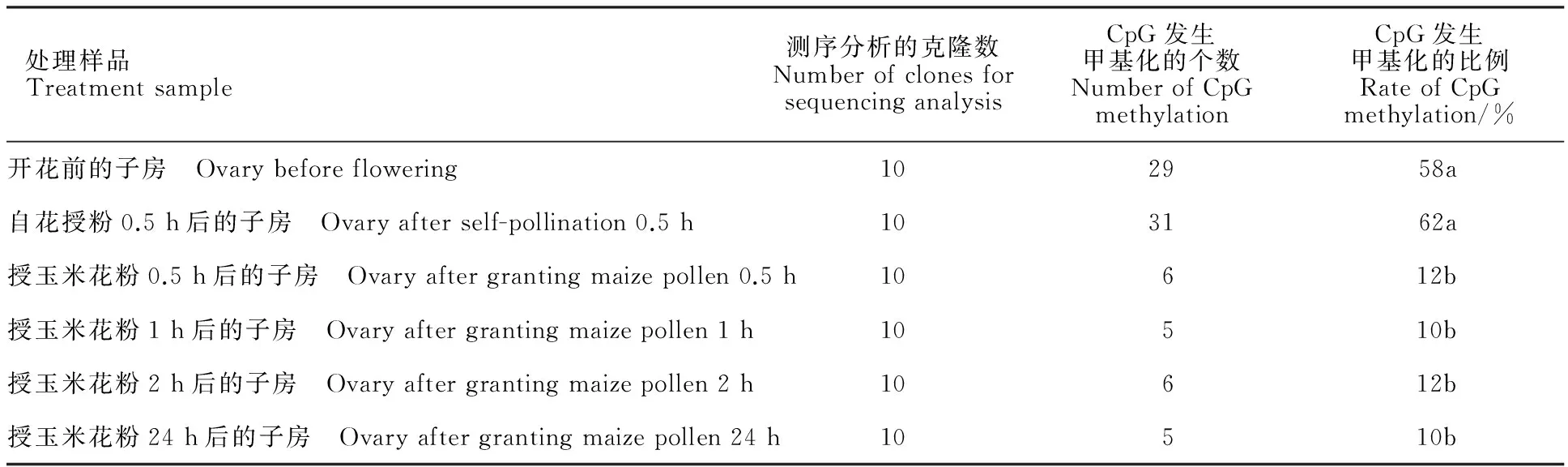
表1 各处理的 Kr1基因甲基化水平
3 讨 论
植物授粉过程极其复杂,有时基因型相同的雌雄配子间并不能自交结实,即自交不亲和;有时完全不同种属之间的雌雄配子却可以突破天然生殖障碍而实现远缘杂交。远缘杂交对植物基因组进化和新物种形成具有创造性作用[30]。在小麦中, Kr1基因失活是实现远缘杂交的关键。遗传学研究认为,失活的 Kr1基因是隐性基因,敏感的 Kr1基因则表现为显性,如中国春和黑麦远缘杂交的结实率为86.39%,其基因型为纯合隐性 kr1kr1;“四棱白麦”和黑麦远缘杂交的结实率为0,其基因型为纯合显性 Kr1Kr1[31],但迄今显、隐性 Kr1基因的分子结构差异并不清楚。本文比较了小麦自花授粉和小麦×玉米远缘杂交两个系统中 Kr1基因的表达差异,结果显示, Kr1基因在小麦自花授粉过程中处于不表达或低量表达状态,而在小麦×玉米远缘杂交过程中的表达是变化的;自花授粉过程在一定程度上抑制了柱头 Kr1基因的表达,远缘杂交过程有效促进了小麦柱头 Kr1基因的表达。据此我们推测,小麦柱头 Kr1基因应该对自身花粉不敏感,而对远缘物种的花粉敏感,这一点与芸薹属异花授粉植物的自交不亲和性正好相反。张爱芬等[32]对不结球白菜自交不亲和基因srk片段的克隆与表达分析表明,srk基因主要在自交不亲和系的柱头中高度表达,而在自交亲和系中的表达量最低。srk基因在芸薹属植物中的自交不亲和性可能类似于 Kr1基因在小麦远缘杂交中的杂交不亲和性,我们前期克隆的 Kr1基因DNA序列与小麦srk基因(Genbank登录号:AY963808)共同区域的同源性达87%[7],但进一步的分析表明,该共同区域仅为115 bp,位于srk基因的第3外显子内,因此并不能充分证明 Kr1基因和srk基因的同源关系。而且除 Kr1基因外,在小麦5A染色体短臂上还存在另外一个抑制远缘杂交的 Kr2基因。同时, Kr1和 Kr2均存在等位的隐性基因,而仅显性Kr基因才具有抑制远缘杂交的能力。因此,小麦远缘杂交不亲和Kr基因和自交不亲和srk基因之间的相互关系及作用机制仍需进一步研究。
小麦远缘杂交和异源多倍体化可诱发稳定遗传的基因组变异和胞嘧啶甲基化变异[25]。本实验表明,小麦 Kr1基因在自花授粉前后一直处于高水平的甲基化状态,但授以玉米花粉后, Kr1基因的甲基化水平迅速降低,并在相当长时间内维持在低水平状态。Lippman 等[33]对拟南芥DNA甲基化与基因抑制表达的研究表明,自交能导致甲基化程度的逐渐积累,而杂交能使甲基化程度得以解除或重新编排。因此, Kr1基因在自交过程中的高甲基化以及与玉米远缘杂交过程中的迅速去甲基化应该有效调控 Kr1基因在自交和远缘杂交系统中的表达,并最终引发小麦自交亲和及远缘杂交不亲和。结合玉米花粉授后不同时间段小麦 Kr1基因的表达变化,推测其可能的调控机制为:在接触外源花粉前,高水平的甲基化修饰使小麦柱头 Kr1基因的表达处于抑制状态,而玉米花粉的刺激使小麦柱头的 Kr1基因迅速去甲基化,促使 Kr1基因大量表达,在很短时间内激活胼胝质反应,形成胼胝质塞,阻碍玉米花粉在小麦柱头上萌发生长和花粉管进入胚囊,进而抑制远缘杂交。但这种甲基化对基因表达的调控可能不是唯一的,这是因为,小麦 Kr1基因表达在远缘杂交后是动态变化的,先是迅速大量表达,一段时间后又逐渐降低;而甲基化水平仅在杂交前后出现剧烈变化,杂交后不同时间内的去甲基化变异并不显著。需要说明的是,因小麦自花授粉过程的准确时间难以确定,本次试验的“自花授粉”是用同一基因型的小麦花粉给去雄的小麦柱头授粉,以获得自花授粉后不同时间段的试验材料。这种采用人工去雄和人工授粉相结合的“自花授粉”是否会对小麦 Kr1基因的表达及甲基化产生影响,尚需研究。
普通小麦含有AA、BB、DD三套染色体组,虽属严格自花授粉植物,但其进化过程中涉及三次远缘杂交及染色体天然加倍,表明其基因组可能具有易于远缘杂交的天然特性[34]。但实际上,小麦远缘杂交很难实现,而且杂交亲和性对外源花粉的敏感性差异极大。如 Kr1基因在小麦×黑麦中敏感,难以杂交成功,而在小麦×玉米中,却可能获得较高频率的杂种胚。而且即使在小麦×玉米中,相同基因型的小麦与不同基因型的玉米杂交时,杂种胚获得率也差异显著。结合本次试验结果,我们推测,小麦远缘杂交不亲和基因的表达受外界环境,尤其是外源花粉的影响巨大;其在小麦×玉米中可能表现出较高亲和性,这也许与玉米基因组含有大量转座子有关,即在玉米花粉与小麦柱头融合过程中,不同基因型玉米的转座子可能会不同程度地插入到小麦远缘杂交不亲和基因内部,导致该基因不同程度的失活,最终引起不同杂交组合的亲和性产生差异。
[1]WANG D W.Wide hybridization:engineering the next leap in wheat yield [J].JournalofGeneticsandGenomics,2009,36(9):509-510.
[2]LAURIE D A,BENNETT M D.The effect of the crossability loci Kr1 and Kr2 on fertilization frequency in hexaploid wheat × maize crosses [J].TheoreticalandAppliedGenetics,1987,73(6):403-409.
[4]ISABELLE B,LESLEY F,TRACIE N F,etal.Development of consistently crossable wheat genotypes for alien wheat gene transfer through Wne-mapping of the Kr1 locus [J].TheoreticalandAppliedGenetics,2009,119(8):1371-1381.
[5]ALAGU M,TAKATO K,KOHEI M,etal.Molecular characterization of crossability gene Kr1 forintergeneric hybridization inTriticumaestivum(Poaceae:Triticeae) [J].PlantSystematicsandEvolution,2009,278(1):125-131.
[6]ALAGU M,TAKATO K,KOHEI M,etal.Identification of differential gene expression for Kr1 gene in bread wheat using annealing control primer system [J].MolecularBiologyReports,2009(36):2111-2118.
[7]CAI H,LIU Q Q.Characrerizing the sequences ofKrgene in different genotypes of common wheat [J].TriticeaeGenomicsandGenetics,2012,3(4):38-43.
[8] 李大玮,欧阳平,邱纪文.小麦Kr基因在小麦与玉米或鸭茅状摩擦禾杂交中的失活[J].遗传学报,1996,23(6):453-459.
LI D W,OU Y P,QIU J W.Inaeitvation of genesKrof wheat in the crosses with maize andTripsacumdactyloides[J].JournalofGeneticsandGenomics,1996,23(6):453-459.
[9]PERSHINA L A,DEVYATKINA E P,TRUBACHEEVA N V,etal.Characterization of fertility restoration in alloplasmic lines derived from hybridization of self-fertilized offspring of barley-wheat(HordeumvulgareL.×TriticumaestivumL.) amphiploid with common wheat varieties Saratovskaya 29 and Pyrotrix 28 [J].RussianJournalofGenetics,2012,48(12):1184-1190.
[10]HARINDER K C,TISU T,VINEETA K,etal.Enhancing the efficiency of wide hybridization mediated chromosome engineering for high precision crop improvement with special reference to wheat ×Imperatacylindricasystem [J].TheNucleus,2013,56(1):7-14.
[11]蔡 华,马传喜,司红起,等.提高小麦×玉米产生的单倍体成胚率的研究[J].麦类作物学报,2005,25(6):28-32.
CAI H,MA C X,SI H Q,etal.Study on increasing frequency of haploid embryo production through wheat× maize [J].JournalofTriticeaeCrops,2005,25(6):28-32.
[12]蔡 华,马传喜,司红起,等.利用小麦与玉米远缘杂交诱导小麦双单倍体的研究进展[J].麦类作物学报,2006,26(4):154-157.
CAI H,MA C X,SI H Q,etal.Advance on producing double haploid of wheat by wide hybridization between wheat and maize [J].JournalofTriticeaeCrops,2006,26(4):154-157.
[13]陈新民,王凤菊,李思敏,等.小麦与玉米杂交产生小麦单倍体与双单倍体的稳定性[J].作物学报,2013,12:2247-2252.
CHEN X M,WANG F J,LI S M,etal.Stable production of wheat haploid and doubled haploid by wheat × maize cross[J].ActaAgronomicaSinica,2013,39(12):2247-2252.
[14]顾 坚,刘 琨,李绍祥,等.小麦×玉米杂交诱导小麦单倍体的割穗离体培养研究[J].麦类作物学报,2008,28(1):1-5.
GU J,LIU K,LI S Q,etal.Study on theinvitroculture of cut plant in wheat haploid embryo induction by wheat × maize cross [J].JournalofTriticeaeCrops,2008,28(1):1-5.
[15]来长凯,王成社,闫 林.冬小麦×玉米远缘杂交产生小麦单倍体胚的研究[J].麦类作物学报,2007,27(2):193-196.
LAI C K,WANG C S,YAN L.Study on haploid embryo production of wheat by distant hybridization between winter wheat and maize [J].JournalofTriticeaeCrops,2007,27(2):193-196.
[16]NIU Z X,JIANG A X,HAMMAD W A,etal.Review of doubled haploid production in durum and common wheat through wheat × maize hybridization [J].PlantBreeding,2014,133(3):313-320.
[17]HENDERSON I R,JACOBSEN S E.Epigenetic inheritance in plants [J].Nature,2007,447(24):418-424.
[18]LISTER R,O′MALLEY R C,TONTI-FILIPPINI J,etal.Highly integrated single-base resolution maps of the epigenome inArabidopsis[J].Cell,2008,133(3):523-536.
[19]XIAO W,CUSTARD K D,BROWN R,etal.DNA methylation is critical forArabidopsisembryogenesisand seed viability [J].ThePlantCell,2006,18(4):805-814.
[20]SCHOB H,GROSSNIKLAUS U.The first high-resolution DNA “methylome”[J].Cell,2006,126(6):1025-1028.
[21]ZHANG M S,KIMATU J N,XU K Z,etal.DNA cytosine methylation in plant development[J].JournalofGeneticsandGenomics,2010,37(1):1-12.
[22]DONG Z Y,WANG Y M,ZHANG Z J,etal.Extent and pattern of DNA methylation alteration in rice lines derived from introgressive hybridization of rice andZizanialatifoliaGriseb [J].TheoreticalandAppliedGenetics,2006,113(2):196-205.
[23]WANG Y P,WANG X Y,LEE T H,etal.Gene body methylation shows distinct patterns associated with different gene origins and duplication modes and has a heterogeneous relationship with gene expression inOryzasativa(rice)[J].NewPhytologist,2013,198(1):274-283.
[24]ZHAO X X,CHAI Y,LIU B.Epigenetic inheritance and variation of DNA methylation level and pattern in maize intra-specific hybrids [J].PlantScience,2007,172(5):930-938.
[25]LIU B,VEGA J M,FELDMAN M.Rapid genomic changes in newly synthesized amphiploids ofTriticumandAegilops.II.Changes in low-copy coding DNA sequences [J].Genome,1998,41(4):535-542.
[26]LI Y D,SHAN X H,LIU X M,etal.Utility of the methylation-sensitive amplified polymorphism(MSAP) marker for detection of DNA methylation polymorphism and epigenetic population structure in a wild barley species(Hordeumbrevisubulatum)[J].EcologicalResearch,2008,23(5):927-930.
[27]张 勇,刘朝辉,刘 成,等.外源种质导入引发小麦表观遗传变异的MSAP分析[J].科学通报,2007,52(24):2857-2865.
ZHANG Y,LIU Z H,LIU C,etal.MSAP analysis of epigenetic during exogenous germplasm guide into wheat genome[J].ChineseScienceBulletin,2007,52(24):2857-2865.
[28]SHADED H Z,KASHKUSH K,OZKAN H,etal.Sequence elimination and cytosine methylation are rapid and reproducible responses of the genome to wide hybridization and allopolyploidy in wheat [J].PlantCell,2001,13(8):1749-1759.
[29]汪艳杰,龙 鸿,姚家玲.亚硫酸氢钠测序法检测水稻FIE基因CpG岛甲基化状态[J].植物科学学报,2011,29(1):134-139.
WANG Y J,LONG H,YAO J L.Analysis of methylation at CpG island ofFIEin rice by bisulfite sequencing [J].PlantScienceJournal,2011,29(1):134-139.
[30]郝艾馨,蓝兴国,王 宇,等.KR1-SCR转基因拟南芥自交不亲和性的研究进展[J].植物生理学报,2013,49(11):1113-1120.
HAO AX,LAN XG,WANG Y,etal.Advance in self-Incompatibility ofArabidopsisthalianawith the transgetic KR1-SCR[J].PlantPhysiologyJournal,2013,49(11):1113-1120.
[31]亓增军,李晴祺,王洪刚.山东地方普通小麦品种与黑麦杂交亲和性的研究[J].华北农学报,1999,14(2):1-5.
QI Z J,LI Q Q,WANG H G.Crossability of some land wheat races from Shandong with rye [J].ActaAgriculturaeBoreali-Sinica,1999,14(2):1-5.
[32]张爱芬,王 立,侯喜林,等.不结球白菜S位点受体激酶基因片段的克隆与表达分析[J].南京农业大学学报,2011,34(3):25-30.
ZHANG A F,WANG L,HOU X L,etal.Cloning and expression analysis of Kr1 gene fragment in non-heading Chinese cabbage [J].JournalofNanjingAgriculturalUniversity,2011,34(3):25-30.
[33]LIPPMAN Z,GENDREL A V,BLACK M,etal.Role of transposable elements in heterochromatin and epigenetic control [J].Nature,2004,430(6998):471-476.
[34] 郝 明,罗江陶,杨 敏,等.普通小麦中两个ph系杂种对部分同源染色体配对的影响[J].四川农业大学学报,2010,28(4):403-406.
HAO M,LUO J T,YANG M,etal.Effects of hybrid backgrounds between two ph lines on homoeologous chromosome pairing [J].JournalofSichuanAgriculturalUniversity,2010,28(4):403-406.
Expression of Kr1 Gene and Its Methylation Variation in Wheat × Maize Distant Hybridization
CAI Hua,ZHAO Weiping,GE Qi,RUAN Zaihao
(School of Biological and Food Engineering, Chuzhou University, Chuzhou,Anhui 239000, China)
Kr1 gene is the major gene regulating incompatibility in wheat distant hybridization. To understand its expression and regulation mechanism, the difference of Kr1 expression in the two systems of wheat self-pollination and wheat × maize distant hybridization were compared systematically in this work, and the variations of DNA methylation of Kr1 gene during the self-pollination and distant hybridization processes were analyzed. The results showed that the expression level of Kr1 gene was always low or even no expression in the process of wheat self-pollination. However, its expression showed a dynamic change in wheat × maize distant hybridization, with low expression before pollination, a rapid great increase of expression after pollination, and low expression after 24 h. The peak expression period was present at about 0.5-2 h after pollinated with the foreign pollen. DNA methylation analysis shows that Kr1 gene stays a high level status before and after the self-pollination, with the proportion of 58% and 62%, respectively. However, after pollinated with maize pollen, Kr1 gene is rapidly de-methylated, dropping to a level of 12% in 0.5 h, and maintains at the low level of 10% to 12% methylation in the subsequent 1, 2, and 24 h. These findings indicate that DNA methylation modification is participated in the expression and regulation of Kr1 gene in wheat × maize distant hybridization.
Wheat; Kr1 gene;Distant hybridization;DNA methylation
时间:2016-07-07
2016-01-06
2016-01-25
安徽省自然科学基金项目(1308085MC34);国家公益性行业(农业)科研专项(201403039);国家重点实验室开放基金项目(ZW2010002)。
E-mail:chczh@163.com
S512.1;S330
A
1009-1041(2016)07-0825-08
网络出版地址:http://www.cnki.net/kcms/detail/61.1359.S.20160707.1529.002.html
