啤酒高分子蛋白检测方法的评估及应用
2016-12-14张彦青李惠萍涂京霞房慧婧李琳
张彦青,李惠萍,涂京霞,房慧婧,李琳
(1.华南理工大学轻工与食品学院,广东广州510640;2.广州珠江啤酒股份有限公司,广东广州510308;3.中国食品发酵工业研究院,北京100027)
啤酒高分子蛋白检测方法的评估及应用
张彦青1,2,3,李惠萍2,涂京霞2,房慧婧2,李琳1
(1.华南理工大学轻工与食品学院,广东广州510640;2.广州珠江啤酒股份有限公司,广东广州510308;3.中国食品发酵工业研究院,北京100027)
通过对考马斯亮蓝法检测啤酒高分子蛋白含量的操作方法进行优化,提升其方法的重复性和稳定性,优化后该方法的重复性和稳定性相对标准偏差(RSD)分别为3.68%和3.92%。同时,对该方法检测的高分子蛋白含量与啤酒泡持性进行了相关性分析。结果表明,巴氏杀菌啤酒泡持值与高分子蛋白含量的Pearson相关系数为0.923(P<0.01);纯生啤酒在贮存3 d、1个月、2个月和4个月的泡持值和其高分子蛋白含量的Pearson相关系数分别为0.700(P<0.01)、0.739(P<0.01)、0.899(P<0.01)和0.883(P<0.01)。表明该方法不仅能用于啤酒高分子蛋白含量的检测,还能用于巴氏杀菌啤酒和纯生啤酒泡持性的监控。
啤酒;高分子蛋白;泡持性;考马斯亮蓝法
啤酒泡沫是啤酒外观质量评价的核心指标,是消费者判断啤酒质量的第一感觉[1]。啤酒中蛋白质对泡沫的影响很大,与泡沫有关的高分子蛋白有脂质转移蛋白(lipid transfer proteins,LTPs)、蛋白质Z、脂质结合蛋白等[2-4]。除蛋白质外,影响啤酒泡沫的还有其他指标,如脂肪等[5]。
国外研究人员对上述泡沫蛋白做了诸多方面的研究,详细研究了其组成、结构和功能[6-7],国内研究人员在此方面也有一些相关研究[8]。随着蛋白质分析技术尤其是二维电泳及质谱技术的不断发展,对啤酒泡沫蛋白的研究也愈加深入[9]。但迄今为止,这些研究主要集中在对泡沫蛋白本质的剖析,而对泡沫蛋白波动量的研究较少,而且复杂的检测方法不利于啤酒企业对泡沫蛋白的监控。目前,啤酒企业尚缺乏简单又行之有效地能反映泡持性的蛋白质检测方法。
采用考马斯亮蓝法检测的啤酒高分子蛋白含量与啤酒泡持值相关性较强,已被很多研究者用于啤酒泡沫蛋白检测,并对方法的检测条件如吸光度值、反应时间、pH值等进行了优化[10-12]。在实际检测过程中发现,该方法检测结果的重复性虽然较好,但在不同时间检测结果的稳定性则较差,这一缺点可能会限制该方法在啤酒企业的推广利用。
本研究对考马斯亮蓝法检测啤酒高分子蛋白含量的方法进行系统评价,同时,针对以往基于巴氏杀菌啤酒中高分子蛋白与泡持性研究情况,对纯生啤酒泡持性和高分子蛋白含量的相关性进一步深入研究。以期改善和提高检测方法的稳定性,为啤酒企业提供简单、方便、可靠的啤酒中高分子蛋白含量的检测方法。
1 材料与方法
1.1 材料与试剂
巴氏杀菌啤酒和纯生啤酒:广州珠江啤酒股份有限公司。
考马斯亮蓝G-25(分析纯):国药集团化学试剂有限公司;牛血清蛋白(分析纯):上海伯奥生物科技有限公司;无水乙醇(分析纯):安徽安特食品股份有限公司;磷酸(分析纯):广州市东红化工厂;十二水合磷酸氢二钠、柠檬酸(分析纯):广州化学试剂厂。
1.2 仪器与设备
V3140型分光光度计:澳大利亚GBC仪器公司;Nibem-T Haffman泡沫测定仪:荷兰Haffmans公司;LRH-250A生化培养箱:广东省医疗器械厂;HHW21-420 XMTB数显调节恒温水浴锅:余姚市东方电工仪器厂;HI8417 pH计:意大利Hanna公司;MEDIFRIGER-BL型冷冻离心机:西班牙JP SELECTA S.A.仪器公司。
1.3 方法
1.3.1 牛血清蛋白标准曲线的绘制
准确称取40 mg牛血清蛋白,加蒸馏水溶解,并定容至200 mL,配制成200 mg/L牛血清蛋白标准溶液。分别取200mg/L牛血清蛋白标准溶液0mL、1mL、2mL、3mL、4mL、5mL、6mL于试管中,加蒸馏水至10 mL,混匀,分别取1 mL上述标准溶液与5 mL考马斯亮蓝G-250染液,充分混匀,在恒定室温下反应10 min,测其在波长595 nm处的吸光度值,做3个平行试验,绘制牛血清蛋白标准曲线。
1.3.2 高分子蛋白含量测定
称取100 mg考马斯亮蓝G-250溶于50 mL体积分数为95%的乙醇溶液中,加入85%磷酸溶液100 mL,用蒸馏水定容至1 000 mL,过滤至棕色试剂瓶中备用。啤酒样品经除气后用蒸馏水稀释4倍(准确吸取2.5 mL除气啤酒,用蒸馏水定容至10 mL),取1 mL啤酒稀释液与5 mL上述配制好的考马斯亮蓝G-250染色液混合均匀,在恒定室温下反应10 min,于波长595 nm处测定吸光度值,重复3次,根据牛血清蛋白标准曲线回归方程计算啤酒中高分子蛋白的含量。
1.3.3 泡持值的测定
按照国标啤酒分析方法GB/T4928—2008《啤酒分析方法》中仪器法检测啤酒泡持值,平行检测两次,取平均值[13]。
1.3.4 数据分析
采用SPSS 19.0数据处理软件对试验结果进行Pearson相关性分析[14]。
2 结果与分析
2.1 牛血清蛋白标准曲线的绘制
采用考马斯亮蓝法测定不同质量浓度牛血清蛋白的吸光度值,以牛血清蛋白质量浓度(x)为横坐标,吸光度值(y)为纵坐标,绘制出牛血清蛋白标准曲线,结果见图1。
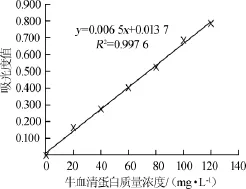
图1 牛血清蛋白标准曲线Fig.1 Standard curve of bovine serum albumin
由图1可知,在牛血清蛋白质量浓度为0~120 mg/L范围内,标准曲线回归方程为y=0.006 5x+0.013 7,相关系数R2=0.997 6。结果表明,牛血清蛋白质量浓度与吸光度值呈良好的线性关系。
2.2 考马斯亮蓝法检测啤酒中高分子蛋白方法优化
2.2.1 染色液颜色对检测结果的影响
在检测过程中发现,染液在静止放置时会出现上清液颜色变浅的现象。染液空白随时间变化的情况结果见图2。由图2可知,染液在放置3周后吸光度值明显下降。染液颜色变化对标准曲线斜率的影响也非常显著,以牛血清蛋白质量浓度(x)为横坐标,以吸光度值(y)为纵坐标,绘制染液放置1周、2周和3周的标准曲线分别为:
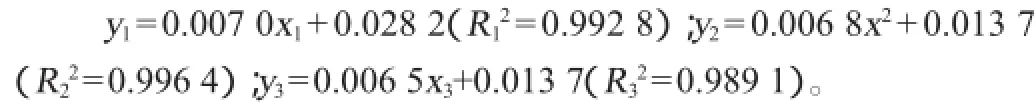
这种标准曲线斜率的变化就会导致检测结果较大的误差。因此,每次比色时严格控制染液的颜色变化,尽量在1周内进行检测。

图2 不同放置时间染液吸光度值的变化Fig.2 Changes of dye solution absorbance values at different time
2.2.2 比色液上层泡沫对检测结果的影响
在用该方法检测啤酒中高分子蛋白含量的过程中,发现染液和样品混合后混合液澄清透明没有气泡的情况下,容易在液面上面产生泡沫,当泡沫比较多时会对吸光度值产生影响。为了清晰地展示泡沫厚度对吸光度值的影响,本研究选取2 mm泡沫厚度(检测方法理想控制值)和5 mm泡沫厚度(混合不当容易导致的结果)对吸光度值的影响。图3为这两个厚度值下同一样品平行检测6次的结果,t检验发现两组结果存在显著性差异(P<0.01)。因此,在检测操作过程中,要尽量小心,不要使液面上面产生过多泡沫,控制泡沫的厚度为2 mm以内。

图3 比色液上层泡沫厚度对吸光度值的影响Fig.3 Effect of the upper foam thickness of color solution on the absorbance value
2.3 考马斯亮蓝法检测结果的重复性和稳定性
通过上述改进,采用考马斯亮蓝法测定啤酒中高分子蛋白含量,在相同操作条件下,进行6次平行试验,计算该方法检测结果的相对标准偏差(relative standard deviation,RSD),重复性试验结果见表1。由表1可知,6次平行试验重复性结果RSD值为3.68%,表明该方法重现性良好。
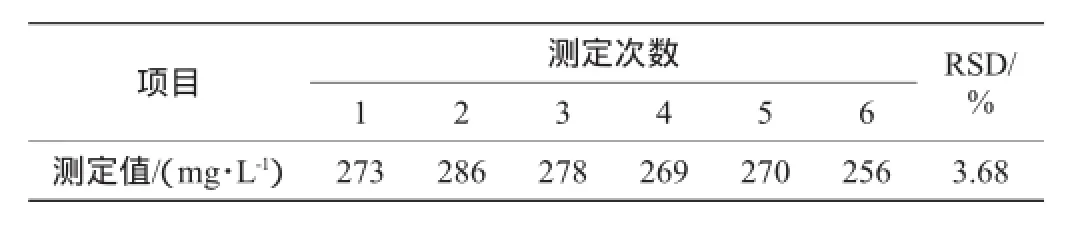
表1 啤酒中高分子蛋白含量重复性试验结果Table 1 Repetitive experiments results of high molecular protein contents in beer
按照相同操作方法,分别放置1 d、2 d、3 d、4 d、5 d和6 d后测定啤酒样品中高分子蛋白含量,计算方法稳定性相对标准偏差(RSD),结果见表2。由表2可知,啤酒中高分子蛋白含量在6 d内,稳定性试验结果RSD值为3.92%,表明该方法稳定性良好。

表2 啤酒中高分子蛋白含量稳定性试验结果Table 2 Stability experiments results of high molecular protein contents in beer
2.4 啤酒中高分子蛋白含量和泡持值的相关性分析
2.4.1 与普通巴氏杀菌啤酒泡持值的相关性
选取17种巴氏杀菌啤酒样品,按照国标法检测啤酒泡持值,并采用考马斯亮蓝法对其高分子蛋白含量进行检测,结果见表3。
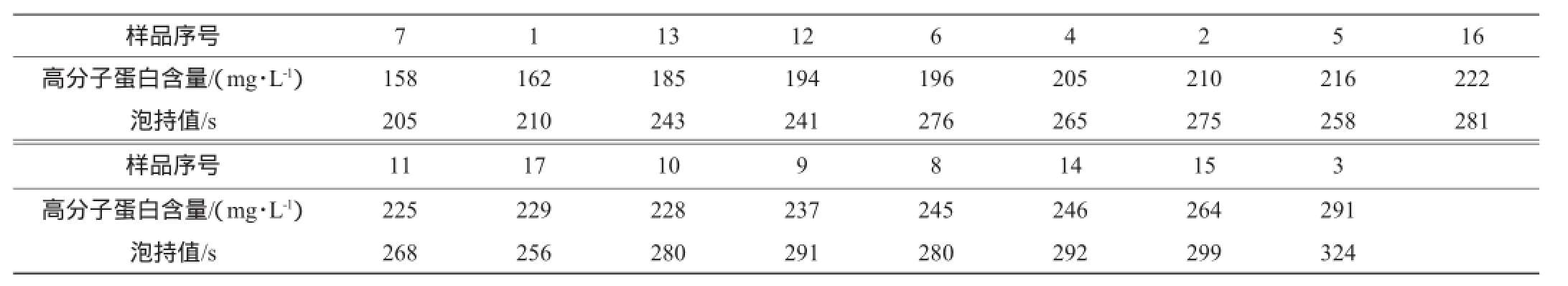
表3 巴氏杀菌啤酒中高分子蛋白含量与泡持值测定结果Table 3 Determination results of high molecular protein contents and foam stability value in pasteurized beer
由表3可知,按照高分子蛋白含量的大小对样品进行排序,发现其与啤酒泡持值大小有较好的对应性。对检测结果进行相关性分析,发现Pearson相关系数为0.923(P<0.01),表明考马斯亮蓝法检测的巴氏杀菌啤酒高分子蛋白含量与其泡持值呈显著正相关,可以用该方法评价巴氏杀菌啤酒泡沫的质量。
2.4.2 与纯生啤酒泡持值的相关性
成品纯生啤酒不经过巴氏杀菌而采用物理膜过滤方式除菌,造成活性蛋白酶A的残留,对高分子蛋白起到分解作用[15]。因此,纯生啤酒在贮存过程中,高分子蛋白含量会一直处在变化过程中。为了研究高分子蛋白含量变化对纯生啤酒泡持值的影响,本研究跟踪分析了13组成品纯生啤酒在贮存过程中高分子蛋白含量与泡持值的变化情况,并进行相关性分析,结果如表4所示。
由表4可知,纯生啤酒贮存3d、1个月、2个月、4个月时,其高分子蛋白含量与泡持值都呈非常显著的正相关,相关系数分别为0.700、0.739、0.899和0.883,这说明在同一时间内,通过测定纯生啤酒高分子蛋白含量高低能反映其泡持值的大小。但由于纯生啤酒在贮存过程中,高分子蛋白含量与泡持值均出现变化,因此,纵向来看,泡持值与高分子蛋白含量之间的相关性呈现出一些规律性的变化,如尽管纯生成品啤酒4个月后的泡持值与其在贮存过程中各个时间段高分子蛋白含量都呈正相关,但4个月时的泡持值与4个月时高分子蛋白含量的相关性更强(相关系数为0.883),与2个月、1个月和3 d时高分子蛋白含量的相关性较弱(相关系数本别为0.866、0.587和0.597)。贮存3 d时的泡持值与各个时间段的高分子蛋白含量也呈现相似的规律。因此,用考马斯亮蓝法检测的高分子蛋白含量能够反映纯生啤酒泡持值的大小。

表4 纯生啤酒贮存过程中高分子蛋白含量与泡持值的相关性分析Table 4 Correlation analysis of high molecular protein content and foam stability value during draft beer storage
3 结论
本研究对考马斯亮蓝法检测啤酒中高分子蛋白含量的方法进行了评估,结果表明,该方法的重复性和稳定性良好,均满足啤酒中高分子蛋白含量的检测要求。在此基础上,对普通巴氏杀菌啤酒和纯生啤酒的高分子蛋白含量与其泡持性的相关性进行了研究,发现该方法检测的高分子蛋白含量不仅能很好地反映巴氏杀菌啤酒的泡持性,也能反映纯生啤酒在贮存过程中的泡持性变化情况。因此,所建立的检测蛋白的方法可用于啤酒企业对啤酒泡持性的质量监控。
[1]EVANS D E,TOLHURST R L,ROBINSON L H,et al.Application of innunological methods to differetiate between foam-positive and hazeactive proteins originating from malt[J].J Am Soc Brew Chem,2003, 61(2):55-62.
[2]KENNETH A L,GRAHAM G S,IAN P M.Beer polypeptides and silica gelpartⅡ.polypeptidesinvolvedinfoamformation[J].J Inst Brew,2003, 109(1):73-79.
[3]SORENSEN S B,BECH L M,MULDBJERG M,et al.Barley lipid transfer protein 1 is involved in beer foam formation[J].Tech Q Master Brew Assoc Am,1993,30:135-145.
[4]EVANS D E,HEJGAARD J.The impact of malt derived proteins on beer foam quality.Part I.The effect of germination and kilning on the level of protein Z4,protein Z7 and LTP1[J].J Inst Brew,1999,105(3):159-169.
[5]杨东升,罗先群,王新广.CO2对啤酒发酵过程中酵母生长代谢及酯的形成影响[J].中国酿造,2013,32(4):70-73.
[6]JEGOU S,DOULIEZ J,MOLLE D,et al.Purification and structural characterization of LTP1 polypeptides from beer[J].J Agr Food Chem, 2000,48(10):5023-5029.
[7]HEJGAAD J.Origin of a dominant beer protein,immunochemical identity with a-amylase-associated protein from barley[J].J Inst Brew,1977, 83(2):94-96.
[8]郝俊光,单连菊,董建军,等.双向电泳和MALDI TOF MS对啤酒泡沫蛋白的鉴定[J].啤酒科技,2010(9):18-22.
[9]刘捷,乔雨轩,祝忠付,等.啤酒胶体稳定性及稳定助剂的研究进展[J].中国酿造2013,32(6):1-4.
[10]HRR V,HERWIG W C.Determination of high molecular weight proteins in beer using coomassie blue[J].J Am Soc Brew Chem,1982, 40:46-50.
[11]李志江.考马斯亮蓝G250染色法测定啤酒中蛋白质含量[J].酿酒,2008,35(1):70-71.
[12]孙浩思,王宏华.制麦过程中浸麦水pH值对泡沫蛋白的影响[J].中国酿造,2010,29(10):90-93.
[13]中华人民共和国国家质量监督检验检疫总局.中国国家标准化管理委员会标准.GB/T 4928—2008啤酒分析方法[S].北京:中国标准出版社,2008.
[14]黄奕雯,戴玉杰,钟成.基于人工神经网络模拟啤酒酿造过程中糖度及乙醇浓度的变化[J].中国酿造,2013,32(1):25-27.
[15]董倩倩,张彦青,李惠萍,等.工业化酿造过程中酵母分泌蛋白酶A的规律及影响因素的研究[J].食品工业科技,2015,36(12):157-161.
Evaluation and application of the detection method for high molecular protein in beer
ZHANG Yanqing1,2,3,LI Huiping2,TU Jingxia2,FANG Huijing2,LI Lin1
(1.College of Light Industry and Food Science,South China University of Technology,Guangzhou 510640,China; 2.Guangzhou Zhujiang Brewery Co.,Ltd.,Guangzhou 510308,China; 3.China National Research Institute of Food and Fermentation Industries,Beijing 100027,China)
Coomassie brilliant blue method for detection of high molecular protein content in beer was optimized to improve the repeatability and stability of the method.The relative standard deviation(RSD)of repeatability and stability of the optimized method were 3.68%and 3.92%,respectively. At the same time,the correlation between the high molecular protein content detected by the method and beer foam stability was analyzed.The results showed that the Pearson correlation coefficient between pasteurized beer foam stability value and high molecular protein content was 0.923(P<0.01). The Pearson correlation coefficient between draft beer foam stability value and high molecular protein content in storage for 3 d,1 months,2 months and 4 months were 0.700(P<0.01),0.739(P<0.01),0.899(P<0.01)and 0.883(P<0.01),respectively.It was found that the method could not only be used to detect high molecular protein content in beer,but also could be used to monitor the foam stability of pasteurized beer and draft beer.
beer;high molecular protein;beer foam stability;coomassie brilliant blue method
TS261.2
0254-5071(2016)11-0172-04
10.11882/j.issn.0254-5071.2016.11.036
2016-05-17
广州市海珠区科技计划项目(2013-ZD-01)
张彦青(1980-),男,高级工程师,博士,研究方向为酿酒工艺技术。
