康复新液对TNBS诱导大鼠溃疡性结肠炎治疗作用的研究
2016-12-13胡婷婷饶朝龙耿福能邓青秀谢晓芳
胡婷婷 饶朝龙 耿福能 邓青秀 谢晓芳*
1.成都中医药大学,四川 成都 611137;2.四川好医生攀西药业有限责任公司,四川 西昌 615000
康复新液对TNBS诱导大鼠溃疡性结肠炎治疗作用的研究
胡婷婷1饶朝龙1耿福能2邓青秀1谢晓芳1*
1.成都中医药大学,四川 成都 611137;2.四川好医生攀西药业有限责任公司,四川 西昌 615000
目的:观察康复新液对2,4,6-三硝基苯磺酸(TNBS)诱导的溃疡性结肠炎模型大鼠的治疗作用。方法:将60只SD大鼠随机分为空白对照组(等体积蒸馏水)、模型对照组(等体积蒸馏水)、柳氮磺吡啶组(SASP,0.6g/kg)、康复新液高、中、低剂量组(20、10、5mL/kg),每组10只,雌雄各半。采用TNBS灌肠造模,造模后第3天开始灌胃给药,连续12d,给药结束后各组取材进行HE染色,并用ELISA法测定结肠组织中髓过氧化物酶(MPO)、肿瘤坏死因子α(TNF-α)、白介素-1β(IL-1β)和白介素-10(IL-10)的水平。结果:造模后大鼠结肠呈明显溃疡样损伤;与空白对照组相比较,模型对照组大鼠结肠组织中促炎相关因子MPO、TNF-α和IL-1β的含量升高(P<0.05),抗炎因子IL-10含量降低(P<0.05);与模型对照组比较,康复新液高剂量组大鼠结肠组织损伤减轻,高、中、低剂量组均能降低大鼠结肠组织中MPO、TNF-α含量(P<0.05),也有降低IL-1β含量和升高IL-10含量的作用趋势。结论:康复新液对TNBS诱导的大鼠结肠炎具有良好的治疗效果,机制可能与调节抗炎因子和促炎因子之间的平衡作用有关。
康复新液;2,4,6-三硝基苯磺酸;溃疡性结肠炎;抗炎作用
溃疡性结肠炎(Ulcerative Colitis,UC)是一种直肠和结肠慢性非特异性炎症性疾病,临床症状常以黏液脓血便、腹痛、腹泻或里急后重为主,病情轻重不一,多呈反复发作;该病的治疗难度大,且与结肠癌的发病有一定的关系[1]。近年来UC的发病率呈上升趋势,并趋于年轻化。但本病的发病机制尚不清楚,目前认为主要与遗传、免疫、感染、环境等因素有关[2]。UC的治疗药物以氨基水杨酸类药物、肾上腺糖皮质激素类药物和免疫抑制剂三类药物为主,其中,氨基水杨酸类药物为治疗轻、中度UC的主要药物,也是维持环节最有效的药物,但毒副作用较大;肾上腺糖皮质激素是单一最有效的抑制急性活动性炎症的药物,但长期使用无维持作用;免疫抑制剂起效慢且毒性较大,主要的副作用是骨髓抑制[3],因此开发更有效而低毒的治疗UC的药物迫在眉睫。康复新液是美洲大蠊干燥虫体的乙醇提取物,常以其干燥或鲜成虫入药,主要成分为多元醇类、肽类、表皮生长因子、粘多糖等活性物质[4]。研究表明[5]康复新液具有抗炎、消肿、促进细胞增殖和新生肉芽组织增长,加速病损组织修复,加快坏死组织脱落,迅速修复各类溃疡及创伤创面,提高机体免疫功能等作用。免疫因素在溃疡性结肠炎发病过程中发挥着重要作用,可触发一个连续的慢性免疫过程,中性粒细胞、巨噬细胞、肥大细胞、T和B淋巴细胞等参与了该过程,这些效应细胞释放的抗体、细胞因子和炎症介质引起组织破坏和炎性病变[6]。因此,实验拟通过观察康复新液对TNBS诱导大鼠溃疡性结肠炎的治疗作用,探讨康复新液治疗溃疡性结肠炎的可能机理,为溃疡性结肠炎的临床治疗提供一定的理论依据。
1 材料
1.1 动物 健康SD大鼠60只,SPF级,体重180~220g,雌雄各半,由四川省中医药科学院实验动物中心提供,动物生产许可证号:SCXK(川)2013-19。
1.2 实验药物 康复新液(批号:20140819,四川好医生攀西药业有限责任公司)为美洲大蠊干燥虫提物,为淡棕色的液体,气微腥臭、味甜。阳性药物为柳氮磺胺吡啶(SASP,批号:09150508,上海信谊天平药业有限公司)。
1.3 实验试剂 水合氯醛(成都市科龙化工试剂厂);2,4,6-三硝基苯磺酸(TNBS,批号:CDBB6609V,购自Sigma公司);无水乙醇(批号:2015031901,成都市科龙化工试剂厂);MPO ELISA试剂盒(批号:21F013,依科赛生物科技(太仓)有限公司);TNF-α ELISA试剂盒(批号:ERC102a)、IL-1β ELISA试剂盒(批号:ERC007)、IL-10 ELISA试剂盒(批号:ERC004)为欣博盛生物科技有限公司产品。
1.4 试剂与药物配制 TNBS的配制:将TNBS按50g/L浓度用纯水进行配制后与无水乙醇等体积混合;水合氯醛溶于生理盐水配成10%的混合液;柳氮磺吡啶研磨碎后用纯水配制成0.6g/kg;康复新液高剂量组为康复新液原液;康复新液中剂量为康复新液原液与纯水按1∶1体积混合;康复新液低剂量为康复新液原液与纯水按1∶3体积混合。
2 方法
2.1 动物模型复制 参照文献[7]的方法制作TNBS诱导的大鼠溃疡性结肠炎模型。将禁食24h的大鼠用10%的水合氯醛3mL/kg的剂量进行腹腔注射麻醉,将麻醉后的大鼠按仰卧姿势固定在硬纸板上,将长12cm、直径2mm左右的橡胶软管管壁均匀抹上凡士林后轻柔缓慢的由大鼠肛门插入至结肠内约8cm处,将TNBS与无水乙醇混合液按80mg/kg剂量注入大鼠结肠内,注入完后轻缓的拔出胶管,为确保TNBS能在肠内分布均匀且不漏出,注入完成后让大鼠呈倒立姿势保持2min后再放回笼中,苏醒后自由饮食进水。
2.2 分组与给药 将健康SD大鼠正常饲养适应环境1周后,按体重随机分为6组,即空白对照组(等体积蒸馏水)、模型对照组(等体积蒸馏水)、柳氮磺吡啶组(SASP,0.6g/kg)、康复新液高、中、低剂量组(20、10、5mL/kg),每组10只,雌雄各半。除空白对照组以外,其余五组按上述方法复制溃疡性结肠炎模型,造模后第3天开始灌胃给药,给药体积20mL/kg灌,每天1次,连续给药12d。实验期间大鼠自由饮水和进食。
2.3 标本取材及检测 末次给药后禁食不禁水24h,用10%水合氯醛按0.3g/kg剂量腹腔注射麻醉后开腹,取出距肛门2cm以上8cm处结肠段,将其表面清理干净后纵向剪开肠腔,用冰生理盐水反复冲洗至干净,用滤纸吸干水分,取病变处1cm左右用10%甲醛溶液中固定,常规脱水,石蜡包埋、切片,HE染色,显微镜下观察结肠形态学变化。剩余部分用冰生理盐水制成10%的匀浆,采用酶联免疫法测定结肠组织中MPO、TNF-α、IL-1β和IL-10的含量。
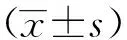
3 结果
3.1 对大鼠一般行为的影响 空白对照组大鼠毛色洁白光泽、紧密顺贴,双眼炯炯有神,活动敏捷自由,正常饮食进水,体重有明显增加,大便呈长椭圆形颗粒。造模大鼠整体毛色较差,无光泽,不整洁,竖毛拱背,较萎靡,喜静扎堆,饮食进水较少,大便排泄较少,肛门处有稀便粘附,给药后部分大鼠上述情况有所改善。
3.2 对结肠组织形态学的影响 空白对照组大鼠结肠黏膜组织颜色呈浅红色,粘膜表面光滑,黏膜皱襞清晰完整、边缘清晰、宽窄厚薄均匀,未见出血点、溃疡和糜烂。模型对照组大鼠结肠黏膜皱襞充血水肿、边缘不清晰、可见增生隆起的结肠组织,肠壁增厚、宽窄不一、颜色变深、可见溃疡或脓点。SASP组大鼠肠粘膜可见散在溃疡,肠壁增厚、宽窄不一。康复新液高剂量组大鼠肠壁增厚,无明显糜烂和溃疡,偶见充血水肿;康复新液中剂量组和低剂量大鼠结肠颜色较红,可见散在的溃疡,组织充血水肿。各组大鼠结肠组织形态见图1。
各组大鼠结肠组织经HE染色后,制成切片,在光学显微镜下进行观察。
由图2可知,空白对照组大鼠结肠组织结构完整,形态清晰,黏膜表面平滑,腺体分布规则,肌层和浆膜层无异常,且无炎症、充血、水肿及坏死现象(A)。模型对照组大鼠黏膜层及黏膜下层伴炎性浸润,可见杯状细胞减少,局灶黏膜淋巴组织增生,黏膜下层和内环行肌之间间隙增宽,外纵行肌下层炎性浸润,血管充血扩大(B),肠壁全层炎症,黏膜糜烂脱落、溃疡形成,局灶腺体轻度不典型增生(C)。与模型对照组相比较,SASP组大鼠黏膜层形态结构较完整,杯状细胞增加,黏膜下层伴有少量中性粒细胞及淋巴细胞(D)。康复新液高剂量组黏膜层结构较完整,黏膜层及黏膜下层炎症减轻,中性粒细胞减少,黏膜下层水肿减轻(E)。康复新液中剂量组黏膜层处于修复期,有新生肉芽组织生成,黏膜下层水肿程度减轻,中性粒细胞减少,有较多新生血管(F)。康复新液低剂量组黏膜层处于修复期,有新生肉芽组织生成,黏膜下层及内环行肌层炎性程度减轻(G)。

3.3 对大鼠结肠组织中炎症因子含量的影响 与空白对照组相比较,模型对照组大鼠结肠组织中MPO含量增加,差异具有统计学意义(P<0.05);与模型对照组相比较,SASP组和康复新液各剂量组大鼠结肠组织中MPO含量降低,差异具有统计学意义(P<0.05)。与空白对照组相比较,其余各组大鼠结肠组织中TNF-α含量均增加,差异具有统计学意义(P<0.05),与模型对照组相比较,SASP组和康复新液各剂量组大鼠结肠组织中TNF-α含量降低,差异具有统计学意义。(P<0.05)。详见表1。

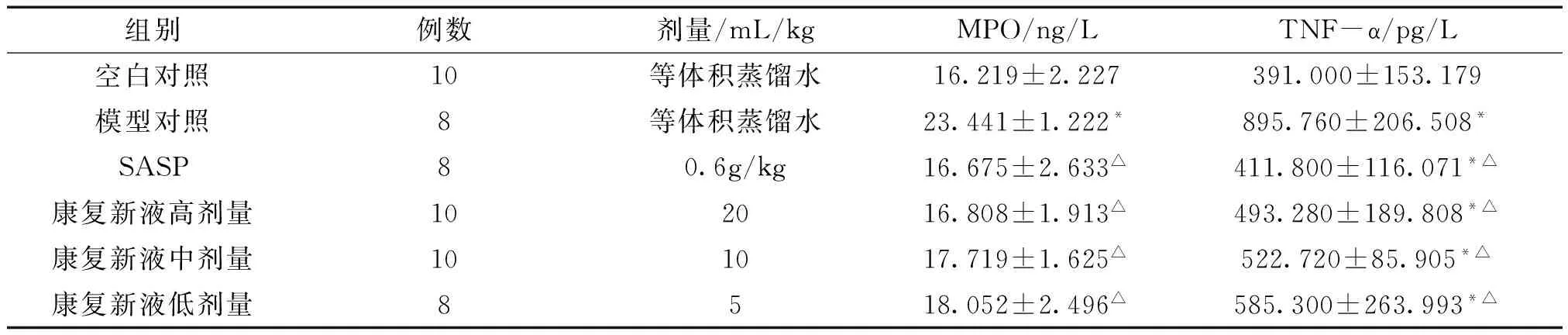
组别例数剂量/mL/kgMPO/ng/LTNF-α/pg/L空白对照10等体积蒸馏水16.219±2.227391.000±153.179模型对照8等体积蒸馏水23.441±1.222*895.760±206.508*SASP80.6g/kg16.675±2.633△411.800±116.071*△康复新液高剂量102016.808±1.913△493.280±189.808*△康复新液中剂量101017.719±1.625△522.720±85.905*△康复新液低剂量8518.052±2.496△585.300±263.993*△
注:与空白对照组相比,*P<0.05;与模型对照组相比,△P<0.05。
与空白对照组相比较,模型对照组大鼠结肠组织中IL-1β含量增加,差异具有统计学意义(P<0.05);与模型对照组相比较,康复新液各剂量组大鼠结肠组织中IL-1β含量有所减少,但差异无统计学意义(P>0.05)。与空白对照组相比较,各组大鼠结肠组织中IL-10含量均减少,差异具有统计学意义(P<0.05);与模型对照组相比较,SASP组以及康复新液各剂量组大鼠结肠组织中IL-10含量增加,但差异无统计学意义。详见表2。

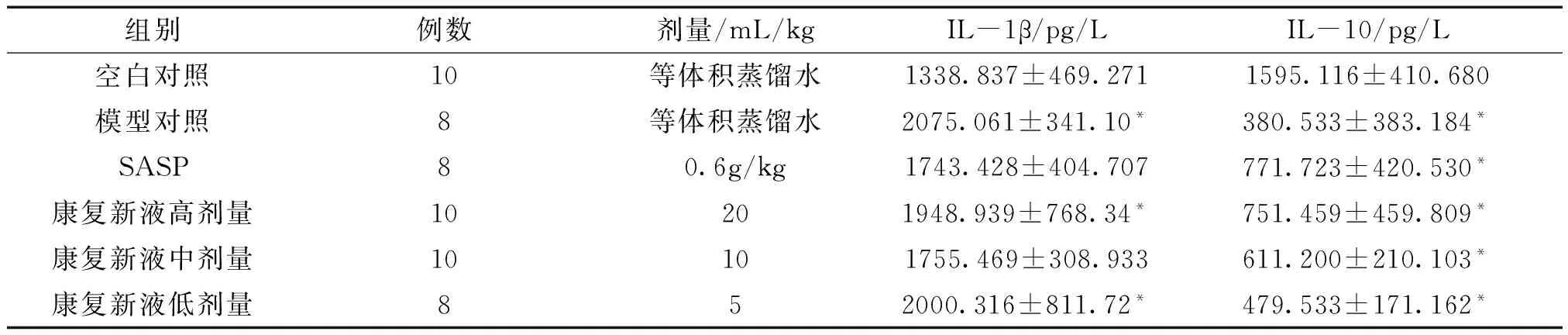
组别例数剂量/mL/kgIL-1β/pg/LIL-10/pg/L空白对照10等体积蒸馏水1338.837±469.2711595.116±410.680模型对照8等体积蒸馏水2075.061±341.10*380.533±383.184*SASP80.6g/kg1743.428±404.707771.723±420.530*康复新液高剂量10201948.939±768.34*751.459±459.809*康复新液中剂量10101755.469±308.933611.200±210.103*康复新液低剂量852000.316±811.72*479.533±171.162*
注:与空白对照组相比,*P<0.05。
4 讨论
由TNBS诱导的溃疡性结肠炎动物模型与人类结肠炎具有相似之处,常用于研究人类溃疡性结肠炎的发病机制和结肠炎药物评价[8]。溃疡性结肠炎的病变以溃疡和炎性细胞的浸润为主,中性粒细胞是急性炎症反应的主要炎症细胞,也是第一个到达损伤组织的炎症细胞[9]。MPO是中性粒细胞嗜天青颗粒产生的一种重要的过氧化物酶,主要存在于嗜中性粒细胞以及单核细胞中,其活性高低是判断中性粒细胞浸润程度的重要指标,也是结肠炎严重程度的指标[10-11]。本次实验发现,模型组MPO活性明显高于空白组,SASP和康复新液可显著降低大鼠结肠组织中MPO含量,20mL/kg剂量的康复新液可使其明显恢复,进一步说明了康复新液对TNBS引起的大鼠溃疡性结肠炎具有治疗作用。TNF-α由活化的T淋巴细胞、巨噬细胞和单核细胞产生,在溃疡性结肠炎的发病中起到重要作用(P<0.05)。TNF-α和NF-κB可相互作用,能刺激单核巨噬细胞和中性粒细胞等合成IL-1、IL-6、IL-8等促炎因子,并能刺激肥大细胞分泌IL-12[12-13]。此外,TNF-α可使溃疡性结肠炎患者肠上皮内的淋巴细胞增殖、分化和移行,并释放炎性介质,对周边肠粘膜产生破坏,使结肠溃疡加重和延续[14]。在本实验中,模型组大鼠结肠组织中TNF-α含量明显高于空白大鼠结肠组织中TNF-α含量,SASP和康复新液可降低TNBS引起的大鼠结肠组织中TNF-α增加,且SASP和20mL/kg的康复新液具有较明显的效果(P<0.05),证明康复新液治疗溃疡性结肠炎的作用机制与下调TNF-α有一定的关系。IL-1β是一种由单核巨噬细胞产生的重要细胞因子和多肽调节因子,能促进血管内皮-白细胞黏附因子的表达,趋化中性粒细胞等炎性细胞进入肠道部位,从而引起一系列肠道炎症反应和损伤,其升高程度可反应疾病的严重程度[15]。IL-10主要由Th2细胞分泌,是一种抗炎细胞因子,有免疫调节和抗炎作用,可下调活化的单核细胞和巨噬细胞转录分泌TNF-α、IL-8、IL-6、IL-1β等促炎因子[16]。实验中,与空白组相比较,模型组大鼠结肠组织中IL-1β含量显著升高而IL-10含量显著降低(P<0.05),同时SASP和康复新液具有一定下调IL-1β的表达并提高IL-10水平的作用。
由此可知,康复新液对于溃疡性结肠炎的治疗作用与其降低MPO的活性和TNF-α、IL-1β含量并升高IL-10含量,调节抗炎细胞因子和促炎细胞因子之间的平衡有一定的关系,且本实验显示,康复新液高剂量与SASP对于溃疡性结肠炎的治疗具有相似效果,但SASP属于氨基水杨酸类药物,相比于SASP较大的副作用,康复新液更为安全有效,这为其临床具体的应用提供了实验依据。
[1]陈文华,黄国栋,方承康.溃疡性结肠炎现代医学研究进展[J].中国医药科学,2011,1(7):51-53.
[2]孙芳美.溃疡性结肠炎的发病机制与治疗进展[J].中国医药指南,2012,10(12):445-447.
[3]王鹏程,赵珊,冯健,等.基于NF-κB信号通路的中药抗溃疡性结肠炎研究进展[J].中草药,2015,46(10):1556-1561.
[4]孙星衍.神龙本草经[M].北京:商务印书馆,1955:90.
[5]杨强,尉永太,连亚楠,等.康复新液局部治疗体表脓肿的临床观察[J].山西医药杂志,2010,39(12):1153-1154.
[6]宫健伟.溃疡性结肠炎发病机制概述[J].胃肠病学,2007,12(1):58-60.
[7]Morris G P, Beck P L, Herridge M S, et al. Hapten-induced model of chronic inflammation and ulceration in the rat colon [J]. Gastroenterology,1989,96(3):795-803.
[8]张夏毅,沈霖,范恒,等.TNBS诱导大鼠实验性结肠炎的疾病机制[J].华中科技大学学报(医学版),2011,40(2):160-164.
[9]柴星宇,林世德,赵廷宝.神经再生复合剂对大鼠急性脊髓损伤后其内MDA、SOD和MPO表达的影响[J].神经解剖学杂志,2011,27(2):215-220.
[10]欧阳钦, Tandon R, Goh K L,et al.亚太地区炎性肠病处理共识意见(二)[J].胃肠病学,2006,11(5):301-305.
[11]Krawisz J E, Sharon W F. Quantitative assay for acute intestinal inflammation based on myeloperocidase activity, Assessment of inflammation in rat and hamster models[J]. Gastroenterology, 1984,87(6):1344-1350.
[12]李彦华,王士雯,朱梅.心力衰竭大鼠组织中核因子κB的活化与细胞因子的表达[J].中华老年多器官疾病杂志,2009,8(5):448-450.
[13]张慧云,马文静,何韶衡.TNF-α对肥大细胞IL-10、IL-12分泌和组胺释放的影响[J].海南医学院学报,2010,16(12):1533-1535.
[14]邓孝廷,田淑琴,邢丽丽.秦瞿制剂对大鼠溃疡性结肠炎的抗炎作用机制[J].中国兽医学报,2010,30(6):837-839.
[15]Ashwood P, Harvey R,Verjee T, et al. Functional interactions between mucosal IL-1,IL-ra and TGF-beta 1 in ulcerative colitis[J]. Inflammation Research,2004,53(2):53-59.
[16]Jahr S, Hentze H, Englisch S, et al. DNA fragments in the biood plasma of cancer patients: quantitations and evidence for their origin from apoptotic and necrotic cells[J]. Cancer Res, 2001,61(4):1659-1665.
(编辑:梁志庆)
Experiment Study of Treatment Effects of Kangfuxin Solution on TNBS-Induced Ulcerative Colitis
HU Tingting1RAO Chaolong1GENG Fu neng2DENG Qingxiu1XIE Xiaofang1*
1.Chengdu University of Traditional Chinese Medicine, Cheng du, 611137, China;2.Good doctor pharmaceutical group, Xichang, 615000,China
Objective To observe the therapeutic effects of Kangfuxin solution on rat model of ulcerative colitis induced by TNBS. Method sixty SD rats were randomly divided into six groups: nomal control groups, model groups, SASP groups, high-dose Kangfuxin groups, medium-dose Kangfuxin groups and low-dose Kangfuxin groups.Each groups have 10 rats including 5 male rats and 5 female rats.TNBS was instilled into the colon of rats to induce ulcerative colitis. 3 days after modeling, every groups were given relevant drugs once a day for 12d. On the day 12,after administration, the rats were sacrificed to collect colon specimens for HE staining. Elisa was performed to detect the levels of MPO, TNF-α, IL-1β andIL-10 in colon specimens of rat. Result Compared with nomal control groups, the contents of anti-inflammatory factors MPO, TNF-α, IL-1β in colon specimens of rats were significantly higher(P<0.05), pro-inflammatory factor IL-10 was significantly reduced (P<0.05). Kangfuxin solution can reduce the contents of MPO and TNF-α in colon specimens of rats(P<0.05) and has a certain influence on the IL-1β and IL-10. Conclusion Kangfuxin solution has a good therapeutic effect on rat model of ulcerative colitis induced by TNBS and it’s mechanism may be related to adjust the balance between anti-inflammatory factors and pro-inflammatory factors.
Kangfuxin Solution; 2,4,6-Trinitro-Benzenesulfonicacid; Ulcerative Colitis; Anti-Inflammatory Effect
2016-09-18
国家自然科学基金项目(J1310034);成都中医药大学中药基础基地科研能力提高项目;中药药理四川省科技创新研究团队(2014TD009);中药资源四川省科技创新研究团队(2016TD0028)。
胡婷婷(1991-),女,汉族,硕士,研究方向为中药药理。E-mail:45960574@qq.com
谢晓芳(1983-),女,汉族,博士,副硕究员,研究方向为中药药理与药理。E-mail:55091620@qq.com
R285.5
A
1007-8517(2016)21-0010-05
