墨西哥玉米草组培体系的建立及愈伤组织切片观察
2016-12-12陈章辉区丁文张盛春阳成伟
曹 雨, 陈章辉, 区丁文, 张盛春, 阳成伟,2*
(1. 广东省植物发育生物工程重点实验室, 华南师范大学生命科学学院, 广州 510631; 2. 连州市东篱种养实业有限公司, 连州 513400)
墨西哥玉米草组培体系的建立及愈伤组织切片观察
曹 雨1, 陈章辉1, 区丁文1, 张盛春1, 阳成伟1,2*
(1. 广东省植物发育生物工程重点实验室, 华南师范大学生命科学学院, 广州 510631; 2. 连州市东篱种养实业有限公司, 连州 513400)
采用墨西哥玉米草 “8493” 种子为实验材料,在含有2,4-D和6-BA的MS培养基上可诱导幼苗基部的膨大节间,以膨大节间为外植体在黑暗条件下两周诱导出胚性愈伤组织.将愈伤组织移到含有6-BA 、KIN和NAA分化培养基中,于光照培养箱(16 h光照/8 h黑暗,25±2 ℃)培养得到分化苗,生根后移栽获得健壮的墨西哥玉米草植株;对诱导出来的愈伤组织采用石蜡切片法进行鉴定,通过切片中愈伤组织细胞的形态结构的观察,细胞核大,染色较浓,细胞规则且连接紧密,可判定此体系诱导的愈伤组织为胚性愈伤组织.
墨西哥玉米草; 膨大节间; 组织培养; 胚性愈伤组织
墨西哥玉米草(Zeamaysspp.mexicanaL),又名大刍草,是玉米(Z.mays)的野生近缘种,墨西哥玉米草原产于中美洲的墨西哥,我国于1979从国外引进,现在我国河南、河北、山西和广东等地种植.禾本科墨西哥玉米草属一年生多茬高产饲料作物,饲草产量与多种因素相关,冯云超等[1]的研究发现,种植密度、施氮量、主茎粗、分蘖数、叶宽、单株鲜质量等与饲草产量呈正相关,单株鲜质量与密度、草长、主茎粗、分蘖数、叶宽、叶面积显著相关. 墨西哥玉米草叶片宽大,对地面形成长期郁蔽,使得杂草不容易生长,易于种植[2]. 墨西哥玉米草有良好的再生性,可延长青草的供应时期,作为牛、羊、猪、鱼、兔等的青饲料,墨西哥玉米草的干草又可作为良好的贮存饲料.
墨西哥玉米草是短日照植物,喜温暖湿润气候,耐热,因此墨西哥玉米草主要在南方种植,在北方不易正常开花结实[3],蒋安等[4]研究了墨西哥玉米草幼苗对低温的胁迫响应,选育出了较抗寒的墨西哥玉米草品种,可在一定程度上解决墨西哥玉米草不耐寒这一问题. 种植墨西哥玉米草可有效提高土壤中石油烃的降解[5],在石油烃等有机物污染的环境修复中具有重要的意义. 氮、磷、钾和锌肥配施能显著提高墨西哥玉米草产量, 并改善其营养品质[6].
玉米是我国重要的粮食作物之一,但由于玉米主要是有人工驯养,在抗逆性及抗病性方面都有很大不足,墨西哥玉米草是玉米的野生近缘种,在野生环境中形成了多种优良的品质,因此可为玉米改良提供重要的基因资源. 同时也可以通过杂交将墨西哥玉米草中的基因引入到玉米基因组中[7],但是杂交过程中也容易将墨西哥玉米草中不利的基因带到玉米当中,所以组培及转基因技术在优良玉米草作物遗传育种当中也势在必行[8],而得到具有胚性的墨西哥玉米草愈伤组织是遗传转化的基础.
1 材料与方法
1.1 材料
墨西哥玉米草“8493”(Zeamaysspp.mexicanaL)种子,来自华南师范大学生命科学学院植物器官发育重点实验室.
1.2 方法
1.2.1 种子消毒处理 选择实验室已有的墨西哥玉米草“8493”种子,将种子置于锥形瓶中,加水后将浮在表面的种子撇除,留下籽粒饱满的种子,加少量洗洁精浸泡半天,使其易于剥壳,半天后将水倒掉,把种子倒在滤纸上,吸干水分,去掉墨西哥玉米草种子外壳,将剥出的种子置于干净的锥形瓶中,用灭菌水清洗1~2次后,用体积分数70%乙醇洗2 min,再用灭菌水冲洗1~2次,然后分别用质量分数(下同)2% NaClO和4% NaClO消毒30 min和60 min,最后转至超净工作台,用灭菌水洗涤6~8次后,将种子铺在滤纸上,吸干种子表面水分,将洗好的种子铺在种子萌发培养基(MS+5 mg/L 2,4-D+3 mg/L 6-BA+质量分数(下同)3%蔗糖,pH 5.8)上. 比较不同质量浓度的消毒液及不同的消毒时间对灭菌的效果及种子萌发情况的影响. 每天记录种子的萌发情况及污染情况,并进行统计分析.
1.2.2 种子萌发处理 将铺有4个不同消毒程度的种子的培养皿置于(25±2)℃光照培养箱中光照条件下培养,每天观察种子萌发生长情况,统计发芽率及种子萌发最佳时间,同时观察膨大节间的形成情况,并统计膨大节间的形成率. 1.2.3 愈伤组织诱导 选取获得的墨西哥玉米草膨大节间,去除茎部和种子,将膨大节间纵向切成两半,置于愈伤组织诱导培养基(MS+2 mg/L 6-BA+1 mg/L KIN+0.5 mg/L NAA+1.5%蔗糖,pH 5.8)上,剖面贴近培养基,然后置于(25±2)℃黑暗培养箱中暗培养2~3周,统计将膨大节间的愈伤组织诱导率,然后将诱导出来的愈伤组织从膨大节间上剥离下来,置于新配制的胚性愈伤组织诱导培养基上,继续置于(25±2)℃黑暗培养箱中黑暗条件下培养和继代.
1.2.4 愈伤组织分化培养 将培养出的嫩黄色的愈伤组织转移到分化培养基上(MS+2 mg/L 6-BA+1 mg/L KIN+0.5 mg/L NAA+1.5%蔗糖,pH 5.8),置于光照培养箱(16 h光照/8 h黑暗,25±2 °C)培养3~4周,待分化芽长出后进行移栽.
1.2.5 植株生根培养 将分化芽取出,置于未添加激素的生根培养基(MS,pH 5.8)上,光照培养箱(25±2)℃光照培养,1~2周后生根.
1.2.6 植株移栽 将生根的墨西哥玉米草移栽到泥炭土:蛭石(3∶1)的盆土中,置于温室内培养.
1.2.7 石蜡切片 方法参照李丹等[9]的整体染色切片法进行切片. 主要流程为:固定→染色→脱水→透明→浸蜡→包埋→切片贴片展片→脱蜡→封片观察.
1.2.8 数据分析 采用Microsoft Excel 2013对实验数据进行处理与统计分析,利用Adobe Photoshop CS3对图片进行处理.
2 结果与分析
2.1 外植体的获得
2.1.1 种子灭菌条件的确定 4% NaClO消毒效果明显比2% NaClO更好(表1),可显著降低墨西哥玉米草种子的染菌率. 不同的消毒时间也对墨西哥玉米草种子的染菌率有影响,当用4% NaClO消毒60 min时,染菌率几乎为0,此时种子的发芽率与4% NaClO消毒30 min的发芽率相近,因此,选取4% NaClO消毒60 min进行种植灭菌处理.

表1 不同质量分数NaClO及不同处理时间对墨西哥玉米草种子灭菌效果的影响
2.1.2 膨大节间的获得 种子消毒处理后在培养基上(25±2) ℃光照1~2周后,长出幼苗,在幼苗基部有颜色较深的节间膨大部位(图1A、B),在无菌条件下切取膨大节间,在滤纸上用解剖刀将膨大节间纵向切开,切面贴于胚性愈伤组织诱导培养基中(图1C),(25±2) ℃黑暗培养2~3周后,膨大节间上开始形成愈伤组织,同时膨大节间褐化.

A:墨西哥玉米草种子在萌发培养基上培养6 d后发芽形成的带有膨大节间的无菌苗;B:纵向切开的膨大节间,剖面贴于培养基;C:玉米草幼苗基部膨大节间放大图.
图1 墨西哥玉米草的种子萌发及膨大节间的形成
Figure 1 Germination and swelled internodes ofZeamaysspp.mexicanaL
2.2 愈伤组织的诱导及细胞学观察
2.2.1 愈伤组织的诱导 墨西哥玉米草组培体系的关键在于获得幼苗基部的膨大节间,当种子直接播种在土壤中时,萌发速率快,萌发率很高,但是幼苗基部节间处无膨大结构,而在含有2,4-D和6-BA的种子萌发培养基上时,萌发速率慢,且萌发率很低,可得到有膨大节间的幼苗. 膨大节间在胚性愈伤组织诱导培养基上可诱导出愈伤组织,随着愈伤组织的诱导,节间也会随之褐化,在3周左右须将愈伤组织从褐化的膨大节间上剥离下来,移到新的胚性愈伤组织培养基上(图2A). 刚开始诱导出来的愈伤组织表面具有透明的黏液包裹,使愈伤组织不易分散,但黏液会随着继代的次数增多而减少,其具体作用有待研究.
2.2.2 愈伤组织的细胞结构 胚性愈伤组织具有完整的胚胎发生能力,生长速度较快,愈伤组织剥离出来容易扩大培养,具有更大的应用价值,而非胚性愈伤组织生长速度缓慢,易褐化,不适于通过生物学手段进行个体的改良应用[10-11]. 墨西哥玉米草愈伤组织呈嫩黄色致密状态,表面有一层粘液包裹(图2A、B),易扩大培养,初步鉴定为胚性愈伤组织. 对墨西哥玉米草愈伤组织石蜡切片进行细胞学观察发现,胚性愈伤组织细胞间连接紧密,细胞呈规则的圆形,细胞体积较小,细胞核较大,着色较深,符合胚性愈伤组织特征(图2C),而非胚性愈伤细胞较大,胞质稀薄,无体细胞胚发生能力[11].

A: 膨大节间在黑暗条件下(25±2) ℃暗培养18 d形成的愈伤组织;B:愈伤组织放大结构,外表呈嫩黄色,结构致密,有黏液包裹;C:愈伤组织石蜡切片下细胞结构,细胞形态规则,连接致密,细胞核大.
图2 墨西哥玉米草愈伤组织及其细胞形态
Figure 2 Callus tissue and cell morphological characters ofZeamaysspp.mexicanaL
植物的胚胎发生过程主要包括3步:原胚形成、胚的分化和胚的成熟. 愈伤组织主要的活动发生在胚的分化这一阶段,与母体相连,从母体上逐渐分化出来,在同一时期的胚性愈伤组织中,发现了分化程度不同的胚型,有早期球型胚,细胞致密,增殖分化能力很强(图3A);有后期球型胚,增殖分化能力旺盛的细胞主要集中在球型胚的顶端及周围,与母体相连的部分细胞逐渐变长变大(图3B);有类心型胚(图3C),不同于双子叶的心型胚,它的增殖旺盛的细胞并不呈对称分布,而是偏向于一端顶部;还有子叶成熟胚(图3D),在顶端集中了分裂分化旺盛的细胞群.
综上所述,通过墨西哥玉米草无菌幼苗基部膨大节间所诱导出的愈伤组织为胚性愈伤组织.
2.3 胚性愈伤组织的分化鉴定
墨西哥玉米草幼苗基部膨大节间所诱导的愈伤组织为胚性愈伤组织后,对愈伤组织进行分化处理,将所诱导的愈伤组织转移到光照条件下培养,4 d愈伤组织开始变绿,2周后已经长出丝状幼叶(图4A),幼叶呈透明嫩绿状,还不具有成型的玉米草结构(图4B). 4~5周愈伤组织可分化出成型的幼苗,将其移到不带激素的MS培养基上进行生根(图4C),生根的过程中,开始是白色的较短的须状根,再过段时间变成红色的很长的须状根. 在长出白色短根时即可移栽到土壤中培养,但成活率稍低于红色长根时的移栽成活率(图4D).
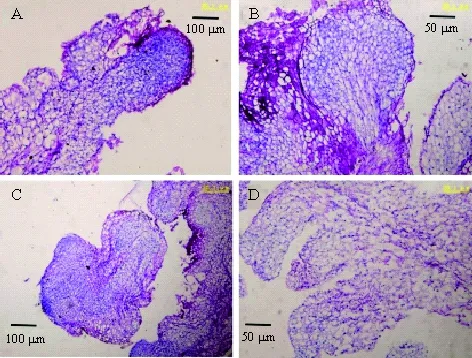
A:早期球型胚;B:晚期球型胚;C:类心型胚;D:成熟子叶胚.
图3 同时期墨西哥玉米草愈伤组织切片观察
Figure 3 Callus tissue sections ofZeamaysspp.mexicanaL

A:愈伤组织转移到光照条件下(25±2) ℃光照培养后分化成苗; B:单个分化愈伤组织放大图;C:将分化苗转移至生根培养基上培养20 d后的生根情况;D:生根的墨西哥玉米草转移至土壤中的生长情况.
图4 墨西哥玉米草愈伤组织分化培养
Figure 4 Differentiation plantlet from callus ofZeamaysspp.mexicanaL
3 讨论
墨西哥玉米草作为新型高产饲料而广泛被种植研究,关于墨西哥玉米草的栽培技术研究较多,如日照、温度、光周期及氮磷钾肥等不同条件对墨西哥玉米草的栽培与刈割情况的影响等[4,6-7,12-13],生物有机肥等对墨西哥玉米草的营养价值的影响[14-17],墨西哥玉米草及其近缘种杂交选育[3,18]和墨西哥玉米草核型分析[19]等方面. 王灵芝等[8]对玉米与墨西哥玉米草杂交后代进行了组织培养,然而对墨西哥玉米草的组培体系还未见报道.
墨西哥玉米草组培体系的建立对其遗传转化至关重要. 建立组培体系的第一步就是外植体的选取,多数报道选择成熟胚作为外植体来诱导胚性愈伤[20-21],短芒大麦草利用幼穗为外植体[22],白羊草以成熟种子为外植体[23],苜蓿以真叶为外植体[24]. 本研究中借鉴玉米组培体系[25],将墨西哥玉米草“8493”的种子消毒后,在添加有6-BA和2,4-D激素的MS培养基上培养6 d后发芽形成的带有膨大节间的无菌苗,选取膨大节间在27℃黑暗条件下可诱导出愈伤组织.
遗传转化并获取转基因植株的前提是具有分化能力较好的,具有胚发生能力的胚性愈伤组织,便于目的基因的插入[26]. 对于胚性愈伤组织的观察,其描述各不相同,李红等[11]研究中的苜蓿胚性愈伤组织是呈致密的淡绿色,且表面粗糙,有颗粒状凸起,林庆良等[27]研究中的甘蔗胚性愈伤组织是呈浅黄色的致密组织,尤培雷等[10]研究中的黄秋葵胚性愈伤组织为黄白色或浅绿色的米状致密组织,但胚性愈伤组织都有愈伤组织致密,生长繁殖速度快,不易褐化等特点. 观察发现墨西哥玉米草愈伤组织呈嫩黄色致密状态,表面有一层粘液包裹,易扩大培养,进一步通过石蜡切片细胞学观察所诱导的愈伤组织符合胚性愈伤组织特征,为深入研究墨西哥玉米草的基因功能和遗传改良奠定了基础.
[1] 冯云超,余志江,霍仕平,等. 玉米×大刍草杂种饲草产量及其构成性状对密度和氮肥的响应[J]. 草业科学,2012,29(10):1563-1568.
FENG Y C,YU Z J,HUO S P,et al. Forage yield and yield component traits ofZeamays×Zeamexicanahybrid responses to planting density and nitrogen application[J]. Pratacultural Science,2012,29(10):1563-1568.
[2] 叶玛丽. 高产青饲料-墨西哥玉米草[J]. 贵州农业科学,1984(6):60-61.
[3] 贾春林,王国良,杨秋玲,等. 光不敏感型大刍草新种质选育及利用的初步研究[J]. 草业科学,2011,28(10):1835-1838.
JIA C L,WANG G L,YANG Q L,et al. Primary selection and utilization of a new germplasm teosinte (Zeamexicana) with photoperiod no-sensitivity[J]. Pratacultural Science,2011,28(10):1835-1838.
[4] 蒋安,郭彦军,范彦,等. 低温胁迫对墨西哥玉米幼苗抗寒性的影响[J]. 草业科学,2010,27(3):89-92.
JIANG A,GUO Y J,FAN Y,et al. Effect of low temperature stress on the cold resistance ofZeamexicanaseedling [J]. Pratacultural Science,2010,27(3):89-92.
[5] 唐景春,王斐,褚洪蕊,等. 墨西哥玉米草-Zeamexicana-寡糖联合修复石油烃污染土壤的研究[J]. 农业环境科学学报,2010,29(11):2107-2113.
TANG J C,WANG F,CHU H R,et al. Bioremediation of petroleum contaminated soils by combination ofZeamexicanaand alginate oligosaccharides [J]. Journal of Agro-Environment Science,2010,29(11):2107-2113.
[6] 赵东海,胡华锋,介晓磊,等. 氮磷钾锌肥配施对墨西哥玉米草首次刈割产量及品质的影响[J]. 草业科学,2010,27(12):87-91.
ZHAO D H,HU H F,JIE X L,et al. Effect of N,P,K and Zn fertilization on first cutting yield and quality ofZeamexicana[J]. Pratacultural Science,2010,27(12):87-91. [7] 连丽君,李朝霞,王雷,等. 短日照处理对墨西哥玉米开花与种子成熟的影响[J]. 山东农业科学,2006,(6):20-23.
LIAN L J,LI Z X,WANG L,et al. Effect of Short-day treatment on the flowering and seed maturity ofEuchlaenamexicana[J]. Shandong Agricultural Sciences,2006,(6):20-23.
[8] 王灵芝,王先艳,张可炜,等. 玉米与其近缘野生种杂交后代的组织培养[J]. 山东大学学报(理学版),2002,37(4):359-363.
WANG L Z,WANG X Y,ZHANG K W,et al. Tissue culture of the descendants of hybridsfrom cultivated maize and its wildZeaspecies[J]. Journal of Shandong University (Natural Science),2002,37(4):359-363.
[9] 李丹,陈少瑜,吴涛,等. 丽江云杉胚性愈伤组织石蜡制片中的整块染色与切片染色方法比较[J]. 热带作物学报,2009,38(4):82-85.
LI D,CHEN S Y,WU T,et al. Comparison of entire staining and section staining in olefin section method with embryonic callus ofPicealikiangensis[J]. Journal of West China Forestry Science,2009,38(4):82-85.
[10] 尤培雷,许杰,钱忠英. 黄秋葵愈伤组织的产生及其切片观察[J]. 上海农业学报,2007,23(3):92-95.
YOU P L,XU J,QIAN Z Y. The callus induction and section observation ofAbelmoschusmanihot[J]. Acta Agriculturae Shanghai,2007,23(3):92-95.
[11]李红,李波,陈雪梅,等. 苜蓿愈伤组织细胞学观察及芽分化的研究[J]. 江苏农业科学,2015,43(6):49-51. [12]王玉麒. 大刍草的栽培技术与饲用价值[J]. 现代畜牧科技,2010(6):42-43.
[13] 陈景堂,张芳,黄亚群,等. 玉米近缘种墨西哥玉米草光周期敏感性与育种利用[J]. 中国农业科学,2011,44(6):1109-1116.
CHEN J T,ZHANG F,HUANG Y Q,et al. Flower induction and utilization ofZealuxuriansin maize breeding [J]. Scientia Agricultura Sinica,2011,44(6):1109-1116.
[14] 任勇,唐祈林,曹墨菊,等. 新选育饲草玉米品系饲用营养价值初步研究[J]. 植物遗传资缘学报,2005,6(4):444-447.
REN Y,TANG Q L,CAO M J,et al. Studies on forage nutritive value of forage maize[J] . Journal of Plant Genetic Resources,2005,6(4):444-447.
[15] 宋金昌,范莉,杨宗泽,等. 饲用墨西哥玉米生长特性及其营养成分含量的研究[J]. 草业科学,2005,22(4):53-56.
SONG J C,FAN L,YANG Z Z,et al. Research of the growth characters and nutritional contents of feedEuchlaenamexicanaschred[J]. Pratacultural Science,2005,22(4):53-56. [16]宋金昌,范莉,杨宗泽,等. 饲用墨西哥玉米适应性及其营养成分含量[J]. 中国畜牧杂志,2005,41(9):43-45. [17] 谢燕妮,林莉,张业怀,等. 生物有机肥对墨西哥玉米饲用价值的影响[J]. 草业科学,2013,30(5):763-766.
XIE Y N,LIN L,ZHANG Y H,et al. Effects of biological organic fertilizer on feeding value of Mexico corn[J]. Pratacultural Science,2013,30(5):763-766.
[18] 王秀全,张华,何丹,等. 墨西哥玉米草血缘普通玉米自交系的配合力分析[J]. 西南科技大学学报,2013,28(4):102-107.
WANG X Q,ZHANG H,HE D,et al. Analysis of combining ability of inbred linesderived from Teosinte × Maize Inbred[J]. Journal of Southwest University of Science and Technology,2013,28(4):102-107.
[19] 杨秀燕,蔡毅,傅杰,等. 玉米及其近缘种大刍草的核型研究[J]. 中国农业科学,2011,44(7):1307-1314.
YANG X Y,CAI Y,FU J,et al. Karyotypes of Maize and its relatives-teosinte [J]. Scientia Agricultura Sinica,2011,44(7):1307-1314.
[20] 陈靖,董浩,马海珍,等. 玉米幼胚和缘于幼苗的幼嫩叶段愈伤诱导及其植株再生的比较[J]. 中国农业科学,2011,44(17):3676-3682.
CHEN J,DONG H,MA H Z,et al. Comparison of induction and regeneration of embryogenic callus initiated from immature embryos and seedling-derived young leaf segments of Maize[J]. Scientia Agricultura Sinica,2011,44(17):3676-3682.
[21] 王世玉,郑用琏,刘亚,等. 玉米成熟胚胚性愈伤组织的诱导-高频再生及转化的研究[J]. 作物学报,2008,34(3):423-428.
WANG S Y,ZHENG Y L,LIU Y,et al. Transformation,inducing and high-frequency regeneration of embryo-genic callus initiated from mature embryos of Maize(ZeamaysL. )[J]. Acta Agronomica Sinica,2008,34(3):423-428.
[22] 李晓玲,张金龙,房强,等. 短芒大麦草组织培养体系的建立[J]. 中国草地学报,2015,37(1):111-115.
LI X L,ZHANG J L,FANG Q,et al. Establishment of tissue culture system forHordeumbrevisubulatum(Trin. ) Link. [J]. Chinese Journal of Grassland,2015,37(1):111-115.
[23] 于娜,董宽虎. 白羊草成熟种子组织培养再生体系研究[J]. 北方园艺,2014,(2):104-107.
YU N,DONG K H. Research on tissue culture of regeneration system of the mature seeds ofBothriochloaischaemum[J]. Northern Horticulture,2014(2):104-107.
[24] 赵金梅,李芳,周禾,等. 紫花苜蓿组织培养体系的建立[J]. 核农学报,2010,24(3):507-521.
ZHAO J M,LI F,ZHOU H,et al. Establishment of alfalfa tissue culture system [J]. Journal of Nuclear Agricultural Sciences,2010,24(3):507-521.
[25]KRISHANA M P,SRUESH T,KAZD M,et al. An efficient and rapid regeneration via multiple shoot induction from mature seed derived embryogenic and organogenic callus of Indian maize (ZeamaysL. )[J]. Plant Signaling & Behavior,2013,10(8):1-6.
[26] 李达旭,张玉,刘刚,等. 禾本科牧草胚性愈伤组织诱导及再生研究进展[J]. 草业与畜牧,2014(5):53-58.
LI D X,ZHANG Y,LIU G,et al. Progress in embryogenic callus induction and regeneration research of gramineous forage[J]. Prataculture & Animal Husbandry,2014(5):53-58.
[27] 林庆良,许莉萍,高世武,等. 甘蔗胚性愈伤组织发生与发育的组织细胞学观察[J]. 热带作物学报,2010,31(8):1303-1308.
LIN Q L,XU L P,GAO S W,et al. Cytohistological examination of embryogenesis in Sugarcane[J]. Chinese Journal of Tropical Crops,2010,31(8):1303-1308.
【中文责编:成文 英文责编:李海航】
The Establishment of Teosinte Tissue Culture and Callus Section Observation
CAO Yu1, CHEN Zhanghui1, OU Dingwen1, ZHANG Shengchun1, YANG Chengwei1,2*
(1. Guangdong Provincial Key Laboratory of Biotechnology for Plant Development, School of Life Science, South China Normal University,Guangzhou 510631, China; 2. Dongli Planting and Farming Industrial Co., LTD of LianZhou City, Lianzhou 510631, China)
Zeamaysspp.mexicanaLplays an important role in animal husbandry, in-depth study of teosinte has important scientific value and economic benefits. Though many studies on the hybridization between teosinte and closely related species of maize have been reported, little research on the tissue culture of teosinte is reported. Here, establishment of technique system of tissue culture for teosinte was made using the variety ‘8493’ ofZeamaysspp.MexicanaLas explants. The high totipotency swelling of the cultured internode was induced from teosinte seeds in the MS culture medium added 2,4-D and 6-BA and subcultured in the dark for induction of callus of teosinte about 2 weeks. The callus are authenticated to embryonic callus by paraffin section observation.
Zeamaysspp.mexicanaL; swelled internodes; tissue culture; embryonic callus
2016-06-21 《华南师范大学学报(自然科学版)》网址:http://journal.scnu.edu.cn/n
广东省农村科技领域公益研究与建设项目(2015A020209155, 2016A020208014 );“扬帆计划”引进创新创业团队专项(2015YT02H032)
Q943.1
A
1000-5463(2016)06-0019-06
*通讯作者:阳成伟,教授,珠江学者,Email: Yangchw@scnu.edu.cn.
