乳腺癌中 VEGF和 MMP9的免疫组织化学表达及其与肿瘤转移复发的关系
2016-12-12袁静萍陈创袁修学高利昆刘琳何惠华饶洁阎红琳
袁静萍,陈创,袁修学,高利昆,刘琳,何惠华,饶洁,阎红琳*
(1武汉大学人民医院病理科,武汉 430060;2武汉大学人民医院乳腺甲状腺外科,武汉 430060;3武汉科技大学基础医学院,武汉 430065)
乳腺癌中 VEGF和 MMP9的免疫组织化学表达及其与肿瘤转移复发的关系
袁静萍1,陈创2,袁修学3,高利昆1,刘琳1,何惠华1,饶洁1,阎红琳1*
(1武汉大学人民医院病理科,武汉 430060;2武汉大学人民医院乳腺甲状腺外科,武汉 430060;3武汉科技大学基础医学院,武汉 430065)
目的 探讨血管内皮生长因子(vascular endothelial growth factor,VEGF)及基质金属蛋白酶9(matrix metalloproteinases 9,MMP9)的表达与乳腺癌临床病理因素及肿瘤转移复发的关系。方法 通过免疫组织化学检测VEGF和MMP9在230例乳腺癌组织芯片中的表达,比较二者表达的相关性并分析二者表达与临床病理因素、肿瘤复发之间的关系。结果
VEGF和MMP9在乳腺癌中的阳性率分别为68.3%和55.2%,显著高于癌旁组织;VEGF的表达与临床分期密切相关,Ⅰ期乳腺癌患者中的VEGF阳性率显著低于Ⅱ期+Ⅲ期;MMP9的表达与组织学分级、淋巴结转移密切相关,在淋巴结转移组中MMP9的阳性率显著高于未发生淋巴结转移组,且随着组织学分级的升高,其阳性率也逐渐升高;MMP9的表达与VEGF的表达呈显著正相关;MMP9与VEGF在复发组中的阳性率均显著高于未复发组,是乳腺癌复发的危险因素。结论 乳腺癌组织中VEGF和MMP9的高表达是乳腺癌术后复发的危险因素,检测其表达对判断乳腺癌术后预后具有重要意义。
乳腺癌;血管内皮生长因子;基质金属蛋白酶9;复发
乳腺癌是女性最常见的恶性肿瘤之一,近年来乳腺癌发病率逐渐上升并且呈年轻化发展的趋势,其复发转移是影响肿瘤预后的关键因素,探讨乳腺癌的生物学特性与其复发及预后的关系是乳腺癌研究的热点。细胞外基质和基底膜的降解破坏以及新生血管的形成是肿瘤细胞侵袭转移的重要条件[1],血管内皮生长因子(vascular endothelial growth factor,VEGF)和基质金属蛋白酶9(matrix metalloproteinases 9,MMP9)是参与该过程最重要的两个因子,本研究应用免疫组织化学方法检测乳腺癌组织中VEGF、MMP9的表达,并探讨二者的表达与乳腺癌转移及术后复发的关系。
材料与方法
1 标本资料
收集武汉大学人民医院、武汉大学中南医院、武汉市中心医院病理科230例术前未行其他化疗、放疗及内分泌治疗、临床病理资料完整的乳腺癌患者的手术标本并制作成组织芯片(2个芯片点/例)。230例患者全为女性,年龄29~78岁,中位年龄48.9岁。术后病理诊断主要为浸润性癌(浸润性导管癌175例,浸润性小叶癌27例,其他28例)。组织学分级G1级37例,G2级135例,G3级58例。190例行改良根治术,36例行传统根治术,4例行保乳手术。在临床随访过程中,87例出现复发,其中8例广泛转移,9例局部复发,24例骨转移,14例肺转移,14例肝转移,12例胸壁转移,3例脑转移,2例盆腔转移,1例内脏转移。
2 免疫组织化学染色
应用常规SP法,进行VEGF和MMP9免疫组织化学染色。组织4μm连续切片,pH6.0的柠檬酸盐缓冲液隔热高压抗原修复。VEGF、MMP9抗体(均为即用型鼠抗人单克隆抗体)、SP法免疫组织化学试剂盒、DAB显色剂均购自DAKO公司,染色步骤按说明书进行。以磷酸盐缓冲液(PBS)代替一抗作为阴性对照,已知阳性切片作为阳性对照。
3 免疫组织化学结果判读
VEGF、MMP9免疫反应产物主要定位于细胞质内,以胞质内出现黄色或棕黄色颗粒为阳性,根据阳性细胞数和着色深度计分。在高倍镜下(×40)每例均随机观察计数5个视野,确定每个视野的阳性率,取平均数,按下列计分:阳性细胞≤5%为0分,>5%至25%为1分,>25%至50%为2分,>50%至75%为3分,>75%为4分。阳性细胞表达的着色深度:基本不着色为0分,黄色为1分,棕黄色为2分,棕褐色为3分。将两项积分相乘:≥1为阳性,<1为阴性。
4 统计学分析
计数资料应用SPSS19.0软件进行统计分析,VEGF、MMP9蛋白的阳性表达率与临床病理参数的关系以及病理类型、VEGF、MMP9表达与乳腺癌复发、转移的单因素分析采用χ2检验,同时采用Logistic回归分析乳腺癌复发的危险因素,VEGF、MMP9的表达相关性分析采用 Spearman等级相关性分析法,检验水准采用α=0.05,P<0.05为差异有统计学意义。
结 果
1 乳腺癌中VEGF和MMP9阳性表达率增高
VEGF主要表达于细胞质,呈棕黄色颗粒(图1上)。230例乳腺癌中,157例VEGF呈阳性表达,阳性率为68.3%,而在癌旁组织中VEGF主要呈低表达或不表达,其中97例呈阳性表达,阳性率为42.2%。MMP9也主要表达于细胞质,呈浅黄色颗粒,阳性反应产物分布不均匀(图1下)。在230例乳腺癌中,127例MMP9呈阳性表达,阳性率为55.2%,而在癌旁组织中MMP9呈低表达或不表达,阳性率为10.4%(24例)。VEGF和MMP9在乳腺癌表达阳性率均显著高于癌旁组织。
2 乳腺癌中VEGF和MMP9的表达与临床病理因素的关系
VEGF蛋白的阳性表达率与乳腺癌患者的临床分期密切相关,在临床分期为Ⅰ期的乳腺癌患者中的阳性率显著低于Ⅱ期+Ⅲ期,而与乳腺癌患者的年龄、是否绝经、组织学分级、淋巴结是否转移无关(表1)。MMP9蛋白的阳性表达率与乳腺癌患者的组织学分级和淋巴结是否转移密切相关,随着组织学分级的升高,MMP9阳性率也逐渐升高,且MMP9在淋巴结转移组中的阳性率显著高于未发生淋巴结转移组,而与乳腺癌患者的年龄、是否绝经、临床分期无关(表1)。
3 乳腺癌中VEGF与MMP9的表达呈正相关
在230例乳腺癌组织中,VEGF阳性的肿瘤组织MMP9也趋于阳性,Spearman等级相关性分析显示MMP9与VEGF的表达呈显著正相关(γ=0.194,P<0.01)(表2),提示二者在乳腺癌中发挥协同作用。
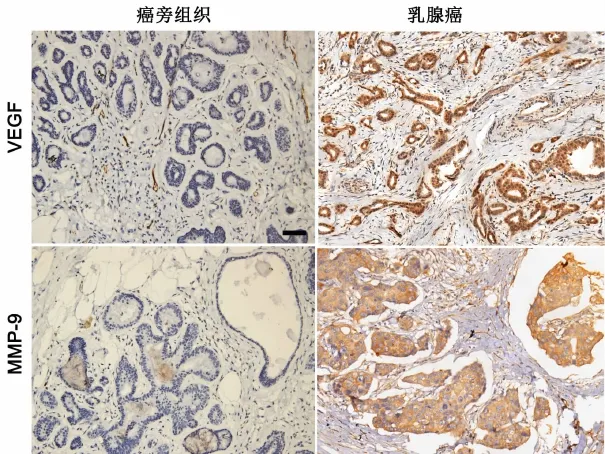
图1 乳腺癌组织及癌旁组织VEGF及MMP9的免疫组织化学表达。比例尺,100μmFig.1 Immunohistochemical staining of VEGF and MMP9 in breast cancer tissues and adjacent tissues.Scale bar,100μm
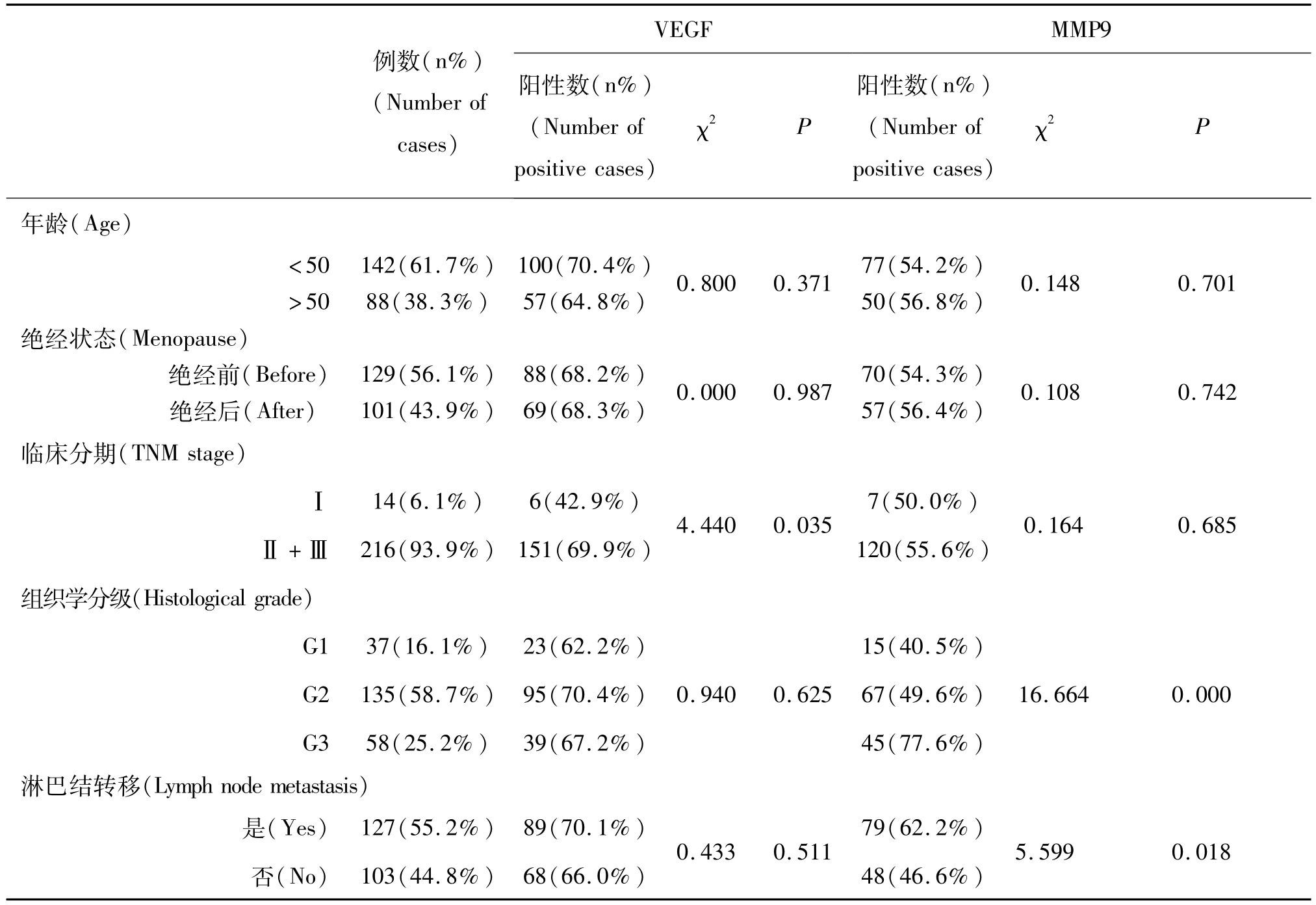
表1 VEGF、MMP9蛋白表达与乳腺癌临床病理特征的关系Table 1 Expression of VEGF and MMP9 in breast cancer and its relationship with clinical pathological characteristics
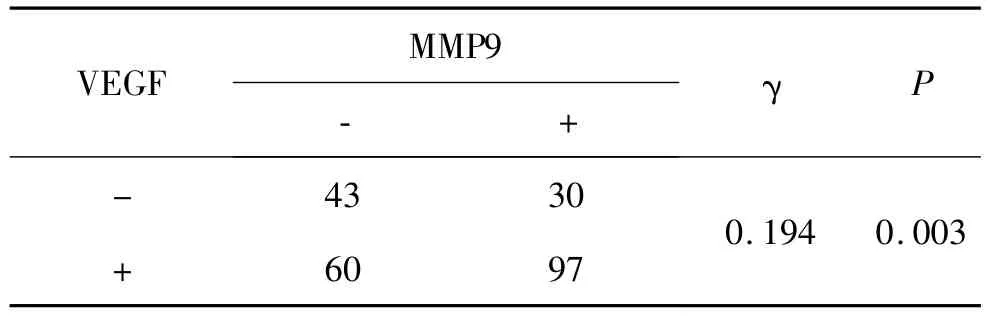
表2 VEGF与MMP9表达的相关性Table 2 Correlation between VEGF and MMP9 expression
4 乳腺癌复发组VEGF与MMP9表达增强
按照术后5年内是否复发将230例乳腺癌患者分为复发组(87例)和未复发组(143例)。单因素预后分析病理类型、VEGF和MMP9表达与乳腺癌复发、转移的相关性(表3),结果显示复发组乳腺癌组织中MMP9及VEGF的阳性率分别为77.0%(67/87)和79.3%(69/87),未复发组MMP9及VEGF的阳性率分别为62.9%(90/143)及40.6%(58/143),复发组MMP9与VEGF蛋白表达均显著高于未复发组,而乳腺癌病理类型与复发无关(表3)。
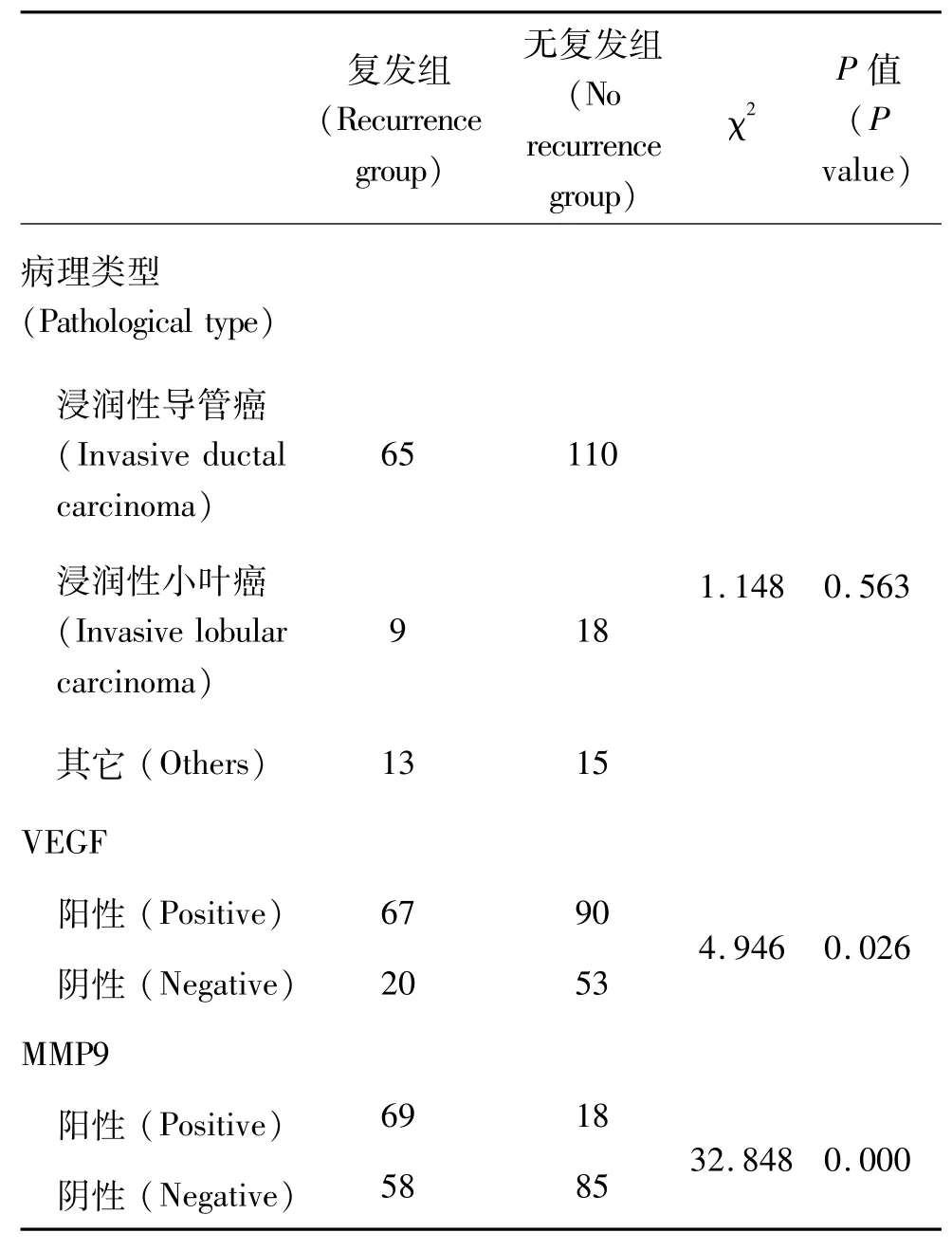
表3 单因素分析 VEGF、MMP9的表达与肿瘤复发的关系Table 3 Single factor analysis of the relationship between VEGF and MMP9 expression and tumor recurrence
Logistic回归分析显示 VEGF(OR=1.973)、MMP9(OR=5.618)是乳腺癌复发转移的危险因素(表4)。

表4 Logistic回归分析 VEGF、MMP9的表达与肿瘤复发的关系Table 4 Logistic regression analysis of the relationship between VEGF and MMP9 expression and tumor recurrence
讨 论
肿瘤转移是乳腺癌治疗失败和患者死亡的主要原因,其过程包括原发肿瘤部位细胞增殖,细胞外基质降解,血管新生,原发肿瘤细胞脱落,肿瘤细胞穿破细胞外基质屏障向外侵袭,转移的肿瘤细胞通过靶点内皮和基底膜,形成继发性转移灶[2]。因此,研究乳腺癌侵袭转移机制对于指导临床预后复发具有重要意义。
在肿瘤转移这一复杂过程中,肿瘤血管新生起到了重要作用。生理状态下,血管新生始于胚胎期血管网络的形成过程,在病理状态下,当受到低氧或炎症刺激时,VEGF等促血管生成因子大量产生引起信号级联,首先引起现存血管基底膜的分解,以便内皮细胞增殖和迁移,在基底膜开始分解后,血管内皮细胞从基底膜分解处开始向外生长,局部大量内皮细胞聚集形成有较强组织侵袭能力的新生血管芽的前体—足体环,从而促进血管新生[3]。VEGF于1986年由Senger[4]实验室首先发现,是一类编码23kD蛋白的促血管生成因子。VEGF有3种受体,分别为VEGFR-1、VEGFR-2、VEGFR-3,其中VEGFR-1是血管生成的必要受体,VEGFR-2与早期成血管细胞发育有关,VEGFR-3影响血管网络的构成[5,6]。VEGF及其受体是公认的介导新生血管形成的关键因素,研究显示VEGF的高表达与肿瘤微血管密度、恶性程度及患者预后不良密切相关[5,6]。大量研究显示VEGF对脑、肺、肾脏、骨等全身各组织器官血管内皮细胞的增殖、迁移和趋化有十分明显的促进作用[7-10]。乳腺癌的相关研究也显示VEGF在浸润性乳腺癌中呈高表达,并与乳腺癌的侵袭转移密切相关[11,12],且高表达VEGF的患者更易发生复发[13]。在浸润性乳腺癌中,有研究发现 VEGF蛋白的表达水平与乳腺癌血管生成以及早期复发有一定关联[14]。本研究中,VEGF在乳腺癌中的阳性率显著高于癌旁组织,且与乳腺癌患者的临床分期及5年是否复发密切相关,在复发组中VEGF的阳性率显著高于未复发组,是乳腺癌复发的危险因素。有研究显示将经典的预后因素ER/PR、Her-2与VEGF联合进行检测对乳腺癌的治疗及预后判断起到互补作用,有一定临床应用价值[15,16]。
血管新生是一个连续的过程,除了依赖于血管外促血管生成因子VEGF等的刺激外,还需要在细胞外基质蛋白酶的作用下进行基质的降解,进而重塑血管并分化成熟形成稳定的血管。尤其是毛细血管内皮细胞周围基质的降解和重塑最为关键,细胞外基质是由细胞合成并分泌到细胞外,分布在细胞表面或细胞之间的大分子物质,是阻止肿瘤细胞转移的重要组织屏障,其降解和重塑对于毛细血管内皮细胞的迁移、增殖及毛细血管管腔的形成必不可少[17]。MMPs是一组Zn2+、Ca2+依赖的内源性蛋白水解酶家族,几乎能降解除多糖以外的全部细胞外基质成分[18]。MMP9是MMPs家族最重要的成员。研究显示,MMP9能促进内皮细胞或肿瘤细胞的VEGF表达上调,并促进VEGF作用于其受体,从而诱导血管生成[19]。同时,VEGF也刺激内皮细胞产生MMPs或通过调控MMPs及其抑制物基质金属蛋白酶组织抑制剂(TIMPs)的平衡,从而激活基质降解的瀑布式反应,使肿瘤细胞的穿透变得更加容易,影响肿瘤的浸润、转移[20]。因此,MMP9和VEGF在一定程度上互相促进,共同推进肿瘤细胞转移。有报道显示,MMP9在乳腺癌中表达上调且与淋巴结转移密切相关[11,12,21],本研究发现乳腺癌组MMP9的阳性率显著高于癌旁组织,组织学分级较高的患者MMP9阳性表达率显著高于组织学分级较低的患者,有淋巴结转移患者MMP9阳性表达率显著高于无淋巴结转移患者患者,提示MMP9高表达者乳腺癌细胞的浸润性和转移性均增高。此外MMP9与VEGF在乳腺癌中的表达呈显著正相关,提示在诱导乳腺癌微血管生成过程中VEGF和MMP9可能具有协同作用,可能是MMP9通过降解细胞外基质释放基质中VEGF促进血管生成。
血管生成是早期肿瘤的生长、转移和发展所必需的。研究显示肿瘤组织中MMP9及VEGF的表达与复发密切相关,高表达MMP9及VEGF的肿瘤细胞更易于复发及转移[22]。有研究采用文献计量分析法对近10年乳腺癌复发相关基因文献进行统计发现650个乳腺癌复发相关基因,其中关键基因87个,瓶颈基因44个,同为关键基因和瓶颈基因的有37个,而MMP9和VEGF就在这37个与复发最为密切相关的基因中[23]。本研究中5年乳腺癌复发组中MMP9与VEGF蛋白表达均显著高于未复发组,且均是乳腺癌复发转移的危险因素,提示二者在乳腺癌的转移和术后复发中起着重要作用,同时也提示VEGF及MMP9可以作为分子指标用于指导乳腺癌预后及术后复发风险。
综上,我们的研究显示VEGF和MMP9在乳腺癌中的高表达与乳腺癌的病理过程密切相关,二者在促进血管新生方面起协同作用,检测二者的表达对于指导术后复发具有重要意义。
[1]Kerbel RS.Tumor angiogenesis.N Engl J Med,2008,358 (19):2039-2049.
[2]Liao WT,Ye YP,Deng YJ,et al.Metastatic cancer stem cells:from the concept to therapeutics.Am J Stem Cells, 2014,3(2):46-62.
[3]向本旭,刘婷婷,孙芳玲,等.VEGF相关信号通路在血管新生中的研究进展.中国比较医学杂志,2015,25(12):81-86.
[4]Senger DR,Perruzzi CA,Feder J.A highly conserved vascularpermeability factor secreted by a variety of human and rodenttumor cell lines.Cancer Res,1986,46(11):5629-5632.
[5]Jain S,Ward MM,O’Loughlin J,et al.Incremental increase in VEGFR1(+)hematopoietic progenitor cells and VEGFR2(+)endothelial progenitor cells predicts relapse and lack of tumor response in breast cancer patients.Breast Cancer Res Treat,2012,132(1):235-242.
[6]Park JA,Kim DY,Kim YM,et al.Endothelial snail regulates capillary branching morphogenesis via vascular endothelial growth factor.Plos Genet,2015,11(7):e1005324.
[7]Quittet MS,Touzani O,Sindji L,et al.Effects of mesenchymal stem cell therapy,in association with pharmacologically active microcarriers releasing VEGF,in an ischaemic stroke model in the rat.Acta Biomater,2015,15:77-88.
[8]Lee CG,Link H,Baluk P,et al.Vascular endothelial growthfactor(VEGF)induces remodeling and enhances TH2-mediated sensitization and inflammation in the lung. Nat Med,2004,10(10):1095-1103.
[9]Iacovelli R,Sternberg CN,Porta C,et al.Inhibition of the VEGF/VEGFR pathway improves survival in advanced kidney cancer:a systematic review and meta-analysis.Curr Drug Targets,2015,16(2):164-170.
[10]Gerber HP,Vu TH,Ryan AM,et al.VEGF couples hypertrophic cartilage remodeling,ossification and angiogenesis during endochondral bone formation.Nat Med,1999,5 (6):623-628.
[11]师晓莉,王蕾,刘存,等.MMP-9、VEGF和 PTEN在乳腺癌中的表达及其临床意义.新疆医科大学学报,2008,3(7):809-811.
[12]赵颖海,苟新敏,陈小毅,等.VEGF、MMP-2、MMP-9在乳腺癌组织中的表达及其对侵袭和转移的影响.广东医学院学报,2005,23(1):1-5.
[13]廖妮,唐利立,王泽强,等.OPN和VEGF的表达在乳腺癌复发转移中的的意义.肿瘤防治研究,2010,37(4):431-434.
[14]Toi M,Yamashiro H,Tsuji W.Risk reduction of distant metastasis in hormone-sensitive postmenopausal breast cancer.Breast Cancer,2009,16(3):207-218.
[15]刘崇梅,李岳,林明晖,等.VEGF在乳腺癌中的表达及其与ER、PR的相关性研究.现代肿瘤医学,2012,20(3):527-529.
[16]张玉洲,赵芳,徐光磊,等.ER、PR、Her-2与VEGF在乳腺癌组织中的表达及其相互关系的研究进展.医学研究杂志,2015,44(2):28-31.
[17]胡梅艳,孙晓红.细胞外基质、基质金属蛋白酶与恶性肿瘤关系的研究进展.肿瘤药学,2016,6(1):26-30.
[18]Scherer RL,McIntyre JO,Martrisian LM.Imaging matrixmeralloproteinases in cancer.Cancer Metastasis Rev, 32008,27(4):679-690.
[19]Ganguly KK,Pal S,Moulik S,et al.Integrins and metastasis.Cell Adh Migr,2013,7(3):251-261.
[20]Min KW,Kim DH,Do SI,et al.Expression patterns of stromal MMP-2 and tumoural MMP-2 and-9 are significant prognostic factors in invasive ductal carcinoma of the breast. APMIS,2014,122(12):1196-1206.
[21]王丽辉,王波,李连宏,等.乳腺癌VEGF、MMP-9及COX-2蛋白表达与淋巴道转移和血管生成的相关性.临床与实验病理学杂志,2008,24(2):154-158.
[22]Ishii Y,Nakasato Y,Kobayashi S,et al.A study on angiogenesis-related matrix metalloproteinase networks in primary hepatocellular carcinoma.J Exp Clin Cancer Res,2003,22 (3):461-470.
[23]姜兆静,岑东芝,杨菲,等.乳腺癌复发相关基因的文献计量学和生物信息学分析.中国肿瘤,2012,21(2):127-131.
Immunohistochemical expression of VEGF and MMP9 in breast cancer and its relationship with tumor recurrence and metastasis
Yuan Jingping1,Chen Chuang2,Yuan Xiuxue3,Gao Likun1,Liu Lin1,He Huihua1,Rao Jie1,Yan Honglin1*
(1Department of Pathology,2Department of Breast and Thyroid Surgery,Renmin Hospital of Wuhan University,Wuhan 430060;3Medical college of Wuhan University of Science and Technology,Wuhan 430065,China)
Objective To investigate the expression of vascular endothelial growth factor(VEGF)and matrix metalloproteinase 9(MMP9)in breast cancer,and their correlation with the clinical symptoms,pathological changes,as well as tumor metastasis and recurrence.Methods Immunohistochemistry was performed to detect the expression of VEGF and MMP9 in a microarray of 230 cases of breast cancer.The correlation between the two and the relationship between their expression and the clinical pathological parameters as well as tumor recurrence of breast cancer were analyzed.Results The positive rates of VEGF and MMP9 in breast cancer were 68.3% and 55.2%respectively,which were remarkably higher than in para-tumorous tissues.The expression of VEGF was closely related to the TNM stage,the positive rate of VEGF in patients of stageⅠbeing significantly lower than that in patients of stageⅡandⅢ.The expression of MMP9 was significantly correlated with histological grading and lymph node metastasis.The positive rate of MMP9 was significantly higher in the group with than without lymph node metastasis,and it gradually increased with the rise of the histological grade. The expression of MMP9 was positively correlated with that of VEGF.The positive rates of MMP9 and VEGF in the recurrence group were significantly higher than in the group without recurrence,both being considered as the risk factors of breast cancer recurrence. Conclusion The high expression of VEGF and MMP9 in breast cancer is a risk factor of postoperative recurrence,and the detection of their expression is of great significance for evaluating prognosis.
Breast cancer;vascular endothelial growth factor;matrix metalloproteinase 9;recurrence
R737.9
A
10.16705/j.cnki.1004-1850.2016.05.010
2016-08-15
2016-10-10
湖北省教育厅科学研究计划指导性项目(B2015350);武汉大学自主科研项目(2042016kf0116)
袁静萍,女(1974年),汉族,主任医师
(To whom correspondence should be addressed):honglin1229@163.com
