JAK2-STAT3基因多态性对真菌性角膜溃疡患者伏立康唑血药浓度的影响
2016-12-05李爽乐曾洪波邓应平
彭 璟,李爽乐,曾洪波,邓应平
·临床论著·
JAK2-STAT3基因多态性对真菌性角膜溃疡患者伏立康唑血药浓度的影响
彭 璟1,2,李爽乐2,曾洪波2,邓应平1
•METHODS: A total of 56 cases (56 eyes) with fungal corneal ulcer wererecruited in our hospital from March 2012 to February 2015. The concentration of voriconazole plasma in each patient was detected by high performance liquid chromatography with fluorescence detection. Meanwhile, the JAK2/STAT3 genotype analysis was performed by polymerase chain reaction restriction fragment length polymorphism (PCR-RFLP).
•RESULTS:All patients were divided into high voriconazole plasma concentration group (35 cases, 62.50%) and low voriconazole plasma concentration group (21 cases, 37.50%) by using standard median as boundary value. There was no significant difference on the male proportion, height, weight, daily dose and adverse reaction of the patients between high and low serum voriconazole concentration group (P>0.05). The median trough concentration and the median standardized serum concentration in the high serum voriconazole concentration group were significantly higher than those of the low serum voriconazole concentration group (P<0.05). The effective rate of high serum voriconazole concentration group was better than that of low serum voriconazole concentration group (P<0.05). In the seven polymorphic loci of JAK2-STAT3 gene, the JAK2, rs10119004, GA allele, GG allele and the STAT3, rs12948909 TT allele of high serum voriconazole concentration group showed significant difference as compared with the low serum voriconazole concentration group (P<0.05).
•CONCLUSION:The JAK2-STAT3 gene polymorphism shows significant effects on the serum voriconazole concentration and clinical efficacy of voriconazole, indicating that pharmacogenetic study of great significance for clinical rational used of voriconazole.
目的:探讨蛋白酪氨酸激酶2/信号转导子与激活子3(Janus kinase signal transducers 2 and activator of transcription 3, JAK2/STAT3)基因多态性对真菌性角膜溃疡患者伏立康唑血药浓度的影响。
方法:选取2012-03/2015-02间我院诊治的56例56眼真菌性角膜溃疡患者为研究对象,采用高效液相色谱-荧光检测法测定每位患者伏立康唑的血药浓度,同时利用聚合酶链式反应-限制性片段长度多态性方法(PCR-RFLP)分别进行JAK2/STAT3基因型分析。
结果:将所有患者以中位标准化伏立康唑血药浓度为分界值,分为高血药浓度组(35例,62%)和低血药浓度组(21例,38%);高、低血药浓度组患者在男性比例、身高、体质量、千克体质量日剂量和不良反应发生情况方面的比较无显著统计学差别(P>0.05);高血药浓度组的中位谷浓度和中位标准化血药浓度都显著高于低血药浓度组(P<0.05);高血药浓度组患者伏立康唑的有效率也优于低血药浓度组(P<0.05);在JAK2-STAT3基因7个多态位点分型中,高血药浓度组患者JAK2 rs10119004位点GG和GA等位基因、STAT3 rs12948909位点TT等位基因与低血药浓度组比较,差异均有统计学意义(P<0.05)。
结论:JAK2-STAT3基因多态性对伏立康唑血药浓度和临床疗效均有明显影响,提示药物遗传学研究对伏立康唑的临床合理用药有重要指导意义。
真菌性角膜溃疡;伏立康唑;JAK2;STAT3
引用:彭璟,李爽乐,曾洪波,等.JAK2-STAT3基因多态性对真菌性角膜溃疡患者伏立康唑血药浓度的影响.国际眼科杂志2016;16(12):2204-2208
0引言
真菌性角膜溃疡是一种主要由真菌引发的感染性角膜病变,具有发病率高、病程长、缺乏敏感性抗真菌药物等特点,也是导致我国角膜盲的首位病因。目前,临床上治疗真菌性角膜溃疡的方式有两种,主要包括手术治疗(角膜移植术或清创术)和抗真菌药物治疗[1]。其中,角膜移植术等手术治疗常因角膜供体严重缺乏,手术难度大,费用昂贵等因素,难以被推广应用,而且术后患者仍存在真菌复发、免疫排斥、角膜穿孔及前房积脓等并发症的风险。因此,抗真菌药物治疗是早期治疗真菌性角膜溃疡最有效的治疗方法之一[2]。然而,遗憾的是,当前用于局部点眼或全身治疗的抗真菌药物数量仍相对偏少,且治疗效果不佳,缺乏药物敏感性和特异性。
伏立康唑是氟康唑的衍生物,属新一代三唑类抗真菌药物,具有抗菌谱广、抗菌作用强等优点,是临床上治疗侵袭性真菌重症感染(包括真菌性角膜溃疡)的一线药物。但最新研究却发现,伏立康唑的药物代谢与单核苷酸多态性(single nucleotide polymorphisms, SNPs)密切相关,并且SNPs也被认为是决定伏立康唑临床疗效优劣的重要影响因素。截至目前,关于伏立康唑的SNPs研究仍仅停留在其药物代谢方面,而对伏立康唑的治疗效果尤其是针对某一特定疾病(如真菌性角膜溃疡)的疗效是否受SNPs的影响尚未明确,且国内外罕见报道[3-4]。蛋白酪氨酸激酶2/信号转导子与激活子3(janus kinase signal transducers 2 and activator of transcription 3,JAK2/STAT3)信号途径是机体内一种重要细胞因子信号转导通路,广泛参与细胞增殖、分化、炎性应激及免疫调节等多种病理生理过程。JAK2/STAT3基因多态性与溃疡性结肠炎、Behcet病、脊柱炎等众多疾病的发生发展紧密相关[5]。重要的是,也有实验研究显示,角膜真菌感染早期即有JAK2和STAT3表达的显著改变,且阻断JAK2/STAT3信号通路具有减轻感染症状的作用,提示JAK2/STAT3基因多态性可能与真菌性角膜溃疡的发生有关[6]。据此,本研究拟以我院诊治的56例真菌性角膜溃疡患者为研究对象,探讨JAK2/STAT3基因多态性与对真菌性角膜溃疡患者伏立康唑血药浓度的相关性,以期为揭示真菌性角膜溃疡的致病机制和伏立康唑临床治疗效果的改善提供科学依据,现总结报道如下。
1对象和方法
1.1对象 选取2012-03/2015-02间我院诊治的56例56眼真菌性角膜溃疡患者为研究对象,其中男34例,女22例,年龄38~59(平均47.19±5.46)岁;发病时间3~41(平均12.85±5.93)d;外伤或异物入眼33例,无明显诱因23例;溃疡位于角膜中央者15例,偏位41例;溃疡最大直径范围1~7mm。纳入标准:(1)中国汉族;(2)所有研究个体间无血缘关系;(3)未罹患高血压、糖尿病、严重感染、自身免疫性疾病等系统性疾病;(4)所有患者均行角膜溃疡刮取物100g/L氢氧化钾湿片镜检查菌丝和孢子,并予以真菌、细菌培养鉴定菌属,确诊为真菌性角膜溃疡;(5)通过相干光断层扫描检查溃疡浸润深度为浅中层,未累及角膜全层;(6)均属首次治疗,且每例患者治疗所用药物均保持一致。排除标准:(1)中重度肝肾功能损害者(内生肌酐清除率≤50mL/min;谷丙转氨酶或谷草转氨酶≥正常3倍;Child-Pugh评分≥10);(2)对伏立康唑使用有禁忌证者;(3)使用其他可影响伏立康唑血药浓度的药物,且与伏立康唑有潜在相互作用的药物。本研究方案经医院伦理委员会批准,且向所有参加研究的患者详细告知血液标本采集的目的,取得患者允许和理解之后,签订书面知情同意书。
1.2方法
1.2.1血药浓度监测 所有患者均予以伏立康唑静脉滴注治疗,负荷剂量300mg,每12h 1次;维持剂量为200mg,每日2次,间隔12h;在滴注结束后72h和下次用药前,即血药浓度达到稳态时采集患者血液,采用高效液相色谱-荧光检测法测定每位患者伏立康唑的血药浓度,并详细记录患者的个人临床资料、体质量和药物剂量等信息。高效液相色谱-荧光法测定条件:(1)流动相,乙腈-水(50∶50);利用Strata-X固相萃取柱过滤后备用;(2)内标:劳拉西泮溶液;(3)色谱柱:4.6mm×250mm,5μm Semmetry碳18柱;(4)流速:每分钟0.8mL;(5)柱温:室温25℃;(6)激发波长:256nm,发射波长:372nm;(7)进样量:20μL。在此色谱条件下,伏立康唑和内标物均有峰值呈现,持续保留时间≤15min。将伏立康唑血药浓度与内标物的荧光测定峰面积作线性回归分析,结果显示伏立康唑标准曲线为Y=0.276X-0.0165(r2=0.9996),线性范围0.211~21.592μg/mL,最低检测质量浓度60ng/mL,浓度梯度的质控样品在日内和日间的相对标准偏差均<5%,相对回收率范围97%~104%,室温放置24h及-20℃反复冻融3次后,测定回收率范围仍保持在85%~101%之间。
1.2.2血液DNA提取 采集患者新鲜外周静脉血液2mL,内置有枸橼酸钠抗凝剂的试管中,-80℃保存备用;利用血液基因组提取试剂盒提取血液DNA,操作流程严格参照试剂说明书执行,将所提DNA分装,置于-20℃贮存。
1.2.3单核苷酸多态性标记基因分型 将JAK2、STAT3基因7个多态性位点于聚合酶链式反应-限制性片段长度多态性方法(PCR-RFLP)分型前即予以测序,并以此作为分型的依据和标准品。PCR引物序列和限制性内切酶详述如下:JAK2,rs7857730,上游:5’-CCCCTTTATTGTAATTTTGAGTTCAT-3’,下游5’-TGAAAACGCCTTCCTTAGAGTC-3’,内切酶HIN1II;JAK2,rs10758669,上游:5’-GAGACAAGGACATGCTGAAGTGC-3’,下游:5’-ACAGACAAGCAAGCAATGTTTTTTTT-3’,内切酶HPYCH4V;JAK2,rs10119004,上游:5’-ATATTGTCATTTTTAACTGCGCTACT-3’,内切酶BSENI;STAT3,rs2293152,上游:5’-CACAAAGGGCCTCTGGCTTC-3’,下游:5’-CATTCCCACATCTCTGCTCCCT-3’,内切酶KPN2I;STAT3,rs6503695,上游:5’-GAGCATATTAAAGTGAAGAAAATAAT-3’;下游:5’-GGGATGTAGATCCAAACTAGAT-3’,内切酶TASI;STAT3,rs744166,上游:5’-GCTGTAATGTCTTGAGGGAATCAAGC-3’,下游:5’-TATTCAGATGGCGGTCACATGC-3’,内切酶HINDIII;STAT3,rs12948909,上游:5’-GGATCTAAAAGAGCCCTACTCTCCA-3’,下游:5’-TCACCCTATTGTGCTACTGAACGT-3’,内切酶TASI。
JAK2-STAT3基因多态性位点PCR反应体系:上下游引物0.25μL浓度10μM,超纯水1μL,模板DNA 1μL,TaKaRa ExTaq酶2.5μL;反应条件:94℃预变性3min,94℃变性40s,退火温度rs6503695,rs10758669,rs744166,rs2293152位点均为58℃,rs7857730,rs10119004位点56℃,rs12948909 为 60℃,40s持续36个循环,72℃延伸5min;结束后将3U的限制性内切酶5μL加入PCR产物中,离心后在反应体系中37℃水浴6h,随后将产物加入8%聚丙烯酰胺凝胶中电泳分离,硝酸银染色观察并拍照。治疗过程中由经验丰富的医师行常规裂隙灯眼科检查,询问患者症状,观察眼部情况并详细记录。
疗效判断标准[7]:(1)治愈: 疼痛症状消失,角膜溃疡灶愈合,荧光染色(-),后弹力层皱褶,角膜水肿消退,前房反应及积脓消失,视力完全或部分恢复。(2)好转:疼痛症状减轻,角膜溃疡灶大部分愈合,荧光染色(±),后弹力层皱褶、角膜水肿明显减轻,前房积脓减少或消失,视力无变化或提高。(3)无效:溃疡灶无变化甚至扩大,前房积脓增加,症状加重,出现角膜穿孔等并发症。治愈和好转均为有效。
统计学分析:所有数据采用SPSS 18.0软件整理和分析。计量资料以均数±标准差表示,两组间的比较利用独立样本Student-t检验;计数资料以率或构成比表示,两组间的比较则应用卡方检验;两组间中位数比较采用Kruskal-Wallis检验。以P<0.05认为差异有统计学意义。
2结果
2.1一般临床资料 真菌性角膜溃疡患者56例一般情况见表1。
2.2等位基因和基因型分布 患者56例DNA样本经PCR-RFLP测定,结果显示JAK2,rs7857730,存在3种基因型和两个等位基因:GG,GT,TT,G,T;JAK2,rs10758669,存在3种基因型和两个等位基因:AA,AC,CC,A,C;JAK2,rs10119004,存在3种基因型和两个等位基因:GG,GA,AA,G,A;STAT3,rs2293152,存在3种基因型和两个等位基因:GG,CG,CC,G,C;STAT3,rs6503695,存在3种基因型和两个等位基因:CC,CT,TT,C,T;STAT3,rs744166,存在3种基因型和两个等位基因:CC,CT,TT,C,T;STAT3,rs12948909,存在3种基因型和两个等位基因:TT,CT,CC,T,C。各基因型多态性分布频率也均符合遗传学的 Hardy-Weinberg平衡定律(P>0.05)。采用标准化伏立康唑血药浓度与56例患者基因型进行对比,即血药浓度除以患者每日每千克体质量的用药日剂量(血药浓度/体质量剂量),单位是μg·kg/mL·mg,以此排除用药剂量和体质量对血药浓度的影响。将所有患者以中位标准化伏立康唑血药浓度为分界值,分为高血药浓度组(35例,62.5%)和低血药浓度组(21例,37.5%)。
表1 所有真菌性角膜溃疡患者一般情况
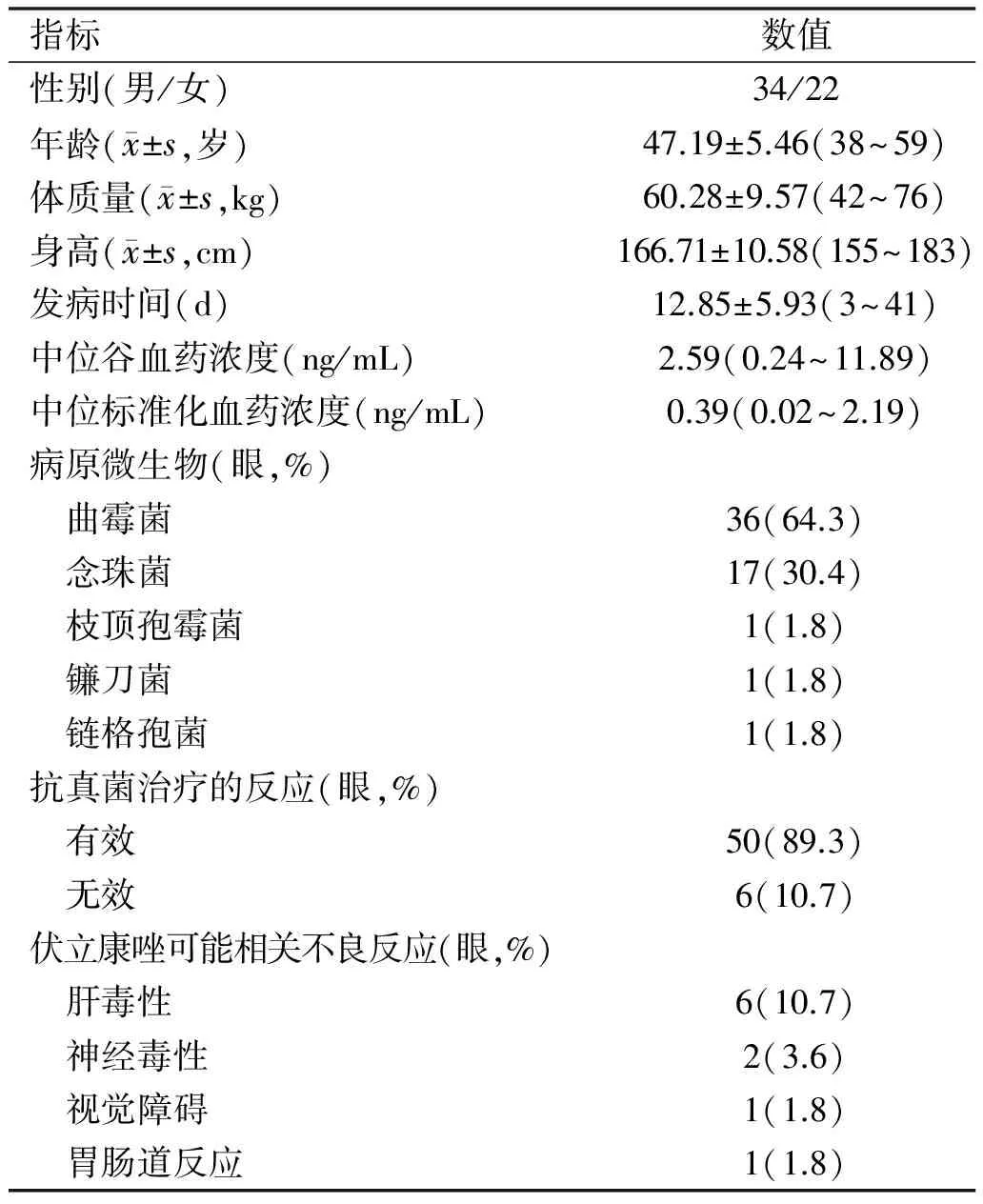
指标数值性别(男/女)34/22年龄( x±s,岁)47.19±5.46(38~59)体质量( x±s,kg)60.28±9.57(42~76)身高( x±s,cm)166.71±10.58(155~183)发病时间(d)12.85±5.93(3~41)中位谷血药浓度(ng/mL)2.59(0.24~11.89)中位标准化血药浓度(ng/mL)0.39(0.02~2.19)病原微生物(眼,%) 曲霉菌36(64.3) 念珠菌17(30.4) 枝顶孢霉菌1(1.8) 镰刀菌1(1.8) 链格孢菌1(1.8)抗真菌治疗的反应(眼,%) 有效50(89.3) 无效6(10.7)伏立康唑可能相关不良反应(眼,%) 肝毒性6(10.7) 神经毒性2(3.6) 视觉障碍1(1.8) 胃肠道反应1(1.8)
2.3血药浓度分组后一般情况、药动学参数、不良反应及疗效比较 如表2所示,高、低血药浓度组患者在男性比例、身高、体质量和千克体质量日剂量方面的比较无显著差别(P>0.05);而高血药浓度组的中位谷浓度和中位标准化血药浓度都显著高于低血药浓度组(P<0.05);此外,高血药浓度组患者伏立康唑的有效率也优于低血药浓度组,差异有统计学意义(P<0.05),且两组间的不良反应发生情况比较差异也无统计学意义(P>0.05)。
2.4基因型与患者血药浓度的关系 如表3所示,JAK2-STAT3基因7个多态位点分型中,高血药浓度组患者JAK2 rs10119004位点GG和GA等位基因与低血药浓度组比较,差异均有统计学意义(P<0.05);另外,高血药浓度组患者的STAT3 rs12948909位点TT等位基因与低血药浓度组比较也有显著性统计学差异(P<0.05)。
3讨论
角膜位于眼球的前端,常因植物划伤、角膜异物和内翻倒睫等引发角膜损伤,进而受细菌或真菌侵袭感染,导致角膜溃疡的发生。真菌性角膜溃疡是当前发病较高的致盲性、顽固性眼部疾病,临床上主要采用抗真菌药物和手术治疗两种方式。然而,由于缺乏有效、广谱的抗真菌药物,手术难度较高,角膜供体来源又不足,因而真菌性角膜溃疡的治疗疗效一直并不令人满意。相对于角膜手术,抗真菌药物治疗对患者的身体和经济的负担较小,且不会出现术后前房积脓、角膜穿孔或免疫排斥等并发症,是一种治疗真菌性角膜溃疡的有效方法之一。当前临床上应用的抗真菌药物主要以氟康唑、伊曲康唑等唑类抗真菌药物为主,它们易穿透角膜,对真菌产生杀灭作用,但长期使用所产生的耐药性一直是困恼一线医师的关键难题[8-9]。
表2 血药浓度分组后一般情况、药动学参数、不良反应及疗效比较
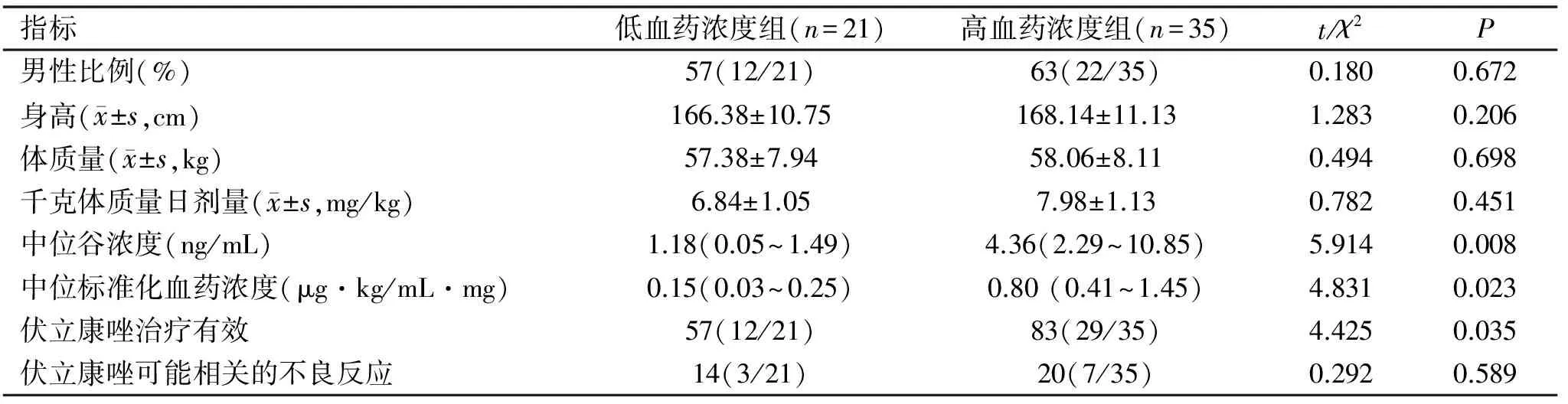
指标低血药浓度组(n=21)高血药浓度组(n=35)t/χ2P男性比例(%)57(12/21)63(22/35)0.1800.672身高( x±s,cm)166.38±10.75168.14±11.131.2830.206体质量( x±s,kg)57.38±7.9458.06±8.110.4940.698千克体质量日剂量( x±s,mg/kg)6.84±1.057.98±1.130.7820.451中位谷浓度(ng/mL)1.18(0.05~1.49)4.36(2.29~10.85)5.9140.008中位标准化血药浓度(μg·kg/mL·mg)0.15(0.03~0.25)0.80(0.41~1.45)4.8310.023伏立康唑治疗有效57(12/21)83(29/35)4.4250.035伏立康唑可能相关的不良反应14(3/21)20(7/35)0.2920.589
表3 JAK2-STAT3不同基因型与血药浓度的相关性

基因SNPs基因型/等位基因低血药浓度组(n=21)高血药浓度组(n=35)χ2PORJAK2rs7857730GG5(24)10(29)0.1520.6970.781GT10(48)16(46)0.0190.8901.080TT6(29)9(26)0.0550.8151.156G10(48)18(51)0.0750.7820.859T11(52)17(49)---JAK2rs10758669AA6(28.57)10(28.57)0.0001.0001.000AC12(57.14)15(42.86)1.0730.3001.778CC3(14.29)10(28.57)1.5030.2200.417A13(61.90)17(48.57)0.9380.3331.721C8(38.10)18(51.43)---JAK2rs10119004GG4(19.05)18(51.43)5.7700.0160.222GA10(47.62)7(20.00)4.7360.0303.636AA7(33.33)10(28.57)0.1410.7081.250G10(47.62)20(57.14)0.4790.4890.682A11(52.38)15(42.86)---STAT3rs2293152GG4(19.05)9(25.71)0.3720.5670.680CG11(52.38)19(54.29)0.0190.8900.926CC6(28.57)7(20.00)0.5410.4621.600G9(42.86)18(51.43)0.3860.5340.708C12(57.14)17(48.57)---STAT3rs6503695CC5(23.81)12(34.29)0.6810.4090.599CT12(57.14)11(31.43)3.5860.0582.909TT4(19.05)12(34.29)1.4930.2220.451C9(42.86)20(57.14)1.0730.3000.563T12(57.14)15(42.86)---STAT3rs744166CC3(14.29)9(25.71)1.0180.3130.481CT11(52.38)18(51.43)0.0050.9451.039TT7(33.33)8(22.86)0.7350.3911.688C8(38.10)19(54.29)1.3780.2400.518T13(61.90)16(45.72)---STAT3rs12948909TT10(47.62)6(17.14)5.9730.0154.394CT6(28.57)18(51.43)2.8000.0940.378CC5(23.81)11(31.43)0.3730.5410.682T14(66.67)15(42.86)2.9800.0842.667C7(33.33)20(57.14)---
伏立康唑是一类新型的抗真菌药物,属氟康唑的衍生物,对眼部多种常见致病真菌如曲霉菌、念珠菌、枝顶孢霉菌和镰刀菌等均有较强的杀菌活性[10]。本研究纳入的研究对象中,感染的致病真菌也以曲霉菌(64%)和念珠菌(30%)为主,伏立康唑也表现出较为良好的抑菌效果,显效率高达89%,这与既往报道的结果基本一致[3,11],但本研究结果显示,有17.9%患者可出现肝毒性、神经毒性和胃肠道应激等不良反应,提示伏立康唑的药物副作用与氟康唑、伊曲康唑等唑类抗真菌药物相比并无明显的优势。有报道显示,伏立康唑对曲霉菌、念珠菌及镰刀菌的最小抑菌浓度分别约为0.016、0.5、2μg/L,在相同剂量水平下,伏立康唑对上述菌株的体外抑制率均为100%,显著高于临床上其他唑类抗真菌药物(如酮康唑,82%;伊曲康唑,67%;氟康唑,60%)[12-14]。本研究结果也发现,即便在低血药浓度组,伏立康唑的中位谷浓度也可达1.18μg/L,表明伏立康唑的靶浓度和抑菌效果均优于其他唑类抗真菌药物,基于此,伏立康唑的治疗有效率高于其他唑类抗真菌药物也在情理之中。然而,遗憾的是,最新的研究结果发现,尽管伏立康唑的治疗有效率较高,但患者个体治疗效果的差异却相对较大,提示伏立康唑临床治疗有效率的高低可能与个体遗传易感性存在关联[15]。
目前,关于伏立康唑的分子遗传学研究主要集中于药物代谢相关的SNPs研究,而对于影响伏立康唑药物作用浓度的药物遗传学研究则相对较少。有学者发现,细胞色素P450同工酶CYP2C19基因的多态性是引起个体对伏立康唑表现出不同代谢能力的主要原因,该酶基因出现突变,可导致蛋白合成过早终止,产生弱活性或无活性的CYP2C19酶,失去羟化代谢能力,进而使得血液中的伏立康唑浓度无法达到较高的浓度,但影响伏立康唑靶作用浓度及疗效的遗传易感性的具体机制目前仍未明确[16]。重要的是,在众多候选基因中,最新的研究发现,JAK2/STAT3基因在角膜感染的早期即可出现表达水平的差异性改变,提示JAK2/STAT3可能在真菌性角膜溃疡中亦发挥重要作用[6]。为验证这一可能,本研究首次对JAK2/STAT3的7个多态性位点进行基因型分析,结果显示JAK2 rs10119004位点GG和GA等位基因、STAT3 rs12948909位点TT等位基因与伏立康唑的血药浓度显著相关,提示上述3个等位基因的多态性也是影响伏立康唑靶浓度的因素,继而导致伏立康唑临床个体治疗效果的产生显著差异性。众所周知,JAK是一种非受体型酪氨酸蛋白激酶,不同类型的JAK异形体合称JAKs家族。其中,JAK2基因定位于染色体9p24,属胞内蛋白酪氨酸激酶,广泛参与造血和免疫等系统的细胞信号转导[17]。作为JAK2的底物,STAT3则是脱氧核糖核酸结合蛋白STAT家族之一,位于17q21.1,可介导IL-12、IL-23等多种细胞因子的信号转导。JAK2/STAT3信号通路的活化也被认为是机体应激性反应的关键影响因素[18]。由于目前尚缺乏关于真菌性角膜溃疡与JAK2/STAT3信号通路的活化的相关机制研究,因而尚无法深入解析该信号通路遗传易感性对伏立康唑血药浓度的影响机制。从理论上分析,我们认为其潜在机制可能有以下两种:(1)JAK2/STAT3基因的多态性可能直接影响该信号通路能否顺利活化,继而激活被JAK2/STAT3信号通路调控的药物代谢相关基因,进而直接影响伏立康唑的血药浓度;(2)既往已有许多研究发现JAK2/STAT3基因的多态性与机体免疫功能水平密切相关,在免疫抑制状态下伏立康唑的药动学参数势必受到严重影响,继而间接影响伏立康唑的血药浓度。
鉴于JAK2/STAT3基因的多态性对伏立康唑血药浓度影响的重要性,我们建议未来临床上可针对SNPs的不同检测结果予以相应的用药方案的建议:若患者为JAK2 rs10119004位点GG型,建议适当减少给药剂量,并密切观察血药浓度,一旦伏立康唑血药浓度过低,则及时增加剂量;如患者为JAK2 rs10119004位点GA型及STAT3 rs12948909位点TT型时,则在常规剂量适量增加给药即可,同时监测伏立康唑血药浓度。该策略可能对提高伏立康唑临床抗真菌疗效,降低药物毒副作用,指导临床伏立康唑的合理使用有积极作用。值得注意的是,由于本研究纳入的样本数量有限,患者多来自于同一人群,且真菌性角膜感染的发病机制较为复杂,故研究的结论仍有待后续深入的机制研究或多中心临床实验加以论证。
1 Lalitha P, Prajna NV, Oldenburg CE,etal. Organism, MIC, and outcome in a fungal corneal ulcer clinical trial.Cornea2012;31(6):662
2 Lalitha P, Sun CQ, Prajna NV,etal.Invitrosusceptibility of filamentous fungal isolates from a corneal ulcer clinical trial.AmJOphthalmol2014;157(2):318-326
3 Arora R, Gupta D, Goyal J,etal.Voriconazole versus natamycin as primary treatment in fungal corneal ulcers.ClinExpOphthalmol2011;39(5):434-440
4 Mikus G, Scholz IM, Weiss J. Pharmacogenomics of the triazole antifungal agent voriconazole.Pharmacogenomics2011;12(6):861-872
5 O’Shea JJ, Holland SM, Staudt LM.JAKs and STATs in immunity,immunodeficiency, and cancer.NEnglJMed2013;368(2):161-170
6 Taylor PR, Roy S, Meszaros EC,etal. JAK/STAT regulation of Aspergillus fumigatus corneal infections and IL-6/23-stimulated neutrophil, IL-17, elastase, and MMP9 activity.JLeukocyteBiology2016;100(1):213-222
7王冬梅,陈光胜,黄明汉.那他霉素在真菌性角膜溃疡愈合中的治疗作用.国际眼科杂志2010;10(4):744-745
8 Dong XH, Gao WJ, He XP.Antifungal efficacy of natamycin in experimental fusarium solani keratitis.IntJOphthalmol2012;5(2):143
9 Gupta S,Shrivastava RM,Tandon R,etal.Role of voriconazole in combined acanthamoeba and fungal corneal ulcer.ContLensAnteriorEye2011;34(6):287-289
10 Troke P, Obenga G, Gaujoux T,etal.The efficacy of voriconazole in 24 ocular Fusarium infections.Infection2013;41(1):15-20
11 Siatiri H, Daneshgar F, Siatiri N,etal. The effects of intrastromal voriconazole injection and topical voriconazole in the treatment of recalcitrant Fusarium keratitis.Cornea2011;30(8):872-875
12 Ozdemir HG, Oz Y, Ilkit M,etal. Antifungal susceptibility of ocular fungal pathogens recovered from around the world against itraconazole, voriconazole, amphotericin B, and caspofungin.MedMycol2012;50(2):130-135
13 Matsumoto Y, Murat D, Kojima T,etal. The comparison of solitary topical micafungin or fluconazole application in the treatment of Candida fungal keratitis.BrJOphthalmol2011;95(10):1406-1409
14 Carrasco MA, Genesoni G.Treatment of severe fungal keratitis with subconjunctival amphotericin B.Cornea2011;30(5):608-611
15 Owusu Obeng A, Egelund EF, Alsultan A,etal. CYP2C19 polymorphisms and therapeutic drug monitoring of voriconazole: are we ready for clinical implementation of pharmacogenomics?Pharmacotherapy2014;34(7):703-718
16 Lee SH,Kim BH,Nam WS,etal. Effect of CYP2C19 polymorphism on the pharmacokinetics of voriconazole after single and multiple doses in healthy volunteers.JClinPharmacol2012;52(2):195-203
17 O’Shea JJ,Schwartz DM,Villarino AV,etal. The JAK-STAT pathway: impact on human disease and therapeutic intervention.AnnuRevMed2015;66:311-328
18 Sansone P,Bromberg J.Targeting the interleukin-6/Jak/stat pathway in human malignancies.JClinOncol2012;30(9):1005-1014
Effects of JAK2-STAT3 gene polymorphism on voriconazole plasma concentration in patient with fungal corneal ulcer
Jing Peng1,2, Shuang-Le Li2, Hong-Bo Zeng2, Ying-Ping Deng1
1Department of Ophthalmology, West China Hospital, Sichuan University, Chengdu 610041, Sichuan Province, China;2Department of Ophthalmology, the First People’s Hospital, Zigong 643000, Sichuan Province, China
Ying-Ping Deng. Department of Ophthalmology, West China Hospital, Sichuan University, Chengdu 610041, Sichuan Province, China. dyp558@163.com
•AIM: To investigate the effects of Janus Kinase 2-Signal Transducers and Activator of Transcription 3 (JAK2/STAT3) gene polymorphism on the voriconazole plasma concentration in patient with fungal corneal ulcer.
fungal corneal ulcer;voriconazole; JAK2; STAT3
1(610041)中国四川省成都市,四川大学华西医院眼科;2(643000)中国四川省自贡市第一人民医院眼科
彭璟,毕业于泸州医学院,大学本科,主治医师,研究方向:眼表疾病、屈光手术。
邓应平,毕业于华西医科大学,博士,教授,硕士研究生导师,主任医师,研究方向:眼表疾病、屈光手术.dyp558@163.com
2016-08-20
2016-11-08
:Peng J, Li SL, Zeng HB,etal. Effects of JAK2-STAT3 gene polymorphism on voriconazole plasma concentration in patient with fungal corneal ulcer.GuojiYankeZazhi(IntEyeSci) 2016;16(12):2204-2208
10.3980/j.issn.1672-5123.2016.12.08
Received:2016-08-20 Accepted:2016-11-08
猜你喜欢
杂志排行
国际眼科杂志的其它文章
- Vision related quality of life and daily visual functioning in patients undergoing pan-retinal photocoagulation for proliferative diabetic retinopathy
- 不同焦点人工晶状体植入治疗白内障患者术后视觉效果
- Easy removal of rust rings formed after metal foreign bodies in cornea
- 白内障及屈光手术源性散光的计算方法汇总
- 屈光参差性弱视治疗后期加入视功能训练的临床观察
- Peters综合征临床特征和基因突变的研究
