红河红茄中总黄酮的提取及抑菌作用
2016-11-28张虹黄文莉张淑梅李春燕袁寒白红
张虹+黄文莉+张淑梅+李春燕+袁寒+白红丽+郭俊明
摘要:以红茄为材料,乙醇为提取剂浸提,采用正交试验对红茄总黄酮提取条件乙醇浓度、提取温度、提取时间进行优化,用紫外分光光度法进行红茄中总黄酮的测定,并研究其抑菌作用。结果表明红茄中总黄酮最佳提取条件为乙醇浓度(体积分数)60%、提取温度80 ℃、提取时间1 h。在此条件下红茄中总黄酮的提取率最高,为1.50%,RSD为1.02%。红茄总黄酮提取液对肠球菌、枯草芽孢杆菌、大肠杆菌都有一定抑制作用,对肠球菌和大肠杆菌的抑制效果较好,而对枯草芽孢杆菌的抑制效果较差。
关键词:红茄;总黄酮;提取;抑菌作用
中图分类号: R284.2 文献标志码: A
文章编号:1002-1302(2016)09-0287-03
红茄(Solanum integrifolium Poir.),别称扁果苦子、大苦子[1],云南蒙自地区也称苦茄,茄科,一年生草本植物,果实扁圆,上有4~6个浅棱,每棱上常有1浅沟,成熟果实橙黄色、红色。红茄果实为野生苦味蔬菜,具有清热解毒功能[1-2]。目前已从野生到少量栽培,红茄颇受蒙自地区人民的青睐,形成了具有当地特色的食用方法,可用来切片炒食或烧后作为“蘸水”调料。
黄酮类化合物是广泛存在于植物中的一类化合物,在蔬菜、作物、水果等植物中均有分布,黄酮类化合物具有保护心脑血管、清除自由基、抗氧化、抗肿瘤、抗病毒的作用[3-6]。黄酮类化合物呈酸性,能使蛋白质凝固或变性,以影响细胞膜的透性,导致微生物细胞吸收营养、核苷酸合成及ATP活性等功能障碍,从而抑制微生物的生长,产生杀菌和抑菌作用[7-8]。
本试验以红茄的果实为研究对象,采用不同的乙醇浓度、提取温度和提取时间对红茄中总黄酮进行水浴加热浸提,用紫外分光光度法进行测定,并对其抑菌作用进行研究,为苦味野生蔬菜资源的开发和利用提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料 新鲜的红茄果实购于云南省红河州蒙自集市。
1.1.2 试剂 芸香苷标准品、乙醇、亚硝酸钠、硝酸铝、氢氧化钠、浓盐酸、氯化铝、锌粉、三氯化铁,均为分析纯。琼脂粉、蛋白胨(生化试剂)、牛肉膏(生化试剂)。
1.1.3 供试菌株 大肠杆菌(Escherichia coli)、枯草芽孢杆菌(Bacillus subtilis)、肠球菌(Enterococcus faecalis),供试菌种均由红河学院生命科学与技术学院实验室提供。
1.1.3 仪器 紫外分光光度仪(UV-4802S型,上海尤尼柯仪器有限公司)、真空干燥箱(上海一恒科学仪器有限公司)、电热恒温水浴锅(HWS-24,上海一恒科学仪器有限公司)、电子分析天平(BSA224S型,赛多利斯科学仪器有限公司)。
1.2 试验方法
1.2.1 原材料处理 将新鲜的红茄果实洗净、切片,在80 ℃条件下烘干,高速粉碎机粉碎,备用。
1.2.2 标准曲线的制备 准确称取干燥的芸香苷标准品10 mg,置50 mL容量瓶中,加入适量60%(体积分数,下同)的乙醇溶解(60 ℃),再用60%的乙醇定容至刻度,摇匀,得到浓度为0.20 mg/mL 的标准品溶液,备用。
准确移取标准品溶液0、1.0、2.0、3.0、4.0、5.0 mL置于25 mL 容量瓶中,加入5%的NaNO2溶液1.0 mL,摇匀,放置6 min后加入10%的Al(NO3)3 溶液1.0 mL,摇匀,放置6 min后加入4%的NaOH溶液10 mL,摇匀,用60%的乙醇定容,静置15 min,同时以试剂空白作参比。在波长510 nm处测定溶液的吸光度[9]。
以吸光度(D)为纵坐标,浓度(C)为横坐标,绘制标准曲线,得线性回归方程:D=10.796C-0.001 1,r=0.999 9。
1.2.3 红茄总黄酮的提取
1.2.3.1 单因素试验 采用恒温水浴加热的提取方法,分别以提取温度、乙醇浓度、提取时间为影响因素,设置3个因素水平,确定相关因素对红茄提取液总黄酮的影响。
1.2.3.2 正交设计提取因素水平 根据单因素试验结果,采用正交设计方案进一步考察乙醇浓度、提取时间和提取温度3个因素对总黄酮提取的影响,以确定红茄中总黄酮提取的最佳条件。每个因素选择3个水平进行正交试验(表1)。
称取制备好的红茄粉末2 g,分别置于带塞三角瓶中,各加入20 mL乙醇,按表1因素水平进行提取。提取后过滤,用相应浓度乙醇溶液将滤液定容至25 mL容量瓶中,为样品提取液。
1.2.4 总黄酮含量的测定 准确吸取样品提取液2mL,置于25 mL容量瓶中,按“1.2.2”节方法操作,在510 nm波长处平行测定3次,同时以样品空白作参比。根据回归方程计算总黄酮含量,总黄酮提取率=[提取液浓度×稀释倍数×体积/样品干重×1 000]×100%[10]。
1.3 红茄总黄酮提取液抑菌方法
1.3.1 菌种的活化 在无菌条件下将大肠杆菌、枯草芽孢杆菌、肠球菌的菌种分别接种在新鲜的培养基中,置于37 ℃恒温箱中培养24 h,进行菌种活化,取第2代备用。
1.3.2 菌悬液的制备 在大肠杆菌、肠球菌、枯草芽孢杆菌的试管斜面培养基上取活化好的少许菌株,用无菌水洗脱,配制成含菌数约为108个/mL的菌悬液备用。
1.3.3 抑菌圈直径的测定[11-12] 在无菌条件下,用已灭菌的滤纸片(直径6 mm)浸入总黄酮提取率最高的60%乙醇浓度红茄总黄酮提取液中,充分浸泡后放在37 ℃干燥箱中烘干制成饱和的药敏纸片,备用。将灭菌后的培养基倒入无菌培养皿中,每皿15 mL,冷却凝固后,用无菌微量注射器取配制好的大肠杆菌、肠球菌、枯草芽孢杆菌的菌悬液各0.1 mL涂布到培养基平板中,将饱和的药敏纸片贴在平板上,以75%乙醇和无菌水的滤纸片作为对照。于37 ℃恒温培养箱中培养24 h,测量抑菌圈直径(d)的大小(mm),测3次求平均值。
1.3.4 红茄总黄酮粗提液用量对抑菌效果的测定 在无菌条件下,向已灭菌的培养皿中分别加入2、3、4、5、6 mL 60%乙醇浓度红茄总黄酮提取液,然后倒入15 mL已灭菌的培养基,混匀、冷却凝固,用无菌移液管将3种菌悬液各加入0.1 mL,用刮铲将菌悬液涂匀后,置于37 ℃恒温培养箱中培养24 h,观察记录细菌生长情况,以得出适宜的总黄酮提取液的用量。每个用量和菌种分别重复3次。
1.3.5 最低抑菌浓度(MIC)的测定 在无菌条件下,将60%乙醇浓度红茄总黄酮提取液稀释成:100%、50%、25%、12.5%、6.25%、3.125%、1.563%的不同浓度系列溶液,分别加入3 mL稀释好的不同浓度的红茄总黄酮提取液于无菌培养皿中,然后倒入15 mL培养基,混匀、冷却凝固后,用无菌微量注射器加入0.1 mL菌悬液,用刮铲将菌液涂匀,置于37 ℃恒温培养箱中培养24 h,观察记录细菌生长情况,每个浓度和菌种分别重复3次。观察记录细菌生长情况,以无菌体生长的浓度为最低抑菌浓度(MIC)。
2 结果与分析
2.1 单因素试验结果
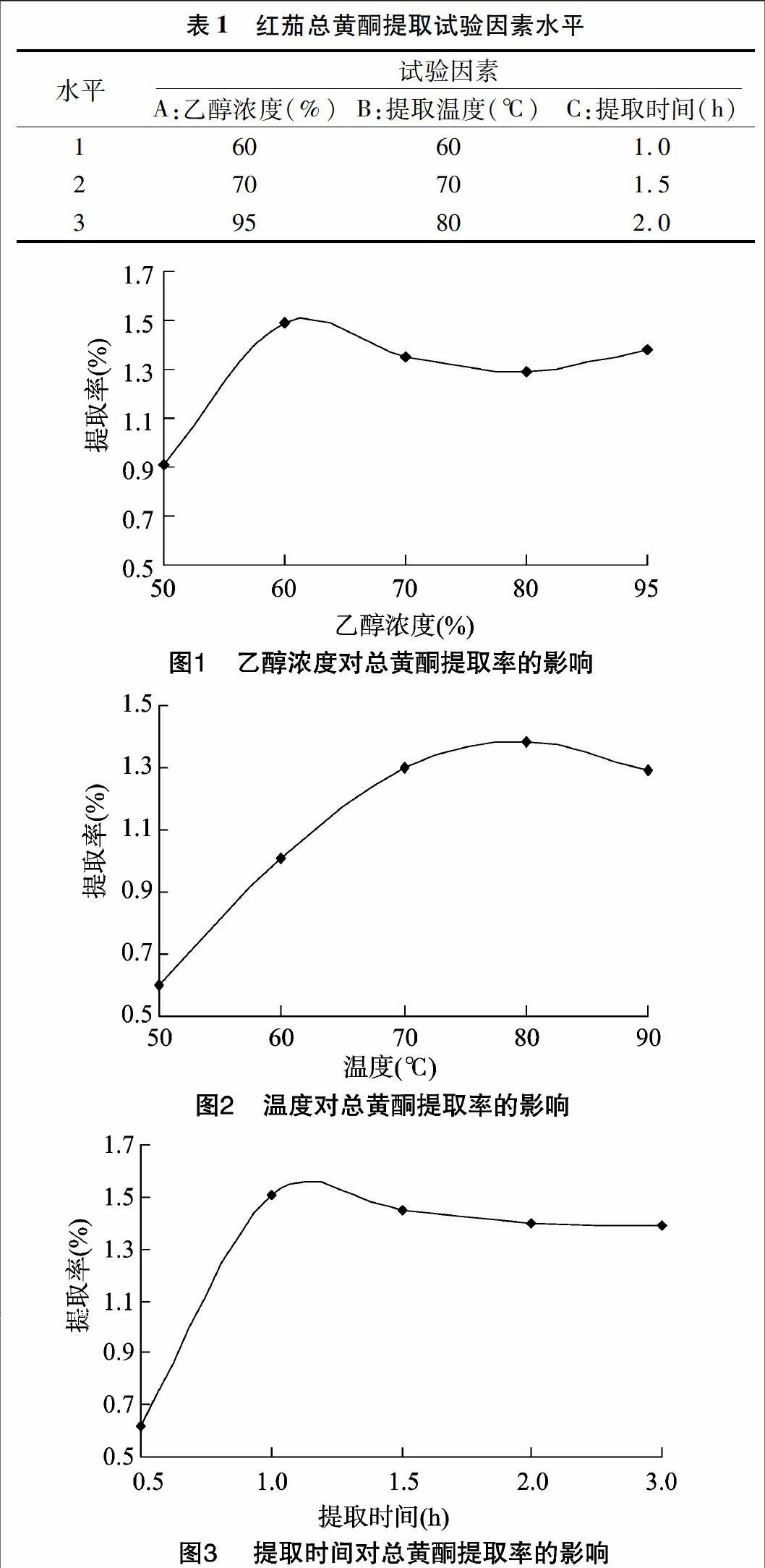
2.2.1 乙醇提取浓度对总黄酮提取率的影响 在温度80 ℃、乙醇浓度50%、60%、70%、80%、95%时,水浴提取1.0 h,结果(图1)表明乙醇浓度在60%、70%、95%时,有较高提取率,60%时总黄酮的提取率最高,70%、80%和95%时的提取率虽有下降,但差别不大。
2.2.2 温度对总黄酮提取率的影响 在乙醇浓度60%、温度50、60、70、80、90 ℃时,水浴提取1.0 h,结果(图2)表明随温度升高,总黄酮的提取率增高,在80 ℃提取率最高,80 ℃以后,提取率略有降低,这可能是因为温度太高,对黄酮类物质会有一定的破坏[13]。
2.2.3 提取时间对总黄酮提取率的影响
在乙醇浓度60%、温度80 ℃,水浴提取0.5、1.0、1.5、2.0、3.0 h的条件下,对红茄总黄酮的提取结果(图3)表明,在提取时间为1.0、1.5、2.0 h时,有较高总黄酮的提取率,在1.0 h时最高;超过1.0 h时,提取率略有下降,但变化幅度不大。
2.2 红茄中总黄酮提取工艺正交结果
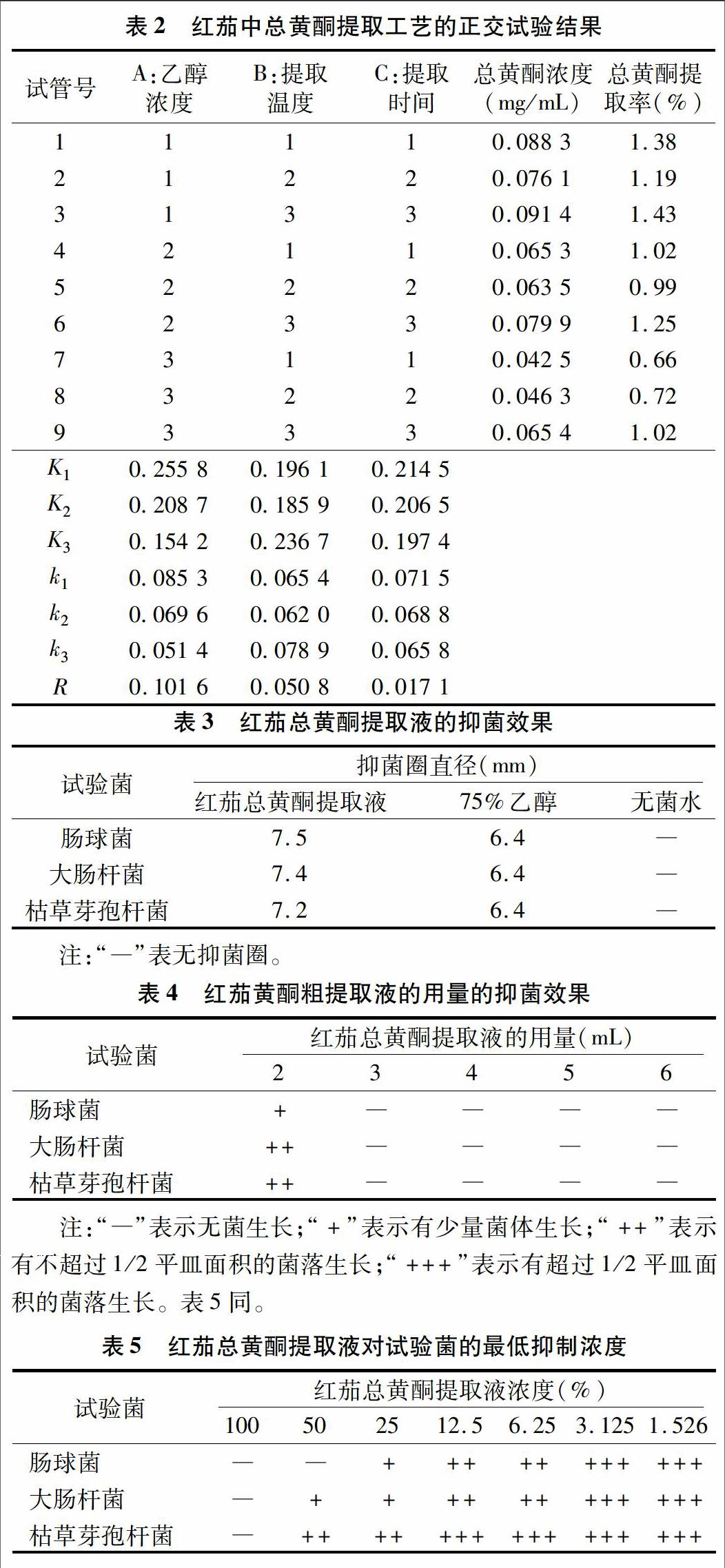
由表2得出红茄中总黄酮提取率最高的为A1B3C3,即乙醇浓度为60%,提取温度为80 ℃,提取时间为2.0 h,最高提取率为1.43%。通过极差(R)分析,各因素对总黄酮提取率的影响程度由大到小为A>B>C;乙醇浓度对总黄酮的提取率影响最大,提取温度影响次之,提取时间影响最小。极差分析的最佳提取条件为A1B3C1,综合考虑其他因素,确定红茄的最优提取工艺为A1B3C1,即乙醇浓度为60%,提取温度为80 ℃,提取时间为1.0 h。
用正交优化的最佳试验条件,按“1.2.2”节方法操作进行红茄中总黄酮的提取试验,做3次平行试验,红茄中总黄酮提取率为1.50%、1.51%、1.50%,平均提取率为1.50%,RSD为1.02%,该提取条件比较稳定、重现性好。
2.3 重复性试验
在乙醇浓度为60%,提取温度为80 ℃,提取时间为1.0 h 的条件下,对红茄中总黄酮重复提取3次,按“1.2.2”节方法操作,总黄酮的提取率平均为1.48%,RSD值为1.10%,试验重复性良好。
2.4 稳定性试验
准确吸取2.0 mL 60%乙醇红茄中总黄酮提取液,按“1.2.2”节方法操作,放置1.0 h,每隔10 min测定1次吸光度,结果表明1.0 h内稳定性良好,RSD为1.03%。
2.5 加标回收率试验
准确吸取60%乙醇红茄总黄酮提取液2.0 mL置于3个25.0 mL容量瓶中,分别加入芸香苷标准品0.2 mg,余下部分按“1.2.2”节方法操作,平行测定5次,计算加标回收率,其平均回收率为99.2%,相对标准偏差RSD为1.17%,表明测定结果准确可靠,符合测定要求。
2.6 红茄总黄酮提取液抑菌效果
由表3可以看出,红茄总黄酮提取液对3种供试菌均有抑制作用,对肠球菌的抑菌效果最好,其次为大肠杆菌,对枯草芽孢杆菌的抑制效果较弱,红茄总黄酮提取液对3种菌的抑制效果均好于对照75%乙醇,无菌水无抑菌作用。
2.7 红茄黄酮粗提取液的用量对抑菌效果的影响
从表4可以看出,红茄总黄酮提取液的用量不同,抑菌效果也不相同。用量为2 mL时肠球菌、大肠杆菌和枯草芽孢杆菌均有少量的菌体生长;当红茄总黄酮提取液用量为3 mL以上时,对3种菌均有明显的抑制作用,因此红茄总黄酮提取液的用量选择3 mL时为最佳的抑菌用量。
2.8 最低抑菌浓度(MIC)的测定
红茄总黄酮提取液对3种供试菌均有抑制作用,抑制作用的强弱与浓度有关,随浓度的增加,抑菌效果增强,其中以红茄总黄酮提取液100%原液的抑菌效果最好。3种菌的MIC值均为100%原液,低于原液浓度的抑菌效果都较弱,尤以红茄总黄酮提取液浓度为3.125%和1.526%时的抑菌效果最差,红茄总黄酮提取液对肠球菌和大肠杆菌的抑制效果较好,但二者差别不大,对枯草芽孢杆菌的抑制效果最差(表5)。
3 结论与讨论
本试验结果表明:各因素对总黄酮提取率的影响程度由大到小为乙醇浓度>提取温度>提取时间。正交试验极差分析得出红茄中总黄酮提取的最佳工艺条件为:乙醇浓度60%、提取温度80 ℃、提取时间为1 h,在此条件下提取红茄总黄酮,总黄酮平均提取率为1.50%,RSD为1.02%。
红茄总黄酮提取液对肠球菌、大肠杆菌、枯草芽孢杆菌都有一定的抑制效果,其抑菌作用的大小与浓度成正相关,以红茄总黄酮提取液100%原液的抑菌效果最好,对3种菌的抑制效果为:对肠球菌和大肠杆菌的抑制效果较好,对枯草芽孢杆菌抑制效果较弱。
有研究表明,黄酮类物质对枯草芽孢杆菌的抑制效果一般好于大肠杆菌[14-17],主要是因为黄酮类物质的抑菌作用与革兰氏阳性细菌和革兰氏阴性细菌细胞壁的组分和结构有关,黄酮类物质对革兰氏阳性菌的抑制效果好于革兰氏阴性菌,但本试验中对枯草芽孢杆菌的抑制效果略低于对革兰氏阴性菌大肠杆菌的抑制效果,与前人研究有一定的差异。
参考文献:
[1]许本汉. 德宏山野蔬果[M]. 德宏:德宏民族出版社,2001.
[2]王海平,余腾琼,耿智德,等. 瑞丽几种苦味野菜资源调研及开发前景[J]. 植物遗传资源学报,2009,10(3):486-489.
[3]田永利,许志宇,葛 林,等. 总黄酮类化合物含量测定方法和药理作用研究进展[J]. 河北医药,2010,32(15):2094-2096.
[4]刘品华,金亚蓉,刘明研,等. 臭参地上部分总黄酮含量及抗氧化活性的研究[J]. 西南农业学报,2014,27(5):1894-1898.
[5]孟庆华,于晓霞,张海凤,等. 天然黄酮类化合物清除自由基机理及其应用进展[J]. 云南民族大学学报:自然科学版,2012,21(2):79-83.
[6]胡英竹,柳 烨. 植物黄酮提取物药理活性的研究[J]. 黑龙江医药,2014,27(3):605-606.
[7]谢 鹏,张敏红. 黄酮类化合物抑菌作用的研究进展[J]. 中国动物保健,2004(12):35-37.
[8]唐浩国,李 叶,刘建学. 黄酮类化合物抑菌作用的研究进展[J]. 农产品加工·学刊,2008(12):53-55.
[9]周文亮,孙蕴哲,唐 星. 用大孔树脂纯化柿叶总黄酮工艺考察[J]. 中国药剂学杂志,2008,6(5):276-282.
[10]刘细祥,黄 斌,马 博,等. 香蕉皮总黄酮提取工艺及其氧化活性研究[J]. 食品工业科技,2014,35(12):258-262.
[11]张益娜,翁 琴. 沙棘叶总黄酮的抑菌性研究[J]. 农产品加工·学刊,2008(9):25-27.
[12]郑津辉,王 威,黄 辉. 苦参提取液中黄酮类化合物的抑菌作用[J]. 武汉大学学报:理学版,2008(4):439-442.
[13]张延杰,田金河. 绿豆壳中提取黄酮工艺的研究[J]. 粮食食品科技,2005,13(5):39-40.
[14]徐金龙,李 倩,王召君,等. 南酸枣皮黄酮提取及其抑菌活性的研究[J]. 食品工业科技,2013,34(11):251-254.
[15]梁 梓,杜 兵,汪淑芳,等. 九节龙总黄酮的抑菌作用[J]. 江苏农业科学,2013,41(6):294-295.
[16]李雪峰,符智荣,魏 燕,等. 田基黄总黄酮提取物的抑菌性能研究[J]. 应用化工,2014,43(3):432-434.
[17]张生潭,王兆玉,兰新宇,等. 响应面法优化麻疯树叶总黄酮提取工艺及其抗菌活性研究[J]. 中药材,2013,36(2):308-311.
