壳聚糖-活性红4缔合体系的荧光猝灭与共振瑞利散射光谱分析及其在壳聚糖定量分析中的应用
2016-11-14张伟爱马彩娟苏政权
张伟爱,王 刚,马彩娟,苏政权,白 研
(广东药学院公共卫生学院,广东 广州 510310)
壳聚糖-活性红4缔合体系的荧光猝灭与共振瑞利散射光谱分析及其在壳聚糖定量分析中的应用
张伟爱,王 刚,马彩娟,苏政权,白 研*
(广东药学院公共卫生学院,广东 广州 510310)
在弱酸性Britton-Robinson缓冲体系中,壳聚糖对活性红4存在荧光猝灭作用,在激发波长(λEx)/发射波长(λEm)=285 nm/341 nm处,在0.050~2.00 µg/mL质量浓度范围内,其荧光猝灭程度与壳聚糖质量浓度呈良好的线性关系。线性方程为ΔF=68.78c+2.648(c,μg/mL),R2=0.999 2,检出限为0.039 μg/mL。在相同的介质环境中,壳聚糖-活性红4离子缔合体系于波长342 nm处产生强烈的共振瑞利散射特征峰,共振瑞利散射强度与壳聚糖质量浓度c呈良好线性关系,在0.050~6.00 µg/mL质量浓度范围内,线性方程为:ΔI=681.31c+114.95(c,μg/mL),R2=0.999 1,检测限为0.033 μg/mL。据此,建立以活性红4为探针定量分析壳聚糖的2 种新方法:荧光猝灭法和共振瑞利散射法。同时,将2 种方法就壳聚糖分子质量对测定结果准确性的影响进行研究。将2 种新方法应用于实际量品的定量检测,测定结果基本一致,且回收率结果令人满意。
壳聚糖;活性红4;荧光猝灭法;共振瑞利散射法
张伟爱, 王刚, 马彩娟, 等. 壳聚糖-活性红4缔合体系的荧光猝灭与共振瑞利散射光谱研究及其在壳聚糖定量分析中的应用[J]. 食品科学, 2016, 37(8): 176-181. DOI:10.7506/spkx1002-6630-201608031. http://www.spkx.net.cn
ZHANG Weiai, WANG Gang, MA Caijuan, et al. Fluorescence quenching and resonance Rayleigh scattering spectra of chitosan-Cibacron brilliant red 3B-A association system and its application for the determination of chitosan[J]. Food Science, 2016, 37(8): 176-181. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201608031. http://www.spkx.net.cn
壳聚糖是甲壳素脱乙酰基产物,其化学名称为聚葡萄糖胺(1,4)-2-氨基-2-脱氧-D-葡聚糖,是自然界含量仅次于纤维素的第二大天然有机高分子化合物[1]。甲壳素是甲壳类(虾、蟹)动物、昆虫的外骨骼的主要成分。壳聚糖及其衍生物是重要的生物活性物质,具有抗肿瘤[2]、抗凝血[3]、减肥降脂[4-5]和增强免疫力[6]等功能,可作为医药保健品、保健食品的重要原料。
随着壳聚糖在功能性食品中的广泛应用,壳聚糖的准确定量显得十分重要。目前,国内外用于壳聚糖定量分析的方法主要集中在分光光度法[7-9]和分子荧光法[10-12]。共振瑞利散射法应用于壳聚糖定量分析的研究很少[13-14]。目前,光谱分析法定量分析壳聚糖普遍忽视了壳聚糖作为高分子天然产物,其相对分子质量可能从几千到百万不等,当未知量品中壳聚糖相对分子质量与壳聚糖标准差异较大时,可能会产生一定的系统误差,影响准确定量,而此方面研究目前还处于空白。
本实验深入研究了在弱酸环境中壳聚糖与活性红4结合后的光谱特征,研究[15-17]发现,壳聚糖能使活性红4的荧光强度产生规律性猝灭,并产生了规律性增强的共振瑞利散射特征峰,据此在分光光度法之外,又建立了2 种定量分析壳聚糖的新方法。同时,本研究结合统计学分析考察壳聚糖标准在不同分子质量的情况下对量品测定结果准确性的影响,提出了量品中壳聚糖更为准确定量的方法。将2 种新方法应用于市售壳聚糖功能食品中壳聚糖的定量分析,检测结果基本一致。
1 材料与方法
1.1材料与试剂
壳聚糖胶囊(奥利维) 威海南波湾生物技术有限公司;壳聚糖胶囊(艾得兰) 上海同济生物制品有限公司;壳聚糖对照品(低分子质量:黏度≤200 mPa·s;中分子质量:黏度200~400 mPa·s;高分子质量:黏度400~1 000 mPa·s;1%溶解在体积分数1%醋酸溶液中,20 ℃)、活性红4染料 美国Sigma公司。实验所用试剂均为分析纯,实验用水为去离子水。
壳聚糖标准贮备液:准确称取0.04 g壳聚糖溶于HAc(0.5 mol/L)溶液中,容量瓶定容至100 mL,得到质量浓度为400.0 μg/mL的标准贮备液。
壳聚糖标准溶液(10.00 μg/mL):吸取壳聚糖标准贮备液2.50 mL于100 mL容量瓶中,以水定容到刻度,临用前制备。
活性红4操作液(1.00×10-4mol/L):精密称取0.025 0 g活性红4染料,用水溶解,于250 mL容量瓶中定容,摇匀,备用。
Britton-Robinson(B-R)缓冲溶液:由0.04 mol/L混合酸((2.71 mL正磷酸+2.36 mL冰乙酸+2.47 g硼酸)/L)与0.2 mol/L NaOH溶液按不同比例配制而成。
1.2仪器与设备
F-2500型荧光分光光度计、UV-3010紫外分光光度计日本日立公司;PHS-3C型精密酸度计 上海虹益仪器仪表公司;CP124C万分之一电子天平 上海奥豪斯有限公司。
1.3方法
1.3.1荧光猝灭法
在一系列10 mL比色管中,依次加入适量的壳聚糖标准溶液或量品操作液、pH4.50的B-R缓冲溶液2.00 mL、活性红4操作液1.00 mL,以水定容至刻度线,摇匀。用1 cm石英比色皿,在激发波长(λEx)/发射波长(λEm)= 285 nm/341 nm处,测定各测试液的荧光强度F,以及对应试剂空白的荧光强度F0,计算ΔF=F0-F。
1.3.2共振瑞利散射法
在一系列10 mL比色管中,依次加入适量的壳聚糖标准溶液或者量品操作液、pH5.50的B-R缓冲溶液2.00 mL、活性红4操作液1.00 mL,以水定容,摇匀,放置10 min。在F-2500荧光分光光度计上,选择激发和发射狭缝宽度均为5 nm,以λEx=λEm进行同步扫描,记录共振瑞利散射光谱,并于波长342 nm处分别测量各测试液的共振瑞利散射光强度I,以及试剂空白的I0,计算ΔI=I-I0。
2 结果与分析
2.1光谱分析
于10 mL比色管中,加入适量的壳聚糖标准溶液,然后加入pH4.50的B-R缓冲溶液2.00 mL,活性红4操作液1.00 mL,以水定容至刻度,摇匀。分别扫描该测试液的紫外-可见吸收光谱、激发光谱、荧光光谱以及共振瑞利散射光谱,结果见图1。

图1 壳聚糖-活性红4体系的吸收光谱、荧光光谱以及共振瑞利散射光谱Fig.1 UV spectra, fluorescence spectra and RRS spectra of chitosan-Cibacron brilliant red 3B-A system
由图1可知,壳聚糖-活性红4在λEx=285 nm、荧光波长341 nm处有最大荧光值,激发光谱和荧光光谱成镜像对称关系,判断荧光图谱应为第一电子激发态的最低振动能级回到基态的各个振动能级所形成的峰,干扰较少,峰值高。且激发光谱与紫外吸收光谱吸收峰位置有较好的重叠,说明在壳聚糖与活性红4之间发生了能量转移。
壳聚糖-活性红4的共振瑞利散射峰位于壳聚糖-活性红4体系的吸收光谱带,此处由于该离子缔合物电子吸收电磁波的频率与散射频率相同,电子因共振而强烈吸收光能并再次散射,从而产生强烈的共振瑞利散射,其散射强度比单纯的瑞利散射提高几个数量级[18]。
荧光光谱位置与共振瑞利散射的最大散射位置有较大重叠,这也意味着在相同频率条件下,在壳聚糖与活性红4之间互相产生共振和能量交换,导致共振瑞利散射增强,其荧光发生相应的猝灭[19]。
2.2荧光光谱

图2 不同壳聚糖质量浓度时的荧光图谱Fig.2 Fluorescence spectra of Cibacron brilliant red 3B-A system
2.3荧光猝灭方式
荧光猝灭过程分为静态猝灭和动态猝灭2 种,静态猝灭是由于猝灭剂与荧光体分子在基态形成不发光的配合物或分子间复合物[20],从而导致荧光体发光强度降低的过程;动态猝灭是猝灭剂与荧光体激发态分子之间的相互作用过程,该过程遵从Stern-Volmer方程[21-22]:

式中:F0为未加猝灭剂的测试液荧光强度;F为加入猝灭剂的测试液荧光强度;KSV为猝灭常数/(mL/µg);[Q]为猝灭剂壳聚糖的质量浓度/(µg/mL)。
按照1.3.1节,检测了3 种不同温度条件下,不同壳聚糖质量浓度时测试液的荧光强度F,以及对应空白的荧光强度F0,以F0/F对[Q]作图,结果见图3,由猝灭曲线得到3 个不同温度的KSV,见表1,从表1中的KSV可见,KSV随着温度的升高而升高,即当壳聚糖质量浓度一定时,ΔF随着温度的升高也逐渐升高。从以上结果可以初步判断壳聚糖对活性红4的荧光猝灭属于动态荧光猝灭,且由于动态猝灭与扩散有关,温度升高时溶液的黏度下降,同时分子的运动加速,分子扩散系数增大,从而增加

图3 不同温度条件下的Stern-Volmer图Fig.3 Stern-Volmer plots of chitosan-Cibacron brilliant red 3B-A at different temperatures

表1 Stern-Volmer方程常数Table 1 Some parameters for Stern-Volmer plots
2.4共振瑞利散射图谱

图4 不同壳聚糖质量浓度的共振瑞利散射图谱Fig.4 RRS spectra of chitosan-Cibacron brilliant red 3B-A systems
参照1.3.2节方法,以λEx=λEm进行同步扫描,记录共振瑞利散射光谱,结果见图4。在弱酸性的B-R缓冲溶液中,壳聚糖和活性红4本身的散射光强度非常弱,但是,两者结合后的共振瑞利散射光强度明显增强,在波长342 nm处呈特征性共振瑞利散射峰。这也由于在弱酸环境中,壳聚糖的氨基阳离子与活性红4的阴离子形成缔合物时呈电中性,疏水性大大提高,导致在所结合产物与水相之间形成界面而产生一种表面增强的散射效应,有利于共振瑞利散射光增强。此共振瑞利散射光增加强度与壳聚糖质量浓度呈线性相关。因此,后续实验选择波长342 nm作为测定波长。
2.5实验条件优化
2.5.1缓冲溶液及pH值的选择
2.5.1.1荧光猝灭法缓冲溶液及pH值的选择
按照1.3.1节方法,考察在HAc-NaAc缓冲溶液、六次甲基四胺-盐酸缓冲溶液和缓冲范围较宽的B-R缓冲溶液中,壳聚糖对活性红4荧光猝灭强度的影响。结果表明,在B-R缓冲溶液中,壳聚糖对活性红4的荧光猝灭程度较强且体系灵敏度最高,在pH 3.50~5.50之间,荧光猝灭强度比较稳定,在pH值为4.50时,ΔF达到最大值。因此,后续实验选用pH 4.50的B-R缓冲溶液体系。
2.5.1.2共振瑞利散射法缓冲溶液及pH值的选择
按照1.3.2节方法,考察B-R缓冲溶液、HAc-NaAc缓冲溶液、六次甲基甲胺-盐酸缓冲溶液和甘氨酸-盐酸缓冲溶液对共振瑞利散射强度ΔI的影响,研究发现在B-R和甘氨酸-盐酸2 种缓冲体系中,测定结果的稳定性较好。但是,采用甘氨酸-盐酸缓冲溶液时,测试液放置时间40 min后有白色的沉淀物析出,放置时间长则干扰后续测定,故选择B-R缓冲溶液。实验得出该缓冲体系pH值为5.50时,ΔI达到最大值,因此,后续实验选择pH 5.50的B-R缓冲溶液。
2.5.2活性红4溶液浓度的选择
按照1.3.2节方法,在固定体系中壳聚糖质量浓度的前提下,考察活性红4浓度对体系荧光强度F和共振瑞利散射强度I的影响,同时测定试剂空白,测定结果见图5。当活性红4溶液浓度为1.00×10-5mol/L时,壳聚糖对体系的荧光猝灭强度ΔF和共振瑞利散射光强度增强值ΔI最大。故后续实验中荧光猝灭方法和共振瑞利散射方法均选用活性红4浓度为1.00×10-5mol/L。

图5 活性红4溶液浓度的影响Fig.5 Effect of different concentrations of Cibacron brilliant red 3B-A
2.5.3缓冲溶液用量的选择
按照1.3.2节方法,在固定壳聚糖质量浓度和其他实验条件的前提下,考察不同B-R缓冲溶液加入量对体系荧光猝灭强度和共振瑞利散射光增强的影响。结果显示当B-R加入2.0 mL时,壳聚糖-活性红4体系的荧光猝灭强度ΔF和共振瑞利散射光增强值ΔI最大。因此,浓度为1.0×10-5mol/L的活性红4实验加入量选择2.0 mL。
2.5.4反应时间和稳定时间
荧光猝灭法测定壳聚糖,测试液的荧光强度在5~60 min内基本恒定,之后,随着反应时间延长,ΔF稍有上升。而共振瑞利散射法测定壳聚糖,测试液的共振散射光强度在120 min内基本不发生变化,稳定性良好。2.6 线性关系与检出限
在优化实验条件下,按照实验方法1.3.1节和1.3.2节分别测定不同质量浓度壳聚糖测试液的荧光强度和共振瑞利散射光强度,同时测定相应试剂空白,以ΔF、ΔI对试液中壳聚糖浓度绘制标准曲线,运算回归方程。选取标准曲线中最低壳聚糖质量浓度,平行制备13 份测试液,同时制备试剂空白(n=13),测定后,根据标准差和标准曲线斜率[10],算得2 种方法检出限。结果见表2。

表2 测定壳聚糖标准曲线的相关参数Table 2 Calibration curve equations with related parameters for the determination of chitosan
2.7共存物质干扰

表3 共存物质干扰实验结果Table 3 Effect of foreign substances on chitosan-Cibacron brilliant red 3B-A
目前,市场上含有壳聚糖的功能性食品以甲壳素胶囊为主,主要成分为壳聚糖,在其中加入辅料成分葡萄糖和淀粉等。
按照1.3.1节和1.3.2节方法,分别于壳聚糖质量浓度为1.00 μg/mL和2.00 μg/mL的测试液中,加入甲壳素胶囊量品中可能的共存物质,进行干扰实验测定,并将测定结果与未加干扰物质的壳聚糖标准测试液测定结果对照,计算产生约±5%相对误差时加入各共存物质的质量浓度,结果见表3。甲壳素胶囊中可能的共存物质如可溶性淀粉、柠檬酸、葡萄糖、甘氨酸及钾、钠等微量元素对测定结果干扰较小,部分金属离子如Ca2+、Mg2+、Cu2+和Fe3+等对壳聚糖的测定影响较大,可以通过在量品中加入适量的乙二胺四乙酸掩蔽剂来消除金属离子的干扰。
2.8壳聚糖分子质量的影响
2.8.1荧光猝灭法
按照1.3.1节方法,取3 组10 mL比色管,分别加入低、中、高分子质量的壳聚糖标准溶液。3 组壳聚糖标准溶液系列质量浓度均为0.05、0.10、0.20、0.30、0.50、1.00、2.00 µg/mL,同时制备试剂空白,各平行3 份。测定以上各测试液的荧光强度,计算相应的ΔF值,绘制不同分子质量壳聚糖的标准曲线。采用统计学软件SPSS 20.0对3 条标准曲线进行斜率显著性检验,得出3 条标准曲线的斜率没有差异(P>0.05),可以初步推断采用此种方法测定壳聚糖含量,即使当壳聚糖标准与量品中壳聚糖的分子质量存在较大差异时,基本不影响测定结果的准确性。
2.8.2共振瑞利散射法
按照1.3.2节方法,取3 组10 mL比色管,参照2.8.1节制备低、中、高3 种壳聚糖分子质量的标准曲线。使用SPSS 20.0软件对3 条标准曲线进行斜率显著性检验,得P<0.05,可以得出,当测定未知量品中的壳聚糖含量时,量品测试液测定数值以3 个不同分子质量的壳聚糖标准曲线进行计算将得出3 个不同的结果,即壳聚糖定量分析结果的准确性受壳聚糖分子质量的影响。
在此基础上,实验研究进一步探索共振瑞利散射法准确定量壳聚糖的方法。首先,考察壳聚糖模量量品的量品曲线与上述3 种标准曲线之间的差异性。壳聚糖模量量品,由中分子质量的壳聚糖标准液中加入葡萄糖10 μg/mL、抗坏血酸5 μg/mL和甘氨酸20 μg/mL干扰物质组成。按照2.8.1节中标准曲线的质量浓度,配制一定质量浓度梯度的量品溶液,平行3 份,同时制备试剂空白。测定各模量量品测试液和试剂空白的共振散射光强度,计算ΔI值,绘制线性方程,与3 种分子质量壳聚糖标准曲线相比较,结果见图6。

图6 低、中、高分子质量壳聚糖的标准曲线以及模拟样品曲线Fig.6 Standard curves for low, medium and high molecular weight chitosan and simulated sample
由图6可知,模量量品曲线与中分子质量标准曲线基本重合。采用SPSS进行斜率显著性检验,得出低、中、高分子质量的壳聚糖标准曲线与模量量品4 条曲线之间存在差异(P<0.05),而中分子质量标准曲线和模量量品曲线之间不存在差异(P>0.05)。
模量量品验证实验。按照1.3.2节方法,取2 组10 mL比色管,模量量品加入量分别为2.50 µg/mL和3.50 µg/mL,各平行3 份,同时制备试剂空白,测定各测试液以及试剂空白的共振瑞利散射光强度值,计算相应ΔI值,分别以低、中、高分子质量壳聚糖标准曲线的回归方程计算模量量品中壳聚糖质量浓度,结果见表4。

表4 采用不同标准曲线计算模拟样品的结果Table 4 Results calculated for one sample according to three standard curves
由表4数据得出,当采用中分子质量壳聚糖标准曲线计算模量量品测得结果时,计算结果误差最小。依此进一步验证,定量检测未知量品中壳聚糖质量浓度时,选取与量品曲线斜率接近的标准曲线作为计算基准可以最大程度降低系统误差。
2.9量品分析
2.9.1量品预处理
准确称取壳聚糖胶囊粉末(奥利维和艾得兰)0.040 0 g,用0.5 mol/L HAc溶液溶解,定容至100 mL,待完全溶解后于6 000 r/min离心15 min,取2.5 mL上清液,并加入0.01 mol/L的乙二胺四乙酸1.00 mL,定容至100 mL,此溶液作为量品操作液。
2.9.2量品含量测定及精密度、加标回收率
按照1.3.2节方法,制备奥利维和艾得兰2 种产品的量品曲线,发现2 种量品曲线均与低分子质量壳聚糖标准曲线的斜率相当。又由于荧光猝灭法测定壳聚糖基本不受标准物分子质量的影响,因此,采用2 种方法检测量品中壳聚糖质量浓度时,均选择低分子质量壳聚糖为定量标准。
按照1.3.1节和1.3.2节方法,于10 mL比色管中加入一定体积的量品操作液,平行3 份,同时制备试剂空白和低分子质量壳聚糖标准曲线。计算量品中壳聚糖含量,结果见表5。荧光猝灭法与共振瑞利散射法测得的结果基本一致。同时做加标回收率实验,结果见表6。荧光猝灭法平均加标回收率为96.27%~105.3%,相对标准偏差为0.95%~2.3%。共振瑞利散射法平均加标回收率为95.85%~104.8%,相对标准偏差为0.73%~4.9%。
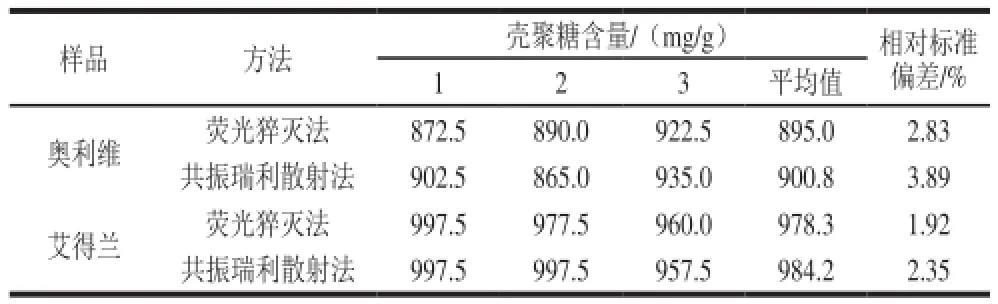
表5 样品测定结果Table 5 Determined results of the sample

表6 2 种测定方法的加标回收率实验结果(n=5)Table 6 Recoveries for spiked samples determined by two methods (n=5)
3 结 论
在弱酸性B-R缓冲体系中,利用壳聚糖与活性红4的离子缔合,建立了2 种定量分析壳聚糖的新方法:荧光猝灭法和共振瑞利散射法。实验过程中系统考察了壳聚糖标准的分子质量大小对未知量品中壳聚糖准确定量的影响,研究发现壳聚糖-活性红4荧光猝灭法基本不受壳聚糖标准分子质量的影响,即当壳聚糖标准物质的分子质量与量品中壳聚糖分子质量存在较大差异时也可以得出较满意的结果,该方法具有准确性和方便性。以活性红4为探针的共振瑞利散射法测定壳聚糖与现有文
献[13-14]报道的共振瑞利散射法测定壳聚糖相比,其灵敏度有较大提升,且通过此方法可以反映出不同分子质量壳聚糖的差异,也可利用此方法初步判断未知量品中壳聚糖的分子质量大小。
[1] KADIB E. Chitosan as a sustainable organocatalyst: a concise overview[J]. ChemSusChem, 2015, 8(2): 217-244. DOI:10.1002/ cssc.201402718.
[2] TORRECILLA D, LOZANO M V, LALLANA E, et al. Anti-tumor efficacy of chitosan-g-poly (ethylene glycol) nanocapsules containing docetaxel: anti-TMEFF-2 functionalized nanocapsules vs. nonfunctionalized nanocapsules[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2013, 83(3): 330-337. DOI:10.1016/ j.ejpb.2012.10.017.
[3] WANG Tan, ZHOU Yue, XIE Weiguo, et al. Preparation and anticoagulant activity of N-succinyl chitosan sulfates[J]. International Journal of Biological Macromolecules, 2012, 51(5): 808-814. DOI:10.1016/j.ijbiomac.2012.07.029.
[4] TAO Yi, ZHANG Hongliang, HU Yinming, et al. Preparation of chitosan and water-soluble chitosan microspheres via spray-drying method to lower blood lipids in rats fed with high-fat diets[J]. International Journal of Molecular Sciences, 2013, 14(3): 4174-4184. DOI:10.3390/ijms14024174.
[5] HSIEH Y, YAO H, CHENG R, et al. Chitosan reduces plasma adipocytokines and lipid accumulation in liver and adipose tissues and ameliorates insulin resistance in diabetic rats[J]. Journal of Medicinal Food, 2012, 15(5): 453-460. DOI:10.1089/jmf.2011.1882.
[6] RANJAN R, PRASAD K P, VANI T, et al. Effect of dietary chitosan on haematology, innate immunity and disease resistance of Asian seabass[J]. Aquaculture Research, 2014, 45(6): 983-993. DOI:10.1111/ are.12050.
[7] 刘树恒, 王立霞, 刘长霞, 等. 刚果红显色法测定羧甲基壳聚糖含量[J]. 化学通报, 2012(4): 376-378. DOI:10.14159/ j.cnki.0441-3776.2012.04.013.
[8] 马卫兴, 章健, 蔡亚雯, 等. 对磺基苯偶氮变色酸褪色光度法测定壳聚糖的研究[J]. 淮海工学院学报(自然科学版), 2012(1): 43-46. DOI:10.3969/j.issn.1672-6685.2012.01.010.
[9] ABOU-SHOER M. A simple colorimetric method for the evaluation of chitosan[J]. American Journal of Analytical Chemistry, 2010, 1(2): 91-94. DOI:10.4236/ajac.2010.12012.
[10] 白研, 苏政权, 魏雪花, 等. 荧光猝灭法测定壳聚糖含量[J]. 分析试验室, 2009(11): 108-110. DOI:10.3969/j.issn.1000-0720.2009.11.029.
[11] 白研, 苏政权, 岑妙兰, 等. OP乳化剂荧光猝灭法测定甲壳素胶囊中壳聚糖的含量[J]. 中国药房, 2012(25): 2367-2369. DOI:10.6039/ j.issn.1001-0408.2012.25.24.
[12] 穆志英, 董存智. 核固红荧光猝灭法测定壳聚糖含量[J]. 分析测试学报, 2010(11): 1221-1224. DOI:10.3969/j.issn.1004-4957.2010.11.023.
[13] PENG Juanjuan, LIU Shaopu, WANG Lei, et al. Study on the interaction between CdSe quantum dots and chitosan by scattering spectra[J]. Journal of Colloid and Interface Science, 2009, 338(2): 578-583. DOI:10.1016/j.jcis.2009.06.055.
[14] WANG Yuwei, LI Nianbing, LUO Hongqun. Resonance Rayleigh scattering method for the determination of chitosan with some anionic surfactants[J]. Luminescence, 2008, 23(3): 126-131. DOI:10.1002/ bio.1020.
[15] 白研, 陈纯, 陈芷仪, 等. 活性红4离子缔合分光光度法测定壳聚糖[J].食品科学, 2010, 31(16): 229-232.
[16] MENDELOVITS A, PRAT T, GONEN Y, et al. Improved colorimetric determination of chitosan concentrations by dye binding[J]. Applied Spectroscopy, 2012, 66(8): 979-982. DOI:10.1366/12-06591.
[17] WISCHKE C, BORCHERT H. Increased sensitivity of chitosan determination by a dye binding method[J]. Carbohydrate Research,2006, 341: 2978-2979. DOI:10.1016/j.carres.2006.10.012.
[18] 韩志辉. 液相纳米微粒体系光散射法测定环境中痕量金属的研究[D].衡阳: 南华大学, 2005. DOI:10.7666/d.y787833.
[19] QIAO Man, WANG Yaqiong, LIU Shaopu, et al. A rapid and sensitive resonance Rayleigh scattering spectra method for the determination of quinolones in human urine and pharmaceutical preparation[J]. Luminescence, 2015, 30(2): 207-215. DOI:10.1002/bio.2714.
[20] 陈淑阳. 喹诺酮药物与生物大分子的相互作用[D]. 杭州: 浙江大学,2006.
[21] 甘晓娟, 刘绍璞, 刘忠芳, 等. 卤代荧光素荧光猝灭法测定肾上腺色腙[J]. 高等学校化学学报, 2012(4): 683-688. DOI:10.3969/ j.issn.0251-0790.2012.04.008.
[22] 田伦富, 刘忠芳, 胡小莉, 等. [Hg(SCN)_4]~(2-)对蛋白质的荧光猝灭反应及其分析应用[J]. 高等学校化学学报, 2012(1): 59-65. DOI:10.3969/j.issn.0251-0790.2012.01.010.
[23] 白文君. 基于碳点荧光猝灭-恢复的分析应用研究[D]. 重庆: 西南大学, 2011.
Fluorescence Quenching and Resonance Rayleigh Scattering Spectra of Chitosan-Cibacron Brilliant Red 3B-A Association System and Its Application for the Determination of Chitosan
ZHANG Weiai, WANG Gang, MA Caijuan, SU Zhengquan, BAI Yan*
(School of Public Health, Guangdong Pharmaceutical University, Guangzhou 510310, China)
A novel method was presented for the determination of chitosan based on its quenching effect on the fluorescence of Cibacron brilliant red 3B-A in B-R buffer solutions. Under the condition of λEx/λEm= 285 nm/341 nm, the degree of fluorescence quenching of Cibacron brilliant red 3B-A was linearly proportional to the concentration of chitosan added in the range of 0.050-2.00 µg/mL and a linear equation was fitted as follows: ΔF = 68.78c + 2.648 (c: μg/mL) (R2= 0.999 2). The detection limit of the fluorescence quenching method was 0.039 μg/mL. Moreover, chitosan-Cibacron brilliant red 3B-A ion-association complex showed a significant resonance Rayleigh scattering peak at 342 nm, and the intensity of resonance Rayleigh scattering was directly proportional to the concentration of chitosan. In the range of 0.050-6.00 µg/mL, linearity equation of chitosan-Cibacron brilliant red 3B-A system was ΔI = 681.31c+114.95 (c: μg/mL) (R2= 0.999 1) with detection limit of 0.033 μg/mL. Therefore, two methods (fluorescence quenching and resonance Rayleigh scattering) by using Cibacron brilliant red 3B-A as a probe have been established and validated for rapid determination of chitosan and chitosan capsules. Meanwhile, the effect of the molecular weight of chitosan on its accurate determination was also investigated. These two methods were applied in analysis of two real chitosan samples, and there was no significant difference in the results from the two methods with acceptable recoveries.
chitosan; Cibacron brilliant red 3B-A; fluorescence quenching; resonance Rayleigh scattering
10.7506/spkx1002-6630-201608031
O657.3
A
1002-6630(2016)08-0176-06
2015-07-01
国家自然科学基金面上项目(81173107);广东省创新训练计划项目(1057312018)
张伟爱(1988—),女,硕士研究生,主要从事环境卫生监测与卫生检验研究。E-mail:zhangweiai0629@126.com
白研(1970—),女,教授,硕士,主要从事卫生检验与药物分析研究。E-mail:angell_bai@163.com
引文格式:
猜你喜欢
杂志排行
食品科学的其它文章
- Optimization of Ethanol Extraction of Total Flavonoids from Suaeda salsa and Its Antioxidant, Hypoglycemic and Hypolipidemic Activities
- 提高冷冻鸡肉丸食用品质的复合抗冻剂配方优化
- 微波处理降低小麦胚芽油中非水化磷脂含量的工艺优化
- Optimization of High Pressure/Temperature Assisted Synthesis of Cyclo(His-Pro)
- NKA-9大孔树脂纯化香椿叶黄酮类物质工艺优化
- 响应面试验优化泡沫分离黄姜中薯蓣皂苷工艺
