原核表达的Neuritin蛋白对PC12细胞突起生长的影响
2016-11-14冯丽娜李晓军
唐 娟,冯丽娜,李晓军,于 娜,王 宏,黄 瑾
原核表达的Neuritin蛋白对PC12细胞突起生长的影响
唐娟1,冯丽娜1,李晓军1,于娜2,王宏1,黄瑾2
目的纯化原核表达的Neuritin蛋白,通过观察其对PC12细胞和研究其神经生物学功能。方法采用镍离子金属螯合亲和层析法纯化Neuritin蛋白,Bradford法对纯化的Neuritin蛋白进行定量, 然后加入到PC12细胞,通过观察PC12细胞突起的生长情况和细胞形态的变化,研究其促进细胞突起生长的功能。结果纯化后的Neuritin蛋白经 SDS-PAGE 电泳显示, 获得唯一蛋白条带,即Neuritin蛋白;Bradford定量法计算出其浓度为0.45 mg/ml,纯化的Neuritin蛋白加入到PC12细胞培养液中,PC12细胞长出突起,发生类神经元样改变。结论原核表达的Neuritin蛋白得到有效纯化及复性,纯化的Neuritin蛋白能促进神经突起生长,考虑Neuritin促进突触发生和调节突触可塑性等方面具有重要作用,为实验室进一步功能研究打下了一定的基础,同时作为新的神经营养因子在治疗神经疾病及其损伤中具有良好的应用前景。
原核表达 ;蛋白纯化;Neuritin;PC12细胞
Neuritin是一种新近发现的与神经可塑性相关的神经营养因子。它是1993年美国麻省理工学院神经生物系的Nedivi发现的神经可塑性相关候选基因15(Candidate Plasticity-Related Gene 15,CPG15)[1];1997年以色列的科学家Naeve发现由CPG15编码的蛋白质能够促进神经突起的快速生长,故将其命名为Neuritin[2,3]。该基因定位于染色体6p25.1,含有429(652-1080)个bp,编码142个氨基酸。Neuritin蛋白以可溶性和膜蛋白两种形式存在,在胚胎早期以可溶性形式存在,晚期才出现少量GPI锚定的Neuritin蛋白[4]。成熟的Neuritin蛋白是小分子量的糖蛋白,可作用于邻近的神经元,促进神经细胞突起的生长及其分支和突触的发育成熟,调节突触回路的形成。阻止神经元的退变与凋亡[5], 促进损伤神经功能的恢复,这提示它在治疗神经系统疾病中具有良好的应用前景[6]。因此,本实验室致力于深入研究其生物学功能,为其能在临床治疗神经系统疾病提供实验基础。
Neuritin的原核表达系统已经成功构建并表达Neuritin蛋白[7,8]。 为了研究 Neuritin的神经生物学活性和功能,使用镍离子柱纯化原核表达的Neuritin蛋白,采用 Bradford法对纯化的蛋白进行定量,然后将其复性后的蛋白加入到PC12细胞,通过观察PC12细胞的突起生长情况,研究其对细胞形态的影响;通过本实验拟为进一步研究Neuritin的神经生物学功能奠定基础。
1 材料和方法
1.1材料Neuritin原核表达体系由本实验室构建;PC12细胞购自中国科学院上海细胞生物学研究所;Ni-NTA纯化试剂盒购自Qiagen公司;F-12K培养基,购自Sigma公司;胎牛血清购自新西兰;马血清购自Hyclon公司;胰蛋白酶购自华美生物工程公司;96孔细胞培养板(美国Costar公司);KW-1型培养箱(中国银川金属制造厂);倒置莹光显微镜系统(Olympus Optical公司)。
1.2方法
1.2.1Neuritin蛋白的纯化(1)将含重组质粒原核表达细菌表达菌分别接种于300 ml LB中进行诱导表达的细菌8600 rpm/min。(2)4 ℃离心,5 min收集诱导表达后的细菌。按每100 ml LB培养的菌液,重悬于50 mmol/L Tris-2 mmol/L EDTA中。(3)加入溶菌酶终浓度为100 μg/ml,再加入10 ml Triton-100在37 ℃水浴箱中温育15 min,让细菌充分的裂解。(4)裂解液放置冰上冰浴30 min,然后在冰上超声处理,300 W,超2 s间歇3 s,进行60个循环。8600 rpm/mim,4 ℃离心30 min,收集的菌液沉淀物即为较纯的包涵体。(5)缓冲液A(8 mol尿素、0.1 mol NaH2PO4,0.01 mol Tris-Hcl pH 8.0)室温溶解包涵体1 h。8600 rpm/min,4 ℃离心30 min取上清。(6)用缓冲液A 600 μl上柱,700 g,4 ℃,离心2 min平衡Ni-NTA柱。离心的细菌裂解的上清600 μl,700 g,4 ℃,离心2 min过柱,重复2~3次。(7)Buffer B(8 mol尿素、0.1 mol NaH2PO4、0.01 mol Tris-Hcl pH 6.3)洗柱,700 g,4 ℃,离心2 min,重复2~3次。(8)在用Buffer C(8 mol尿素、0.1 mol NaH2PO4,0.01 mol Tris-Hcl pH 4.5)700 g,4 ℃,离心2 min,脱柱,重复2~3次。(9)收集各洗脱液取15 μl做SDS-PAGE分析。考马氏亮蓝染色3 h,然后脱色3 h分析、观察结果。
1.2.2Neuritin蛋白的复性准备透析袋:从成卷的透析膜中剪下适当的长度,在过量的10 mmol/L NaHCO3中浸润透析膜并煮沸几分钟,随后在10 mmol/L Na2 EDTA的溶液中煮沸几分钟。重复以上步骤两次。然后用蒸馏水洗数次,放于20%~50%乙醇中置4 ℃保存。把蛋白纯化液装入透析袋,放入装有500 ml复性液1的烧杯中置4 ℃,12 h;弃去复性液,加入新的500 ml复性液2的烧杯中,4 ℃,4 h,其间搅拌数次。重复上述操作4次;在超净台取出透析袋中的蛋白,过滤除菌后,分装于EP试管中置-80 ℃冰箱中,备用。
1.2.3Neuritin蛋白定量用Bradford法定量,以牛血清白蛋白为标准绘制标准曲线,按蛋白浓度(μg/ml)=A595 nm×550×稀释倍数计算。
1.2.4Neuritin蛋白对PC12细胞的影响
1.2.4.1PC12细胞的培养和传代(1)复苏液氮保存的PC12细胞,第2天观察细胞,细胞贴壁生长,形态正常。(2)继续在37 ℃、5% CO2细胞培养中培养,每隔48 h换液。(3)待细胞汇合率达80%~90%时,准备超净工作台,将试剂和材料置于超净台。将培养物置于无菌工作区域,弃去旧的培养基。(4)加3 ml 0.25%胰酶消化液到培养瓶细胞面的对侧,翻转培养瓶平放以确保胰酶完全覆盖细胞层。静置15~30 s,弃去大部分胰酶,只保留少量的胰酶,直至细胞完全消化下来。(5)加入培养液6 ml,用吸管反复吹打培养细胞面10次将瓶壁的细胞冲下来,使细胞分散均匀。稀释细胞悬液直至合适的接种浓度。(6)以8 ml/瓶分别加入两个细胞培养瓶中,显微镜下观察细胞密度情况,放入细胞培养箱中培养。
1.2.5Neuritin促进PC12细胞分化和促神经突起的生长(1)取对数生长期细胞,0.25%胰酶+0.02%EDTA混合消化细胞。(2)用含15%马血清,2.5%胎牛血清的F-12K培养基终止消化并在倒置显微镜下计数按每孔细胞悬液100 μl,细胞密度为6×103个/ml,接种96孔培养板中,37 ℃、5% CO2培养24 h。(3)实验组每孔加入等体积浓度分别为10 μg/ml、20 μg/ml、30 μg/ml、40 μg/ml、50 μg/ml的Neuritin蛋白培养液使总体积为125 μl。(4)阳性组加入浓度为25 ng/ml的NGF,并使每孔的体积为125 μl。(5)阴性组加入空质粒诱导复性后的蛋白浓度分别为20 μg/ml、40 μg/ml。(6)空白对照组加入100 μl的细胞培养液和25 μl PBS使每孔的总体积为125 μl;同时每组设5个复孔。(7)12 h后开始在倒置显微镜下观察细胞的形态的变化。(8)培养72 h,弃上清液,如上述步骤给细胞换液。在倒置显微镜下继续观察细胞形态学的变化及生长情况。
2 结 果
2.1Neuritin重组蛋白的纯化和蛋白定量表达产物经镍离子柱纯化后,进行 SDS-PAGE分析,可见一条颜色较深的蛋白条带,即Neuritin蛋白,无其它杂蛋白条带,由此推断Neuritin蛋白成功得到纯化(见图1)。
2.2Bradford法测定纯化后的Neuritin蛋白浓度为0.45 mg/ml(见图2)。
2.3Neuritin蛋白对PC12细胞的影响使用倒置显微镜观察PC12细胞,结果显示:PBS对照组PC12细胞呈小圆型,无突起生长(见图3-1);6×His对照组与空白对照组几乎无差别(见图3-2);Neuritin组的细胞胞体增大, 有细胞突起长出,切较长较密,细胞形态似神经细胞(见图3-3);NGF 阳性对照组的细胞突起比Neuritin组的更多、更长、更粗,有些突起交织成网状结构(见图3-4)培养3 d后,使用倒置显微镜观察PC12细胞,结果显示:PBS阴性对照组PC12细胞呈圆形,存活的细胞胞体小;而阳性组细胞的胞体较大,变成梭形,并可见明显的突起的生长。培养第3天,实验组细胞周围的突起更加致密,并增长,可见有些突起相互连接成网状,细胞形态似神经细胞,胞体较大,生长状况良好;阴性对照组细胞突起无,细胞小,呈圆形。阳性组胞体增大,突起生长更长、更粗,大部分也融合成网状结构。

1:marker;2:诱导前pET32a/BL21;3:诱导后 pET32a/BL21;4:未诱导pET32a-neuritin/BL21;5:诱导pET32a-neuritin/BL216h后蛋白沉淀;6:诱导pET32a-neuritin/BL21 6 h后上清;7、8:洗脱液;9、10:洗脱后纯化蛋白
图1纯化蛋白的SDS-PAGE鉴定

图2Bradford -考马斯亮蓝法测定蛋白质浓度的标准曲线
3 讨 论
神经营养因子在神经再生中有非常显著的作用,它们在神经系统的发育、分化以及损伤后的再生修复过程中发挥了重要的生物学作用[9~12],而作为Neuritin是一种与神经可塑性相关的神经营养因子,研究表明Neuritin具有较广泛的生物学活性,可促进神经突起的快速生长和分支,并参与神经元的突触活动,因而对多种因素引起的神经系统损伤后轴突和突起的生长具有潜在的治疗与预防作用,因此,深入研究Neuritin的功能及研发基因相关药物具有十分重要的意义。
众所周知,PC12细胞即嗜铬细胞瘤细胞株,是大鼠肾上腺髓质瘤而移植出的一种肿瘤细胞,PC12细胞在培养过程中以易获得性和细胞均一性而成为神经科学离体研究中的重要工具[13]。常规条件下可作为一种儿茶酚胺细胞,表现出增殖细胞的一些特性;当用神经营养因子处理后可分化为交感神经元样细胞,表现出神经细胞的表型,这种分化使其在生态、生理、生化方面更接近于神经元[14,15]。因此PC12细胞是目前广泛用来研究神经细胞功能、分化和凋亡的一种组织细胞培养模型。
实验结果显示:未经处理的PC12细胞呈圆形、有的细胞两极有短的突起,分别以不同浓度的Neuritin蛋白液处理PC12细胞24 h后,即可观察到明显细胞突起;可见细胞体积明显增大,形态由圆形变为短梭形或三角形,突起数目增多;处理48 h时,可见PC12细胞出现多个突起,培养3 d后细胞突起继续伸长,其中有的较长较粗,其上还可见小的突起,类似神经元轴突。除轴突样突起外,细胞还伸出多条其他突起,有长有短,突起数目不等。同时可见随Neuritin剂量的升高,细胞的直径、最长突起长度和突起数目均增大或增多。表明细胞在Neuritin处理后出现的神经样改变呈现良好的剂量和时间相互关系。结果同阳性对照组相当。但实验中Neuritin 蛋白的作用浓度比NGF高很多,可能原因:(1)其促进神经突起和神经纤维生长的活性比NGF低;(2)Neuritin蛋白的纯度比NGF低;(3)蛋白纯化技术不成熟,纯化过程中一些Neuritin蛋白失活及复性不成功,加大了Neuritin蛋白的使用量。而阴性和空白对照组则细胞胞体较小,呈圆形,无突起的生长。随着时间的延长,细胞因缺少营养而出现裂解。
本研究初步的观察了重组的Neuritin能明显的促进神经细胞的分化和神经突起的生长,这为深入的研究Neuritin功能,为治疗神经系统的疾病奠定了基础。
[1]Nedivi E,Hevroni D,Naot D.Numerous candidate plasticity-related genes revealed by differential cDNA cloning[J].Nature,1993,363(12):718-722.
[2]Naeve GS,Ramakrishnan M,Kramer R,et al.Neuritin:a gene induced by neural activity and neurotrophins that promotes neuritogenesis[J].Proc Natl Acad Sci USA,1997,94:2648-2653.
[3]Chen ZY,Chai S,Wang YF,et al.Glial cell line-derived neurotrophicfactor enhances axonal regeneration following sciatic nerve transection in adult rats[J].Brain Res,2001,902(2):272-276.
[4]Raggo C,Ruhl R,McAllister S,et al.2005 novel cellular genes essential for transformation of endothelial cells by kaposi’s sarcoma-associated herpesvirus[J].Cancer Res,2005,65(12):5084-5089.
[5]Fujino T,Lelie JH,Eavri R,et al.CPG15 regulates synapse stability in the developing and adult brain[J].Genes Dev,2011,25:2674-2685.
[6]曹文格,许家军.Neuritin在神经管发育、损伤和疾病中的变化及作用[J].神经解剖学杂志,2012,28:312-316.
[7]唐娟,于娜,吴亮生,等.人Neuritin在原核表达系统的构建及表达纯化[J].中国生物工程杂志,2006,26(4):46-50.
[8]黄瑾,杨磊,应康,等.人类neuritinCDNA的克隆和表达[J].复旦学报,2001,40(5):521-524.
[9]Bonnet D,Garcia M,Vecino E,et al.Brain-derived neurotrophic factor signalling in adult pig retinal ganglion cell neurite regeneration in vitro[J].Brain Res,2004,1007(1/2):142-151.
[10]Wirenfeldt M,Babcock AA,Ladeby R,et al.Reactive microgliosis engages distinct responses by microglial subpopulations after minor central nervous system injury[J].Neurosci Res,2005,82(4):507-514.
[11]Lobner D,Ali C.Mechanisms of bFGF and NT-4 potentiation of necrotic neuronal death[J].Brain Res,2002,954(1):42-50.
[12]Hoke A,Gordon T,Zochodne DW,et al.A decline in glial cell-line derived neurotrophic factor expression is associated with impaire regeneration after long-term Schwanncell denervation[J].Neurol,2002,173(1):77-85.
[13]杨浩,王春婷,于玲,等.稳定表达人CNTF诱导PC12细胞分化研究[J].脑与神经疾病杂志,2003,11(1):4-8.
[14]Campbell XZ,Nee KE.Hierarchical analysis of the nerve growth factor-dependent and nerve growth factor-independent differentiation signaling pathways in PC12 cells with protein kinase inhibitors[J].J Neurosci Res,1995,42(2):207-219.
[15]王丽梅,魏传垠,陈雪红.大鼠GDNF基因的克隆表达及对pc12工程细胞的影响[J].基础医学与临床,2003,23(3):263-268.
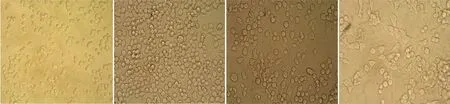
1:阴性组2:空白组3:实验组4:阳性组
图3Neuritin促进PC12 细胞突起生长
Neuritin prokaryotic expression of protein on the impact of the PC12 cells
TANGJuan,FENGLina,LIXiaojun,etal.
(DepartmentofNeurology,TheFirstAffiliatedHospitaloftheMedicalCollege,ShiheziUniversity,Shihezi832002,China)
ObjectiveTo purify Neuritin protein from Prokaryotic expression system of neuritin,and study its neurobiological function by observing its effects on PC12 cells.MethodsUsing Ni affinity chromatography to purify Neuritin protein,and Bradford method to quantify purified Neuritinprotein,then added it into the culture medium of PC12 cells.The promoting neurite outgrowth on cells and cellular morphology change was detected by observing the neurite outgrowth of PC12 cells,and the activity of promoting nerve fibers growth was detected by observing the nerve fibers growth of PC12 cells.ResultsThe purified Neuritin protein was analyzed by SDS-PAGE,and showed only one band of protein was Neuritin protein.Its concentration was 0.45 mg/ml through the Bradford quantitative method calculation.After adding purified Neuritin protein into PC12 cell culture medium,PC12 cells grew protrusions and neuron-like changes appeared;and which were positively correlated with the concentration.ConclusionThe Neuritin protein from Prokaryotic expression system is purified successfully and it can promote the neurite outgrowth of cells,which lays a good foundation for further study on the function and mechanism of neuritin.
Prokaryotic expression;Protein purification;Neurite;PC12 cells
1003-2754(2016)04-0316-04
2015-12-17;
2016-03-29
国家自然科学基金资助项目(No.30260029);石河子大学医学院第一附属医院课题 (No.YL2008-S026)
(1.石河子大学医学院第一附属医院神经内科,新疆 石河子 832002;2.石河子大学医学院生化教研室,新疆 石河子 832002)
黄瑾,E-mail:huangjin623@163.com
R741
A
