基于乙烯基砜化学的高分子膜表面化学糖基化及其活性研究*
2016-11-12孙世猷李明洋王汉奇
孙世猷,李明洋,王汉奇,程 昉
(大连理工大学 精细化工国家重点实验室,制药科学与技术学院,辽宁 大连 116024)
基于乙烯基砜化学的高分子膜表面化学糖基化及其活性研究*
孙世猷,李明洋,王汉奇,程 昉
(大连理工大学 精细化工国家重点实验室,制药科学与技术学院,辽宁 大连 116024)
在高分子膜表面通过化学方法构建糖基化层,实现对生物膜致密“糖被“层的仿生模拟,可以充分拓展及发挥膜材料和糖的生物学功能。利用二乙烯基砜与羟基反应的特性,以乙烯基砜为偶联剂将甘露糖接枝到聚甲基丙烯酸-2-羟乙酯(PHEMA)聚合物膜表面,制备甘露糖糖基化PHEMA膜。利用傅里叶变换红外光谱对糖基化膜结构进行了表征,根据血凝素蛋白特异性识别糖的性质对糖基化反应条件进行了优化,并在蛋白和细胞水平对其进行了生物学评价。结果表明,制备的甘露糖糖基化PHEMA膜具有良好的抗垢性能,能够特异性识别和吸附伴刀豆球蛋白A(ConA);糖基化膜能够引起小鼠单核巨噬细胞(RAW 264.7)特异性粘附且具有较低的细胞毒性。提供了一种高分子膜表面糖基化的简单方法,为仿生膜表面的构建以及细胞表面糖参与的生物代谢活动的研究提供了基础。
聚甲基丙烯酸-2-羟乙酯;乙烯基砜化学;糖基化膜;蛋白吸附;细胞学响应
0 引 言
细胞作为机体生命活动的体现者在生物代谢过程中扮演极其重要的作用,而存在于细胞膜外表面由聚糖构成的“糖被”层[1-3]是生物膜功能的主要体现者,在细胞粘附、细胞间信号传导以及防止外界生物分子在细胞膜上的非特异性吸附[4-6]等一系列生物学过程中起到关键作用。如炎症和癌症的发生与细胞表面聚糖表达的变化息息相关[7];如糖作为“活化剂”可以激活巨噬细胞以起到抵御感染和抗肿瘤的效果,而且糖(如甘露糖)与巨噬细胞的特异性识别[8-9]也可以产生干扰素在杀伤肿瘤细胞的同时还可以保护正常细胞,以此达到免疫调节的作用[10]。受此启发,以聚合物膜-糖为结构模型来构建生物膜表面仿生“糖被”[11],在赋予聚合物膜类似生物膜特性和功能的同时以此为模型在体外实现生物体糖代谢过程的模拟,对于认识和研究膜表面糖参与的生理过程具有指导意义。
表面糖基化[12]即在材料表面通过自组装或接枝等修饰方法引入糖基,而高分子材料作为广泛使用的膜材料[13]在进行表面糖基化时,各种传统和新型的糖基化方法都能采用。表面糖基化方法主要分为3大类[14]:非共价固定,共价固定和酶催化表面糖基化。
非共价固定是指基底材料表面与糖基通过疏水相互作用、静电相互作用、范德华力和氢键等非共价作用力结合来实现表面糖基化。此类方法的优点是对材料基底表面不进行或只进行简单处理,操作过程简单,如Yang将末端为三苯基的烷基甘露糖以疏水作用连接在孔板表面并以此表面糖基化的孔板得到甘露糖与伴刀豆球蛋白A的特异性作用[15]。共价固定[14]指的是基底材料表面与糖基以化学键的形式固定来实现表面糖基化,与前者相比糖基共价固定途径广且得到的糖基化膜稳定性有所提高。Knaus等人对葡萄糖叠氮化修饰后与聚丙烯和聚乙烯薄膜表面连接,明显改善聚烯烃膜材料表面的亲水性能[16]。酶催化表面糖基化[17],即糖基在生物催化剂或酶的作用下通过化学键与基底表面相连来实现表面糖基化,该法反应条件温和、糖苷键的形成具有较高的选择性。Egusa将乳糖通过纤维素酶固定在纤维素膜表面,并利用该乳糖基化膜进行肝细胞的培养[18]。以上所提及的方法仍存在一些弊端,如糖合成复杂且基底与糖基之间的作用力较弱,造成糖基化层稳定性差,或活性糖基供体合成提取困难且稳定性差,构建表面仿生‘糖被’的应用难以推广等。目前仍缺乏一种操作简单、糖基化效果好且易于推广的糖基化新方法。
乙烯基砜化学[19]是指二乙烯基砜在室温条件下其水溶液在各个PH条件下均呈现稳定状态,且对巯基、氨基和羟基[20]具有较强的反应活性,从而可以作为一种出色的生物偶联剂,广泛用于药物输送[21]、生物传感[22]以及亲和层析[23]等领域。
本文所提供了一种基于天然单糖对高分子聚甲基丙烯酸-2-羟乙酯(PHEMA)膜进行化学糖基化的新方法,利用甘露糖作为糖基化底物,以二乙烯基砜为连接配体将其直接接枝到PHEMA聚合物膜表面制备甘露糖糖基化PHEMA膜,对其进行了分析和表征,并利用血凝素蛋白特异性识别糖的性质对糖基化反应条件进行了优化,分别在蛋白和细胞水平对制备的甘露糖糖基化膜进行了生物学评价。
1 实 验
1.1 试剂与材料
聚甲基丙烯酸-2-羟乙酯(PHEMA), SIGMA公司产品,Mw=300 000;二乙烯基砜(DVS),北京中科拓展化学技术有限公司产品,纯度≥98%;D-(+)-甘露糖,TCI公司产品,纯度≥98.0%;PierceTMHoechst 33342 Fluorescent Stain,Thermo Fisher公司产品;LIVE/DEAD©Viability/Cytotoxity Kit(Invitrogen L3224,含Calcein AM和EthD-1),Life Techonologies公司产品。
1.2 实验过程
1.2.1 甘露糖糖基化聚甲基丙烯酸-2-羟乙酯膜(PHEMA膜)的制备与表征
如图1所示,将50 mg PHEMA溶于1 mL无水乙醇中均匀涂覆在硅片表面,室温干燥制备PHEMA薄膜。将PHEMA薄膜浸没于10%(体积分数)DVS(pH值=11,含 10% 丙酮)溶液中室温活化2 h,蒸馏水冲洗2次。将DVS活化的PHEMA薄膜置于20%(m/v)甘露糖溶液(pH值=10)中室温反应12 h,蒸馏水冲洗2次,室温干燥制备甘露糖糖基化PHEMA膜。制备的糖基化膜用傅里叶变换红外光谱仪(Nicolet 6700 Flex,美国Thermo Fisher Scientific公司)进行表征。

图1 甘露糖糖基化聚甲基丙烯酸-2-羟乙酯膜(PHEMA膜)的制备流程
1.2.2 甘露糖糖基化PHEMA膜制备条件优化
在96孔板中分别选择不同pH值条件DVS活化液-甘露糖糖基化溶液对PHEMA膜糖基化,制备甘露糖糖基化PHEMA膜,制备流程同1.2.1,并并加入巯基-聚乙二醇溶液(1 mmol/L,pH值=7.5)封闭残留的乙烯基砜基团。分别在PHEMA膜和甘露糖糖基化PHEMA膜的孔板内加入植物血凝素蛋白-辣根过氧化物酶偶联物,本实验采用牛血清白蛋白(BSA)和伴刀豆球蛋白A(Concanavalin A,Con A,能够特异性识别甘露糖基团)。37 ℃孵育2 h后采用QuantaBluTMFlurogenic Peroxidase Substrate试剂盒测定孔板上蛋白吸附情况。
1.2.3 甘露糖糖基化PHEMA膜的细胞粘附和材料毒性实验
分别在96孔板中制备PHEMA膜、DVS活化PHEMA膜和甘露糖糖基化PHEMA膜,制备流程同1.2.1,并用巯基-聚乙二醇溶液(1 mmol/L,pH值=7.5)封闭甘露糖基化膜中残留的乙烯基砜基团。分别以每孔20 000的细胞密度接种巨噬细胞(RAW 264.7,细胞膜具有甘露糖受体,能够特异性识别甘露糖基团)。接种细胞的孔板在37 ℃,5% CO2条件下无血清培养4 h后去除培养液并用缓冲液冲洗,向孔板内加入100 μL Hoechst 33342(1 μg/mL)和Invitrogen L3224(2 μmol/L)混合液,37 ℃孵育20 min后弃去染色液并用缓冲液冲洗后用倒置荧光显微镜分别在461,515和590 nm波长下观测细胞粘附情况。
2 结果与讨论
2.1 红外光谱分析
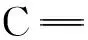

图2 PHEMA膜、DVS活化PHEMA膜和甘露糖糖基化PHEMA膜的红外谱图
2.2 甘露糖糖基化PHEMA膜制备条件优化
糖作为一类多羟基化合物,其具有的极强的亲水性可以用来抑制蛋白质等在膜表面的非特异性吸附[26]。除此之外,糖的另一重要生物功能是能够特异性识别蛋白质,可以根据糖基类型识别目标蛋白。凝集素就是糖能够识别的一类蛋白,且对糖基有高度专一的结合性[27],如甘露糖能够特异性识别伴刀豆球蛋白A。
图3比较了不同pH值条件下活化-糖基化处理得到的甘露糖糖基化PHEMA膜对蛋白的特异和非特异性吸附情况。由图可知,与PHEMA膜相比,甘露糖糖基化PHEMA膜对BSA蛋白的非特异性吸附(图3(a))和对ConA的特异性吸附(图3(b))量均有增多, DVS活化PH-糖基化pH值在11-11条件下非特异性吸附量最低;在11-11、12-10条件下特异性吸附量最高。为了便于比较,将相同条件下得到的特异性吸附与非特异性吸附量做比(图3(c)),在11-11的pH值条件下糖基化的特异性吸附相对较高的同时非特异性吸附相对较低。该结果说明制备的甘露糖糖基化PHEMA膜能够特异性识别和吸附ConA,且非特异性蛋白吸附量小,即具有一定的抗垢性能,证明经过该法制备的糖基化高分子膜在蛋白水平具有糖生物活性。
2.3 甘露糖糖基化PHEMA膜细胞粘附和材料毒性实验
细胞膜表面存在大量的糖蛋白受体,能够识别和调节细胞间相互作用[6],因此糖基化膜可以用来模拟细胞膜,研究细胞识别以及糖基与细胞间的作用机理,如小鼠单核巨噬细胞RAW264.7表面有甘露糖的特异性识别受体[28],能够选择性识别并结合甘露糖,可以提高RAW264.7在膜表面的粘附能力。
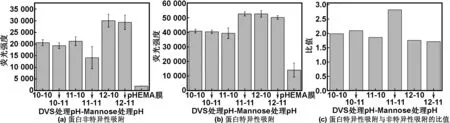
图3 不同PH条件活化-糖基化处理得到的甘露糖糖基化PHEMA膜对蛋白的特异和非特异性吸附情况
由图4可知,RAW264.7细胞在PHEMA膜上几乎没有粘附(图4(a)-(c)),该结果说明富含羟基的PHEMA膜有一定的抗细胞粘附的特性。细胞在经过DVS活化后的PHEMA膜上有大量粘附(图4(d))但存在大量的死亡细胞(图4(f)),这表明细胞可以在DVS活化PHEMA膜上粘附,但对细胞的毒性较高,可以在短期内杀死细胞,不适于细胞体外培养。细胞在甘露糖糖基化PHEMA膜上有大量粘附(图4(g)),并且活细胞数目(图4(h))明显高于死细胞数目(图4(i)),表明甘露糖糖基化PHEMA膜可以用于巨噬细胞的初期粘附,且细胞毒性低,短期内不会引起细胞的死亡。以上实验结果证明甘露糖糖基化PHEMA膜能够引起巨噬细胞细胞的特异性粘附,并具有较低的细胞毒性,在细胞水平具有糖生物活性。
糖基化膜作为一类仿生材料,在细胞识别、体外培养以及人工器官和组织的构建[29]等方面具有重要研究意义。但由于糖基合成提取复杂以及糖基-基底膜间化学稳定差等原因导致糖基化膜的研究难以推广。本文利用二乙烯基砜与羟基反应的特点,建立一种简单可行的高分子膜表面糖基功能改性的新方法,可以改善高分子膜抗污染能力并可以作为细胞的体外培养基质,丰富高分子膜的生物功能。

图4 RAW 264.7细胞在PHEMA膜、DVS活化PHEMA膜和甘露糖糖基化PHEMA膜上的粘附
3 结 论
建立了一种新颖的高分子膜表面糖基化的新方法,利用无需修饰的甘露糖作为糖基化底物,以二乙烯基砜为偶联剂将糖接枝到聚甲基丙烯酸-2-羟乙酯(PHEMA)聚合物膜表面,成功制备得到了甘露糖糖基化PHEMA膜。该法所制备的糖基化高分子膜在蛋白质水平对伴刀豆蛋白A具有良好的的特异性识别和吸附能力并具有一定的抗垢性能,同时还能够引起巨噬细胞(RAW264.7)的特异性粘附且具有较低细胞毒性,赋予了PHEMA膜抗非特异性吸附和特异性识别的仿生功能,使其可以作为体外载体进行细胞的选择性培养,为人工组织和器官的构建提供了基础。
[1] Rademacher T W, Parekh R B, Dwek R A. Glycobiology[J]. Annu Rev Biochem, 1988, 57: 785-838.
[2] Lee Y C, Lee R T. Carbohydrate-protein interactions-basis of glycobiology[J]. Accounts of Chemical Research, 1995, 28(8): 321-327.
[3] Crocker P R, Feizi T. Carbohydrate recognition systems: functional triads in cell-cell interactions[J]. Current Opinion in Structural Biology, 1996, 6(5): 679-691.
[4] Holland N B, Qiu Y, Ruegsegger M, et al. Biomimetic engineering of non-adhesive glycocalyx-like surfaces using oligosaccharide surfactant polymers[J]. Nature, 1998, 392(6678): 799-801.
[5] Zeng X, Andrade C S, Oliveira M L, et al. Carbohydrate-protein interactions and their biosensing applications[J]. Analytical and Bioanalytical Chemistry, 2012, 402(10): 3161-3176.
[6] Lis H, Sharon Nathan. Lectins: carbohydrate-specific proteins that mediate cellular recognition[J]. Chemical Reviews, 1998, 98(2): 637-674.
[7] Christiansen M N, Chik J, Lee L, et al. Cell surface protein glycosylation in cancer[J]. Proteomics, 2014, 14(4-5): 525-546.
[8] Wang C, Wu J A, Xu Z K. High-density glycosylation of polymer membrane surfaces by click chemistry for carbohydrate-protein recognition[J]. Macromolecular Rapid Communications, 2010, 31(12): 1078-1082.
[9] Revell D J, Knight J R, Blyth D J, et al. Self-assembled carbohydrate monolayers: formation and surface selective molecular recognition[J]. Langmuir, 1998, 14(16): 4517-4524.
[10] Spiro R G. Protein glycosylation: nature, distribution, enzymatic formation, and disease implications of glycopeptide bonds[J]. Glycobiology, 2002, 12(4): 43-56.
[11] Ulbricht M. Advanced functional polymer membranes[J]. Polymer, 2006, 47(7): 2217-2262.
[12] Dai Zhengwei, Wan Lingshu, Xu Zhikang. Glycosylation of polymeric separate membrane[J]. Science China Series B: Chemistry[J]. 2008, 38(8): 669-673.
[13] Ladmiral V, Melia E, Haddleton D M. Synthetic glycopolymers: an overview[J]. European Polymer Journal, 2004, 40(3): 431-449.
[14] Bertozzi C R, Kiessling L L. Chemical glycobiology[J]. Science, 2001, 291(5512): 2357-2364.
[15] Yang Q, Hu M X, Dai Z W, et al. Fabrication of glycosylated surface on polymer membrane by UV-induced graft polymerization for lectin recognition[J]. Langmuir, 2006, 22(22): 9345-9349.
[16] Knaus S, Nennadal A, Froschauer B. Surface and bulk modification of polyolefins by functional aryl nitrenes as highly reactive intermediates[J]. Macromolecular Symposia, 2001, 176: 223-232.
[17] Fang Y, Huang X J, Chen P C, et al. Polymer materials for enzyme immobilization and their application in bioreactors[J]. Bmb Reports, 2011, 44(2): 87-95.
[18] Egusa S, Yokota S, Tanaka K, et al. Surface modification of a solid-state cellulose matrix with lactose by a surfactant-enveloped enzyme in a nonaqueous medium[J]. Journal of Materials Chemistry, 2009, 19(13): 1836-1842.
[19] Wang H, Cheng F, Li M, et al. Reactivity and kinetics of vinyl sulfone-functionalized self-assembled monolayers for bioactive ligand immobilization[J]. Langmuir, 2015, 31(11): 3413-3421.
[20] Yu Y, Chau Y. One-step “click” method for generating vinyl sulfone groups on hydroxyl-containing water-soluble polymers[J]. Biomacromolecules, 2012, 13(3): 937-942.
[21] Park Y, Kwok K Y, Boukarim C, et al. Synthesis of sulfhydryl cross-linking poly(ethylene glycol)-peptides and glycopeptides as carriers for gene delivery[J]. Bioconjug Chem, 2002, 13(2): 232-239.
[22] Shang J, Cheng F, Dubey M, et al. An organophosphonate strategy for functionalizing silicon photonic biosensors[J]. Langmuir, 2012, 28(6): 3338-3344.
[23] Porath J, L S T, Janson J C. Agar derivatives for chromatography, electrophoresis and gel-bound enzymes: Ⅲ. Rigid agarose gels cross-linked with divinyl sulphone (DVS)[J]. Journal of Chromatography A, 1975, 103(1): 49-62.
[24] Bakhshpour M, Bereli N,enel S. Preparation and characterization of thiophilic cryogels with 2-mercapto ethanol as the ligand for IgG purification[J]. Colloids and Surfaces B: Biointerfaces, 2014, 113(0): 261-268.
[25] Barker S A, Bourne E J, Stacey M, et al. Infra-red spectra of carbohydrates. Ⅰ. some derivatives of D-glucopyranose[J]. Journal of the Chemical Society, 1954, (Jan): 171-176.
[26] Kou R Q, Xu Z K, Deng H T, et al. Surface modification of microporous polypropylene membranes by plasma-induced graft polymerization of alpha-allyl glucoside[J]. Langmuir, 2003, 19(17): 6869-6875.
[27] Hileman R E, Fromm J R, Weiler J M, et al. Glycosaminoglycan-protein interactions: definition of consensus sites in glycosaminoglycan binding proteins[J]. Bioessays, 1998, 20(2): 156-167.
[28] Stahl P, Schlesinger P H, Sigardson E, et al. Receptor-mediated pinocytosis of mannose glycoconjugates by macrophages-characterization and evidence for receptor recycling[J]. Cell, 1980, 19(1): 207-215.
[29] Hench L L, Polak J M. Third-generation biomedical materials[J]. Science, 2002, 295(5557): 1014-1017.
Preparation and bioactivity study of glycosylated polymer film based on vinyl sulfone chemistry
SUN Shiyou,LI Mingyang, WANG Hanqi, CHENG Fang
(State Key Laboratory of Fine Chemicals, School of Pharmaceutical Science and Technology,Dalian University of Technology, Dalian 116024, China)
Glycosylation of polymer film is essential for mimicking the dense “glycocalyx” in biomembrane and development of bio-functional materials. In this study, a convenient method was developed to conjugate glycose onto poly(2-hydroxyethyl methacrylate)(pHEMA) film using divinyl sulfone(DVS) as the coupling agent. A mannose glycosylated pHEMA film was prepared and characterized by Fourier transform infrared spectroscopy (FT-IR). The reaction conditions were optimized using specific protein adsorption studies, and the bioactivity of the glycosylated film was assessed at protein and cell level. The protein level results show that the mannose glycosylated pHEMA film has good anti-fouling capabilities and can specifically recognize Concanavalin A (ConA). The cell adhesion experiment using macrophages (RAW 264.7) suggest that the glycosylated film is highly bioactive and low cytotoxic. The glycosylation of polymer film using DVS provides a neat approach for the construction of biomimetic membrane and researches on glycometabolism process at cell level.
poly (2-hydroxyethyl methacrylate);vinyl sulfone chemistry; glycosylated film;protein adsorption;cell response
1001-9731(2016)10-10019-05
国家自然科学基金资助项目(21104008);中央高校基本科研业务费资助项目(DUT13LAB07)
2015-09-15
2015-12-20 通讯作者:程 昉,E-mail: ffcheng@dlut.edu.cn
孙世猷 (1989-),男,辽宁阜新人,在读硕士,师承程昉副教授,从事生物材料研究。
TB34
A
10.3969/j.issn.1001-9731.2016.10.004
