锂离子电池正极材料磷酸钒锂的改性研究*
2016-11-12李月姣曹美玲
李月姣, 曹美玲, 吴 锋
(1. 北京理工大学 材料学院, 环境科学工程北京重点实验室, 北京 100081;2. 国家高技术绿色材料发展中心,北京 100081)
锂离子电池正极材料磷酸钒锂的改性研究*
李月姣1,2, 曹美玲1, 吴 锋1,2
(1. 北京理工大学 材料学院, 环境科学工程北京重点实验室, 北京 100081;2. 国家高技术绿色材料发展中心,北京 100081)
近年来,作为锂离子电池正极的磷酸盐材料因为其结构稳定,循环性能优良,受到研究者的普遍关注。磷酸钒锂理论容量为197 mAh/g,具有较高的能量密度和充放电电压平台,热稳定性好,相比其它正极材料具有明显的优势。但是磷酸钒锂电子电导率较低,且不适合大电流充放电的缺点限制了其实际应用,必须对其进行改性研究。目前改性方法主要包括表面包覆导电材料,金属掺杂,控制形貌特征等。结合磷酸钒锂的结构,综述了各种改性方法的工艺及优缺点,结合本研究团队关于磷酸钒锂改性的研究成果探讨了目前存在的问题及今后的研究趋势。
锂离子电池;正极材料;磷酸钒锂;改性
0 引 言
锂离子电池因为能量高,循环寿命长,工作电压高,环境友好等优点被认为是二十一世纪理想的储能装置。正极材料在锂离子电池生产成本和性能的发挥中起着重要的作用。近年来,聚阴离子型磷酸盐材料被认为是传统锂离子电池氧化物材料的理想替代品,其中LiMPO4(M = Fe,Co,Ni,Mn)[1-5]和Li3V2-(PO4)3[6-7]由于工作电压高、可逆性好、离子流动性强和热稳定性好受到研究者的普遍关注。相比同为聚阴离子正极材料的LiFePO4,单斜结构的Li3V2(PO4)3表现出明显的优势,其拥有更高的放电电压平台和能量密度,特别是在高倍率充放电性能和高低温性能方面,体现出潜在的应用前景。然而,纯相的Li3V2-(PO4)3由于电子电导率较低(约为10-8cm/s[8-9]),导致其电化学性能并不理想,限制了其实际应用,必须对其进行改性研究。目前Li3V2(PO4)3主要的改性方法有表面包覆导电材料[10]、金属掺杂[11]和控制形貌特征等。本文结合国内外的研究热点以及磷酸钒锂的结构,结合本研究团队的研究成果,着重介绍了各种改性方法并加以对比分析,探讨了目前存在的问题及今后的研究趋势。
1 Li3V2(PO4)3结构及缺点
LVP属于NASICON结构化合物,具有单斜和菱方两种晶型,因为菱方晶型结构不稳定,库仑效率低没有实际的应用价值,因此,目前致力于对单斜晶型的研究中。在LVP的单斜晶系结构中,3个Li+均能可逆的嵌入、嵌出。聚阴离子PO43-具有四面体结构,与八面体VO6通过共用顶点的氧原子形成三维网状骨架结构,并且能形成更高配位的由其它金属离子占据的空隙,此时每个VO6与6个PO4单元相连,每个PO4周围有4个VO6,确保了结构的稳定性。但是由于PO4将VO6八面体分隔开来,使得VO6之间不能形成连续的网络,扩大了原子间距,导致电子传输受阻,电子迁移率较低[12]。
其次,LVP在3.0~4.8 V区间的倍率性能和循环稳定性较差。如图1所示,在循环伏安曲线出现3.60,3.68,4.08和4.55 V 4个充电平台以及3.57,3.65和4.03 V 3个放电平台。
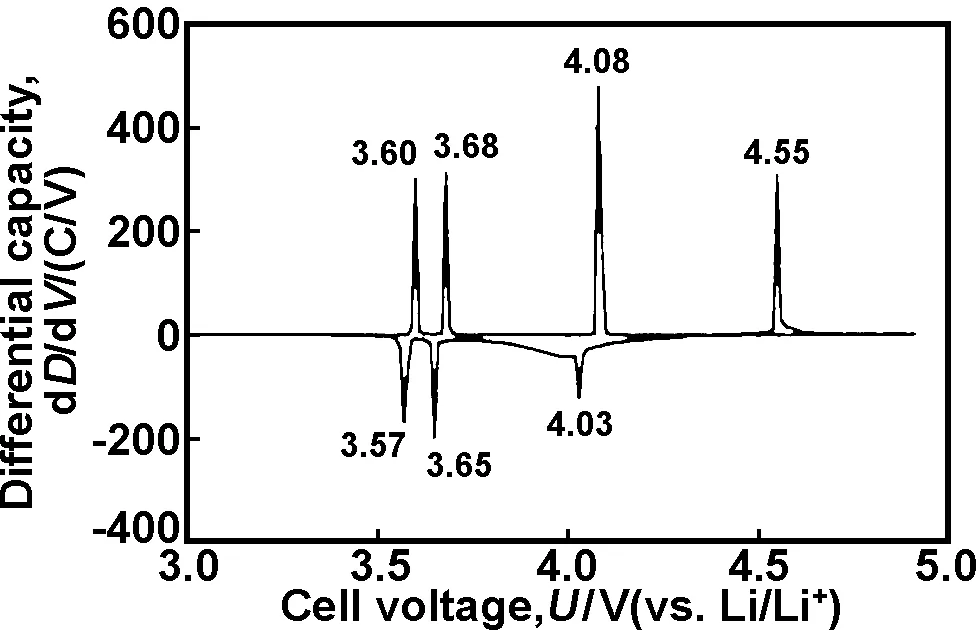
图1 3.0~5.0 V电压范围内LVP的循环伏安图[13]
前3个充放电平台对应着3.0~4.3 V的充放电性能,此时能可逆脱嵌两个锂离子,理论容量为133 mAh/g。而当电压达到4.55 V时,没有对应的还原峰,可逆性较差,小电流循环性能和高倍率性能也都不理想,没有体现理论容量197 mAh/g的优点。因此,在LVP材料的改性研究中,提高其电子导电性,改善其循环性能和倍率性能是目前急于解决的关键问题,也是研究的热点。
2 LVP的改性研究
针对LVP存在的问题及缺点,常采用表面包覆导电材料,金属掺杂和形貌特征控制3种手段进行改性。包覆是指在材料表面包覆一层导电材料,通过提高电子导电性来改善电化学性能。金属掺杂是指通过掺入杂质离子,改变晶体的体相特征,从而在实质上提高电子导电率和锂离子迁移速率。形貌特征控制是指将材料制成特定形状,使得颗粒体积减小,比表面积增大,从而减小锂离子扩散路径,更有利于电极反应的发生。
2.1 表面包覆导电材料
2.1.1 碳包覆改性研究
碳包覆是将材料颗粒表面包覆一层碳材料,不仅可以提高粒子间的导电性,还可以在产物结晶过程中作为成核剂来减小产物的颗粒大小,从而缩短锂离子的扩散通道,提高材料的电化学性能。目前,该改性方法主要针对碳源种类、合成工艺和碳包覆量等方面进行研究。碳源具有无机碳和有机碳两种形式,无机碳主要采用直接添加乙炔黑、石墨等方法,合成工艺简单,效果明显;有机碳主要包括柠檬酸[14]、聚乙二醇[15]、聚乙烯醇[16]、抗坏血酸[17]、甘氨酸[18]、硬脂酸[19]、聚乙烯酰胺[20]、β-环糊精或聚苯乙烯[21]等单种或多种复合碳源。有机碳前驱体可以在高温气氛分解前均匀地包覆在Li3V2(PO4)3表面,在高温碳化过程中具有更好的包覆均匀性和廉价的生产成本。
H.Liu等[22]采用溶胶-凝胶法,将LVP前驱体置于石墨烯氧化物上,经搅拌烧结,制成粒径大小为280 nm的LVP/graphene复合材料,其在3.0~4.3 V电压区间0.1 C倍率下首次放电容量为128 mAh/g,20 C高倍率条件下首次放电容量109 mAh/g,且经100次循环后容量保持在108 mAh/g,容量衰减较少,展现了优异的高倍率性能和循环稳定性。
W.Mao等[23]首次以壳聚糖(25%,质量分数)作为还原剂和碳源,采用新型碳热还原法制成粒径为50 nm的复合材料,其在3.0~4.3 V电压区间20 C充放电时,最大稳定放电容量为106.91 mAh/g,经过331次循环后,容量保持率为91.01%,展现了很好循环稳定性。Q.Chen等[24]采用静电纺丝法,以柠檬酸为碳源制成纳米纤维形碳包覆的复合材料,其在3.0~4.8 V电压区间20 C时,首次放电容量为132 mAh/g,经300次循环后容量保持率高达85.6%,表现了优异的高倍率性能。
本课题组首次以EDTA为螯合剂和碳源,采用流变相法制成LVP/C复合材料,该材料在3.0~4.3 V电压区间0.1 C倍率下,首次放电容量为129.1 mAh/g(图2),首次放电库仑效率为97%,与未包覆材料相比(88.7%),库仑效率有很大提高;2 C高倍率下,首次放电容量为116.5 mAh/g,50次循环后容量保持率为96.5%和93.1%(图3)[25]。
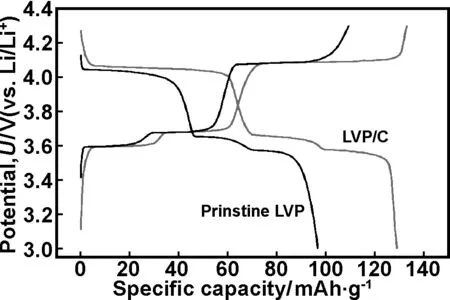
图2 3.0~4.3 V、0.1 C时,磷酸钒锂正极材料的首次充放电曲线[25]
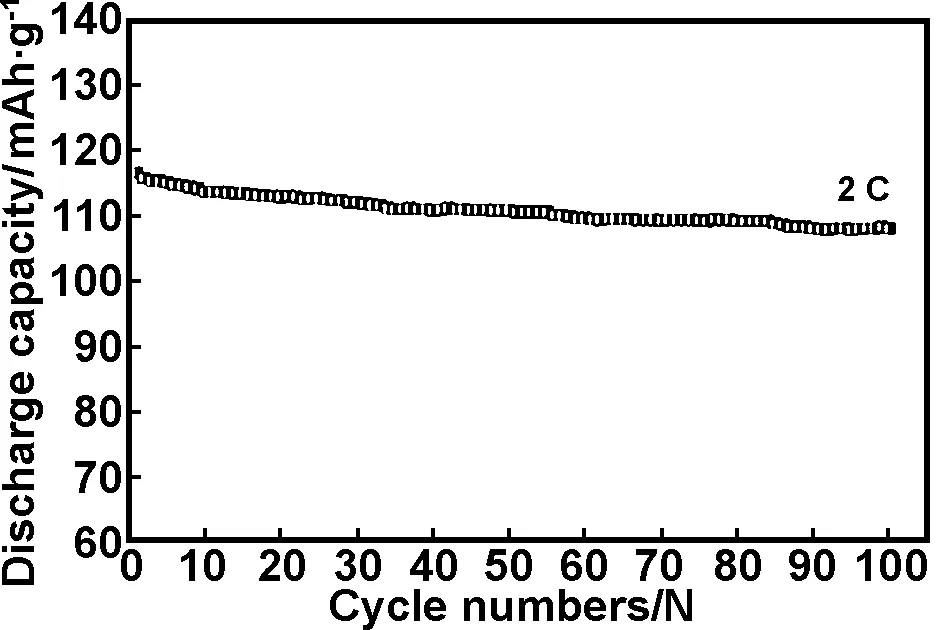
图3 3.0~4.3 V、2 C时, 磷酸钒锂正极材料的循环性能曲线[25]
碳包覆改性方法操作简单,应用广泛,对LVP电化学性能的提高效果显而易见。但是,实验研究发现,碳往往不能完全包覆在每个LVP颗粒的表面,另外,碳含量过多会减少LVP材料的能量密度反而抑制电化学性能的发挥,因此碳的含量应适量控制。
2.1.2 金属单质包覆改性研究
金属粒子的添加能起到抑制粒子长大和有效改善材料的表面电子电导率的作用,分散在LVP中的金属粒子充当导电桥,增强粒子之间的导电能力,也能减小LVP颗粒的大小,从而提高其可逆容量。当前在该领域的主要研究有金属单质包覆[26]及金属与碳复合包覆[27]。
T.Jiang等[26]利用溶胶-凝胶法,将1.8%(质量分数) Cu粉末加入到前驱体溶液中,制成复合材料,与LVP相比,锂离子扩散系数从1.3×10-9cm2/s增加到2.8×10-8cm2/s,放电容量从132 mAh/g提高到160 mAh/g(在3.0~4.8 V区间)。这是由于Cu包覆层在电化学反应过程中会形成内部电场,使离子扩散加速,表现更好的电化学性能。而且,L.Zhang等[27]利用碳热还原法和化学镀反应,制备出粒径范围为0.5~1 μm的复合材料,单薄的碳层和单质银均匀的分布在晶体周围将晶体结构紧密联系,起到桥梁作用,增加了电子导电性。在3.0~4.8 V区间,1 C循环50次后放电容量为140.5 mAh/g,为首次充放电容量的97.5%,5 C倍率条件下仍高达120.5 mAh/g,首次库伦效率为99%。
金属单质包覆或金属与碳复合包覆可有效降低材料的电荷转移电阻,增强电子导电性。但由于金属单质密度较大,不易形成均匀的包覆层,对合成工艺和实验条件要求较为严格。因此,探求更适合的金属种类,确定包覆量,优化合成工艺应成为该研究方向的关键问题。
2.1.3 金属氧化物包覆改性研究
金属氧化物包覆方法常被用来提高材料的电化学性能,一方面氧化物层可抑制在锂离子脱嵌过程中c轴膨胀转变所产生的应力,形成零应力正极材料,提高材料的结构稳定性;另一方面,氧化物层阻止了电极材料与电解液的过多接触,减少了电解液对材料的腐蚀。目前,单独采用金属氧化物包覆LVP改性的研究较少,而多以金属氧化物/碳对LVP材料复合包覆。
M.Zhao等[28]利用溶胶-凝胶法,合成出MgO包覆的复合材料,有2.0~2.5 nm厚的MgO包覆在LVP/C表面,包覆的MgO层能充当保护层,防止电极活性物质直接接触电解液,从而提高材料结构稳定性。MgO包覆量为4.5%(摩尔分数)时,3.0~4.3 V电压区间,0.1 C 100次循环后容量保持在137.5 mAh/g,容量保持率为70.73%,明显高于原始状态的LVP/C(43.7%)。
包覆改性是目前研究较多的改性方法,但是该方法只能提高材料的表面电子导电性,对体相特征几乎没有影响,不能从本质上解决LVP的缺点。因此,通过掺入金属离子取代原材料中离子所在的晶格位置,从而在实质上提高电子导电率和锂离子迁移速率的方法更具意义。
2.2 金属掺杂
掺杂能改变晶体的体相特征,通过占据原子位置改变晶格参数提高材料的导电率。根据掺杂离子占据LVP晶格位置的不同,可以分为锂位掺杂、钒位掺杂和磷酸根位掺杂等。锂位掺杂主要有Na+[29]、K+[30]等,钒位掺杂有Co2+[31]、Cr3+[32]、Fe2+[33]、Al3+[34]、Mg2+[35]、Sn4+[36]和Ni2+[37]等,磷酸根位掺杂有F-[38]和Cl-[39]等。根据掺杂的数量,可分为单离子掺杂和双离子掺杂。根据掺杂元素的种类,可分为金属掺杂和非金属掺杂。目前以金属元素锂位和钒位掺杂研究较多。
H.Liu等[40]以SnO2为Sn源,合成了钒位掺杂的Li3V2-xSnx(PO4)3/C(x=0, 0.01, 0.02, 0.05, 0.1),适量Sn4+的掺杂在很大程度上提高了材料结构稳定性和导电性,样品Li3V1.95Sn0.05(PO4)3/C在2.5~4.5 V电压区间内,0.5 C首次放电容量为136 mAh/g,循环80次后容量保持率为91.2%,而未掺杂的仅为88.8%。
J.Dang等[41]以Ce(NO3)3为Ce源,制备出钒位掺杂的Li3V2-xCex(PO4)3/C (x=0, 0.01, 0.02, 0.03, 0.05, 0.10)复合材料。适量的Ce3+能有效改善材料的电化学性能,尤以样品Li3V1.98Ce0.02(PO4)3/C最为突出。3.0~4.8 V电压区间,0.2 C充放电倍率下,样品的首次放电容量为180.7 mAh/g,库伦效率为94%,100周循环后,放电容量为171.6 mAh/g。10 C高倍率充放电条件下,掺杂材料容量保持为120 mAh/g,比未掺杂材料容量高出60%。
Q.Chen等[42]制备了锂位掺杂的Li3-xNaxV2-(PO4)3/C,当x=0.05时,材料的循环性能最优:3.0~4.8 V电压区间,0.2 C条件下,首次放电容量187 mAh/g,30次循环后容量保持率为95.3%,未掺杂材料为90.4%;1 C条件下30次循环后,放电容量由首次的173.1 mAh/g降为158.2 mAh/g,容量保持率为91%,明显高于未掺杂材料的87%。
本课题组采用流变相法合成出Nd3+掺杂的磷酸钒锂改性材料Li3NdxV2-x(PO4)3,通过改变配比探索出最佳掺杂量。当x=0.08时,3.0~4.3 V区间0.2 C条件下,材料的首次放电比容量为115.8 mAh/g,库伦效率高达93.8%。当电流提高到2 C循环50周后,材料容量保持率为80.86%,容量最高,阻抗最小,表现出极优的循环性能和倍率性能,而未掺杂材料仅为41.16%[43]。
金属离子掺杂通过改变体相特征,在本质上提高了材料的电子导电性,扩大了Li+扩散系数。但是,对于掺杂元素种类的选择标准以及相应的反应机理目前尚未有统一的定论,需要进一步的探究。
2.3 控制形貌特征
将材料制成具有特殊形貌特征,如带状[44]、多孔状[45]或球状[46]等形貌,能在一定程度上促进锂离子的扩散,增强材料的高倍率性能。此方法也常与碳包覆相结合,利用碳包覆能增大材料电子导电性、抑制晶体增长的优点,弥补性能上的不足。
S.Wang等[47]采用新型胶体晶体模板法,通过控制PMMA的添加量,制备出孔径分别为210,120和65 nm的材料,其中孔径为210 nm的LVP性能最优,3.0~4.8 V电压区间,0.1 C放电容量为189.4 mAh/g,0.5,1和5 C倍率下,首次放电容量分别为170.5,166和149.5 mAh/g,100周循环后,容量保持率分别为77.3%,71.2%和77.1%。
控制或改变LVP材料的形貌特征,可促进锂离子在电极/电解质中的快速扩散,从而提高电极的电化学性能。但是该改性方法对合成工艺要求较为严格,条件不易控制,如何有效控制晶体生长是需解决的关键技术问题。
3 结 语
磷酸钒锂材料具有较高的能量密度和充放电电压平台,循环寿命长,热稳定性好,极有可能成为新一代的锂离子电池正极材料,但是较低的电子导电率和锂离子扩散系数限制了其实际应用。表面包覆导电材料,金属离子掺杂以及控制形貌特征等方法为Li3V2-(PO4)3改性研究的主要方向。表面包覆能提高材料的表面电子导电性、抑制LVP晶体的生长、阻止电极材料和电解液的过多接触从而提高材料的结构稳定性和循环性能,但是合成过程中不易形成均匀的包覆层,对体相特征也几乎没有影响。金属离子掺杂能从体相内部提高材料的电子导电性,但对掺杂元素的选择标准以及改善机理有待深度探究。控制材料的形貌特征能有效提高材料的电化学性能,但对合成工艺要求较为严格,如何有效控制晶体生长是需解决的关键技术问题。未来的研究中,一方面要优化合成工艺,利用包覆、掺杂或控制形貌等改性手段从本质上提高材料的循环和倍率性能;另一方面要针对材料改性机理进行研究,利用理论研究成果指导实验,从而推动磷酸钒锂正极材料的实际应用。
[1] Ouyang X, Lei M, Shi S, et al. First-principles studies on surface electronic structure and stability of LiFePO4[J]. J Alloys Compd, 2009, 476(1-2): 462-465.
[2] Shenouda A Y, Liu H K. Studies on electrochemical behaviour of zinc-doped LiFePO4for lithium battery positive electrode[J]. J Alloys Compd, 2009, 477(1-2): 498-503.
[3] Zhou F, Cococcioni M, Kang K, et al. The Li intercalation potential of LiMPO4and LiMSiO4olivines with M=Fe, Mn, Co, Ni[J]. Electrochem Commun, 2004, 6(11): 1144-1148.
[4] Chen J, Wang S, Whittingham M S. Hydrothermal synthesis of cathode materials[J]. J Power Sources, 2007, 174(2): 442-448.
[5] Li H H, Jin J, Wei J P, et al. Fast synthesis of core-shell LiCoPO4/C nanocomposite via microwave heating and its electrochemical Li intercalation performances[J]. Electrochem Commun, 2009, 11(1): 95-98.
[6] Ren M M, Zhou Z, Gao X P, et al. Core-shell Li3V2(PO4)3@C composites as cathode materials for lithium-ion batteries[J]. J Phys Chem C, 2008, 112(14): 5689-5693.
[7] Wang D, Buqa H, Crouzet M, et al. High-performance, nano-structured LiMnPO4synthesized via a polyol method[J]. J Power Sources, 2009, 189(1): 624-628.
[8] Yin S C, Strobel P S, Grondey H, et al. Li2.5V2(PO4)3: a room-temperature analogue to the fast-ion conducting high-temperature γ-phase of Li3V2(PO4)3[J]. Chem Mat, 2004, 16(8): 1456-1465.
[9] Rui X H, Yesibolati N, Li S R, et al. Determination of the chemical diffusion coefficient of Li+in intercalation-type Li3V2(PO4)3anode material[J]. Solid State Ionics, 2011, 187(1): 58-63.
[10] Guo Xiaodong, Zhong Benhou, Song Yang, et al. Effects of carbon content on lithium vanadium phosphate cathode materials[J]. Rare Metal Mat Eng, 2011,(01): 130-133.
郭孝东,钟本和,宋 杨,等. 碳含量对磷酸钒锂正极材料的影响[J]. 稀有金属材料与工程, 2011,(01): 130-133.
[11] Hu Depeng, Lu Daorong. Effects of doping Co2+on the electrochemical performance of Li3V2(PO4)3[J]. Battery Bimonthly, 2012,(03): 138-141.
胡德鹏,鲁道荣. Co(2+)掺杂对磷酸钒锂电化学性能的影响[J]. 电池, 2012,(03): 138-141.
[12] Wang J, Liu J, Yang G, et al. Electrochemical performance of Li3V2(PO4)3/C cathode material using a novel carbon source[J]. Electrochim Acta, 2009, 54(26): 6451-6454.
[13] Fu P, Zhao Y, An X, et al. Structure and electrochemical properties of nanocarbon-coated Li3V2(PO4)3prepared by sol-gel method[J]. Electrochim Acta, 2007, 52(16): 5281-5285.
[14] Yan J, Yuan W, Xie H, et al. Novel self-catalyzed sol-gel synthesis of high-rate cathode Li3V2(PO4)3/C for lithium ion batteries[J]. Mater Lett, 2012, 71: 1-3.
[15] Wang J, Liu J, Yang G, et al. Electrochemical performance of Li3V2(PO4)3/C cathode material using a novel carbon source[J]. Electrochim Acta, 2009, 54(26): 6451-6454.
[16] Wang J, Zhang X, Liu J, et al. Long-term cyclability and high-rate capability of Li3V2(PO4)3/C cathode material using PVA as carbon source[J]. Electrochim Acta, 2010, 55(22): 6879-6884.
[17] Huang J S, Yang L, Liu K Y. One-pot syntheses of Li3V2(PO4)3/C cathode material for lithium ion batteries via ascorbic acid reduction approach[J]. Mater Chem Phys, 2011, 128(3): 470-474.
[18] Qiao Y Q, Wang X L, Mai Y J, et al. Synthesis of plate-like Li3V2(PO4)3/C as a cathode material for Li-ion batteries[J]. J Power Sources, 2011, 196(20): 8706-8709.
[19] Qiao Y Q, Wang X L, Xiang J Y, et al. Electrochemical performance of Li3V2(PO4)3/C cathode materials using stearic acid as a carbon source[J]. Electrochim Acta, 2011, 56(5): 2269-2275.
[20] Mao W, Yan J, Xie H, et al. An in-situ copolymerization synthesis of Li3V2(PO4)3/C nanocomposite with ultrahigh discharge capacity[J]. J Power Sources, 2013, 237: 167-171.
[21] Qiao Y Q, Wang X L, Zhou Y, et al. Electrochemical performance of carbon-coated Li3V2(PO4)3cathode materials derived from polystyrene-based carbon-thermal reduction synthesis[J]. Electrochim Acta, 2010, 56(1): 510-516.
[22] Mao W, Yan J, Xie H, et al. A novel synthesis of Li3V2(PO4)3/C nanocomposite with excellent high-rate capacity and cyclability[J]. Mater Res Bull, 2012, 47(12): 4527-4530.
[23] Chen Q, Zhang T, Qiao X, et al. Li3V2(PO4)3/C nanofibers composite as a high performance cathode material for lithium-ion battery[J]. J Power Sources, 2013, 234: 197-200.
[24] Liu H, Gao P, Fang J, et al. Li3V2(PO4)3/graphene nanocomposites as cathode material for lithium ion batteries[J]. Chem Commun, 2011, 47(32): 9110-9112.
[25] Li Y, Hong L, Sun J, et al. Electrochemical performance of Li3V2(PO4)3/C prepared with a novel carbon source, EDTA[J]. Electrochim Acta, 2012, 85: 110-115.
[26] Jiang T, Wei Y J, Pan W C, et al. Preparation and electrochemical studies of Li3V2(PO4)3/Cu composite cathode material for lithium ion batteries[J]. J Alloys Compd, 2009, 488(1): L26-L29.
[27] Zhang L, Wang X L, Xiang J Y, et al. Synthesis and electrochemical performances of Li3V2(PO4)3/(Ag+C) composite cathode[J]. J Power Sources, 2010, 195(15): 5057-5061.
[28] Zhai J, Zhao M, Wang D, et al. Effect of MgO nanolayer coated on Li3V2(PO4)3/C cathode material for lithium-ion battery[J]. J Alloys Compd, 2010, 502(2): 401-406.
[29] Wang R, Xiao S, Li X, et al. Structural and electrochemical performance of Na-doped Li3V2(PO4)3/C cathode materials for lithium-ion batteries via rheological phase reaction[J]. J Alloys Compd, 2013, 575: 268-272.
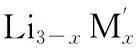
[31] Kuang Q, Zhao Y, An X, et al. Synthesis and electrochemical properties of Co-doped Li3V2(PO4)3cathode materials for lithium-ion batteries[J]. Electrochim Acta, 2010, 55(5): 1575-1581.
[32] Chen Y, Zhao Y, An X, et al. Preparation and electrochemical performance studies on Cr-doped Li3V2(PO4)3as cathode materials for lithium-ion batteries[J]. Electrochim Acta, 2009, 54(24): 5844-5850.
[33] Ren M, Zhou Z, Li Y, et al. Preparation and electrochemical studies of Fe-doped Li3V2(PO4)3cathode materials for lithium-ion batteries[J]. J Power Sources, 2006, 162(2): 1357-1362.
[34] Ai D, Liu K, Lu Z, et al. Aluminothermal synthesis and characterization of Li3V2-xAlx(PO4)3cathode materials for lithium ion batteries[J]. Electrochim Acta, 2011, 56(7): 2823-2827.
[35] Huang J S, Yang L, Liu K Y, et al. Synthesis and characterization of Li3V(2-2x/3)Mgx(PO4)3/C cathode material for lithium-ion batteries[J]. J Power Sources, 2010, 195(15): 5013-5018.
[36] Liu H, Bi S, Wen G, et al. Synthesis and electrochemical performance of Sn-doped Li3V2(PO4)3/C cathode material for lithium ion battery by microwave solid-state technique[J].J Alloys Compd, 2012, 543: 99-104.
[37] Wu W, Liang J, Yan J, et al. Synthesis of Li3NixV2-x(PO4)3/C cathode materials and their electrochemical performance for lithium ion batteries[J]. J Solid State Electr, 2013, 17(7): 2027-2033.
[38] Zhong S, Liu L, Liu J, et al. High-rate characteristic of F-substitution cathode materials for Li-ion batteries[J]. Solid State Commun, 2009, 149(39-40): 1679-1683.
[39] Yan J, Yuan W, Tang Z, et al. Synthesis and electrochemical performance of Li3V2(PO4)3-xClx/C cathode materials for lithium-ion batteries[J]. J Power Sources, 2012, 209: 251-256.
[40] Liu H, Bi S, Wen G, et al. Synthesis and electrochemical performance of Sn-doped Li3V2(PO4)3/C cathode material for lithium ion battery by microwave solid-state technique[J]. J Alloys Compd, 2012, 543: 99-104.
[41] Dang J, Xiang F, et al. Synthesis and electrochemical performance characterization of Ce-doped Li3V2(PO4)3/C as cathode materials for lithium-ion batteries[J]. J Power Sources, 2013, 243: 33-39.
[42] Chen Q, Qiao X, Wang Y, et al. Electrochemical performance of Li3-xNaxV2(PO4)3/C composite cathode materials for lithium ion batteries[J]. J Power Sources, 2012, 201: 267-273.
[43] Li Y, Zhou C, Chen S, et al. Nd3+-doped Li3V2(PO4)3cathode material with high rate capability for Li-ion batteries[J]. Chinese Chem Lett, 2015, 26(8): 1004-1007.
[44] Pan A, Choi D, Zhang J, et al. High-rate cathodes based on Li3V2(PO4)3nanobelts prepared via surfactant-assisted fabrication[J]. J Power Sources, 2011, 196(7): 3646-3649.
[45] Zhang L, Xiang H, Li Z, et al. Porous Li3V2(PO4)3/C cathode with extremely high-rate capacity prepared by a sol-gel-combustion method for fast charging and discharging[J]. J Power Sources, 2012, 203: 121-125.
[46] Qiao Y Q, Tu J P, Wang X L, et al. Synthesis and improved electrochemical performances of porous Li3V2(PO4)3/C spheres as cathode material for lithium-ion batteries[J]. J Power Sources, 2011, 196(18): 7715-7720.
[47] Wang S, Zhang Z, Fang S, et al. Synthesis and electrochemical properties of ordered macroporous Li3V2(PO4)3cathode materials for lithium ion batteries[J]. Electrochim Acta, 2013, 111: 685-690.
Modification of Li3V2(PO4)3cathode material for lithium ion batteries
LI Yuejiao1,2, CAO Meiling1,WU Feng1,2
(1. Beijing Key Laboratory of Environmental Science and Engineering,School of Materials Science and Engineering, Beijing Institute of Technology, Beijing 100081, China; 2. National Development Center of High Technology Green Materials, Beijing 100081, China)
In recent years, poly anionic phosphate cathode materials for lithium ion batteries are widely concerned by the researchers because of their stable structure and excellent cycling performance. Lithium vanadium phosphate has the theoretical capacity of 197 mAh/g. It has high energy density, high charge and discharge voltage platform and excellent thermal stability. Compared to other cathode materials, it has obvious advantages. But its electronic conductivity is low and not suitable for high current charge and discharge, which limits its practical application, we must carry on the modification research. Current modification methods include coating conductive materials on its surface, metal doping, controlling its morphology etc. In this paper, combined with the structure of lithium vanadium phosphate, we reviewed various modification methods and make a comparative analysis. Furthermore, combined with the research achievements of our team, the existing problems and the future research trend are discussed.
Li-ion batteries; cathode materials; lithium vanadium phosphate; modification
1001-9731(2016)10-10001-05
国家重点基础研究发展计划(973计划)资助项目(2009CB220100);国家高技术研究发展计划(863计划)资助项目(2011AA11A235);北京理工大学基础研究基金资助项目(3100012211410)
2016-02-18
2016-05-08 通讯作者:李月姣,E-mail: lyj@bit.edu.cn
李月姣 (1982-),女,北京人,讲师,硕士生导师,博士,从事绿色能源材料研究。
TM911
A
10.3969/j.issn.1001-9731.2016.10.001
