光照波长和光子照度对霜鹿角珊瑚(Acropora pruinosa)生长及代谢的影响
2016-11-12肖宝华廖宝林杨小东谢子强
肖宝华,廖宝林,杨小东,谢子强
(1.广东海洋大学,广东 湛江 524088,2.广东海洋大学深圳研究院,广东 深圳 518108,3.深圳市碧海蓝天海洋科技有限公司,广东 深圳 518108)
光照波长和光子照度对霜鹿角珊瑚(Acropora pruinosa)生长及代谢的影响
肖宝华1,2,廖宝林2,杨小东2,谢子强3
(1.广东海洋大学,广东 湛江 524088,2.广东海洋大学深圳研究院,广东 深圳 518108,3.深圳市碧海蓝天海洋科技有限公司,广东 深圳 518108)
在实验室条件下设置380~410、430~460、530~560、610~640 nm 等4种波长,以及60、120、180、240、300、360 µmol·m-2·s-1等6组梯度光子照度,分别观察单枝霜鹿角珊瑚在不同光谱波长、光子照度条件下珊瑚的生长特性和代谢水平。结果表明:光子照度240 µmol·m-2·s-1的不同光谱条件下,霜鹿角珊瑚平均生长率(G)、单位面积叶绿素含量(Nchl-a)、蛋白质(ωP)、脂质(ωL)、碳水化合物(ωC)质量分数变化呈显著性差异( P<0.05),除ωC以外,均在波长530~640 nm光谱光照条件下达到最大值,其中ωL是ωP和ωC的10倍以上;不同光谱、光子照度梯度条件下,光照条件下的钙化率(GL)、净光合作用效率(PN)、总光合作用效率(PG)差异具统计学意义(P<0.05),在一定范围内,GL、PG、PN随着光子照度增强而升高,当光子照度超过光合效率光饱和值时,停止升高或开始降低;GL/GD和GL/PG值也随着光子照度增强而升高,变化范围分别在1.51~7.05、0.26~0.69之间,但PG/PN值随着光子照度增强而降低,变化范围在0.69~7.38之间。
造礁石珊瑚;光谱;光子照度;光合作用效率;钙化率
Calcification rates;
珊瑚礁分布主要受纬度限制,除此之外还受光照和霰石饱和度(aragonite)等条件影响[1]。其中,光是影响珊瑚生长的主要因素之一[2-3],可见光(PAR,400~700 nm)与紫外光(UVR,290~400 nm)是珊瑚共生虫黄藻光合作用的能量来源[4]。到达海底的光照主要由地理纬度和海水深度等因素决定,同时还受到水体中悬浮微粒和溶解有机物影响而衰减,随着深度增加,光强和光谱变化较大,能进入水体中的光波长急剧缩减[5]。
光照为珊瑚礁提供了较高的初级生产力能量,同时加速了石珊瑚和珊瑚藻CaCO3骨骼的沉淀[6]。国外研究多以造礁石珊瑚和珊瑚礁为对象,在细胞层面主要报道了光合作用与钙化作用过程中无机碳、钙离子的运输路径及机制,在组织层面主要研究了光照条件下的光合作用与钙化作用间的相互作用及联系,在生态系统层面主要分析了珊瑚礁初级生产力、钙化或碳酸钙沉淀及大气与海洋二氧化碳交换量间相互作用及联系[7]。然而,除了光条件之外,温度、盐度、营养盐等多种因素对石珊瑚光合、钙化作用及生长、分布也具有重要影响,而且常常因研究种类[8-9]、生活史阶段[10-11]以及模拟OA环境方式[9,12]的不同,所得研究结果不一致,从而无法确定单个因素变化对特定状态下石珊瑚生理代谢的调节机制。
本研究选择生态位较宽的霜鹿角珊瑚(Acropora pruinosa)为代表,研究4种波长光谱以及不同光子照度梯度下的生长特性和代谢变化,间接反映光谱质量和光子照度对石珊瑚共生体光合作用和钙化作用的作用效果以及光合、钙化过程间相互作用,以期为光照影响珊瑚生长代谢的复杂机制研究提供科学依据。
1 材料与方法
1.1 实验材料采集与暂养
霜鹿角珊瑚(Acropora pruinosa)于2015年3月份在徐闻珊瑚礁国家级自然保护区采集,采集后立即浸水转运至浸水转运至规格1 900mm × 1 100mm × 1 100mm养殖池内暂养,暂养海水直接从珊瑚礁区引入,经冷暖机稳定水温26℃,每天换水1次,换水量30%,水处理维生系统循环水流速度4 t/h,保持水体稳定。养殖池左右两侧配备两组造浪泵,间歇式运转造浪。
1.2 仪器设备
1.2.1 工具 KeibaPL-726S剪切钳;阿隆发Gel-10胶水;4cm × 4 cm陶瓷底座;微孔0.45 µm滤膜过滤。
1.2.2 设备 尺寸1 200mm × 600mm × 600mm珊瑚养殖缸5个;尺寸800mm × 250mm × 200mm玻璃槽6个;T5HO 2 × 80 W灯具,T5紫外蓝25 000 K、T5海水蓝 25 000 K、T5 绿色 10 000 K、T5高效红 13 000 K灯管;海利-冷水机HC-1000BH 1HP;托普云农-TP-PH-1光合有效辐射传感器;梅特勒-托利多便携式pH计FG2;荧光法溶氧RDO电极(Thermo Scientific Orion RDO®);Bradford蛋白浓度测定试剂盒 PC0010;京华752紫外可见分光光度计。
1.3 实验方法
1.3.1 单枝实验珊瑚移植 待整株珊瑚暂养 48 h恢复正常生长状态后,将整株珊瑚截肢为高度2 cm、形状规则、含有完整螅体的单枝实验珊瑚,共320株。采用胶水将单枝实验珊瑚粘附在陶瓷底座上,接触空气不超过30 s,集中暂养,确保破碎组织得到完全恢复,暂养条件同上。于实验室养殖缸进行光处理研究,实验结束后,所有单枝实验珊瑚移植至自然海域生长。
1.3.2 不同光谱波长条件下的珊瑚生长特性研究
将 150株单枝实验珊瑚平均分配到 5个养殖缸,其中1个养殖缸作为对照组,提供自然光照,其余4个养殖缸作为实验组,分别提供光谱波峰范围380~410 nm、430~460 nm、530~560 nm、610~640 nm的光照,确保透射进入养殖缸水体并到达珊瑚所在水层光子照度维持在240 µmol·m-2·s-1。实验周期30 d,第1天和30天测定生长指标和生理指标。生长指标包括平均生长率(G,mm·d-1),代表单枝珊瑚纵向生长高度日变化。生理指标包括单位面积虫黄藻密度(NZ,个·cm-2)和叶绿素含量Nchl-a,μg·cm-2),蛋白质(ωP,%)、脂质(ωL,%)、碳水化合物(ωC,%)质量分数,分别以铝箔纸重量法结合血球计数板计数[13],丙酮萃取法[14]、Bradford蛋白浓度测定试剂盒法、重量差法[15]、苯酚-硫酸法[16]测定。随机选取的单枝实验珊瑚样品液氮处理后,用10mL 1 mol/L的NaOH溶液90℃消化1 h,加入10mL水制成泥浆样品,泥浆样品的一部分用于检测碳水化合物含量,另一部分用于检测蛋白质含量。
1.3.3 不同光子照度条件下珊瑚代谢反应研究
在完全不透光的暗室内开展实验,共设置4个实验组,一个空白对照组。分别提供上述四种范围的照射光谱(灯具、灯管同上),每种光谱设置60、120、180、240、300、360 µmol·m-2·s-16个光子照度梯度,以暗处理为对照组。单个实验组处理为将18个盛有1 000mL新鲜过滤海水(微孔0.45 µm滤膜过滤)的具塞三角瓶均匀分配、并以45° 斜置于一组玻璃槽内(6个高度可调节、紧密、平行排列的玻璃槽为一组,单个玻璃槽与灯管间光子照度与直线距离的平方成反比),调节每一个玻璃槽与灯管间距离使其对应每一个光子照度梯度。暗处理对照组只占用一个玻璃槽和3个具塞三角瓶。从暂养池随机选取单枝实验珊瑚,每2株平铺于一只具塞三角瓶瓶底,五组实验共采用150株单枝珊瑚,其中4个实验组各自36株,对照组6株。所有玻璃槽内水位浸没至具塞三角瓶表面500mL刻度线,三角瓶和玻璃槽内水温通过冷暖机保持在 26.0~26.5℃。
每组实验周期为 4 h,实验前后采用碱性异常技术[17]快速检测每一只瓶内水体总碱度[c(A),µmol·L-1]和溶解氧量[c(O2),µmol·L-1)]。通过测定的c(A)和c(O2)变化分析珊瑚代谢过程[18],包括光照条件下的钙化率(GL,mol·cm-2·h-1);暗环境条件下的钙化率(GD,mol·cm-2·h-1);净光合作用效率(PN,mg·cm-2·h-1);暗呼吸作用效率(R,mg·cm-2·h-1);总光合作用效率(PG= PN+R,mg·cm-2·h-1)。为了更加直观的说明不同光谱条件下GL或PG伴随光子照度梯度升高或降低的速率,通过相比较于前一光子照度梯度下的 GL原始值 GL(X-1)[或PG(Y-1)],将后一光子照度梯度下的GL(X)[或PG(Y)]升高或降低的比例定义为GL(或PG)变化率(%)。
1.3.4 实验数据分析 采用SPSS 22.0 for Windows统计软件进行数据统计分析。以α = 0.05和α = 0.01作为差异显著水平,描述性统计值采用平均值±标准误(M±S.D)表示。单因素方差和Duncan多重比较不同光谱波长条件下的珊瑚生长参数值和不同光子照度条件下珊瑚代谢反应值。
2 结果与分析
2.1 不同波长范围光谱对珊瑚生长特性的影响
在同一波长范围条件下,来源于同一霜鹿角珊瑚母株的单枝珊瑚平均生长率(G)、单位面积虫黄藻密度(NZ)、叶绿素含量(Nchl-a)以及蛋白质(ωP)、脂质(ωL)、碳水化合物(ωC)质量分数的差异不显著(P>0.05),但不同波长光谱条件下霜鹿角珊瑚G、Nchl-a、ωP、ωL、ωC变化呈显著性差异(P<0.05)。波长 530~560 nm 条件下,G、Nchl-a、NZ达到最大值,分别为(0.024±0.002)mm·d-1、(3.315±0.033)μg·cm-2、(54 980±260)个·cm-2;在波长610~640 nm光谱光照条件下,ωP和ωL达到最大值,分别为(0.089±0.017)%和(0.602±0.012)%;但ωC在波长380~410 nm光谱光照条件下达到最大值,为(0.058±0.005)%。这表明霜鹿角珊瑚生长适合可见光范围内高波长光照(530~640 nm),此光谱条件下珊瑚生长处于最佳状态,并且光合作用效率最高。在不同光谱条件下,霜鹿角珊瑚组织中ωP、ωL、ωC变化较小,但ωL是ωP和ωC的10倍以上(表1),表示脂质可能为珊瑚能量储备或投入的关键指标。
2.2 不同波长范围光谱对对珊瑚代谢的影响
从表2可以看出,在不同波长光谱光照条件下,光子照度增强对霜鹿角珊瑚光照条件下的钙化率(GL)、净光合作用效率(PN)、总光合作用效率(PG)有显著影响,统计分析也发现不同波长光谱光子照度梯度条件下,霜鹿角珊瑚珊瑚GL、PN、PG差异显著(P<0.05)。一定范围内GL、PN、PG都随着光子照度增强而升高,当光子照度超过某一值时停止升高或开始降低。
波长380~410、530~560、610~640 nm光谱条件下,霜鹿角珊瑚 GL都在光子照度 240 µmol·m-2·s-1时达到最大值,分别为(0.410±0.015)、(0.529±0.051)、(0.443±0.095)mol·cm-2·h-1,但在波长 430~460 nm光谱条件下 GL在 300 µmol·m-2·s-1时达到最大值,为(0.461±0.016) mol·cm-2·h-1(表2)。表明光谱和光子照度变化对霜鹿角珊瑚的钙化作用具有显著影响。
因为PG= PN+ R,PN、PG具有线性变化关系。在波长380~410、610~640 nm光谱条件下,霜鹿角珊瑚PN、PG都在光子照度300 µmol·m-2·s-1时达到最大值,430~460 nm时,PN、PG在光子照度240 µmol·m-2·s-1时达到最大值,530~560 nm时,PN、PG在光子照度180 µmol·m-2·s-1时达到最大值(表2)。表明霜鹿角珊瑚共生藻光合作用过程对不同光谱光能的利用效率不同,对波长530~560 nm光谱的利用率最高。

表1 240 µmol·m-2·s-1光子照度不同波长光谱条件下霜鹿角珊瑚生长变化(M±SD)Table 1 Variation of growth and physiological parameters in the light intensities 240 µmol photons m-2s-1for Acropora pruinosa nubbins grown under a range of light wavelength(M±SD)
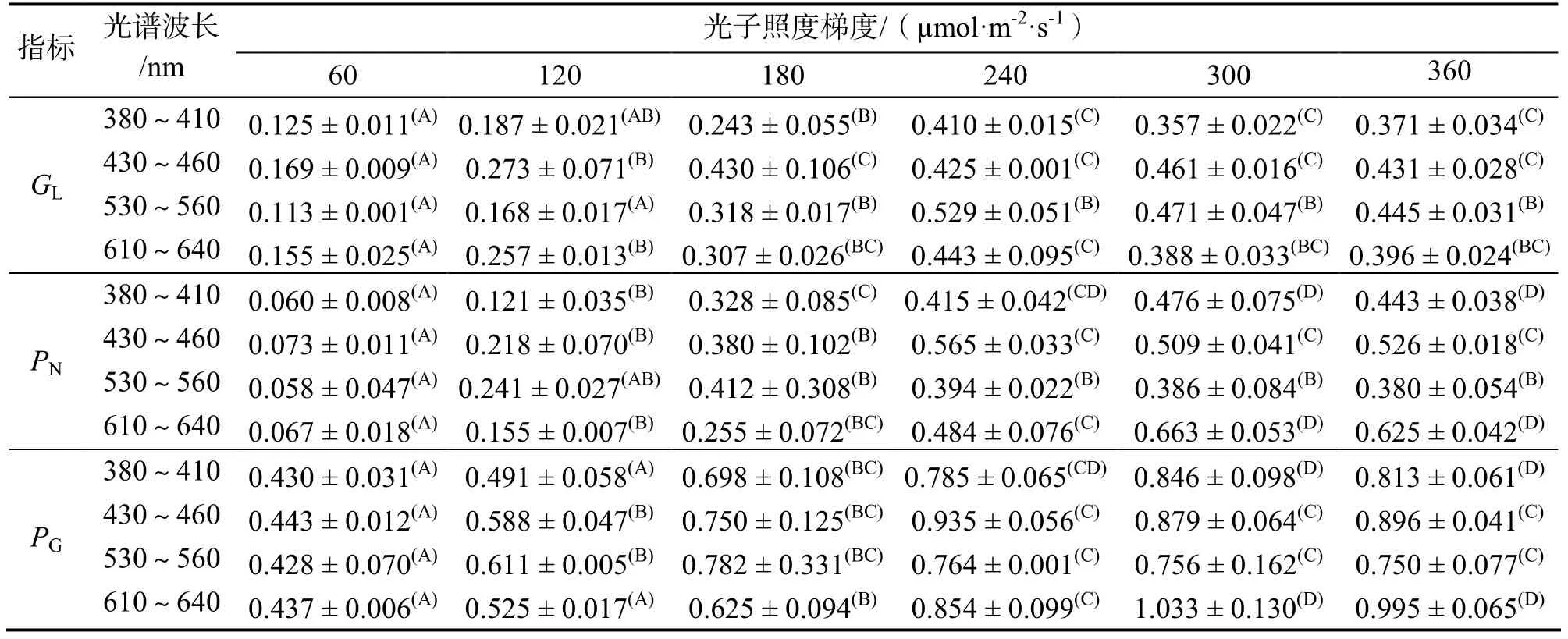
表2 不同光谱、光子照度梯度条件下霜鹿角珊瑚代谢反应(M±SD)Table 2 Metabolic responses of Acropora pruinosa under a range of light spectral quality and light intensities
在波长380~410、530~560、610~640nm光谱、光子照度梯度条件下,GL变化率都为初期较高,中期升高,后期骤降,而430~460 nm光谱条件下,GL变化率始终呈现降低趋势。380~410、530~560 nm光谱条件下 GL升高率(%)最大值都出现在180~240 µmol·m-2·s-1,430~460、610~640 nm光谱条件下GL升高率(%)最大值都出现在60~120 µmol·m-2·s-1(表3)。
虽然PG类似于GL都随着光子照度增强不断升高或降低,但是两者变化率不同。在波长不同光谱条件下,PG变化率分别在不同光子照度下的变化如表3所示。在不同波长光谱、同一光子照度条件下,GL/GD差异显著(GD为0.075±0.00 mol·cm-2·h-1)如在240 µmol·m-2·s-1时,波长530~560 nm时的GL/GD值高出其他3种波长光谱条件下19~29%;一定范围内 GL/GD值随着光子照度增大而升高,380~410、430~460、530~560、610~640 nm条件下,GL/GD值变化范围分别为1.67~5.47、2.25~6.15、1.51~7.05、2.07~5.91(表4)。不管何种光谱、光强条件下,GL/GD值差异显著,GD保持不变,说明光谱、光子照度对GL产生了显著性影响。
在不同波长光谱、同一光子照度条件下,GL/PG值差异显著,表明霜鹿角珊瑚对不同波长光谱的能量利用效率不同,导致光合作用效率、钙化速率不同;在波长380~410、430~460、530~560、610~640 nm光谱条件下,GL/PG值随着光子照度的增大而增大,变化范围分别为0.29~0.52、0.38~0.57、 0.26~0.69、0.35~0.52,总体在0.26~0.69之间(表4),表明在一定光子照度变化范围内,相比较于PG,GL增长速率较慢。
在不同波长光谱、同一光子照度条件下,PG/PN值差异显著,例如在60 µmol·m-2·s-1时,波长530~560 nm时的PG/PN值分别高出其它3种波长光谱条件下3%、13%、29%;在不同光谱条件下,380~410、430~460、530~560、610~640 nm条件下,PG/PN值随着光子照度增大而减小,变化范围分别为1.78~7.16、1.65~6.07、0.69~7.38、1.56~6.52,总体在0.69~7.38之间(表4)。

表3 不同光谱、光子照度梯度条件下霜鹿角珊瑚光照钙化率和光合作用效率变化率Table 3 Variation of light-dependent calcification and Gross photosynthesis of Acropora pruinosa under a range of light spectral quality and light intensities %
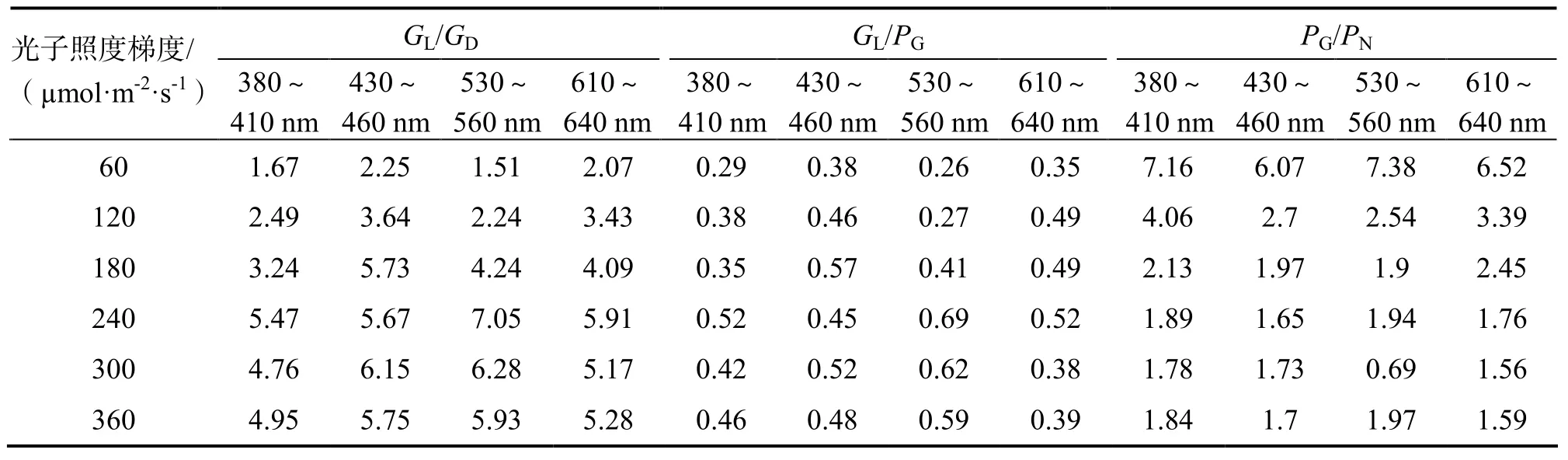
表4 不同光谱、光子照度梯度条件下霜鹿角珊瑚代谢指标比率Table 4 Ratio of Metabolic index of Acropora pruinosa under a range of light spectral quality and light intensities
3 讨 论
3.1 光谱对珊瑚生长的影响
在 530~640 nm光谱光照条件下霜鹿角珊瑚G、NZ、Nchl-a、ωP、ωL、ωC较高,说明珊瑚生长处于最佳状态,其生长更趋向于长波长光谱条件。这是因为波长越短,光子的能量越强,对珊瑚体内共生体虫黄藻的破坏作用也就越强;相反的,光谱波长越大,光子的能量越弱,珊瑚可能通过增加光合作用单位数量来提升光合效率。有学者研究发现造礁石珊瑚尖枝列孔珊瑚 Nchl-a/Nchl-c值随深度加深而增大,可接受的光适应过程是每个共生藻内叶绿素含量随光子照度减弱而不断积累增加[19]。石珊瑚共生藻功能是利用太阳光吸收珊瑚虫代谢产生的二氧化碳、磷酸盐、硝酸盐等,并将其转化为珊瑚虫所需的营养[20],而本研究中 NZ、Nchl-a在不同光谱条件下变化较大,最大值为(54 980±260)个·cm-2和(3.315±0.033)μg·cm-2,相当于以往研究资料中密度的一半(A:1×106cells·cm-2;Z:7.0 μg·cm-2),这可能是石珊瑚在不同条件下具有种类特异性,或者在较高辐射下(180 µmol·m-2·s-1),每个珊瑚虫中NZ、Nchl-a都会明显下降[21]。相反的,在低辐射下,共生藻会通过增加叶绿素含量及类囊体膜面积的方式[22]来增加对有限光能的吸收。相对于NZ、Nchl-a,不同光谱条件下霜鹿角珊瑚组织中ωP、ωL、ωC变化较小,但ωL却是ωP和ωC的10倍以上。研究发现,脂质一般作为珊瑚能量投入的关键指标,在所有珊瑚代谢产物中所占比例是相当高的,而且在所有珊瑚种类中排卵前后降低最为明显(85%~100%),而ωP和ωC相对能量投入和变化较小,一般降低1%~15%或者小于1%。如鹿角珊瑚科珊瑚Acropora tenuis ωL为 4.68 mg·cm-2,Montipora digitataωP为 2~4 mg·cm-2,ωC为 0.2~0.4 mg·cm-2[16]。
3.2 光照、光合作用效率、钙化率间相互关系
3.2.1 光照对光合作用效率的影响 4种波长光谱条件下,一定范围内PG、PN随着光子照度增强而升高,当光子照度超过光合效率光饱和值时,PG、PN停止升高或开始降低,此时光合作用的光抑制发生,光合效率开始降低,而且不同波长光谱光照条件下光合效率光饱和值有所不同。珊瑚对不同光谱光子照度的耐受能力不同,这可能是珊瑚体内光合单位吸收光谱具有选择性,或者对于不同波长光谱光能的利用效率有差异,但具体机制仍有待进一步的研究。PG/PN比值随着光子照度增强而降低,变化范围在0.69~7.38之间。因为PG=PN+R,因此可以认为光合作用产生的大部分能量被珊瑚体各种生理活动所消耗以维持共生体正常的新陈代谢,包括钙化过程。Al-Horani等[23]以Ca2+、pH 和 O2微传感器为技术手段研究丛生盔形珊瑚钙化机制与光合作用、呼吸作用间的联系发现PG大约是PN的7倍,也认为是呼吸作用消耗了共生藻光合作用产出O2的大部分。
3.2.2 光照对钙化率的影响 本研究中发现随着 4种波长光谱光子照度的增强,GL/GD值不断增大,表明霜鹿角珊瑚钙化率在光照条件下高于暗环境中,光子照度增强对石珊瑚钙化过程具有促进作用。有研究发现光照和暗环境条件下碳酸钙沉淀的位点是不一样的,但是都可能利用相似的离子运输机制[24]。光照条件下钙化率高于暗环境的机制解释包括虫黄藻吸收代谢废物[25]、光合作用过程吸收耗能产生的 CO2增加了组织体内外的 CaCO3饱和度[26]、光合作用加强了钙化过程中的耗能运输[27]等。然而,Marshall[28]认为在虫黄藻共生的珊瑚体中钙化作用不受光照影响,而受暗环境抑制。
不同光谱光子照度梯度条件下GL/GD值变化范围在1.51~7.05之间,而历史资料统计发现[7],因为研究过程采用技术(I4C、45Ca固定、浮重、碱度异常技术)、模拟环境(光照、温度、pH、pO2、pCO2等)不同,GL/GD值变化较大,存在从小于1(4%的研究中观察到碳酸钙溶解)至127的大范围的变化,仅仅9%的研究中发现比值在0~1之间(暗环境钙化率高于光照条件),71%比值为1~5之间,还有15%比值高于5,平均数为3.0。
3.2.3 光合作用与钙化作用间相互影响 不同波长光谱光子照度梯度条件下,GL伴随PG、PN升高,当光子照度接近或超过光合效率光饱和值时,伴随PG、PN降低,GL也开始降低,但此过程存在同步性和滞后性,而且类似于光合效率光饱和值,也存在一个钙化率光饱和值。380~410 nm、430~460 nm、530~560 nm、630~660 nm波长光谱条件下霜鹿角珊瑚钙化率光饱和度值分别为240、300、240、240 µmol·m-2·s-1,而 Suggett等[18]研究发现Acropora horrida和Porites cylindrica两种珊瑚钙化率光饱和度值分别在 274和 232 µmol·m-2·s-1。Schutter等研究表明光子照度与石珊瑚钙化有紧密关系,而且石珊瑚体内共生藻的光合作用和钙化作用间也具有紧密的联系[29-30]。许多研究采用钙离子通道抑制剂[31]、矿物质沉淀抑制剂(HEBP)[32]等多种手段99%限制钙化过程,发现并未对光合作用过程产生任何影响;相反的采用 verapamil限制光合作用,当100 µmol时,100%抑制了钙化过程[31],表明光合作用过程会影响钙化过程的进行。也有研究发现光合作用、呼吸作用、钙化作用同时发生在珊瑚共生体内不同时空,骨骼形成位点在外胚层的上皮细胞,光合位点在虫黄藻,其位于内胚层,光合作用和钙化作用都需要无机碳,而且其两个过程可以看做是相互补充的过程,因为钙化过程产生的CO2被直接用于光合作用的碳固定[29]。
虽然PG类似于GL都随着光子照度增强不断升高或降低,但是两者变化率不同,GL与PG具有一定的线性相关性,但是变化率的差异性意味着 PG可能只是影响GL的因素之一。而且GL/PG比值随着光子照度的增大而增大,相比较于PG,GL增长速率较慢,进一步说明光合作用对钙化作用具有促进作用,但这一作用效果随着光子照度的增强不断减弱。不同光谱光子照度梯度条件下GL/PG值变化范围为0.26~0.69,但Mc Connaughey 和 Whelan[33]研究发现光合作用和钙化作用的植物、共生虫黄藻的动物、生态系统钙化率和光合效率间的比率接近1。这可能是G/PG值分析方法或调查尺度不同的原因,因为PG来源于PN和R,一般很难测定白天的呼吸耗能,而且对于珊瑚白天的呼吸作用耗能高于晚上,所以容易低估PG,从而高估G/PG值。除此之外,Yamashiro[32]通过3个梯度的辐射强度研究,也发现GL/PG值随着辐射的增大而降低。
[1]BEN D R,GHENIM N,TRABELSI L,et al.Modeling growth and photosynthetic response in Arthrospira platensis as function of light intensity and glucose concentration using factorial design[J].Journal of applied phycology.2010,22:745-752.
[2]LESSER M P,STOCHAJ W R,TAPLEY D W,et al.Bleaching in coral reef Anthozoans:effects of irradiance,ultraviolet radiation and temperature,on the activities of protective enzymes against active oxygen[J].Coral reefs,1990,8:225-232.
[3]GLEASON D F,WELLINGTON G M.Ultraviolet radiation and coral bleaching[J].Nature,1993,365:836-838.
[4]LESSER R.M P,FARRELL J H.Exposure to solar radiation increases damage to both host tissues and algal symbionts of corals during thermal stress [J].Coral reefs,2004,23(3):367-377.
[5]KLEYPAS J A,BUDDEMEIER R W,ARCHER D,et al.Geochemical consequences of increased atmospheric carbon dioxide on coral reefs [J].Nature,1999,284:118-120.
[6]JOHANSEN.Coralline algae a first synthesis[M].Florida,USA:CRC Press,1981,152-158.
[7]GATTUSO J P,ALLEMAND D,FRANKIGNOULLEJ A M.Photosynthesis and Calcification at Cellular,Organismal and Community Levels in Coral Reefs:A Review on Interactions and Control by Carbonate Chemistry [J].Zoologist,1999,39(1):160-183.
[8]ANTHONY K R N,KLINE D I,DIAZ-PULIDO S,et al.Ocean acidification causes bleaching and productivity loss in coral reef builders[J].Proceedings of the national academy of sciences usa,2008,105:17442-17446.
[9]EDMUNDS P J.Zooplanktivory ameliorates the effects of ocean acidification on the reef coral Porites spp[J].Limnology and oceanography,2011,56:2402-2410.
[10]DUNNE R P,BROWN B E.The influence of solar radiation on bleaching of shallow water reef corals in the Andaman Sea,1993-1998[J].Coral reefs,2001,20:201-210.
[11]ALBRIGHT R,MASON B,MILLER M,et al.Ocean acidification compromises recruitment success of the threatened Caribbean coral Acropora palmata[J].Proceedings of the national academy of sciences usa,2012,107:20400-20404.
[12]MARUBINI F,FERRIER-PAGES C,FURLA P,et al.Coral calcification responds to seawater acidification:a working hypothesis towards a physiological mechanism[J].Coral reefs,2008,27:491-499.
[13]FITT W K,MCFARLAND F K,WARNER M E,et al.Seasonal patterns of tissue biomass and densities of symbiotic dinoflagellates in reef corals and relation to coral bleaching[J].Limnology and oceanography,2000,45(3):677-685.
[14]JEFFREY S W ,HUMPHREY G F.New spectrophotometric equations for determining chlorophylls a,b,c1 and c2 in higher plants,algae and natural phytoplankton[J].Plant physiology and biochemistry,1975,167:191-194.
[15]FOLCH J,LEES M,SLOANE STANLEY G H.A simple method for the isolation and purification of total lipids from animal tissues[J].Biological Chemistry,1957,226:497-509.
[16]SEBASTIAN L,Kenneth R N,Bette L,et al.Reproductive energy investment in corals:scaling with module size[J].Oecologia,2003,136:524-531.
[17]SMITH S,KINSEY D.Calcification and organic carbon metabolism as indicated by carbon dioxide [M] // Stoddart D,Johannes R.Coral reefs:Research methods.Monographs on oceanographic methodology,unesco,Paris,1978,469-484.
[18]SUGGETT D J,DONG L F,LAWSON T,et al.Light availability determines susceptibility of reef building corals to ocean acidification [J].Coral reefs,2013,32:327-337.
[19]NIR O,GRUBER D F,EINBINDER S,et al.Changes in scleractinian coral Seriatopora hystrix morphology and its endocellular Symbiodinium characteristics alonga bathymetric gradient from shallow to mesophotic reef[J].Coral reefs,2011,30:1089-1100.
[20]ROWAN R,KNOWLTON N,BAKER A,et al.Landscape ecology of algal symbionts creates variation in episodes of coral bleaching[J].Nature,1997,388(6639):265-269.
[21]KUGUR B,WINTERS G,BEER S,et al.Adaptation strategies of the corallimorpharian Rhodactis rhodostoma to irradiance and temperature[J].Marine Biology,2007,151(4):1287-1298.
[22] STAMBLER N.Effects of light intensity and ammoniumenrichment on the hermatypic coral Stylophora pistillata and its zooxanthellae[J].Symbiosis,1998,24(1):127-146.
[23] AL-HORANI F A,AL-MOGHRABI S M.The mechanism of calcification and its relation to photosynthesis and respiration in the scleractinian coral Galaxea fascicularis[J].Marine Biology,2003,42:419-426.
[24]MARSHALL A T,WRIGHT A.Coral calcification:Autoradiography of a scleratinian coral Galaxea fascicularis after incubation in45Ca andI4C[J].Coral reefs,1998,17:37-47.
[25]CROSSLAND C J,BARNES D J.The role of metabolic nitrogen in coral calcification[J].Mar Biol,1974,28(4):325-332.
[26]SIMKISS K.Phosphates as crystals poisons of calcification[J].Biological Reviews,1974,39:487-505.
[27]CHALKER B E,Taylor D L.Light-enhanced calcification and the role of oxidative phosphorylation in calcification of the coral Acropora cervicornis[J].Proceedings of the Royal Society of London.Series B,Biological Sciences,1975,190(1100):323-331.
[28]MARSHALL A T.Calcification in hermatypic and ahermatypic corals[J].Science,1996a,271:637-639.
[29]SCHUTTER S,Van Velthoven B,Janse M,et al.The effect of irradiance on long-term skeletal growth and net photosynthesis in Galaxea fascicularis under four light conditions[J].Journal of experimental marine biology and ecology,2008,367(2):75-80.
[30]GATUSSO J P,Allemand D,Frankignoulle M.Photosynthesis and calcification at cellular,organismal and community levels in coral reefs:A review on interactions and control by carbonate chemistry[J].American Zoologist,1999,39(1):160-183.
[31]AL-MOGHRABI S,Goiran S C,Allemand D,et al.Inorganic carbon uptake for photosynthesis by the symbiotic coral-dinoflagellate association II.Mechanisms for bicarbonate uptake [J].Journal of experimental marine biology and ecology,1996,199(2):227-248.
[32]YAMASHIRO H.The effects of HEBP,an inhibitor of mineral deposition,upon photosynthesis and calcification in the scleractinian coral,Stylophora pistillata[J].Journal of experimental marine biology and ecology,1995,191:57-63.
[33]MCCONNAUGHEY T A,WHELAN J F.Calcification generates protons for nutrient and bicarbonate uptake[J].Earth-Science Reviews,1997,42(1/2):95-117.
(责任编辑:陈庄)
Effect of Light Ⅰntensity and Spectral Quality on Growths and Metabolic Response of Acropora pruinosa
XIAO Bao-hua1,2,LIAO Bao-lin2,YANG Xiao-dong2,XIE Zi-qiang3,
(1.Guangdong Ocean University,Zhanjiang 524088,China;2.Shenzhen Research Institute of Guangdong Ocean University,Shenzhen 518108,China;3.Shenzhen Ocean Hyaline Marine Science and Technology Co.Ltd,Shenzhen 518108,China)
Nubbins from Acropora pruinosa were dissected and cultured unifactor and control experiment.By the survey of growth characteristics and metabolic level under a range of light wavelength and light intensities,the results suggest the four light spectral(40 µmol photons m-2s-1)have significant impact on the Mean growth rates(G),areal zooxanthellae density(NZ)and zooxanthellae chlorophyll-a content(Nchl-a),ratio of Protein(ωP),Carbohydrate(ωC)and Lipid content(ωL),indicating significant differences between control and treatment(P<0.05).Both parameters of peaked at 530~640 nm,except Carbohydrate.Lipid content to almost 10-fold higher values for the Protein(ωP)and Carbohydrate(ωC).The light-dependant calcification rates(GL),net photosynthesis(PN)and gross photosynthesis(PG)show significant difference among themunder a range of light wavelength and light intensities(P<0.05).the increases of light-dependent calcification rates(GL),gross photosynthesis(PG)and net photosynthesis(PN)along with the increase of light intensities,and begin to stop increase or decrease when the light intensities reach their peak at a threshold that was found between the light intensity and photosynthetic efficiency.Accordingly,the ratio of light-dependant calcification rates(GL)to dark calcification rates(GD)and light-dependant calcification rates(GL)to gross photosynthesis(PG)remains a similar variation curve and the ratio ranges from 1.51 to 7.05 and 0.26 to 0.69.However,the ratio gross photosynthesis(PG)to net photosynthesis(PN)begin to decrease along with the increase of light intensities and the ratio ranges from 0.69 to 7.38.
reef-building corals;light spectral;light intensity;photosynthetic efficiency;
Q959.135.3
A
1673-9159(2016)03-0057-08
10.3969/j.issn.1673-9159.2016.03.010
2016-05-05
广东省公益研究与能力建设专项(K15216);广东省海洋渔业科技推广专项(A201308E02);大鹏新区产业发展专项(DPKJ201500080)
肖宝华(1978—),男,硕士,助理研究员,主要从事水产养殖及海洋生态学研究。电话:0759-2396216,E-mail: gdouxxhpaper@126.com
