叶酸代谢酶MTHFR、MTRR基因多态性与原因不明复发性流产的关系
2016-11-12谢晓媛张颖辛力冷俊宏鲁衍强薛琰朱秀兰
谢晓媛,张颖,辛力,冷俊宏,鲁衍强,薛琰,朱秀兰
临床研究
叶酸代谢酶MTHFR、MTRR基因多态性与原因不明复发性流产的关系
谢晓媛1,张颖2,辛力1,冷俊宏1,鲁衍强3,薛琰3,朱秀兰4△
目的探讨叶酸代谢相关酶亚甲基四氢叶酸还原酶(MTHFR)、甲硫氨酸合酶还原酶(MTRR)基因多态性与原因不明复发性流产(URSA)之间的关系。方法采用病例对照的研究方法,选取天津医科大学总医院和天津市妇女儿童保健中心2013年1月1日—2015年3月1日因URSA就诊的非妊娠妇女244例(URSA组)和健康非妊娠妇女116例(对照组)。获取口腔黏膜上皮细胞,使用荧光定量PCR检测MTHFR基因C677T、A1298C位点和MTRR基因A66G位点的单核苷酸多态性(SNP),同时测定MTHFR酶活性及红细胞叶酸、血浆叶酸、血浆同型半胱氨酸水平,分析叶酸代谢相关酶MTHFR、MTRR基因多态性与URSA之间的关系。结果URSA组MTHFR C677T位点TT基因型频率高于对照组,CT基因型频率低于对照组(P<0.05)。2组间MTHFR A1298C、MTRR A66G基因型频率差异无统计学意义。URSA组MTHFR酶活性、红细胞叶酸、血浆叶酸水平低于对照组,同型半胱氨酸水平高于对照组(P<0.05);URSA组中<35岁、≥35岁患者血浆叶酸、红细胞叶酸、同型半胱氨酸水平差异无统计学意义。结论MTHFR C677T基因多态性与URSA有一定关系。
流产,自然;5,10-亚甲基四氢叶酸还原酶(FADH2);多态性,单核苷酸;原因不明复发性流产;甲硫氨酸合成酶还原酶
复发性流产(recurrent spontaneous abortion,RSA)是指连续发生2次或2次以上流产,其发生率约占妊娠总数的1%~2%,占自然流产数的15%~20%[1]。导致反复流产发生的病因十分复杂,包括染色体异常、内分泌异常、解剖因素、血型不合、免疫因素、感染甚至精神因素等。目前,仍有40%~60%的患者原因不明,称为原因不明复发性流产(unexplainedrecurrentspontaneousabortion,URSA)[2],是妇产科疑难之症。目前国内外重点研究集中在血栓形成遗传倾向性,亚甲基四氢叶酸还原酶(methylenetetrahydrofolate,MTHFR)及甲硫氨酸合酶还原酶(methionine synthase reductase,MTRR)基因的多态性[3]。本研究经过对最常见的叶酸代谢相关酶MTHFR基因C677T位点、A1298C位点和MTRR基因A66G位点多态性的检测,探讨其与红细胞和血浆叶酸、同型半胱氨酸及URSA之间的相互关系,为孕前及孕期补充叶酸降低复发性流产率提供理论基础。
1 对象与方法
1.1 研究对象URSA组:选自2013年1月1日—2015年3月1日来天津医科大学总医院优生遗传咨询门诊和天津市妇女儿童保健中心筛查科就诊非妊娠患者244例,符合以下前提:(1)自然流产≥2次、有或无正常分娩史。(2)夫妻双方外周血染色体核型分析正常,无家族遗传病史。(3)多普勒超声、子宫输卵管造影等检查诊断无生殖器解剖学畸形。(4)内分泌相关检查正常,包括月经周期正常、记录基础体温呈双相,检测有排卵,甲状腺功能检查正常,无糖尿病史。(5)排除支原体、衣原体、弓形虫、巨细胞病毒、梅毒螺旋体及单纯疱疹病毒等病原体感染。(6)抗核抗体、抗磷脂抗体、抗精子抗体等免疫相关抗体均为阴性。(7)无静脉栓塞史,无肝脏及肾脏的急、慢性疾病。(8)近3个月内未进行过任何方式的维生素补充治疗。对照组:选自2013年1月1日—2015年3月1日在天津市妇女儿童保健中心进行孕前检查的健康非妊娠女性116例,至少有1次成功妊娠史,无自然流产病史、胚胎停育史、胎儿生长受限、妊娠高血压综合征和宫内死胎病史,并且无血栓性疾病史。
1.2 DNA提取、基因型分析及MTHFR酶活性检测用无菌棉拭子反复刮取受试者口腔黏膜上皮细胞(在口内侧刮拭40次以上,强度以略为鼓起为宜),然后用柱提取试剂盒提取DNA。PCR引物分别为:MTHFR C677T-上游5′-GAAAAGCTGCGTGATGATG-3′、下游5′-TTGAAGGAGAAGGTGTC-3′;MTHFRA1298C-上游5′-AAGAACGAAGACTTCAAA-3′、下游5′-TGGGGGGAGGAGCTGAC-3′;MTRR A66G-上游5′-AGGCAAAGGCCATCGCA-3′、下游5′-ATCCATGTACCACAGCTT-3′。Taqman-MGB探针基因序列分别为:MTHFR C677T-V2 5′-AATCGGCTCCCGC-3′、MTHFR C677T-M2 5′-AATCGACTCCCGC-3′,MTHFR A1298C-V2 5′-ACACTTGCTTCACT-3′、MTHFR A1298CM2 5′-ACACTTTCTTCAC T-3′,MTRR A66G-V2 5′-AAGAAATATGTGAG-3′、MTRR A66G-M2 5′-AAGAAATGTGTGAG-3′,相关仪器、试剂均使用美国应用生物系统(ABI)公司产品。按照试剂盒说明书采用Taqman-MGB技术进行检测,对3个位点分别进行荧光定量PCR反应,PCR反应体系10 μL,包括DNA模板(20 mg/L)1 μL,Taqman Universal Master Mix 5 μL,Taqman-MGB探针0.5 μL,去离子水3.5 μL,PCR反应条件(两步法):95℃预变性10 min,随后进行20个循环的扩增(92℃变性15 s、60℃退火延长1 min),再进行30个循环的扩增(89℃变性15 s、60℃退火延伸90 s)。实验结束后,ABI7900荧光定量PCR仪在荧光端读取样品孔,软件分析各样本的基因分型结果同时测定MTHFR酶活性。
1.3 同型半胱氨酸、红细胞叶酸、血浆叶酸检测空腹静脉取血5 mL,分别加入EDTA-K2抗凝真空采血管和肝素钠抗凝真空采血管内,充分混匀,于取血40 min内离心,3 500 r/min,15 min。离心后立即分离血浆,所有标本应保存于-20℃,避免反复冻融。采用微生物培养法测定血浆叶酸和红细胞叶酸,所用检测微生物为乳酸杆菌。同型半胱氨酸用东芝TBA-120FR全自动生化分析仪进行检测。
1.4 统计学方法采用SPSS 19.0软件分析数据,计量资料以均数±标准差(x¯±s)表示,2组间比较采用t检验。计数资料用率或者构成比表示,组间比较用卡方检验。2组间基因型与等位基因频率比较采用卡方检验。P<0.05为差异有统计学意义。
2 结果
2.1 URSA组与对照组的年龄分布2组间年龄分布差异无统计学意义(χ2=1.361,P>0.05),见表1。

Tab.1The age distribution of URSA group and control group表1 URSA组与对照组的年龄分布情况例(%)
2.2 基因型分布
2.2.1 Hardy-Weinberg平衡分析MTHFR C677T基因包括CC、CT、TT 3种基因型;MTHFR A1298C基因包括AA、AC、CC 3种基因型;MTRR A66G基因包括AA、AG、GG 3种基因型。URSA组MTHFR C677T、A1298C和MTRR A66G基因多态性,检验结果符合Hardy-Weinberg遗传平衡(χ2分别为3.198、0.991、0.352,均P>0.05),对照组检验结果亦符合Hardy-Weinberg遗传平衡(χ2分别为0.641、1.289、0.653,均P>0.05),表明样本具有本区域的群体代表性。
2.2.22 组间基因型和等位基因频率比较2组MTHFR C677T位点基因型、等位基因频率差异有统计学意义,URSA组TT基因型频率高于对照组,CT基因型低于对照组。2组MTHFR A1298C、MTRR A66G位点基因型、等位基因频率比较差异无统计学意义,见表2。

Tab.2Comparison of MTHFR C677T,MTHFR A1298C and MTRR A66G gene polymorphisms between two groups表2 2组MTHFRC677T、MTHFR A1298C、MTRR A66G基因多态性比较例(%)
2.2.3 2组MTHFR酶活性、血浆同型半胱氨酸、红细胞叶酸、血浆叶酸比较URSA组MTHFR酶活性、红细胞叶酸、血浆叶酸水平低于对照组,血浆同型半胱氨酸水平高于对照组(均P<0.05),见表3。
2.3 URSA组不同年龄患者同型半胱氨酸、红细胞叶酸、血浆叶酸的比较URSA组中<35岁、≥35岁患者血浆同型半胱氨酸、红细胞叶酸、血浆叶酸比较差异无统计学意义,见表4。
Tab.3Comparison of MTHFR enzyme activity,plasma homocysteine,red cell folate and plasma folate levels between two groups表3 2组MTHFR酶活性、血浆同型半胱氨酸、红细胞叶酸、血浆叶酸水平比较
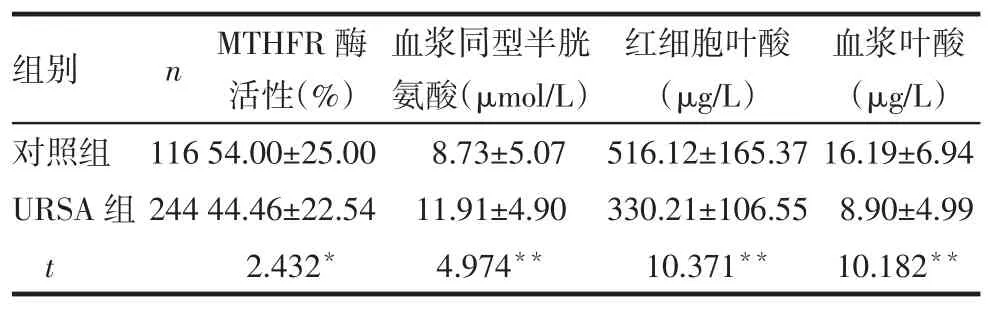
Tab.3Comparison of MTHFR enzyme activity,plasma homocysteine,red cell folate and plasma folate levels between two groups表3 2组MTHFR酶活性、血浆同型半胱氨酸、红细胞叶酸、血浆叶酸水平比较
*P<0.05,**P<0.01
组别对照组URSA组t n 116 244 MTHFR酶活性(%)54.00±25.00 44.46±22.54 2.432*血浆同型半胱氨酸(μmol/L)8.73±5.07 11.91±4.90 4.974**红细胞叶酸(μg/L)516.12±165.37 330.21±106.55 10.371**血浆叶酸(μg/L)16.19±6.94 8.90±4.99 10.182**
Tab.4Comparison of plasma folate,red cell folate and homocysteine levels betweeen different age patients with URSA表4 URSA组不同年龄患者血浆叶酸、红细胞叶酸、同型半胱氨酸的比较

Tab.4Comparison of plasma folate,red cell folate and homocysteine levels betweeen different age patients with URSA表4 URSA组不同年龄患者血浆叶酸、红细胞叶酸、同型半胱氨酸的比较
均P>0.05
组别<35岁≥35岁t n 171 73血浆同型半胱氨酸(μmol/L)10.08±5.45 10.19±3.98 0.131红细胞叶酸(μg/L)445.10±188.30 410.10±141.18 1.182血浆叶酸(μg/L)13.52±7.16 10.19±6.70 1.275
3 讨论
叶酸代谢酶MTHFR基因多态性导致的酶活性降低,不仅会造成胚胎发育所必需的DNA和蛋白质的甲基化不足,还可使血浆同型半胱氨酸水平升高,引起血管内皮细胞损伤和毒性作用,同时激活血小板的黏附和聚集作用,导致胎盘血管栓塞性病变,最终导致胎儿畸形或URSA。因此叶酸代谢酶MTHFR基因多态性是神经管缺陷及URSA的影响因素[4-5]。
本研究结果显示,URSA组MTHFR C677T位点TT基因型频率高于对照组,提示携带TT基因型会增加孕妇流产的风险,表明MTHFR C677T基因多态性与原因不明复发性流产有关。而2组MTHFR A1298C、MTRR A66G基因型分布无明显差异,说明MTHFR A1298C、MTRR A66G基因多态性与URSA无关,这对于孕前及孕期叶酸补充指导和监测,从而进一步降低复发性流产率有着重要的意义。同时本研究结果也验证了这些基因多态性与红细胞叶酸、血浆叶酸及血同型半胱氨酸水平关系密切[6-7],提示基因的改变可导致酶活性、红细胞叶酸、血浆叶酸水平下降,血浆同型半胱氨酸水平升高,发生URSA的风险增加。
由于人体内血清叶酸水平易受近期身体吸收状况、饮食结构等多方面因素的影响,因此本研究中采用微生物培养法检测相对稳定的红细胞叶酸,可较好地反映体内叶酸储备,对于孕妇尤有意义。本研究结果显示URSA组中<35岁、≥35岁患者间血浆叶酸、红细胞叶酸、血浆同型半胱氨酸水平差异无统计学意义,提示不同年龄段的人群均应及时补充叶酸。有关研究表明,妊娠早期可补充0.4~0.8 mg/d低剂量叶酸[8],或经循证医学证实含有叶酸成分的复合维生素[9]。以往妊娠过神经管缺陷(NTD)胎儿的孕妇,有必要每天补充4 mg叶酸[10]。对于由MTHFR遗传性因素造成的叶酸代谢异常和高半胱氨酸血症,进而使凝血机制发生异常[11],URSA的危险增加,可以通过补充叶酸,降低维生素K依赖的凝血因子水平,从而降低妊娠期胎盘血管血栓性病变的危险性[12]。郝玲等[13]认为正常妊娠孕妇膳食叶酸摄入量与血浆5-甲基四氢叶酸水平呈正相关,而URSA组要达到指定的血浆5-甲基四氢叶酸水平,需摄入更多的叶酸。对携带TT基因型且有URSA史的患者,补充常规剂量的叶酸已经不能满足妊娠期的需要,加大剂量补充叶酸尤其重要。但是,如何增加大剂量的叶酸和用药时间的长短,以及补充大剂量叶酸后会对胎儿及孕妇产生哪些负面影响,还需要更深入的研究。
[1]Kurzawińska G,Seremak-Mrozikiewicz A,Drews K,et al.Genetic conditioned changes in activity of 5,10-methylenetetrahydrofolate reductase(MTHFR)and recurrent miscarriages[J].Ginekol Pol,2009,80(10):762-767.
[2]Kutteh WH,Park VM,Deitcer SR.Hypercoagulable state mutation analysis in white patients with early first-trimester recurrent pregnancy loss[J].Fertil Steril,1999,71(6):1048.
[3]Zeng Y,Zhang JJ.Research progress on the relationship between URSA and genetic polymorphism in Chinese population[J]. Chinese Journal of Birth Health,2015,23(7):1-3.[曾艳,张建军.中国人群URSA与基因多态性相关性的研究进展[J].中国优生与遗传杂志,2015,23(7):1-3].doi:10.13404/j.cnki. cjbhh.2015.07.001.
[4]Yu Y,Wang F,Bao Y,et al.Association between MTHFR gene polymorphism and NTDs in Chinese Han population[J].Int J Clin Exp Med,2014,7(9):2901-2906.
[5]Li QX,Wu PZ,He LL,et al.Relationship between folic acid metabolism-related enzyme gene polymorphism and susceptibility of abnormal pregnancy[J].Chongqing Medical Journal,2015,44(10):1330-1333.[李茜西,伍萍芝,何琳琳,等.叶酸代谢相关酶基因多态性与不良孕产发生易感性的关系[J].重庆医学,2015,44(10):1330-1333].
[6]Liu YH,Chen Y.Relationship between folate metabolism genes and birth defects and adverse pregnancy[J].Chinese Journal of Birth Health,2012,28(8):6-8.[刘英华,陈瑛.叶酸代谢基因与出生缺陷和不良妊娠的关系[J].中国优生与遗传杂志,2012,28(8): 6-8].doi:10.13404/j.cnki.cjbhh.2012.08.002.
[7]WangSY,LuYQ,MaSJ,etal.Relationshipofplasma homocysteine with gene polymorphisms of MTHFR and MTRR among Han women in Xiangtan city[J].Tianjin Med J,2014,42(12):1205-1208.[王淑媛,鲁衍强,马少杰,等.湘潭市汉族女性MTHFR和MTRR基因多态性分布及其与血浆Hcy水平的关系[J].天津医药,2014,42(12):1205-1208].doi:10.3969/j. issn.0253-9896.2014.12.015.
[8]Zhang S,Lu YQ,Rui XY,et al.Effects of folic acid supplement on subjects with different methylenetetra-hydrofolate reductase C677T genotypes[J].Tianjin Med J,2013,41(7):628-631.[张爽,鲁衍强,芮欣忆,等.不同5,10-亚甲基四氢叶酸还原酶基因型人群叶酸补服效果评价[J].天津医药,2013,41(7):628-631].doi: 10.3969/j.issn.0253-9896.2013.07.002.
[9]De-Regil LM,Peña-Rosas JP,Fernández-Gaxiola AC,et al. Effects and safety of periconceptional oral folate supplementation for preventing birth defects[J].Cochrane Database Syst Rev,2015,(12):CD007950.doi:10.1002/14651858.CD007950.pub3.
[10]Hursthouse NA,Gray AR,Miller JC,et al.Folate status of reproductive age women and neural tube defect risk:the effect of long-term folic acid supplementation at doses of 140 μg and 400 μg per day[J].Nutrients,2011,3(1):49-62.doi:10.3390/ nu3010049.
[11]Li XY,Chen LJ,Guo HP,et al.Study on genetic polymorphisms of folatemetabolismenzymesandsusceptibilitytorecurrent spontaneous abortion[J].Journal of Modern Medicine,2015,21(33):1-3.[李晓英,陈丽娟,郭惠萍,等.叶酸代谢酶基因多态性与反复自然性流产易感性的研究[J].当代医学,2015,21(33):1-3].doi:10.3969/j.issn.1009-4393.2015.33.001.
[12]Liu N,Yan J,Yang L.Relationship between gene polymorphism and folate metabolism among women with abnormal pregnancy history[J].Chin Journal Fam Plann,2015,23(5):318-320.[刘念,阎炯,杨林.叶酸代谢相关酶基因多态性与不良孕产关系的研究[J].中国计划生育学杂志,2015,23(5):318-320].
[13]Hao L,Tang Y.Serum folate levels in pregnant women and its influencing factors[J].Chinese Journal of Preventive Medicine,1996,30:375-377.[郝玲,唐仪.孕妇血液叶酸水平及其影响因素[J].中华预防医学杂志,1996,30:375-377].
(2016-03-01收稿2016-06-28修回)
(本文编辑李国琪)
The relationship of the folate metabolism related gene polymorphisms of MTHFR and MTRR with unexplained recurrent spontaneous abortion
XIE Xiaoyuan1,ZHANG Ying2,XIN Li1,LENG Junhong1,LU Yanqiang3,XUE Yan3,ZHU Xiulan4△
1 Tianjin Women's and Children's Health Center,Tianjin 300070,China;2 Tianjin Medical University General Hospital;3 Shanghai Institute of Targeted Therapy and Molecular Medicine;4 Department of Reproductive Health and Infertility,Maternal and Child Health Hospital of Guangdong Province,Guangzhou Medical University,Guangzhou 510000,China△
ObjectivesTo investigate the relationship of methylenetetrahydrofolate reductase(MTHFR)and methioninesynthase reductase(MTRR)with unexplained recurrent spontaneous abortion(URSA).MethodsCase control study was used to select 244 patients with URSA(miscarriage group)and 116 normal women(control group)who were admitted to Tianjin Medical University General Hospital and Tianjin Women's and Children's Health Center from January 2013 to March 2015.The oral mucosal epithelial cells were extracted using fluorescence quantitative PCR to detect MTHFR gene C677T,A1298C and MTRR gene loci of A66G single nucleotide polymorphisms(SNP).The relationship between folate metabolism related gene polymorphisms of MTHFR and MTRR and URSA was analysed.ResultsThe frequency of C677T genotype MTHFR was significantly higher in URSA group than that in the control group,and the frequency of CT genotype was significantly lower than that of the control group(P<0.05).There was no significant difference in the frequencies of A1298C MTRR and A66G MTHFR between the two groups.The activity of MTHFR,red cell folate and plasma folate levels were significantly lower in URSA group than those of control group.Homocysteine levels were significantly higher in URSA group than those of control group(P<0.05).There were no significant differences in serum folic acid,red cell folate,homocysteine cysteine levels between patients<35 years old and≥35 years old in URSA group.ConclusionC677TMTHFR gene polymorphism is associated with unexplained recurrent spontaneous abortion.
abortion,spontaneous;5,10-methylenetetrahydrofolate reductase(FADH2);polymorphism,single nucleotide;unexplained recurrent spontaneous abortion;methionine synthase reductase
R715.5
A
10.11958/20160099
国家自然科学基金青年科学基金(项目编号81300479)
1天津市妇女儿童保健中心(邮编300070);2天津医科大学总医院;3上海靶向分子医学研究所;4广州医科大学附属广东省妇儿医院生殖健康与不孕症科
谢晓媛(1982),女,主治医师,硕士,主要从事妇产科优生与遗传研究
△通讯作者E-mail:409459957@qq.com
