应用CRISPR/Cas9系统在G401细胞株中敲除p21基因
2016-11-12赵秀娟陈万标张沛涛张娜楚晓文白向阳杨冰吴旭东王玺
赵秀娟,陈万标,张沛涛,张娜,楚晓文,白向阳,杨冰,吴旭东,王玺△
应用CRISPR/Cas9系统在G401细胞株中敲除p21基因
赵秀娟1,陈万标2,张沛涛1,张娜2,楚晓文3,白向阳4,杨冰1,吴旭东1,王玺1△
目的运用CRISPR/Cas9基因编辑技术,在人恶性横纹肌样瘤细胞株G401中敲除p21基因。方法通过反转录定量PCR(RT-qPCR)及Western blot检测各瘤细胞株中p21的表达,针对p21基因作用的功能域,设计了靶向人p21基因第3个外显子的向导RNA(sgRNA),克隆入lentiCRISPR v2载体。将测序及酶切鉴定正确的重组质粒在293T工具细胞中制备慢病毒颗粒并感染G401细胞,使用嘌呤霉素进行阳性细胞筛选,显微镜下挑取单克隆细胞团并继续培养获得G401单克隆细胞株。提取单克隆细胞株RNA及蛋白,利用RT-qPCR及Western blot方法检测细胞株中p21的敲除效果。结果p21在人横纹肌样瘤细胞中高表达。成功构建靶向p21基因的lentiCRISPR v2-sgRNA重组慢病毒质粒。与对照组相比,筛选得到的G401亚克隆细胞系中p21蛋白表达缺失。结论针对难转染的G401细胞,应用CRISPR/Cas9系统成功构建了p21基因敲除的稳定株,为后续深入研究p21在人恶性横纹肌样瘤中的作用机制奠定了基础。
横纹肌瘤;p21;基因敲除;CRISPR/Cas9;慢病毒
肿瘤的发生发展是由多基因共同参与的复杂过程,涉及多条信号通路。p21蛋白作为熟知的抑癌因子,通常以p53调控依赖的方式使细胞周期发生阻滞,属于细胞周期蛋白依赖性激酶抑制因子[1]。但后续有研究表明p21也可促进细胞增殖,发挥癌基因作用[2]。因此,p21在肿瘤中的作用及机制仍需进一步研究。CRISPR/Cas9(Clustered Regularly InterspacedShortPalindromicRepeats/CRISPR-associated 9)是基于细菌保护自身免受病毒感染的系统衍生而来,在细菌[3]、斑马鱼[4]、大鼠[5]以及人类细胞[6]中均表现出较强的基因组编辑活性。本实验是基于在人恶性横纹肌样瘤(malignant rhabdoid tumor,MRT)细胞中观察到的p21的表达,利用CRISPR/Cas9基因编辑系统中适用于难转染的细胞的慢病毒载体质粒,在感染靶细胞的同时产生向导RNA(sgRNA)靶向p21基因,并表达招募Cas9核酸酶对其进行切割,导致p21基因的敲除。G401细胞p21基因敲除稳定株的构建,为更加深入地研究p21在相关肿瘤中的作用机制奠定了基础。
1 材料与方法
1.1 实验材料
1.1.1 质粒、菌株及细胞质粒lentiCRISPR v2购自addgene公司。质粒图谱可于http://www.addgene.org网站查询。感受态细菌Stbl3购自北京全式金生物技术有限公司。人胚肾细胞株293T及人恶性横纹肌样瘤细胞株A204、G401、TTC642及BT16为本实验室存留。
1.1.2 酶类及主要试剂Fast Digest BsmBI、FastAP、10× FastDigest Buffer(Green)购自Fermentas公司;T4 PNK、T4 ligase、10×T4 Ligation Buffer、10 mmol/L ATP购自NEB公司;Plasmid Safe exonuclease、10×Plasmid Safe Buffer购自Epicentre公司;AxyPrep DNA凝胶回收试剂盒购自爱思进生物技术(杭州)有限公司;质粒大量提取试剂盒购自QIAGEN公司;DMEM高糖培养基、血清及双抗购自Gibco公司;兔源p21抗体,鼠源β-actin抗体及辣根过氧化物酶标抗鼠IgG、抗兔IgG购自CST公司;2xSYBR Green qPCR Mix购自Roche公司。
1.1.3 其他基因测序工作由华大科技公司完成。sgRNA寡链核苷酸(oligo)DNA序列由苏州金唯智生物科技有限公司合成。
1.2 方法
1.2.1 sgRNA oligo序列的设计利用http://www.ncbi.nlm. nih.gov/网站确定针对p21 CDs区基因序列,sgRNA序列设计参考http://crispr.mit.edu/网站。设计原则如下:(1)首选第1个外显子进行序列分析设计靶点,若exon1<100 bp,则顺延选择合适大小的外显子。(2)根据网站分析反馈的结果,选择分数较高的一对序列,去掉PAM序列碱基。(3)sgRNA的5′端第1个碱基若不是G,则需要在前面补G。(4)以sgRNA序列为模版,设计出其互补链,在其两端加上酶切位点。即在每条sgRNA序列F链的5′端添加CACC,R链的5′端添加AAAC。以下将lentiCRISPRv2重组质粒简称为v2-p21。
1.2.2 lentiCRISPR v2-p21的构建与鉴定lentiCRISPR v2为含U6启动子的sgRNA骨架慢病毒表达载体,既表达具有Cas9切口酶,又带有氨苄青霉素和嘌呤霉素抗性。(1)lentiCRISPR v2载体线性化:用Fast Digest BsmBI对v2进行酶切,DNA凝胶电泳后回收线性化的载体。(2)sgRNA的合成及形成二聚体:用T4 PNK对oligo进行磷酸化并使用梯度退火形成二聚体。(3)sgRNA二聚体与v2线性载体连接:v2载体和退火产物比例为1∶3,室温(25℃)反应60 min。(4)重组质粒纯化:使用质粒保护的核酸外切酶去除非特异连接。(5)转化感受态细菌Stbl3,在氨苄抗性的LB平板上筛选克隆。挑取阳性克隆摇菌,送测序。(6)酶切验证:使用Fast Digest BsmBI对v2质粒载体、v2-p21进行酶切。酶切后,使用1%的琼脂糖凝胶电泳对酶切产物进行鉴定。测序正确的克隆提取重组质粒v2-p21。
1.2.3 病毒包装、细胞感染及单克隆细胞的获得培养293T工具细胞,待细胞汇合度达到90%左右进行磷酸钙转染,转染前2 h换新鲜的含10%灭活血清的DMEM高糖培养基,配置磷酸钙转染复合物:管A中为CaCl2和DNA的混合液,其中vector∶VSVG∶psPAX2为10∶3.5∶6.5,余体积用水补足;管B中为2×HBS,与管A体积相等。将B中液体逐滴加入A中并不断混匀,室温放置10 min后,将转染复合物缓慢均匀加入293T细胞中。转染16 h内给293T细胞换新鲜培养基,48 h后开始收集含病毒的培养基,连续收集2次。感染前24 h将G401细胞接种至6 cm培养皿中,感染时将收集的病毒上清(含polybrene 8 mg/L)加入到靶细胞中,感染8~12 h后更换新鲜培养基,感染48 h后加入嘌呤霉素筛选(2 mg/L)。筛选48 h后消化细胞,计数400个单细胞接种于10 cm培养皿中,待生长1周左右获得单细胞集落,在显微镜下挑取细胞团接种至24孔板继续培养。
1.2.4 Western blot及反转录定量PCR(RT-qPCR)检测p21的表达培养人MRT细胞株及对照细胞293T,收集各株细胞,一部分用RIPA裂解细胞获得全细胞裂解液,离心取上清作为样品。测定样品蛋白浓度,取等量蛋白样品进行SDSPAGE电泳,经半干转印至NC膜后,5%脱脂牛奶封闭,一抗、二抗孵育,加入曝光底物进行曝光,以β-actin为内参。收集的另一部分细胞用Trizol法提取细胞总RNA,去除基因组DNA,再逆转成cDNA。设计扩增p21基因的qPCR引物,进行RT-qPCR扩增检测p21在细胞中的表达,β-actin作为内参,内参与目的基因的退火温度均为60℃。同样,野生型G401细胞和测序正确的单克隆细胞被收集用于Western blot及RT-qPCR扩增,进而检测p21在细胞中的表达情况,比较野生型和p21基因敲除细胞中p21的表达差异。具体操作同上。
1.3 统计学方法采用SPSS 19.0统计软件进行分析,计量资料采用均数±标准差表示,多组间均数比较采用方差分析,组间多重比较采用LSD-t法,两个样本的组间比较采用独立样本的t检验,P<0.05为差异有统计学意义。
2 结果
2.1 p21在人MRT细胞中的表达RT-qPCR结果显示,p21的mRNA表达水平在对照及瘤细胞株中的差异有统计学意义(n=6,F=747.367,P<0.01)。4株人恶性横纹肌样瘤细胞中p21的mRNA表达水平(分别为2.776±0.135、5.153±0.126、4.866±0.150、5.966±0.330)均高于对照细胞(0.993±0.015,均P<0.01),见图1A。Western blot结果显示,p21蛋白在对照细胞和肿瘤细胞中表达变化与mRNA水平一致,见图1B。
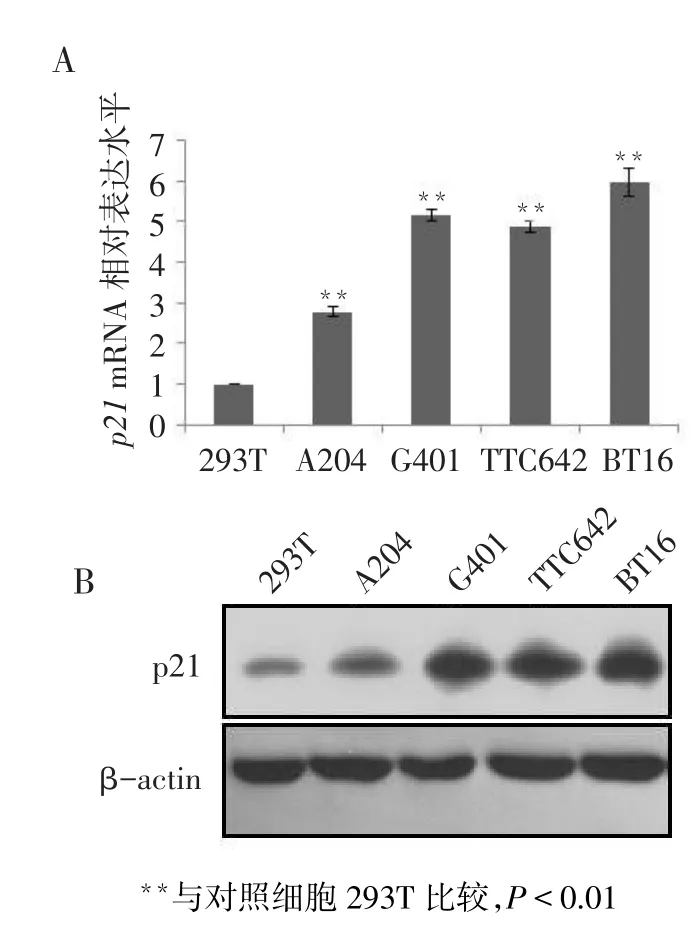
Fig.1The expression of p21 in MRT cell lines图1 p21在MRT细胞株中的表达
2.2 sgRNA靶点的选择及寡核苷酸序列人p21基因前2个外显子区太短,因此选取此基因的第3个外显子区进行sgRNA设计,挑选脱靶效应最低的sgRNA合成,单链DNA模板序列见表1。

Tab.1The sequences of hp21 sgRNA oligo and RT-qPCR primer表1 hp21 sgRNA及RT-qPCR引物序列
2.3 重组质粒lentiCRISPR v2-p21的测序及酶切酶切鉴定结果见图2A,成功构建的质粒不含有BsmBI酶切位点,因此不能被切割为线性。测序结果见图2B,插入序列的位置、方向均正确,重组质粒构建成功。
2.4 Western blot及RT-qPCR检测p21基因敲除的效果同G401野生型细胞相比,G401-p21-KO单克隆细胞中未检测到p21蛋白表达,表明G401细胞p21基因敲除稳定株构建成功,见图3A。相比于野生型G401细胞,G401-p21-KO单克隆细胞中p21 mRNA表达降低(n=6,1.000±0.020 vs.0.157± 0.010,t=63.234,P<0.01),见图3B。
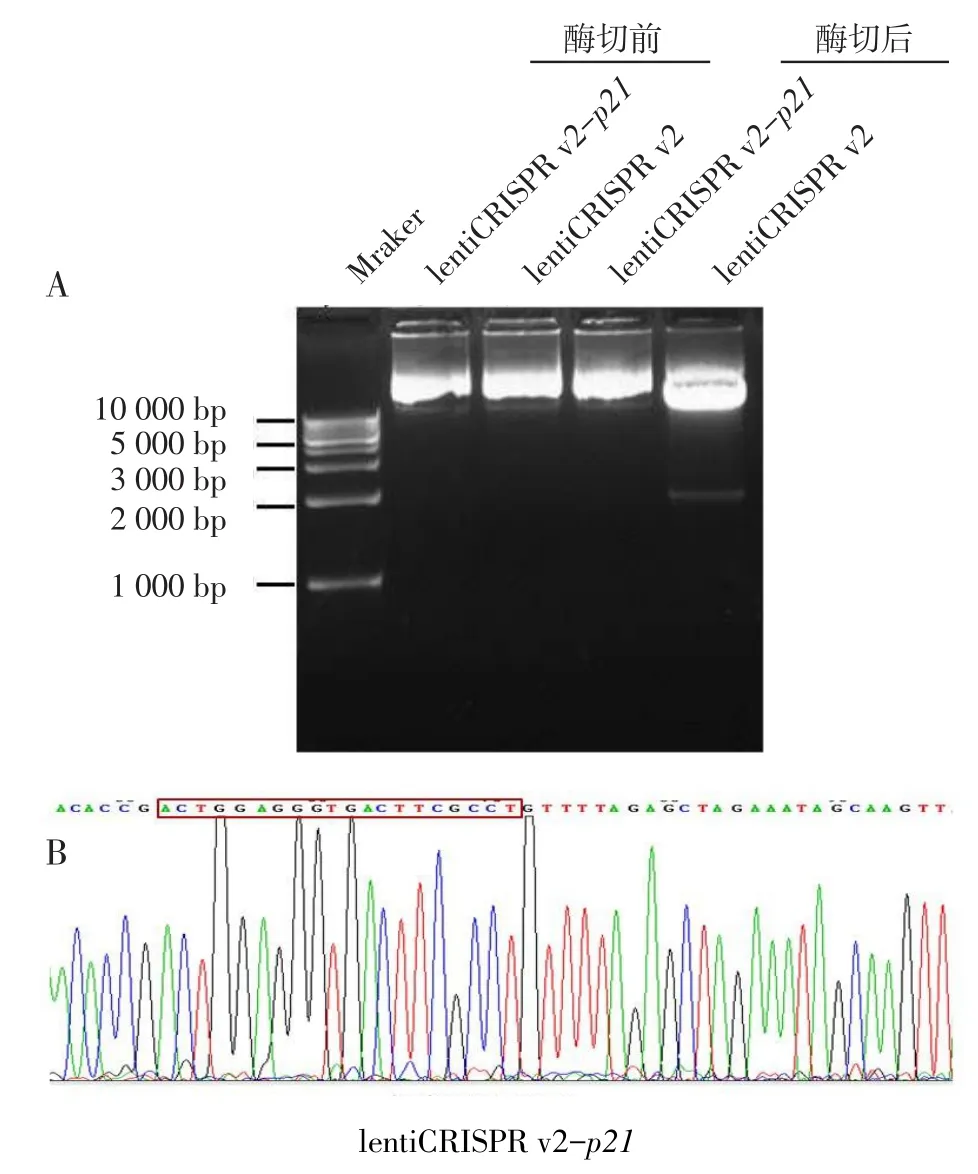
Fig.2The enzyme digestion and sequencing of recombinant eukaryotic expressional plasmid图2 重组真核表达质粒的酶切和测序结果
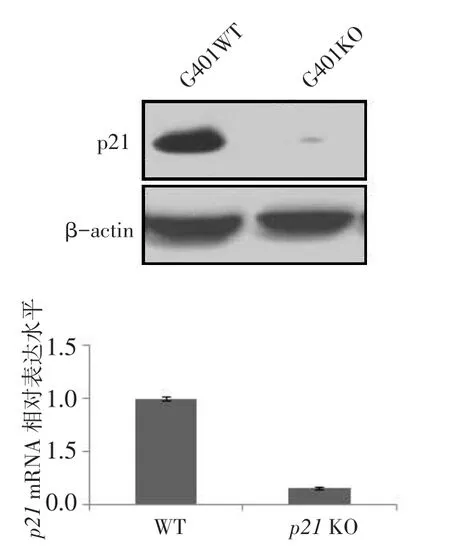
Fig.3Protein and mRNA expression analysis of p21 KO图3 p21敲除后蛋白及mRNA表达水平结果
3 讨论
3.1 p21在肿瘤中的双重作用自从1993年首次发现p21作为抑癌基因p53的抑癌活性的介导者以来[7],越来越多的文献报道了p21在肿瘤中的相关作用。首先利用Cdkn1a敲除致瘤的小鼠模型,Martin-Caballero等[8]研究表明细胞周期调控子p21发挥抑癌作用,随后系列研究报道了多种肿瘤包括结肠癌[9]、宫颈癌[10]、肺癌[11]等均与p21的低表达有关。进一步研究发现在ras基因突变或暴露于致癌物的小鼠联合p21基因突变会导致肿瘤的发生[12],表明p21可能不是经典的抑癌基因。与之相反,p21被发现在多种情况下还具有癌基因的作用。研究发现p21不仅过表达于各种人类肿瘤如膀胱癌、乳腺癌等,还随肿瘤的发生发展表达上调,与患者的预后密切相关[13]。具有双重角色的p21蛋白在肿瘤进展的研究中可能作为新范本,即其作用不是永恒的,而是由其所处的特殊细胞内环境决定的。近年来,有研究者发现p21的这种功能多样性与其在细胞中的定位相关,即p21表达在胞浆具有抗凋亡作用,而抑制细胞增殖与促进凋亡与其核定位有关[14]。MRT是一种好发于婴幼儿和儿童的比较少见但高度恶性的肿瘤,大多发生于肾、软组织及中枢神经系统[15]。本研究显示p21高表达于MRT多种细胞株中,提示p21在其中可能发挥重要的作用。目前关于p21在MRT中的作用及机制仍不清楚,需进一步研究。
3.2 CRISPR/Cas9慢病毒系统本实验利用CRISPR/Cas9系统来完成对G401细胞中p21基因的靶向性敲除,包括选择一个靶区域、构建慢病毒载体、优化转染等。CRISPR/Cas9系统是新一代的基因定向编辑技术,相比于锌指核酸内切酶(zinc finger endonuclease,ZFN)[16]和类转录激活因子效应物核酸酶(transcription activator-like effector nuclease,TALEN)[17]等经典的基因打靶技术,具有操作简单、制备周期短、成本低、可同时沉默任意数量的单个基因等优点[18]。此外,CRISPR/Cas9技术与TALEN和ZFN技术相比在降低脱靶效应方面也具有一定的优越性。在CRISPR/Cas9系统中,通过设计及预测出具有最小脱靶率的特异sgRNA,将其导入细胞,对目的基因进行靶标并招募Cas9蛋白进行切割,导致细胞通过非同源性末端接合(nonhomologousendjoining,NHEJ)和同源重组(homology directedrepair,HDR)机制进行DNA修复。在修复过程中断裂的位点处会发生插入或缺失部分片段,产生框移突变,从而达到敲除目的基因的作用[19]。由于CRISPR/Cas9技术的高效实用性,其在各种细胞模型中被广泛应用。将目的序列连接到载体并转染至靶细胞是获得长期稳定表达细胞株的首要步骤。目前,转染目的细胞常用的基因导入载体主要包括质粒载体和病毒载体。对于转染效率较高的细胞通常选择质粒载体便可达到理想效果[20]。与质粒载体相比,病毒载体具有转染率高、目的基因长期稳定表达及适用范围广等优势。其中慢病毒载体系统是目前基础和临床应用研究中使用最广泛的一类载体,尤其适用于干细胞、原代细胞及难转染的细胞株。本实验使用lentiCRISPR v2质粒作为载体,该质粒不仅可以同时表达Cas9和插入的sgRNA,简化了表达Cas9质粒和sgRNA质粒共转染的步骤,而且还含有嘌呤霉素(puromysin)抗性筛选标记,转染后通过药物筛选得到阳性克隆。最重要的是其具有慢病毒载体骨架,能够通过病毒包装产生慢病毒颗粒导入低转染率的目的细胞。CRISPR/Cas9介导的基因组编辑技术是目前成功广泛应用的热门技术,其在简易克隆和多重基因组编辑方面有着很大优势,为利用基因疗法治疗疾病提供了新方法,在医学领域具有广阔的发展前景。
本研究构建的p21基因稳定敲除细胞株,为后续研究p21在人MRT发生发展中的作用及机制提供了工具,也为制定相应的治疗策略、提高患者预后奠定了基础。
[1]Deng C,Zhang P,Harper JW,et al.Mice lacking p21CIP1/WAF1 undergo normal development,but are defective in G1 checkpoint control[J].Cell,1995,82(4):675-684.
[2]Abbas T,Dutta A.p21 in cancer:intricate networks and multiple activities[J].Nat Rev Cancer,2009,9(6):400-414.doi:10.1038/ nrc2657.
[3]Wiedenheft B,Sternberg SH,Doudna JA.RNA-guided genetic silencing systems in bacteria and archaea[J].Nature,2012,482(7385):331-338.doi:10.1038/nature10886.
[4]Chang N,Sun C,Gao L,et al.Genome editing with RNA guided Cas9 nuclease in zebrafish embryos[J].Cell Res,2013,23(4): 465-472.doi:10.1038/cr.2013.45.
[5]Ma Y,Zhang X,Shen B,et al.Generating rats with conditional alleles using CRISPR/Cas9[J].Cell Res,2014,24(1):122-125. doi:10.1038/cr.2013.157.
[6]Ramalingam S,Annaluru N,Chandrasegaran S.A CRISPR way to engineer the human genome[J].Genome Biol,2013,14(2):107. doi:10.1186/gb-2013-14-2-107.
[7]el-Deiry WS,Tokino T,Velculescu VE,et al.WAF1,a potential mediator of p53 tumor suppression[J].Cell,1993,75(4):817-825.
[8]Martin-Caballero J,Flores JM,Garcia-Palencia P,et al.Tumor susceptibility of p21(Waf1/Cip1)-deficient mice[J].Cancer Res,2001,61(16):6234-6238.
[9]Bukholm IK,Nesland JM.Protein expression of p53,p21(WAF1/ CIP1),bcl-2,Bax,cyclin D1 and pRb in human colon carcinomas[J].Virchows Arch,2000,436(3):224-228.
[10]Kim YT,Zhao M.Aberrant cell cycle regulation in cervical carcinoma[J].Yonsei Med J,2005,46(5):597-613.doi:10.3349/ ymj.2005.46.5.597.
[11]Huang CL,Yokomise H,Miyatake A.Clinical significance of the p53 pathway and associated gene therapy in non-small cell lung cancers[J].Future Oncol,2007,3(1):83-89.doi:10.2217/ 14796694.3.1.83.
[12]Gartel AL.Is p21 an oncogene?[J].Mol Cancer Ther,2006,5(6): 1385-1386.doi:10.1158/1535-7163.
[13]Gartel AL.p21WAF1/CIP1and cancer:A shifting paradigm?[J]. BioFactors,2009,35(2):161-164.doi:10.1002/biof.26.
[14]Ohkoshi S,Yano M,Matsuda Y.Oncogenic role of p21 in hepatocarcinogenesis suggests a new treatment strategy[J].World J Gastroenterol,2015,21(42):12150-12156.doi:10.1038/ nrc2657.
[15]Biegel JA,Kalpana G,Knudsen ES,et al.The role of INI1 and the SWI/SNF complex in the development of rhabdoid tumors:meeting summary from the workshop on childhood atypical teratoid/rhabdoid tumors[J].Cancer Res,2002,62(1):323-328.
[16]Sander JD,Dahlborg EJ,Goodwin MJ,et al.Selection-free zincfinger-nucleaseengineeringbycontextdependentassembly(CoDA)[J].Nat Methods,2011,8(1):67-69.doi:10.1038/ nmeth.1542.
[17]Sanjana NE,Cong L,Zhou Y,et al.A transcription activator-like effector toolbox for genome engineering[J].Nat Protoc,2012,7(1): 171-192.doi:10.1038/nprot.2011.431.
[18]Yu Z,Ren M,Wang Z,et al.Highly efficient genome modifications mediated by CRISPR/Cas9 in Drosophila[J].Genetics,2013,195(1):289-291.doi:10.1534/genetics.113.153825.
[19]Nishimasu H,Ran FA,Hsu PD,et al.Crystal structure of Cas9 in complex with guide RNA and target DNA[J].Cell,2014,156(5): 935-949.doi:10.1016/j.cell.2014.02.001.
[20]Fang JP,Zhao XJ,Qi Y,et al.Construction of Asxl2 gene knock out stable NIH3T3 cell line with CRISPR/Cas9n system[J].Tianjin Med J,2015,43(10):1104-1107.[方佳萍,赵秀娟,齐艳,等.利用CRISPR/Cas9n系统构建Asxl2基因敲除的NIH3T3稳定细胞系[J].天津医药,2015,43(10):1104-1107].doi:10.11958/j. issn.0253-9896.2015.10.005.
(2016-08-02收稿2016-08-24修回)
(本文编辑李鹏)
Study on p21 gene knock out in G401 cell line by using CRISPR/Cas9 system
ZHAO Xiujuan1,CHEN Wanbiao2,ZHANG Peitao1,ZHANG Na2,CHU Xiaowen3,
BAI Xiangyang4,YANG Bing1,WU Xudong1,WANG Xi1△1 Department of Cell Biology,School of Basic Medical Sciences,2 School of Biomedical Engineering,Tianjin Medical University,Tianjin 300070,China;3 The 66350 Military Medical Team,Lingyun Street,Lianchi District,Baoding City,Hebei Province;4 Dealiner Bioelectronics LLC,Jiangyin△
ObjectiveTo knock out p21 gene in human malignant rhabdoid tumor(MRT)cell line G401 by using CRISPR/Cas9 genome engineering technology.MethodsThe expression of p21 was detected by reverse transcription quantitative PCR(RT-qPCR)and Western blot assay in several MRT cell lines.The guide RNA was designed by targeting the third exon of p21 gene,which encoded its home domains,and then subcloned into lentiCRISPR v2 vector and validated sequencing.The validated plasmids were further used to package and produce the lentivirus in 293T cells,and the G401 cells were infected,then puromycin was used to screen positive cells,and the clusters of G401 monoclonal cells,were obtained by selecting monoclonal cells and culturing under the microscope.The RNA and protein of new clonal cell line were extracted,and RT-qPCR and Western blot assay were applied to confirm whether p21 was successfully knocked out. ResultsThe p21 was highly expressed in MRT tumor cells.The CRISPR/Cas9 lentivirus plasmids,targeted p21 gene were successfully constructed.Compared with negative control group,the expression of p21 was not detected in G401 monoclonal cells,which were successfully screened.ConclusionIn view of the difficult transfection of cells such as G401,p21 knockout stable cell line has been successfully constructed by using CRISPR/Cas9 system,which lays the foundation for further study of the mechanism of p21 in MRT tumors.
rhabdomyoma;p21;gene knockout;CRISPR/Cas9;lentivirus
R73,R349.64
A
10.11958/20160731
天津市高等学校科技发展基金计划项目(093-201301);天津市自然科学基金青年项目(16JCQNJC10300,16JCQNJC12100);国家自然科学基金资助项目(81500170)
1天津医科大学基础医学院细胞生物学系(邮编300070),2生物医学工程与技术学院;3河北省保定市莲池区凌云街66350部队卫生队;4江阴迪林生物电子技术有限公司
赵秀娟(1983),女,博士,讲师,主要从事肿瘤的表观遗传学研究
△通讯作者E-mail:wangxi@tmu.edu.cn
