绿花百合胚性愈伤组织诱导与植株再生研究
2016-11-10王元忠黄衡宇
高 洁 王元忠 黄衡宇*
(1.云南中医学院中药材优良种苗繁育工程研究中心,昆明 650500; 2.云南省农业科学院药用植物研究所,昆明 650200)
绿花百合胚性愈伤组织诱导与植株再生研究
高 洁1王元忠2黄衡宇1*
(1.云南中医学院中药材优良种苗繁育工程研究中心,昆明 650500;2.云南省农业科学院药用植物研究所,昆明 650200)
建立绿花百合(LiliumfargesiiFranch.)胚性愈伤组织诱导体系,为保护和合理利用这一重要植物资源提供高效、稳定的再生技术途径。以绿花百合鳞片为外植体,通过正交实验研究不同激素种类及其质量浓度对绿花百合胚性愈伤组织诱导、胚状体和小鳞茎分化及植株再生的影响。结果表明:较适宜诱导胚性愈伤组织的培养基为MS+6-BA 0.5 mg·L-1+NAA 0.5 mg·L-1+2,4-D 0.1 mg·L-1,出愈率达89.29%,小鳞茎发生系数亦达4.7;胚性愈伤组织增殖及小鳞茎发生培养基为MS+6-BA 1.0 mg·L-1+2,4-D 0.1 mg·L-1,繁殖倍数5.0/35 d;根的诱导则在1/2MS+NAA 0.2 mg·L-1的培养基上进行,生根率达100%,幼苗移栽至排水良好的沙土中,保温保湿培养35 d后,成活率可达90%以上。本研究为保持绿花百合优良品种特性、种苗繁育提供了有效途径,也为保护其野生资源,发展人工栽培和利用胚状体进行无性育种奠定了基础。
绿花百合;胚性愈伤组织;小鳞茎;组织培养
中国百合属(Lilium)植物资源非常丰富,特有种多且分布广,其中有很多观赏、食用价值很高的种类是世界百合杂交育种不可多得的原始材料[1]。百合的传统繁殖方式主要有珠芽繁殖、小子球繁殖和鳞片繁殖等3种方式,其中通过鳞片繁殖获得的百合品质最佳。组织培养由于繁殖系数高而成为百合重要的人工繁殖方式之一,通过组织培养快速得到量大质佳的种苗是世界百合产业的一大趋势[2]。
绿花百合(LiliumfargesiiFranch.)是我国特有植物,花绿白色,花瓣上有稠密的紫褐色斑点,气味芳香,观赏性强[3],其科学研究和开发利用价值极高,是百合品种选育的重要资源[4]。本文采用绿花百合鳞茎片为外植体,通过诱导胚性愈伤组织和小鳞茎建立其植株再生体系,以期为绿花百合种质资源保存、基因工程及遗传育种提供有益参考。
1 植物材料
供试材料采自云南省农业科学研究院药用植物研究所昆明小哨药用植物资源圃,经云南中医学院钱子刚教授鉴定为绿花百合(L.fargesiiFranch.)。
2 方法
2.1 外植体的选择与处理
取健康植株的地下鳞茎作为外植体,用自来水洗去污物,5%洗衣粉溶液(质量浓度)漂洗10 min,再用清水反复冲洗干净,然后置于超净工作台内进行消毒灭菌。先用75%乙醇(体积浓度)浸泡10 s,再转入0.1%升汞溶液(质量浓度)中浸泡10 min,无菌水冲洗6~8次,每次不低于2 min。在超净工作台中将消毒好的鳞片切成约0.8 cm×0.8 cm方块接种于诱导培养基上,将培养出来的胚性愈伤组织切成小块,接种于愈伤组织增殖及小鳞茎诱导培养基上;最后将形成的分化苗移至生根培养基上,以培养出完整的小植株。
2.2 培养基
以MS为基本培养基,蔗糖3%(30 g·L-1),琼脂4.5 g·L-1,培养基pH值5.8~6.0。3种植物激素6-BA、NAA和2,4-D的母液质量浓度均为0.1 mg·mL-1。培养基121℃灭菌22 min备用。
胚性愈伤组织和小鳞茎的诱导培养基:在MS中添加不同质量浓度的6-BA(A)、NAA(B)和2,4-D(C),采用L9(34)正交试验,考察不同激素组合对诱导胚性愈伤组织及小鳞茎发生的影响(表1)。将消毒好的鳞片外植体分别接入不同培养基中,35 d后统计胚性愈伤组织出愈率和小鳞茎发生系数。
增殖培养基:以6-BA和2,4-D为外源激素,采用完全组合实验,将诱导出的胚性愈伤组织分割成1.0 cm×1.0 cm大小,分别接种于完全组合培养基中,每种培养基接种10瓶,每瓶3个胚性愈伤组织块,35 d后分别统计愈伤组织增殖系数及小鳞茎发生系数。
表1绿花百合诱导胚性愈伤组织L9(34)正交设计
Table1L9(34)orthogonaldesignforembryoniccallusinductioninL.fargesii
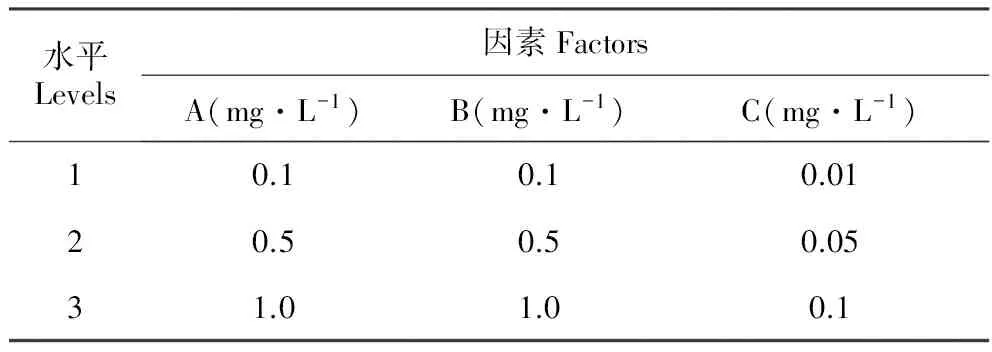
水平Levels因素FactorsA(mg·L-1)B(mg·L-1)C(mg·L-1)10.10.10.0120.50.50.0531.01.00.1
生根培养基:分别采用附加0、0.1、0.2、0.5、1.0 mg·L-1NAA的1/2MS培养基作为促进瓶苗生根的培养基。选取生长健壮且长势基本一致,高3~4 cm的小植株接入生根培养基中,每种培养基接种10瓶,每瓶3个小植株,35 d后统计生根率。
2.3 培养条件
培养室温度控制在(20±1)℃,光照度1 500~2 000 lx,光照时间12 h·d-1。
2.4 再生苗移栽
当再生植株高度达5~8 cm,且根系生长良好,苗长势健壮,先在温室大棚中闭口练苗7 d,开口炼苗2 d,再从培养瓶中取出苗,用清水洗净根部的培养基,移栽于蛭石、珍珠岩、细河沙等成分的混合基质中,10 d内塑料薄膜覆盖,确保湿度为70%~90%,温度20℃左右,35 d后统计成活率。
2.5 统计指标
愈伤组织诱导率(%)=产生胚性愈伤组织的外植体数/接种外植体总数
(1)
小鳞茎发生率(%)=产生小鳞茎愈伤组织数/接种胚性愈伤组织总数
(2)
小鳞茎发生系数=产生的小鳞茎总数/接种外植体总数
(3)
愈伤组织增殖系数=愈伤组织分割块数/起始接种愈伤组织块数
(4)
生根率(%)=产生根的小鳞茎丛苗/接种小鳞茎丛苗总数
(5)
所得数据采用Excel和SPSS(19.0)软件处理分析。
3 结果与分析
3.1 愈伤组织和小鳞茎的诱导
将消毒好的鳞片外植体接种于正交实验设计的培养基中,统计结果见表2,方差分析结果见表3~4。
表2绿花百合初始诱导培养L9(34)正交试验设计与结果
Table2ResultsofcallusinductionforL.fargesiibyL9(34)orthogonaltest
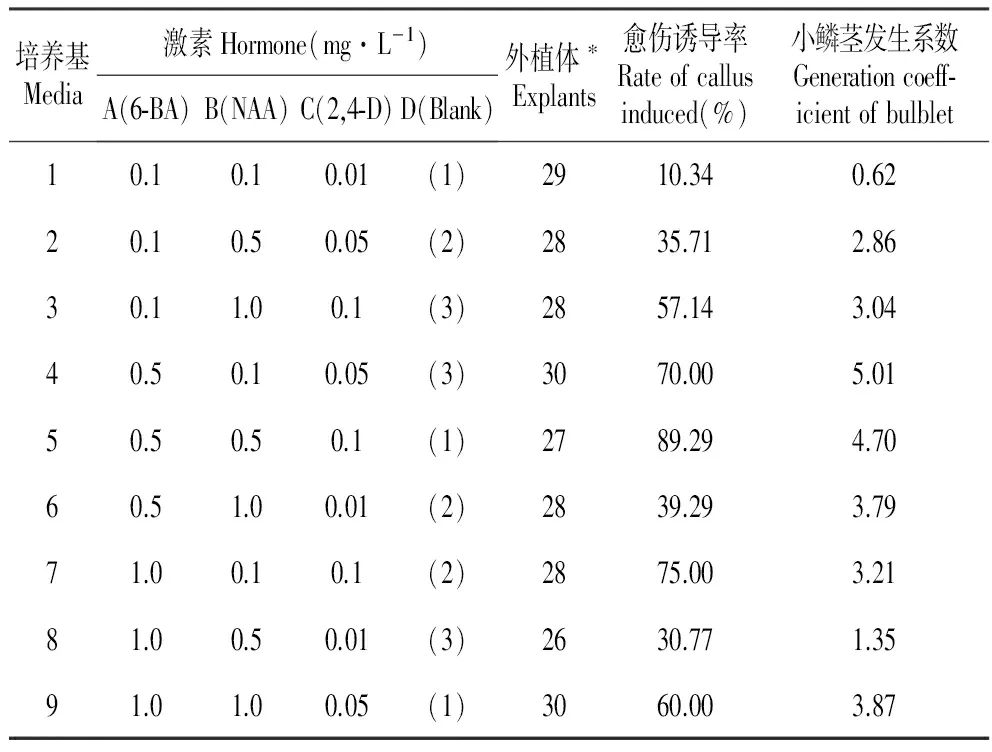
培养基Media激素Hormone(mg·L-1)A(6⁃BA)B(NAA)C(2,4⁃D)D(Blank)外植体∗Explants愈伤诱导率Rateofcallusinduced(%)小鳞茎发生系数Generationcoeff⁃icientofbulblet10.10.10.01(1)2910.340.6220.10.50.05(2)2835.712.8630.11.00.1(3)2857.143.0440.50.10.05(3)3070.005.0150.50.50.1(1)2789.294.7060.51.00.01(2)2839.293.7971.00.10.1(2)2875.003.2181.00.50.01(3)2630.771.3591.01.00.05(1)3060.003.87
注:*除去污染数的实际外植体数,下同。
Note:*excepting the numbers of pollution,the same as below.
表3绿花百合愈伤组织诱导方差分析结果
Table3VarianceanalysisofcallusinductioninL.fargesii

方差来源SourceⅢ型平方和Sumofsquare自由度df均方MeansquareF值Fvalue显著性Sig.A(6⁃BA)1565.782782.9089.04P<0.05B(NAA)0.2020.100.01P>0.05C(2,4⁃D)3363.5521681.78191.28P<0.01空白Blank17.5928.79
表4绿花百合小鳞茎发生系数方差分析结果
Table4VarianceanalysisofGenerationcoefficientofbulbletinL.fargesii

方差来源SourceⅢ型平方和Sumofsquare自由度df均方MeansquareF值Fvalue显著性Sig.A(6⁃BA)8.6524.32109.65P<0.01B(NAA)0.7520.379.45P>0.05C(2,4⁃D)7.0223.5189.02P<0.05空白Blank0.0820.39
愈伤组织诱导方差分析(表3)显示,2,4-D对愈伤组织有极显著影响(P<0.01),6-BA亦有显著影响(P<0.05),而NAA则无显著影响(P>0.05)。由6-BA、2,4-D 3个水平的Duncan检验(表5)可知,6-BA和2,4-D 3个水平间在愈伤组织诱导率上均有显著性差异(P<0.05);6-BA水平2(0.5 mg·L-1)与水平1(0.1 mg·L-1)差异极显著(P<0.01),2,4-D水平2(0.05 mg·L-1)、3(0.1 mg·L-1)与水平1(0.01 mg·L-1)差异亦极显著(P<0.01),说明6-BA和2,4-D不同质量浓度对愈伤组织诱导影响很大。通过平均值分析可知,绿花百合愈伤组织最佳激素组合为A2C3,即6-BA 0.5 mg·L-1+2,4-D 0.1 mg·L-1。
表56-BA、2,4-D不同水平Duncan检验
Table5Duncan’stestindifferentlevelsof6-BAand2,4-D

ItemsFactorsLevelsMean0.05level0.01level愈伤组织诱导Callusinduction6⁃BA2,4⁃D266.19aA355.26bAB134.4cB373.81aA255.24bA126.8cB小鳞茎发生Bulbletsgeneration6⁃BA2,4⁃D24.50aA32.81bB12.17bB23.91aA33.65aA11.92bB
注:同列不同小写字母表示差异显著(0.05水平);不同大写字母表示差异极显著(0.01水平),下同。
Note:The different lowercase letters in the same column indicated the significant difference at 0.05;the different uppercase letters in the same column indicated the significant difference at 0.01.The same as below.
小鳞茎发生系数方差分析结果(表4)显示,6-BA对小鳞茎发生有极显著影响(P<0.01),2,4-D亦有显著影响(P<0.05)。Duncan检验(表5)表明,6-BA和2,4-D无论在0.05或0.01水平,各质量浓度反映出的效应是相同的。6-BA对小鳞茎发生系数影响最大的是水平2(0.5 mg·L-1),与水平1(0.1 mg·L-1)、水平3(1.0 mg·L-1)呈极显著差异(P<0.01),它的均值显著地高于其它两个水平;2,4-D对小鳞茎发生系数影响最大的是水平2(0.05 mg·L-1)和水平3(0.1 mg·L-1),它们和水平1(0.01 mg·L-1)均具极显著差异(P<0.01)。NAA虽无显著影响(P>0.05)但具协同作用。通过平均值分析可知,绿花百合愈伤组织最佳激素组合为A2B1C2,即6-BA 0.5 mg·L-1+NAA 0.1 mg·L-1+2,4-D 0.05 mg·L-1。
从综合效应来看,本研究重点放在愈伤组织诱导上,故采用A2B2C3,即5号培养基MS+6-BA 0.5 mg·L-1+NAA 0.5 mg·L-1+2,4-D 0.1 mg·L-1作为绿花百合愈伤组织和小鳞茎同步诱导培养基,在此培养基中培养7 d后,鳞茎基部开始膨大,出现芽点(图1:A);培养21 d后,鳞片切口产生小鳞茎(图1:B);培养30 d后,在小鳞茎周围出现黄绿色、排列紧密、具有颗粒状的愈伤组织(图1:C~D),表明绿花百合属于体细胞胚胎发生型。实验中观察到两种类型的愈伤组织:黄绿色、细胞排列紧密、形状规则并有颗粒状突起的愈伤组织(图1:C~D);灰白色、排列无序、松散的愈伤组织(图1:E)。前者具有胚性愈伤组织的基本特点,而后者则为发育畸形的非胚性愈伤组织。

图1 愈伤组织和小鳞茎的诱导 A.培养7 d后,外植体基部膨大;B.培养21 d后形成的小鳞茎;C~D.黄绿色、细胞排列紧密、形状规则的胚性愈伤组织;E.灰白色、排列无序、松散的非胚性愈伤组织Fig.1 Induction of callus and bulblets A. Explant base enlargement after 7 d culture; B. Bulblets produced after 21 d culture; C-D. Closely-packed shape-rule yellow-green embryonic callus; E. Friable disorderly gray non-embryonic callus
3.2 增殖培养
根据愈伤组织和小鳞茎诱导培养结果,选择6-BA和2,4-D作为外源激素进行愈伤组织增殖和小鳞茎发生培养。将诱导出的胚性愈伤组织(培养35~40 d)切割成适当大小(1.0 cm×1.0 cm),接种于附加6-BA和2,4-D的完全组合培养基中,培养结果见表6。
表6通过完全组合试验筛选绿花百合增殖培养基的结果
Table6EffectsofselectingproliferationmediumthroughsinglefactorexperimentdesigninL.fargesii

培养基Media激素Hormone(mg·L-1)6⁃BA2,4⁃D接种数Explants小鳞茎发生系数Generationcoefficientofbulblet愈伤组织增殖系数Regenerationcoefficientofcallus1000210e0f110.50.1271.89±0.65c2.86±1.47bc120.50.2300.96±0.52d2.33±1.25c130.50.5301.32±0.58c1.90±1.16cd141.00.1303.98±1.37a5.00±2.34a151.00.2273.50±1.12a4.42±1.97a161.00.5272.88±1.26b3.28±1.86b171.50.1301.63±0.63c1.73±1.21de181.50.2271.40±0.61cd1.56±1.18de191.50.5301.07±0.36d1.40±1.03e
从表6中可知,在14号培养基MS+6-BA 1.0 mg·L-1+2,4-D 0.1 mg·L-1和15号培养基MS+6-BA 1.0 mg·L-1+2,4-D 0.2 mg·L-1中愈伤组织增殖系数较高,分别达5.00和4.42;小鳞茎发生系数亦较高。但后期在15号培养基中部分胚性愈伤组织生长过快而导致分化或失去胚性状态,不利于胚性愈伤组织增殖和小鳞茎形成。
将黄绿色、质地紧密的愈伤组织转接至MS+6-BA 1.0 mg·L-1+2,4-D 0.1 mg·L-1培养基中培养10 d后,转变为淡黄色、松散并有绿色颗粒物产生的胚性愈伤组织(图2:A),绿色颗粒状小体即为胚性愈伤组织产生的体细胞胚(图2:B~C);培养21 d后,体细胞胚迅速生长,形成小鳞茎前体(图2:D);27 d后,形成小鳞茎(图2:E~F),随后分化出叶片形成小植株(图2:G);培养35 d后,小植株生长迅速,在其基部又形成胚性愈伤组织,继而再产生体细胞胚和小植株(图2:H),形成连续的增殖再生体系。
3.3 生根与移栽
选取生长健壮且长势基本一致,高3~4 cm的小植株接入附加0、0.1、0.2、0.5、1.0 mg·L-1NAA的1/2MS培养基中进行生根培养。结果表明,即使在未加激素的空白培养基中,小植株的生根率亦达70%以上,其他附加不同质量浓度NAA的培养基中生根率均达90%以上,且根系粗壮多根毛,材料基部基本无愈伤组织;各组间生根率和生长势均无显著性差异(表7)。其中,1/2MS+NAA 0.2 mg·L-1生根率达100%,故选用此培养基作为绿花百合瓶苗生根培养基。生根培养35 d后,幼苗移栽成活率达90%以上。

图2 胚性愈伤组织的增殖与小鳞茎的形成 A.转接10 d后形成的胚性愈伤组织;B~C.体细胞胚;D.小鳞茎前体;E~F.小鳞茎;G.分化出叶片的小植株;H.继代苗基部不断产生小鳞茎形成的小植株Fig.2 Regeneration of embryonic callus and formation of bulblets A. Embryonic callus formation after 10 d culture; B-C. Somatic embryos; D. Pre-bulblet; E-F. Bulblets; G. Leaves differentiated plantlet; H. Plantlet from bulblets of the base of subculture seedlings

培养基MediumNAA(mg·L-1)接种数∗No.ofinoculations生根率Rootingrate(%)根系状况Rootingcondition20(CK)03076.67b根长细,根毛少,基部偶有少量愈伤Rootslong,slender,lesshairs;thebasehasasmallamountcallus210.12796.29a根长且较壮,多根毛,基部无愈伤Rootslongandlessstrong,multi-hairs;thebasehasnocallus220.230100.00a根长且较壮,多根毛,基部无愈伤Rootslongandlessstrong,multi-hairs;thebasehasnocallus230.53093.33a根长且壮,多根毛,基部无愈伤Rootslongandstrong,multi-hairs;thebasehasnocallus241.02792.59a根长且壮,多根毛,基部无愈伤Rootslongandstrong,multi-hairs;thebasehasnocallus
4 讨论
影响胚性愈伤组织发生的因素很多,例如光照、基因型、外植体种类、渗透压、氮源、碳源、激素和天然附加物等[5]。对绿花百合来说,激素配比在其胚性愈伤组织增殖和形成体细胞胚上尤为重要,由体细胞胚形成小鳞茎的一个重要特征是能够反复进行次生胚发生,利用小鳞茎这一特性不仅可以进行快速繁殖,而且还能进行遗传转化。与百合属其他一些种不同[6],绿花百合小鳞茎的发生要早于愈伤组织发生,在小鳞茎发生后愈伤组织才从小鳞茎四周的破裂口处形成,之后愈伤组织不断变大增多,表明绿花百合属于体细胞胚发生类型。
在启动培养中,小鳞茎的诱导主要受6-BA质量浓度的影响,在一定范围内(0.1~0.5 mg·L-1),小鳞茎发生率随6-BA质量浓度的增加而增高,当高于1.0 mg·L-1时,对小鳞茎的发生有抑制作用。较适合的6-BA质量浓度为0.5 mg·L-1;而2,4-D对体细胞胚发生具有双重效应:低浓度时,能促进鳞片外植体产生胚性愈伤组织;浓度稍高却又抑制胚性愈伤组织产生体细胞胚。除百合[7]外,在对臭崧[8]、匍匐剪股颖[9]和中华结缕草[10]等植物愈伤组织的研究中,也都证实了2,4-D的双重效应。实验结果表明,绿花百合较适宜诱导胚性愈伤组织的培养基为MS+6-BA 0.5 mg·L-1+NAA 0.5 mg·L-1+2,4-D 0.1 mg·L-1;胚性愈伤组织增殖及小鳞茎诱导培养基为MS+6-BA 1.0 mg·L-1+2,4-D 0.1 mg·L-1。此外,绿花百合组培苗生根与移栽均较容易,可能与其为胚性起源有关。
以快速繁殖为目的的百合组织培养形成再生植株的途径可分愈伤组织途径[11]、不定芽途径[12]、小鳞茎途径[13]和体细胞胚途径[14]。在以育种为目标的再生体系中,胚性愈伤组织是基因转化的良好受体材料,有利于外源基因整合到植物基因组中,诱导愈伤组织并较长时期维持其胚性状态对其基因转化有重要意义[15]。本研究通过实验表明以绿花百合鳞茎片为外植体,可以诱导愈伤组织并长期维持其胚性状态,进而可以在短时间内大量诱导小鳞茎,并能顺利形成完整植株,借此建立的植株再生体系可以为绿花百合种质资源保存、基因工程以及遗传育种提供有益参考。
1.龙雅宜,张金政.百合属植物资源的保护与利用[J].植物资源与环境,1998,7(1):40-44.
2.周春华,尤超,陈凝华.百合组织培养研究进展[J].北方园艺,2013,14:193-195.
3.杜喜春,赵银萍,张九东,等.秦岭珍稀野生花卉绿花百合资源种质保护及利用[J].北方园艺,2012,11:102-104.
4.杜运鹏,贾桂霞.陕西秦岭地区百合科野生花卉资源及园林应用评价[J].福建林学院学报,2010,30(3):284-288.
5.李浚明,朱登云.植物组织培养教程[M].北京:中国农业大学出版社,2005.
6.袁雪,钟雄辉,李晓昕,等.铁炮百合的胚性愈伤组织诱导和植株再生[J].核农学报,2012,26(3):454-460.
7.狄翠霞,安黎哲,张满效,等.西伯利亚百合器官离体培养及结鳞茎的研究[J].西北植物学报,2005,25(10):1931-1936.
8.姜云天,陈艳秋,朱俊义,等.日本臭崧体细胞胚胎发生及植株再生体系的建立[J].核农学报,2009,23(1):85-89.
9.王培佳,贾玉芳,陈逸锋,等.匍匐剪股颖匍匐茎愈伤组织的诱导[J].核农学报,2009,23(4):621-625.
10.钱永强,孙振元,韦善君,等.中华结缕草成熟胚再生影响因素研究[J].核农学报,2005,19(6):436-440.
11.申玉华,段永平,李超,等.西伯利亚百合花托的组织培养与离体快繁[J].江苏农业科学,2009,2:79-80,87.
12.潘理云,张海洋.宜兴百合组培快繁技术的研究[J].安徽农业科学,2012,40(10):5748-5750.
13.张立,王日明.香水百合花瓣组织培养[J].现代农业科技,2011,10:191-194.
14.吴若菁,阮少宁.百合胚状体形成途径及植株的再生研究[J].福建林学院学报,2003,4:322-325.
15.李邱华,洪波,仝征,等.新铁炮百合遗传转化体系的建立及Zm401基因的导入[J].农业生物技术学报,2008,16(1):96-102.
EmbryonicCallusInductionandPlantRegenerationofLiliumfargesii
GAO Jie1WANG Yuan-Zhong2HUANG Heng-Yu1*
(1.Engineering Research Center for Reproducing Fine Varieties of Chinese Medicinal Plants Yunnan University of Chinese Traditional Medicine,Kunming 650500;2.Institute of Medicinal Plants,Yunnan Academy of Agricultural Sciences,Kunming 650200)
In order to rationally protect and utilize the important wild traditional Chinese medicine resources, we built an efficient and instability regeneration system ofLiliumfargesiiFranch. by embryonic callus induction. With the scales as explants, by an orthogonal experiment, we studied the effect of different kinds and contents of plant hormone on embryonic callus induction and plantlet regeneration, and established a propagation system by tissue culture. The optimal medium for inducing embryonic callus was MS+6-BA 0.5 mg·L-1+NAA 0.5 mg·L-1+2,4-D 0.1 mg·L-1, the callus induction rate was 89.29%, and the generation coefficient of bulblet was 4.7. The optimal medium for regeneration of embryonic callus and inducing the bulblets was MS+6-BA 1.0 mg·L-1+2,4-D 0.1 mg·L-1, and its regeneration rate was 5.0/35d. The optimal rooting medium was 1/2MS+NAA 0.2 mg·L-1, and the rooting rate was 100%. There were 90% of plantlet surviving after transplanting rooted plantlets into sand when cultured in constant temperature and humidity condition for 35 d. Our study could provide a basis on protecting the improved trait of wild resources ofL.fargesii, and lay the foundation for expanding the artificial cultivation and embryoid asexual breeding.
LiliumfargesiiFranch;embryonic callus;bulblet;tissue culture
国家自然科学基金(31260077)和湖南省高校科技创新平台项目(11K053)联合资助
高洁(1982—),女,硕士,讲师,主要从事中药学研究。
* 通信作者:E-mail:hhyhhy96@163.com
2015-04-17
Q949.762.6
A
10.7525/j.issn.1673-5102.2016.01.007
