微波辅助提取暴马丁香中紫丁香苷和橄榄苦苷的工艺研究
2016-11-10周丽萍李梦莎朱良玉穆立蔷倪红伟
王 化 周丽萍 李梦莎 朱良玉 穆立蔷 倪红伟*
(1.黑龙江省科学院自然与生态研究所,湿地与生态保育国家与地方联合工程实验室,哈尔滨 150040; 2.东北林业大学,哈尔滨 150040)
微波辅助提取暴马丁香中紫丁香苷和橄榄苦苷的工艺研究
王 化1,2周丽萍1,2李梦莎1朱良玉1,2穆立蔷2倪红伟1*
(1.黑龙江省科学院自然与生态研究所,湿地与生态保育国家与地方联合工程实验室,哈尔滨 150040;2.东北林业大学,哈尔滨 150040)
主要采用微波辅助提取法对暴马丁香中紫丁香苷和橄榄苦苷两种重要活性成分的同时提取工艺进行了研究,通过Box-Behnken响应面法分析建立二次多项式数学模型,优化提取工艺。结果表明,工艺所及因素对紫丁香苷和橄榄苦苷两种物质总得率影响大小的顺序是乙醇体积分数>微波时间>微波功率,提取工艺最佳参数条件为:浸泡时间1 h,45%乙醇溶液,料液比例1∶20 g·mL-1,微波功率600 W,提取时间5 min。在此最佳条件下,紫丁香苷和橄榄苦苷总得率5.28%±0.102%。该工艺高效省时,投入一批原料,即可同时提取其中的紫丁香苷和橄榄苦苷,有利于暴马丁香资源的综合加工利用。
暴马丁香;紫丁香苷;橄榄苦苷;微波辅助提取
暴马丁香(Syringareticulata)木犀科(Oleaceae)丁香属(Syringa)植物,为温性树种,适应性强,喜光,稍耐阴,具有一定耐寒和耐旱能力,其树干、树皮、枝条均能入药[1],是重要的药源植物。药理学实验证明暴马丁香在清肺、祛痰、消炎、止咳、平喘、利尿等方面具有良好功效[2],研究人员已从其中分离鉴定出紫丁香苷、橄榄苦苷、鹅掌楸苷、女贞子苷、齐墩果酸、白桦脂酸、槲皮素等40余种活性成分[3~5],其中的紫丁香苷和橄榄苦苷含量较高,是具有多种药理活性的天然药用成分。
紫丁香苷又名刺五加苷B,具有调节机体免疫[6]、保肝[7]、抗炎[8]、降血压[9]、提高耐受能力[10]等药理活性。橄榄苦苷是一种无毒的裂环烯醚萜苷类化合物,具有抗氧化[11]、抗炎[12]、抗菌[13]、抗癌[14]、抗病毒[15]、抗动脉粥样等活性[16],及降血脂[17]、降糖[18]、保护心脏[19]的作用。两种物质在药品、保健品和化妆品领域均有应用,国际国内市场的需求量逐年增大,供不应求。李明华等[20]测定了不同产地暴马子皮中紫丁香苷和橄榄苦苷的含量,最高可达2.76%和16.27%,表明从暴马丁香中分离紫丁香苷和橄榄苦苷具有可行性。本文从提高暴马丁香原料的有效利用率,实现资源综合利用的角度出发,对同时提取暴马丁香中橄榄苦苷及紫丁香苷的工艺进行了研究。
1 实验材料与仪器
1.1 材料、试剂
暴马丁香枝条,2014年采集于黑龙江省哈尔滨市;紫丁香苷和橄榄苦苷对照品(≥98%)购自天津一方科技有限公司;甲醇(色谱纯),无水乙醇(分析纯),超纯水自制。
1.2 仪器
Waters高效液相色谱仪e2695-2998液相检测系统;C18色谱柱(4.6 mm×150 mm,5 μm,waters公司);XH-100A型微波萃取仪(北京祥鹄科技发展有限公司)装置示意图如图1所示;3K30型离心机(美国Sigma公司);Milli-Q超纯水仪(法国默克化工技术有限公司);手提式高速中药粉碎机(温岭市大德中药机械有限公司);BS210S电子天平(北京Sartorious有限公司)。

图1 微波提取装置示意图Fig.1 Microwave extraction device
2 实验方法
2.1 HPLC测定
2.1.1 HPLC检测条件
流动相为甲醇(A)-0.5%磷酸水溶液(B),梯度洗脱(0~25 min,10%A→40%A);流速为1.0 mL·min-1;检测波长为230 nm;进样量为10 μL;柱温30℃。
2.1.2 标准曲线绘制
精密称定紫丁香苷和橄榄苦苷对照品15 mg,用50%甲醇定容于5 mL容量瓶中,制成浓度为3.0 mg·mL-1的紫丁香苷和橄榄苦苷溶液作为对照品储备液。精密量取对照品的储备液,加入浓度为50%的甲醇,配制浓度为0.1、0.2、0.5、1.0、2.0、3.0 mg·mL-1的对照品溶液,分别以两种对照品浓度(mg·mL-1)为横坐标(X),以HPLC检测得到峰面积为纵坐标(Y),绘制标准曲线,进行线性回归得紫丁香苷回归方程为:Y1=232 273 42.63X1-253 568.20,R2=0.999 0;得橄榄苦苷回归方程为:Y2=145 489 27.44X2+184 292.65,R2=0.999 1。结果表明:紫丁香苷和橄榄苦苷浓度在0.1~3.0 mg·mL-1范围内线性关系良好。
2.2暴马丁香中紫丁香苷、橄榄苦苷提取流程及含量测定
分别取暴马丁香粉末1.00 g,置于100 mL锥形瓶中,分别加入一定体积、不同体积分数的乙醇溶液,浸泡一段时间后,在微波不同功率作用下,提取一定时间。将适量提取液至于离心管中,12 000 r·min-1,离心15 min,取上清液至于样品瓶中进行HPLC检测,每个样品重复3次。得率计算公式:
YS=CS×V/1000/M×100%
(1)
YO=CO×V/1000/M×100%Y=YS+YO
(2)
式中:YS是紫丁香苷得率(%);YO是橄榄苦苷得率(%);Y是总得率(%);CS是提取液中紫丁香苷的浓度(mg·mL-1);CO是提取液中橄榄苦苷的浓度(mg·mL-1);V是提取液的体积(mL);M是原料的质量(g)。
2.3响应面优化微波辅助提取暴马丁香中紫丁香苷和橄榄苦苷的最佳条件
根据Box-Behnken试验设计原理,在预实验结果基础上,选取乙醇体积分数、微波时间和微波功率3个实验因素和3个水平,对提取工艺进行响应面分析实验,实验因素及水平见表1。

表1 因素水平表
3 结果与讨论
3.1 初步实验
为找出对暴马丁香中紫丁香苷和橄榄苦苷得率影响比较大的因素,首先对选定因素进行了初步考察,选定因素包括:浸泡时间、乙醇体积分数、料液比例、微波功率、微波时间。料液比例对紫丁香苷和橄榄苦苷提取得率的影响如图2(a)所示,料液比例1∶10和1∶15 g·mL-1时总得率均低于其它各组,1∶20~1∶30 g·mL-1条件下并未见提取率的显著提高。因此,选取料液比例为1∶20 g·mL-1被确定为最佳条件。浸泡时间对紫丁香苷、橄榄苦苷提取得率的影响如图2(b)所示,干燥的暴马丁香原料提取前在提取溶剂中浸泡1、2、3、4 h均能提高紫丁香苷和橄榄苦苷的提取得率。随着浸泡时间的延长,提取率并没有显著的提高,因此,选定最佳浸泡时间为1 h。

图2 料液比例及浸泡时间对提取得率的影响Fig.2 Effects of solid to liquid ratio(a) and soaking time(b)
经过初步实验之后,浸泡时间1 h,料液比例为1∶20 g·mL-1被确定为最佳条件。乙醇体积分数、微波功率、微波时间对提取得率的影响较大,进行进一步优化实验。
3.2响应面法优选暴马丁香中紫丁香苷和橄榄苦苷提取工艺的研究
3.2.1 响应面法优化实验结果及拟合模型
在初步实验结果基础上,利用Box-Behnken响应面分析法进行设计。实验具体设置显示在表2中,17个实验中中心实验5个,用以分析实验误差;析因实验12个。以暴马丁香中紫丁香苷和橄榄苦苷总得率(Y)为响应值,经回归拟合各影响因子与响应值的回归方程为:
Y=5.24+0.17A-0.047B+0.19C-0.005AB+0.063AC-0.01BC-0.23A2-0.45B2-0.25C2
(3)
表2响应面分析设计及实验结果
Table2Designandexperimentresultofresponsesurfacemethodology

序号No.A:乙醇体积分数Thevolumefractionofethanol(%)B:微波功率Microwavepower(W)C:微波时间Microwavetime(min)YS(%)YO(%)Y(%)15080040.624.084.7024040060.963.864.8233080040.953.424.3745040040.634.124.7553060020.983.474.4564060041.034.225.2575060060.774.415.1884060041.054.265.3194060041.014.185.19104060041.034.215.24114040020.783.624.40124080020.813.464.27135060020.544.144.68144060041.024.195.21153060061.093.614.70163040041.053.354.40174080060.913.744.65
通过表3的方差分析结果可以看到总得率回归方程各变量对指标影响的显著性。概率P值越小,表明相应变量的显著程度也越高。各因素中A、C、A2、B2、C2对总得率的影响均为极显著(P<0.01),B和AC对总得率的影响为显著(P<0.05),可见,各个具体的试验因素对响应值的影响不是简单的线性关系,且影响大小的顺序是乙醇体积分数>微波时间>微波功率。回归方程的相关系数r=97.00%,表明可以利用该模型对暴马丁香中紫丁香苷和橄榄苦苷提取效果进行分析。失拟项是用来评估方程可靠性的一个重要数据,方程分析结果显示失拟项F值为1.03,不显著,表明方程拟合的比较好,可以很好地描述各个因素与响应值之间的真实关系,利用该方程确定暴马丁香中两种物质的最佳提取条件。由二次回归模型得到每两个因素同时对响应值的影响结果如图3所示。总得率的响应曲面均为开口向下凸面,且中心在考察区域之内,表明在考察区域范围内存在响应值的最大值。通过Design-Expert 8.0.6软件分析,同时提取暴马丁香中紫丁香苷和橄榄苦苷的最佳条件为:乙醇体积分数44.30%,微波功率为587.98 W,提取时间4.87 min,总得率为5.31%。
表3总得率回归方程方差分析表
Table3Varianceanalysistableofregressionequationforsyringinandoleuropein

方差来源Source总和Sumofsquares自由度df均方MeansquareF值FvalueP值Prob>F模型Model2.0792.03108.44<0.0001A:乙醇体积分数Thevolumefractionofethanol(%)0.2410.24113.65<0.0001B:微波功率Microwavepower(W)0.01810.0188.490.0225C:微波时间Microwavetime(min)0.3010.30141.23<0.001AB1.000×10-411.000×10-40.0470.8344AC0.01610.0167.350.0301BC4.000×10-414.000×10-40.190.6774A20.2310.23108.26<0.0001B20.8610.86403.47<0.0001C20.2710.27127.58<0.0001残差Residual0.01572.125×10-3失拟项Lackoffit6.475×10-332.158×10-31.030.4695净误差Pureerror8.400×10-342.100×10-3总离差Cortotal2.0916
3.2.2 最佳工艺条件的验证实验
对优化所得最佳条件进行验证实验,为方便操作,选取各条件临近整数值,具体为:称取暴马丁香树枝粉末1.00 g,按照提取溶剂为体积分数45%的乙醇溶液,浸泡时间1 h,料液比例为1∶20 g·mL-1,微波功率600 W,提取时间为5 min,提取液经离心后进行HPLC检测,计算紫丁香苷和橄榄苦苷总得率,重复5次。实际测得紫丁香苷得率0.94±0.03%,橄榄苦苷得率为4.34±0.07%,总得率为5.28±0.102%,与模型预测值之间误差为0.56%,验证了模型的正确性。
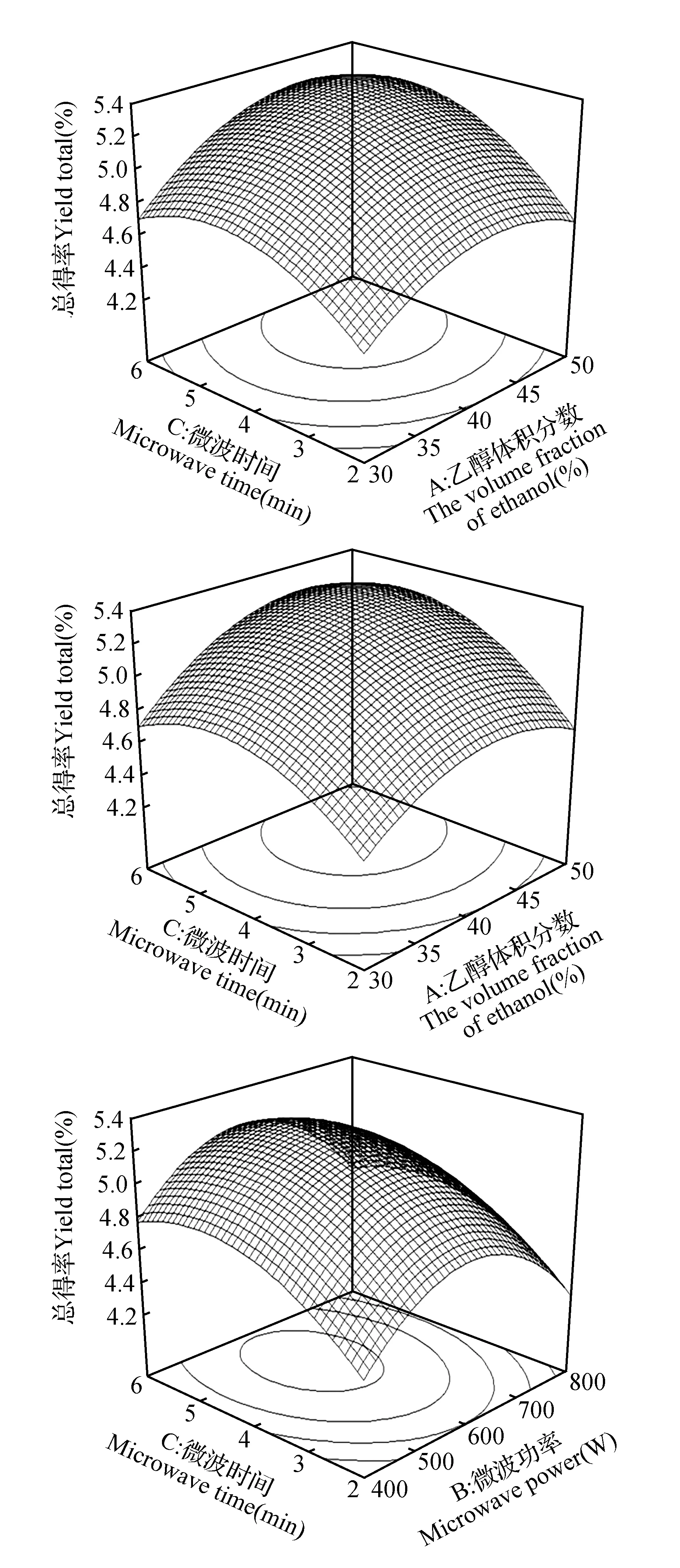
图3 各因素对总提取率的响应曲面图Fig.3 Effects of different factors on the yields of syringin and oleuropein
3.3 微波辅助提取法与其他常规提取方法的比较
本研究选择了常规的常温浸泡提取和加热回流提取方法与微波辅助提取法进行比较。原料1.00 g,提取溶剂为体积分数45%的乙醇,料液比例1∶20 g·mL-1,3种方法提取效果的比较结果如表4所示。
由微波辅助提取法与常温浸泡提取法和加热回流提取法的比较结果可以看出,微波辅助提取暴马丁香中的紫丁香苷和橄榄苦苷的得率高,且所需时间短,提取效果明显优于其他两种方法。该工艺操作简单,微波穿透力强,能够使植物的细胞组织变形或破壁,增大了样品与提取溶液间的接触面积,有利于紫丁香苷和橄榄苦苷的溶出,可以充分、快速地提取有效成分,提高提取效率。
表4不同提取方法比较
Table4Comparisonofdifferentextractionmethods

方法名称Methods提取温度Temperature(℃)消耗时间Time(min)紫丁香苷得率Yieldofsyringin(%)橄榄苦苷得率Yieldofoleuropein(%)总得率Yieldofsyringinandoleuropein(%)常温浸泡提取Roomtemperatureextraction254800.311.441.75加热回流提取Refluxextraction802400.762.403.16微波辅助提取Microwaveassistedextraction80650.944.345.28
4 结论
本实验首次采用微波辅助提取法从暴马丁香中同时提取紫丁香苷及橄榄苦苷,对于浸泡时间、料液比例、乙醇体积分数、微波功率及微波时间等因素对提取工艺的影响进行了考察,采用响应面法进行工艺优化,得到最优工艺条件为:浸泡时间1 h、料液比例为1∶20 g·mL-1、乙醇体积分数45%、微波功率600 W、微波时间5 min。最佳条件下暴马丁香紫丁香苷和橄榄苦苷的总得率为5.28±0.102%,为实现暴马丁香资源高附加值的综合加工利用奠定了基础。
1.王清君,刘立波,陈志新,等.暴马丁香药用原料林高产栽培技术[J].东北林业大学学报,2007,35(9):30-32.
2.蔡恩博,张崇禧,朱启光,等.星点设计—效应面法优选暴马丁香树皮中紫丁香苷的提取工艺[J].药物分析杂志,2011,31(9):1808-1811.
3.徐国兴.长白山暴马丁香枝化学成分的研究[D].长春:吉林大学,2003.
4.宋光西,马玲云,魏锋,等.暴马子皮化学成分研究[J].中国药学杂志,2012,47(24):1979-1982.
5.蔡恩博.长白山暴马丁香树皮化学成分及药理活性的研究[D].长春:吉林农业大学,2012.
6.聂淑琴.紫丁香苷对半乳糖胺致肝毒性的防护作用[J].国外医学中医中药分册,2000,22(6):346.
7.Kapil A,Sharma S.Immunopotentiating compounds from Tinospora cordifolia[J].J Ethnopharmacol,1997,58(2):89.
8.Diaz Lanza A M,Abad Martinez M J,Fernandez Matellano L,et al.Lignan and phenylpropanoid glycosides from Phillyrea latifolia and their in vitro anti-inflammatory activity[J].Planta Med,2001,67(3):219-221.
9.Mansoor A,Khalid A.Hypotensive action of syringin from Sytingia vulgaris[J].Phytother Res,1995,9(6):452-453.
10.凌海燕,鲁学照,赵咏丽,等.丹参水溶性成分的研究概况[J].天然产物研究与开发,1999,11(6):75.
11.Visioli F,Poli A,Galli C.Antioxidant and other biological activities of phenols from olives and olive oil[J].Med Res Rev,2002,22:65-75.
12.Visioli F,Bellosta S,Galli C.Oleuropein,the bitter principles of olives,enhances nitric oxide production by mouse macrophages[J].Life Sci,1998,62:541-546.
13.Tripoli E,Giammanco M,Tabacchi G,et al.The phenolic composition of olive oil:structure,biological activity,and beneficial effects on human health[J].Nutr Res Rev,2005,18:98-112.
14.Owen R W,Giacosa A,Hull W E,et al.Olive oil consumption and health:the possible role of antioxidants[J].Lancet Oncol,2000,1:107-112.
15.Fredrickson W R,F and S Group,Inc.Method and Composition for Antiviral Therapy with Olive Leaves.U.S.Patent,2000,6:117,884.
16.Carluccio M A,Siculella L,Ancora M A,et al.Olive oil and red wine antioxidant polyphenols inhibit endothelial activation:antiatherogenic properties of mediterranean diet phytochemicals[J].Arterioscler Thromb Vasc Biol,2003,23:622-629.
17.Andreadou I,Iliodromitis E K,Mikros E,et al.The olive constituent oleuropein exhibits anti-ischemic,antioxidative,and hypolipidemic effects in anesthetized rabbits[J].J Nutr,2006,136:2213-2219.
18.Al-Azzawie H F,Alhamdani M S.Hypoglycemic and antioxidant effect of oleuropein in alloxan-diabetic rabbits[J].Life Sciences,2006,78(12):1371-1377.
19.Andreadou I,Sigala F,Iliodromitis E K,et al.Acute doxorubicin cardiotoxicity is successfully treated with the phytochemical oleuropein through suppression of oxidative and nitrosative stress[J].J Mol Cell Cardiol,2007,42:549-558.
20.李明华,程显隆,陆以云,等.HPLC法同时测定暴马子皮中紫丁香苷、橄榄苦苷的含量[J].药物分析杂志,2014,34(10):1861-1863.
OptimizationofMicrowave-assistedExtractionofSyringinandOleuropeinfromSyringareticulata
WANG Hua1,2ZHOU Li-Ping1,2LI Meng-Sha1ZHU Liang-Yu1,2MU Li-Qiang2NI Hong-Wei1*
(1.Institute of Natural Resources and Ecology,Heilongjiang Academy of Sciences,National Wetland and Ecological Conservation Engineering Lab,Harbin 150040;2.Northeast Forestry University,Harbin 150040)
We used microwave-assisted extraction to extract syringin and oleuropein from Syringa reticulate, and optimized the extraction process by the Box-Behnken response surface method. The order of the effect of factors on the yield of syringin and oleuropein was the concentration of ethanol>the microwave time>microwave power. The optimum conditions for the extraction were as follows: soaking time of 1 h, ethanol concentration of 45%, ratio of solid to liquid of 1∶20 g·mL-1, microwave output power of 600 W, and extraction time of 5 min. With the optimum extraction conditions, the yield of syringin and oleuropein from Syringa reticulate was 5.28%±0.102%. The microwave-assisted extraction was efficient and rapid for extraction syringin and oleuropein from Syringa reticulate, and was benefit for the comprehensive utilization of Syringa reticulate.
Syringareticulate;syringin;oleuropein;microwave-assisted extraction
黑龙江省科学院青年创新基金
王化(1981—),女,助理研究员,博士,主要从事植物天然产物研发。
* 通信作者:E-mail:nihongwei2000@163.com
2015-05-18
TQ423
A
10.7525/j.issn.1673-5102.2016.01.020
