基于直立碳纳米管大面积金粒子的DNA生物传感器用于早幼粒白血病/维甲酸受体α融合基因检测
2016-11-09杨丽珠朱婧章仁毅马丹琦何品刚方禹之温州医科大学药学院温州505华东师范大学化学系上海004浙江省台州市路桥区计划生育宣传技术指导站台州8050
杨丽珠朱婧章仁毅马丹琦何品刚*方禹之(温州医科大学药学院,温州505) (华东师范大学化学系,上海004)(浙江省台州市路桥区计划生育宣传技术指导站,台州8050)
基于直立碳纳米管大面积金粒子的DNA生物传感器用于早幼粒白血病/维甲酸受体α融合基因检测
杨丽珠*1朱婧2章仁毅2马丹琦1,3何品刚*2方禹之2
1(温州医科大学药学院,温州325035)2(华东师范大学化学系,上海200241)3(浙江省台州市路桥区计划生育宣传技术指导站,台州318050)
基于直立碳纳米管上的大面积金粒子构建了新型的电化学DNA生物传感器,用于急性早幼粒细胞白血病PML/RARα融合基因的检测。首先在直立碳纳米管电极表面溅射金粒子,采用自组装方法将巯基修的单链DNA固定到电极上,将氨基修的单链DNA和羧基化的CdTe量子点通过酰胺缩合反应生成CdTe修的DNA探针,通过与目标DNA的双杂交反应形成三明治结构,利用差分脉冲阳极溶出伏安法检测电极表面捕获的CdTe量子点,从而对DNA进行定量分析。结果表明,电极上Cd2+峰电流与目标DNA浓度(1.0× 10-12~1.0×10-8mol/L)的对数值呈线性关系,线性方程为ipa(μA)=1.626+0.132lg C(mol/L)(R=0.996),检出限为4.0×10-13mol/L(3σ)。传感器表现出良好的重现性和稳定性。
直立碳纳米管;金粒子;急性早幼粒细胞白血病;DNA生物传感器;差分脉冲阳极溶出伏安
1 引言
急性早幼粒细胞白血病(Acute promyelocytic leukemia,APL)是急性骨髓系白血病中一种严重危害人类健康的恶性白血病[1],而早期诊断直接影响患者的治疗效果及生存质量。早幼粒白血病/维甲酸受体α(Promyelocytic leukaemia/retinoic acid receptorα,简称PML/RARα)融合基因是APL特异性的标志物,对其检测有助于APL诊断,且对融合基因的定量也有重要意义。目前,APL的临床诊断方法,如Southern-Blot法、荧光原位杂交技术(FISH)和实时定量分析PCR方法,普遍存在局限性,如特异性低、灵敏度不高、操作繁琐、检测费用高等[2~4],限制了在临床检测中的应用。
DNA生物传感器具有灵敏度高、检测成本低、操作简单等优点[5],在流行病、遗传疾病、肿瘤临床检验和基因诊断等方面有很高的应用价值[6~9]。直立碳纳米管阵列(ACNTs)与无序碳纳米管相比,在导电性、比表面积和生物兼容性等方面具有更为突出的优势[10,11],已被应用于生物传感器的研究[12~14]。Wang等[12]通过有序自组装碳纳米管技术制备了DNA生物传感器,该传感器比无序多壁碳纳米管的传感器具有更高的杂交效率和更高的选择性。Yang等[13]在直立碳纳米管修电极上制备了基于金纳米粒子和二氧化硅凝胶的生物传感器,测定了血红蛋白的直接电化学。本研究组前期的工作中,在直立碳纳米管电极上以重氮化固定环糊精,构建了基于主客体识别技术的DNA生物传感器[14]。
本研究在电极表面修的直立碳纳米管表面溅射大面积金粒子,通过自组装固定巯基修的DNA探针,与CdTe量子点修的DNA检测探针以及目标DNA形成三明治结构,构建一种新型的DNA生物传感器,通过阳极溶出法测定捕获至电极表面的CdTe量子点,用于PML/RARα融合基因的检测。由于直立碳纳米管表面固定了大量的金粒子,以CdTe量子点作为杂交指示剂,结合阳极溶出法的放大作用,本传感器具有灵敏度高、制备简便、重现性好和稳定性高等优点。
2 实验部分
2.1仪器与试剂
CHI660A电化学工作站(上海辰华仪器有限公司),采用三电极体系:直立碳纳米管阵列电极(直径d=2 mm)为工作电极,铂丝为对电极,Ag/AgCl为参比电极。JEOL S-4800 FE-SEM型场发射扫描电子显微镜(日本JEOL公司)。
羧基化的CdTe量子点(深圳市中鼎盛投资有限公司,编号QDWS-1L-54001,粒径约3.0 nm);1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC·HCl,上海延长生化科技公司);N-羟基琥珀酰亚胺磺酸钠盐(NHSS,上海生工生物技术公司);牛血清白蛋白(BSA,Sigma-Aldrich公司)。其它试剂为分析纯,实验用水为超纯水(Milli-Q,美国Millipore公司)。缓冲溶液:0.1mol/L磷酸盐缓冲液(PBS,pH 7.0);0.1mol/L NaAc-HAc缓冲液(pH 5.2)。所用DNA序列由上海生工生物技术公司合成,具体序列见表1。

表1 本文中用到的DNA序列Table 1 DNA sequences used in this work
2.2实验方法
2.2.1直立碳纳米管阵列(ACNTs)电极的制备[14]用化学气相沉积法合成ACNTs[15],再用磁共振法在其上溅射一层金粒子[14],用10%HF将直立碳纳米管阵列从石英基底上剥离,制成ACNTs工作电极。
2.2.2CdTe量子点修的DNA探针(CdTe-ssDNA)的制备在含2 OD检测ssDNA(探针2)的样品管中加入200μL 3 mol/L咪唑溶液,室温涡旋振荡30 min。再加入5 mL 0.1g/L CdTe量子点溶液和100μL 0.1 mol/L的EDC溶液,继续搅拌12 h。14000 r/min离心30 min,黄色沉淀用PBS缓冲液充分洗涤,再分散到PBS缓冲液中,得CdTe量子点修的DNA探针(CdTe-ssDNA)。
2.2.3探针1在ACNTs电极上的自组装固定在4°C条件下,将巯基修的捕获探针(探针1)通过自组装(组装时间12 h)修到ACNTs电极表面的金粒子上,用1%(w/w)BSA封闭非特异性作用位点,用PBS缓冲液清洗电极,得ACNTs/probe 1电极。
2.2.4双杂交反应在37℃恒温箱中,将ACNTs/probe1电极和一定浓度的目标DNA溶液,在缓慢振荡下,杂交反应30 min,用PBS缓冲液冲洗电极。将该电极和CdTe-ssDNA进行杂交反应30 min,用PBS缓冲液冲洗电极,得到ACNTs/probe1/target DNA/CdTe-ssDNA电极。
2.2.5电化学检测用0.2 mL 0.1 mol/L HNO3溶液充分溶解电极表面的CdTe量子点,加入1.8 mL 0.1 mol/L NaAc-HAc缓冲溶液(pH 5.2)配制成检测液。以镀汞膜的玻碳电极为检测电极,利用差分脉冲阳极溶出伏安法[16]测定Cd2+的峰电流。
3 结果与讨论
3.1基于直立碳纳米管大面积金粒子构建DNA生物传感器的检测原理
通过在ACNTs电极面溅射了大面积金粒子,采用三明治模式,构建高灵敏的电化学DNA生物传感器,用于检测急性早幼粒细胞白血病PML/RARα融合基因的DNA片段。检测原理如图1所示。首先在金粒子表面通过自组装固定巯基修的捕获探针,再将氨基修的探针2与羧基化的CdTe量子点通过酰胺缩合反应制备成CdTe修的探针,然后与目标DNA杂交形成三明治结构。采用HNO3溶解捕获至电极表面的CdTe量子点,利用阳极溶出法检测Cd2+信号。直立碳纳米管大的比表面积以及在碳管表面溅射的大量的金粒子,大大增加DNA分子在电极上的固定量,结合阳极溶出法对Cd2+富集与溶出的放大作用,所制备的传感器表现出很高的灵敏度。

图1 基于直立碳纳米管大面积金粒子构建DNA生物传感器的检测示意图Fig.1 Schematic representation of DNA biosensors based on large-area gold particles on aligned carbon nanotubes (ACNTs)electrode
3.2ACNTs电极的SEM表征和循环伏安特性
图2是直立碳纳米管(长度约50μm)的侧面(图2a)和顶端(图2b和2c,c为b黑框区域的放大图)的场发射扫描电镜(FESEM)图像。由图可以看出,直立碳纳米管排列致密且均匀有序,定向性好,顶端开口(图2b和2c),侧壁上包裹了大面积的金粒子(图2a和2c),相比于常规金电极具有更大的表面积,可以固定更多的生物分子。

图2 场发射扫描电镜图。(a)ACNTs的侧面图;(b和c)ACNTs的顶部俯视图Fig.2 Field emission scanning electron microscopic(FESEM)images(a)sidewall view of ACNTs,(b)and(c)top view of ACNTs.
图3显示的是裸金电极(Φ=2 mm)(a)和ACNTs电极(b)在0.1 mol/L H2SO4溶液中的循环伏安图,两种电极均在1.4 V出现一个氧化峰,生成的金的氧化物在反向扫描时还原,但ACNTs电极的氧化还原峰电流与金电极相比明显增大。根据文献[17]方法,通过还原峰电流测得ACNTs电极中金粒子的有效面积为39.8 mm2,明显大于ACNTs电极的几何面积3.14 mm2,粗糙度系数(Rf)为12.7[18]。由此可见,在ACNT表面溅射金粒子可增加电极的表面积,提高DNA分子在电极表面的固定量和直立碳纳米管电极的导电性。
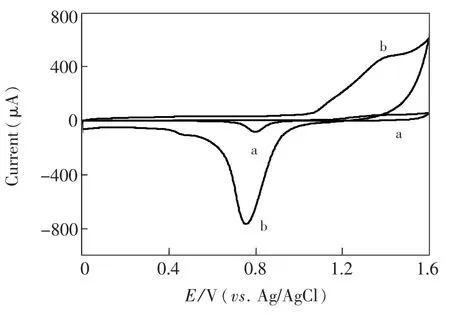
图3 裸金电极(a)和ACNTs电极(b)在0.1 mol/L H2SO4溶液中的循环伏安图,扫速为100mV/sFig.3 Cyclic voltammograms of bare Au electrode(a) and ACNTs electrode(b)in 0.1mol/L H2SO4at a scan rate of 100 mV/s
3.3杂交反应时间的优化
对两次杂交反应的时间进行了优化。实验发现,当杂交时间在0~30 min之间,响应信号随着杂交时间延长而增大;当杂交时间超过30 min,响应信号增大的较慢,因此选择两次杂交时间均为30 min。
3.4DNA的测定
将两步杂交反应后捕获到电极表面的CdTe量子点先用硝酸溶解,然后利用差分脉冲阳极溶出法(DPASV)测定其电化学信号。结果表明,响应信号随着目标DNA浓度的增加而增大。图4是不同浓度的目标DNA对应的Cd2+的DPASV响应,插图为目标DNA的浓度对数值与相对应的Cd2+的DPASV响应电流的关系曲线。当目标DNA浓度在1.0×10-12~1.0×10-8mol/L范围内时,Cd2+的DPASV响应电流与目标DNA的浓度对数值之间呈线性关系,线性方程为ipa(μA)=1.626+0.132lg C(mol/L),相关系数R=0.996,检出限为4.0×10-13mol/L(3σ,n=11)。结果表明,构建的DNA传感器具有很高的灵敏度,并且高于文献报道的基于金电极和CdS纳米粒子检测DNA杂交的方法[14]及基于CdS纳米粒子和主客体识别技术的均相杂交的DNA生物传感器[16]。同一批内5支电极制备的传感器响应电流的RSD =6.9%。显示出良好的重现性。

图4 不同浓度的目标DNA存在下Cd2+的差分脉冲阳极溶出(DPASV)响应。目标DNA浓度为(a到f):0,1.0×10-12mol/L,1.0×10-11mol/L,1.0×10-10mol/L,1.0×10-9mol/L,1.0×10-8mol/L。插图为Cd2+的DPASV响应与不同浓度目标DNA的关系曲线Fig.4 Differential pulse anodic stripping voltammetry (DPASV)response of Cd2+in the presence different concentration of target DNA(a to f:0,1.0×10-12mol/L,1.0×10-11mol/L,1.0×10-10mol/L,1.0×10-9mol/L,1.0× 10-8 mol/L).Inset: DPASV responses of Cd2+corresponding to different concentrations of target DNA.
3.5方法的特异性
图5是不同DNA序列存在下电极表面的Cd2+的DPASV响应。与空白样品相比,完全互补PML/ RARα融合基因序列产生了非常明显的DPASV信号;而另外4个序列的DPASV信号很低,和空白样品的差别不大。上述结果表明,所构建的DNA传感器可以区分单碱基错配DNA序列、三碱基错配DNA序列、PML基因片段(只有一半互补)、RARα基因片段(只有一半互补)和完全互补的PML/RARα基因序列序列,具有良好的特异性。

图5 不同DNA序列存在下Cd2+的DPASV响应图a,1.0×10-9mol/L完全互补的早幼粒白血病/维甲酸受体α(PML/RARα)融合基因;b,1.0×10-8mol/L单碱基错配DNA;c,1.0×10-8mol/L三碱基错配DNA; d,1.0×10-8mol/L PML基因片段;e,1.0×10-8mol/L RARα基因片段和(f)空白样品。Fig.5 DPASV responses of Cd2+for the detection of 1.0×10-9mol/L complementary target DNA(a);1.0× 10-8mol/L one-base mismatched sequence(b);1.0× 10-8mol/L three-basemismatched sequence(c);1.0× 10-8mol/L promyelocytic leukaemia(PML)segment (d);1.0×10-8mol/L retinoic acid receptorα(RARα) segment(d);and blank sample(f).
结果表明,由于直立碳纳米管的大的比表面积、碳管表面溅射的大量的金粒子,以及CdTe量子点作为杂交指示剂利用阳极溶出检测的放大用,构建的生物传感器具有灵敏度高、特异性好、制作简单等优点。
References
1Bennett J,Catovsky D,Daniel M,Flandrin G,Galton D A G,Gralnick H R,Sultan C.Br.J.Haematol.,1976,33(4):451-458
2Han JY,Kim K E,Kim K H,Park J I,Kim JS.Leukemia Res.,2007,31(2):239-243
3Mokany E,Todd A V,Fuery C J,Applegate T L.Methods Mol.Med.,2006,125:127-147
4ZHANG Qiang,LIYu-Yun,XU Xiu-Cai,ZHAIZhi-Min.Chinese J.Clin.Lab.Sci.,2010,28(4):281-282张强,李玉云,徐修才,翟志敏.临床检验杂志,2010,28(4):281-282
5Sun W,Zhang Y Y,Hu A H,Lu Y X,Shi F,Lei B X,Sun Z F.Electroanalysis,2013,25(6):1417-1424
6CHENG Gui-Fang,HUANG Cui-Hua,ZHAO Jie,TAN Xue-Lian,HE Pin-Gang,FANG Yu-Zhi.Chinese J.Anal.Chem.,2009,37(2):169-173程圭芳,黄翠华,赵洁,谭雪莲,何品刚,方禹之.分析化学,2009,37(2):169-173
7Yola M L,Eren T,Atar,N.Electrochim.Acta,2014,125(10):38-47
8Li Y,Deng J,Fang L C,Yu K K,Huang H,L L,Liang W B,Zheng JS.Biosen.Bioelectron.,2015,63(15):1-6
9XU Kai,YE Zun-Zhong,YING Yi-Bin.Chinese J.Anal.Chem.,2008,36(8):1113-1116许凯,叶尊忠,应义斌.分析化学,2008,36(8):1113-1116
10Jin L,Bower C,Zhou O.Appl.Phys.Lett.,1998,73(9):1197-1199
11Vigolo B,Pénicaud A,Coulon C,Sauder C,Pailler R,Journet C,Bernier P,Poulin P.Science,2000,290(5495):1331-1334
12Wang SG,Wang R,Sellin P J,Zhang Q.Biochem.Biophys.Res.Commun.,2004,325(4):1433-1437
13Yang J,Xu Y,He PG,Fang Y Z.Electroanalysis.,2013,25(10):2345-2353
14Yang L Z,Xu Y,Wang X H,Zhu J,Zhang R Y,He PG,Fang Y Z.Anal.Chim.Acta,2011,689(1):39-46
15SONG Hai-Yan,LIYan-Nan,ZHAO Kun,YE Xiao-Yan,HE Pin-Gang,SUN Zhuo,FANG Yu-Zhi.Chem.J.Chinese Universities,2007,28(9):1622-1626宋海燕,李艳楠,赵琨,叶晓燕,何品刚,孙卓,方禹之.高等学校化学学报,2007,28(9):1622-1626
16Chen X,Wang Y,Zhou J,Yan W,Li X,Zhu J J.Anal.Chem.,2008,80(6):2133-2140
17Angerstein-Kozlowska H,Conway B E,Hamelin A,Stoicovicu L.J.Electroanal.Chem.Interf.Electrochem.,1987,228(1-2):429-453
18Fan H,Xing R,Wang X H,Xu Y,Wang Q J,He PG,Fang Y Z.Electroanalysis.,2010,22(15):1781-1786
This work was supported by the National Natural Science Foundation of China(No.31300819)and the Natural Science Foundation of Zhejiang Province,China(No.LQ12B05004)
DNA Biosensor Based on Large Area of Gold Particles on Aligned Carbon Nanotubes for Detection of Prom yelocytic Leukaem ia/Retinoic Acid ReceptorαFusion Gene
YANG Li-Zhu*,ZHU Jing2,ZHANG Ren-Yi2,MA Dan-Qi1,3,HE Pin-Gang*2,FANG Yu-Zhi2
1(School of Pharmaceutical Sciences,Wenzhou Medical University,Wenzhou 325035,China)2(Department of Chemistry,East China Normal University,Shanghai200241,China)3(Family Planning Publicity&Education Technical Advising Center of Luqiao,Taizhou 318050,China)
A novel electrochemical DNA biosensor was fabricated based on the large area of gold particles on the aligned carbon nanotubes for the detection of promyelocytic leukaemia/retinoic acid receptorα(PML/ RARα)fusion gene in acute promyelocytic leukemia.Firstly,the thiol-modified single-stranded DNA (ssDNA,probe 1)was immobilized on the gold particles sputtered on the aligned carbon nanotubes electrode by self-assembly technique.Then,amino-modified ssDNA and carboxyl-modified CdTe quantum dots(QDs) were combined to get CdTe-modified DNA probe through an amidization reaction.After hybridization with target DNA,a sandwich-type assay structure was formed.Finally,the CdTe quantum dots captured on the electrode surface were detected by differential pulse anodic stripping voltammetry.The change of peak current of Cd2+on the electrode was found to be linear with the logarithm of target DNA concentration in the range of 1.0×10-12mol/L to 1.0×10-8mol/L.The Linear equation was ipa(μA)=1.626+0.132lg C(mol/L)(the correlation coefficient R was 0.996)and the detection limitwas 4.0×10-13mol/L(3σ).The fabricated DNA biosensor exhibited excellent reproducibility and stability.
Aligned carbon nanotubes;Gold particles;Acute promyelocytic leukemia;DNA biosensor; Differential pulse anodic stripping voltammetry
1 October 2015;accepted 5 January 2016)
10.11895/j.issn.0253-3820.150773
2015-10-01收稿2016-01-05接受
本文系国家自然科学基金项目(No.31300819)和浙江省自然科学基金项目(No.LQ12B05004)资助
*E-mail:yanglz3000@aliyun.com,pghe@chem.ecnu.edu.cn
